2. 中国科学院大学, 北京 100049
红壤广泛分布于我国南方热带、亚热带地区,具有富铁铝化、酸化和低肥力等特征。研究表明,与其他土壤类型相比,红壤中有机污染物如多环芳烃[1]、抗生素[2]的降解速率偏低。鉴于红壤地区是我国重要的粮食、经济作物生产基地,研究红壤中有机污染物的转化及其调控技术,对于保障粮食安全、生态安全具有重要科学意义。
阿特拉津是一种选择性内吸传导型除草剂,由于其低成本、易应用的特点,使用量逐年增加。据统计,2019年我国消耗阿特拉津近1 300万公斤[3]。在我国南方地区,阿特拉津常用于玉米、甘蔗等作物的杂草控制。阿特拉津易残留、易迁移[4],导致深层土壤、地表水及地下水中阿特拉津及其降解产物的检出[5-6],产生健康和生态环境风险。阿特拉津具有毒性及内分泌干扰性,低浓度即可损害青蛙、斑马鱼的生殖健康[3, 7-8]。农田土壤中残留的阿特拉津可能对后茬作物产生影响[9]。已知微生物可通过氧化脱烷基化或脱卤反应降解阿特拉津[10],与土壤-污染物相互作用,共同决定着阿特拉津的环境归趋。
农业生产中,常采用施肥、调节酸度等措施进行土壤改良,提高农田生产力。这些措施在不同程度上影响着土壤的理化及微生物性质[11-12],并进而影响有机污染物的微生物降解与环境行为。例如,付登强等[13]利用碳酸钙调节土壤pH,影响污染物的降解。而木质素能有效促进多环芳烃污染土壤的修复[14-15]。目前,仍缺乏对不同施肥、不同土壤改良措施影响下红壤中阿特拉津降解过程的认识。本研究依托旱地红壤长期定位施肥试验,设置土壤微宇宙,通过同位素示踪研究调节酸度和添加改良剂下阿特拉津的环境归趋;采用微生物高通量测序等方法,解析土壤微生物群落及阿特拉津降解菌的群落响应。研究结果有助于阐明不同施肥处理下旱地红壤中阿特拉津的微生物降解规律,并为开发适用于红壤的有机污染物修复技术提供科学依据。
1 材料与方法 1.1 供试土壤供试土壤采自江西鹰潭农田生态系统国家野外科学观测研究站长期定位施肥试验地,土壤类型为第四纪红色黏土。该试验始于1996年,本研究选取其中氮磷钾化肥(U)和猪粪配施磷钾(M)两个处理,在4个重复小区中采集表层10 cm表层土壤后组合为一个混合样。自然风干后磨细、过2 mm筛,储存于4 ℃。经测定,施化肥土壤U和施有机肥土壤M的基本理化性质分别为:pH 5.13、6.20(土水比1︰2.5,m︰V),有机质12.0、13.9 g/kg,全氮0.84、1.00 g/kg,全磷0.36、1.15 g/kg,全钾15.8、14.9 g/kg,其他基本理化性质参见文献[16]。
1.2 化学试剂14C-阿特拉津购自American Radiolabeled Chemicals, Inc.,12C-阿特拉津(纯度 > 97%)购自梯西爱(上海)化成工业发展有限公司,碱性木质素购自Sigma-Aldrich,牡蛎壳粉为自制。其他所用试剂均为分析纯或以上。
1.3 试验设计设置两组平行试验,研究不同施肥红壤中阿特拉津的环境归趋及调控措施的影响。第一组试验(试验Ⅰ)通过加入混合的14C- 和12C-阿特拉津研究污染物的环境归趋,共设立4个处理(表 1):仅添加阿特拉津的对照(CK),CK基础上添加牡蛎壳粉调节pH处理(OS)、添加木质素处理(L)、添加牡蛎壳粉及木质素处理(OS+L)。第二组试验(试验Ⅱ)在上述4个处理中仅添加12C-阿特拉津,另设立不添加阿特拉津的对照(CK0)(表 1),用于研究微生物群落响应。所有处理均设立3个重复。
|
|
表 1 试验处理 Table 1 Experimental treatment |
在开展矿化研究前,预先开展了牡蛎壳粉调节土壤pH的效果评估。结果表明,加入0.5% 或1% 牡蛎壳粉后两种施肥土壤pH的变化趋势一致,均为先快速增加,后缓慢下降。较高牡蛎壳粉用量(1%)能长期(110 d)维持土壤pH近中性,因此在研究中设置牡蛎壳粉用量为1%。木质素用量参照文献[15]设定为1%。
土壤微宇宙设置为:60 ml矿化管中装入5.0 g土壤,阿特拉津的加入参照文献进行[14]。添加土壤改良剂后调节土壤含水量为田间持水量的60%,于黑暗条件下室温(25 ℃)培养。试验Ⅰ每周取样测定14CO2,试验结束后破坏性取样,测定14C在土壤中的分布;试验Ⅱ于培养第7周、第14周进行破坏性取样,提取DNA后用于下游分子生态分析。
1.4 阿特拉津矿化、可提取态和结合态的测定矿化部分:用1 mol/L NaOH溶液吸收CO2,采用液体闪烁计数法测定14CO2量。计算累加的14CO2释放量,用于评价阿特拉津的矿化趋势。
可提取态:培养结束后,土壤样品风干过60目筛,丙酮、正己烷1︰1混合液超声提取30 min,2 500 r/min离心5 min,经装有5 g无水硫酸钠的滤纸过滤至茄型瓶中,重复3次。提取液旋转蒸干,正己烷溶解,液闪法测定可提取态含量。
腐殖酸与富里酸结合态:将经过丙酮、正己烷提取后的土壤风干,在充N2保护下加入无氧NaOH,250 r/min振荡24 h后,16 000 g离心30 min。收集上清液,经液闪法测定即为富里酸和腐殖酸结合态的和。再取2 ml上清液,加入HCl调节至pH为1.0,在4 ℃沉淀24 h,5 000 g离心30 min,取上清液测定,得到富里酸的结合态。两者相减即为阿特拉津与腐殖酸的结合态。
1.5 DNA提取、高通量测序及分析使用FastDNA® SPIN Kit for Soils试剂盒(MP Biomedicals, Solon, USA)提取土壤DNA。利用引物341F/805R扩增细菌16S rRNA基因,其中正向引物带有5-bp条形码标记。扩增后,经琼脂糖凝胶电泳验证,每个样品PCR扩增子等摩尔混合,提交至Illumina Miseq高通量测序平台(武汉贝纳)。使用默认参数的QIIME 1.9.1流程进行序列分析。序列经拼接、比对后在97% 相似性水平划分操作分类单元(operational taxonomic unit, OTU)。通过与SILVA基因数据库比较确定系统学分类。
1.6 细菌16S rRNA及降解功能基因定量PCR分析参照文献方法,采用定量PCR方法测定各样品细菌16S rRNA和阿特拉津降解功能基因(atzC和trzN)[17]的拷贝数。定量PCR标准品制备方法:PCR扩增基因片段,纯化后测定DNA浓度,经计算获得拷贝数。梯度稀释制备标准曲线(拷贝数范围102 ~ 108 copies/μl),定量PCR标准曲线R2 > 0.99,扩增效率≥80%。
采用SYBR Green方法对样品进行定量PCR测定,以无菌水作为阴性对照。扩增程序参照文献设定。根据熔解曲线或1% 琼脂糖凝胶电泳检测评价扩增的特异性。
1.7 AtzC及trzN基因克隆、测序与序列分析PCR扩增atzC及trzN基因,PCR产物经电泳鉴定,将目的条带纯化后克隆至pESI-T载体,并转化感受态大肠杆菌。对转化子的菌落进行PCR鉴定,并进一步使用试剂盒提取质粒,酶切法挑选阳性克隆并测序。所获序列经去除载体和引物部分后,用Mothur软件进行比对和划分操作分类单元OTU。采用MEGA6软件,以Neighbor-Joining方法建立atzC及trzN基因的系统发育树。
1.8 数据分析采用SPSS19.0进行单因素方差分析(ANOVA),并采用Duncan多重比较来判断差异显著性(P < 0.05)。用R Studio的vegan包计算布雷距离(bray distance)进行主坐标分析(principal co-ordinates analysis,PCoA)。三元图分析方法参考文献[15]。采用pheatmap包(https://CRAN.R-project.org/package=pheatmap)进行热图分析。
2 结果 2.1 不同处理下阿特拉津的环境归趋利用同位素示踪阿特拉津在土壤微宇宙中的归趋,结果如图 1所示。16周培养期间,两种施肥土壤中阿特拉津的背景矿化率分别为0.25% 和0.33%(图 1A)。添加1% 牡蛎壳粉后,阿特拉津的矿化显著增加:在U-OS处理中,16周累积矿化率达到43.3%;M-OS处理中,累积矿化率也达到9.51%。单独添加木质素处理(U-L、M-L)对阿特拉津矿化没有明显影响。在同时添加牡蛎壳、木质素的处理中,与对照相比,阿特拉津的矿化有所提高,其中U-OS+L组的矿化率为12.3%,M-OS+L组为2.67%。
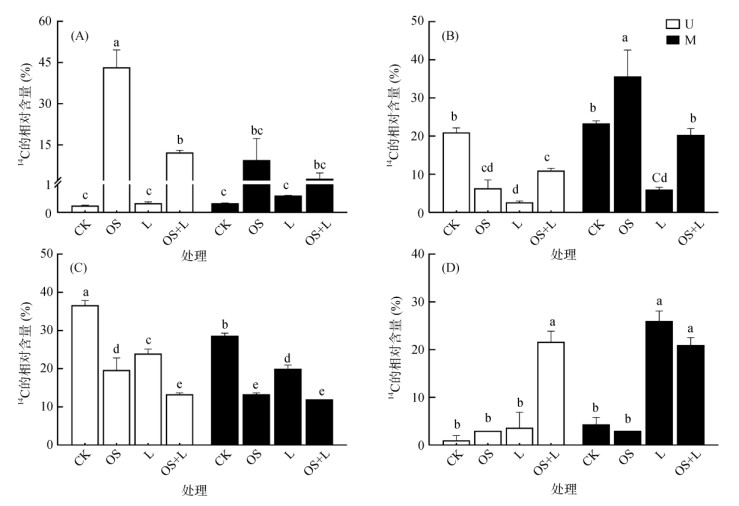
|
(A. 阿特拉津矿化率;B. 阿特拉津DCM可提取态;C. 阿特拉津富里酸结合态;D. 阿特拉津腐殖酸结合态;U:施化肥土壤;M:施有机肥土壤;CK:对照;OS:添加牡蛎壳粉;L:添加木质素;OS+L:添加牡蛎壳粉和木质素;图中小写字母不同表示处理间差异显著(P < 0.05),下同) 图 1 土壤微宇宙中阿特拉津的矿化及归趋 Fig. 1 Mineralization and fate of atrazine |
除矿化外,将土壤中留存的阿特拉津-14C进一步区分为DCM可提取态及有机质结合态(包括胡敏酸和富里酸组分)。施用猪粪土壤M中的DCM可提取态略高于施化肥土壤U(图 1B)。牡蛎壳粉的效应存在差异,在施化肥土壤中,U-OS处理显著降低可提取态至6.33%,但在M-OS处理中DCM提取态为35.7%,高于对照处理。与对照相比,木质素显著降低了两种土壤的DCM提取态,而同时加入牡蛎壳粉和木质素并未体现出叠加效应。
阿特拉津可与土壤有机质形成结合残留态。土壤改良处理总体上降低了富里酸结合部分(图 1C)。添加木质素对腐殖酸结合部分有促进作用(图 1D),U-OS+L处理中,21.7% 的阿特拉津-14C与腐殖酸结合,高于对照87.8倍;施猪粪土壤中,M-L、M-OS+L处理下腐殖酸结合态分别为26.0%、21.0%,是M-CK(4.3%)的6.1倍和4.9倍。
2.2 细菌16S rRNA基因与阿特拉津降解功能基因定量采用定量PCR测定细菌16S rRNA基因、阿特拉津降解功能基因atzC、trzN的拷贝数,结果如图 2所示。施猪粪土壤M中的16S rRNA基因拷贝数总体高于单施化肥土壤U。培养期间,U-CK0、U-CK、U-OS等各处理中16S rRNA基因拷贝数保持基本稳定;添加木质素处理中,拷贝数自培养初始的1.53×109 copies/g增加到培养结束时的3.54×109 (U-L)和4.22×109 copies/g(U-OS+L)(图 2A)。M-CK0、M-CK、M-OS各处理中拷贝数从5.24×109 copies/g分别下降到4.43×109、2.49×109和2.90×109 copies/g;添加木质素逆转了下降的趋势,M-L、M-OS+L处理中的拷贝数小幅增加到6.37×109和7.31×109 copies/g (图 2B)。

|
(A. 施化肥土壤;B. 施有机肥土壤;0W、7W、14W代表培养第0、7、14周,下同) 图 2 土壤微宇宙中的16S rRNA基因丰度 Fig. 2 16S rRNA gene abundances in inorganic fertilizer soil (A) and organic fertilizer soil(B) |
仅在添加牡蛎壳粉的处理(U-OS、M-OS)中成功扩增出atzC和trzN基因。培养期间,两个基因的丰度变化趋势基本一致。培养至第7周时,有机肥土壤中阿特拉津两种降解功能基因拷贝数分别达到2.59×107 copies/g和3.22×107 copies/g,几乎是施化肥土壤的近10倍。随着培养时间的延长,两种土壤中阿特拉津降解功能基因都显著降低,培养结束时,M-OS中功能基因拷贝数低于检测限。
2.3 土壤细菌群落多样性及组成细菌16S rRNA基因高通量测序共获得589万余条序列,单个样品的序列数为34 519 ~ 127 987。这些序列在97% 相似性水平划分为7 473个OTU,并基于此进行细菌多样性及物种组成分析。α-多样性分析结果(图 3A)显示,施用猪粪土壤M中细菌群落的物种丰富度及多样性均明显高于施化肥土壤U。与CK0处理相比,CK处理中的阿特拉津降低了微生物的物种丰富度及多样性,而牡蛎壳粉恢复了微生物的物种丰富度及多样性,木质素则降低了微生物的物种丰富度但增加了微生物的多样性。
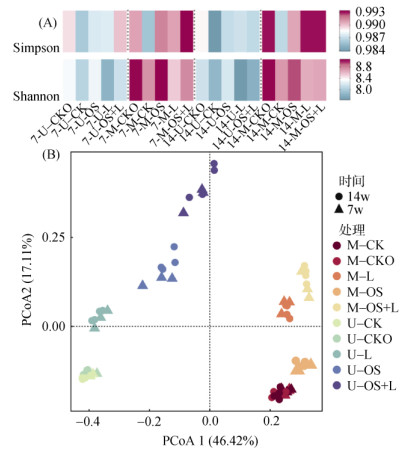
|
(A. Alpha多样性;B. PCoA分析) 图 3 细菌群落的多样性分析 Fig. 3 Diversity analysis of bacterial community |
采用主坐标分析(PCoA)计算各处理间的β-多样性差异。结果显示,培养期间两种土壤的细菌群落结构发生明显变化(图 3B)。排序图的第一轴和第二轴分别解释了46.42% 和17.11% 的群落变异。两种土壤主要沿着第一轴分开,显示长期不同施肥对细菌群落的重要影响。U-L、U-OS、U-OS+L与U-CK间距离逐渐增大,提示在施化肥土壤中,牡蛎壳粉调节pH对细菌群落的影响要大于木质素。在施猪粪土壤中,与对照M-CK的距离随M-OS、M-L、M-OS+L的顺序增加,表明木质素的作用较牡蛎壳粉更为明显。但阿特拉津对细菌群落β-多样性影响较小。
将所获序列与SILVA数据库进行比对后,选择相对丰度大于1% 的细菌门进行分析(图 4)。结果显示,初始阶段两个土壤中的优势细菌存在差异:施化肥土壤中绿弯菌门(Chloroflexi,相对丰度31.76% ~ 33.05%)、浮霉菌门(Planctomycetes,6.24% ~ 11.62%)的相对丰度明显高于施猪粪土壤(12.20% ~ 15.19%,4.07% ~ 7.84%),土壤M中放线菌门(Actinobacteria,16.8% ~ 19.91%)、厚壁菌门(Firmicutes,6.99% ~ 9.44%)的相对丰度均高于施化肥土壤。
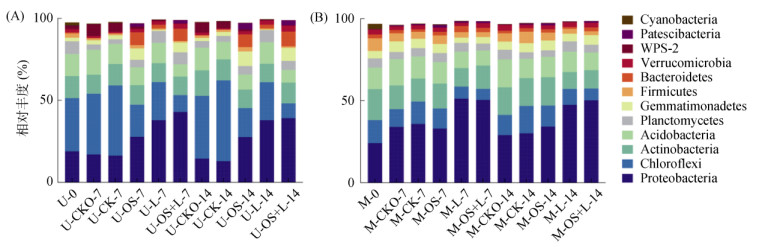
|
(A. 施化肥土壤;B. 施有机肥土壤) 图 4 细菌门水平的相对丰度 Fig. 4 Relative abundances of bacteria at phylum level |
牡蛎壳粉和木质素均明显改变了两种土壤的细菌组成,主要体现为变形菌门(Proteobacteria)相对丰度增加,绿弯菌门、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)降低。此外牡蛎壳粉明显增加了U-OS、U-OS+L、M-OS、M-OS+L处理中芽单胞菌门(Gemmatimonadetes)的相对丰度,增加了U-OS、U-OS+L中拟杆菌门(Bacteroidetes)的相对丰度;而木质素明显增加了U-L、M-L处理中的浮霉菌门比例。
为探究对照、牡蛎壳粉、木质素处理下细菌群落的响应特征,利用三元图找出差异物种,并在科水平对差异物种进行热图分析(图 5)。两种土壤各处理富集的细菌群落存在明显差异。木质素对微生物具有明显的选择作用,而牡蛎壳粉对施猪粪土壤中微生物的作用远大于在施化肥土壤中的作用。牡蛎壳粉增加了施化肥土壤中变形菌门的小单孢菌科Micromonospoaceae、芽单胞菌门的芽单胞菌科Gemmatimonadaceae,富集了施猪粪土壤中变形菌门的鞘脂单胞菌科Sphingomonadaceae、厚壁菌门的芽孢杆菌科Bacillaceae等。木质素在化肥土壤中显著富集了酸杆菌门的酸杆菌科Acidobacteriaceae (Subgroup 1)、放线菌门的酸热菌科Acidothermaceae、变形菌门的柄杆菌科Caulobacteraceae等;而在有机肥土壤中变形菌门嗜甲基菌科Methylophilaceae、鞘脂单胞菌科Sphingomonadaceae、伯克氏菌科Burkholderiaceae等相对丰度显著增加。同时添加木质素和牡蛎壳粉的U-OS+L、M-OS+L中生毛霉菌科Hyphomicrobiaceae变得相对丰富。这些结果表明,土壤改良剂可以通过改变土壤微生物的丰度和引入新的细菌谱系来改变土壤微生物群落结构。

|
(A、B:化肥处理第7、14周;C、D:有机肥处理第7、14周;E:差异OTU在主要细菌科水平上的热图) 图 5 不同处理间的差异OTU分析 Fig. 5 Difference OTU analysis between different treatments |
为揭示两种土壤中阿特拉津降解功能基因的组成差异,选择丰度较高的第7周U-OS、M-OS处理土壤样品进行atzC和trzN基因的克隆和测序。结果显示,两个土壤中的atzC基因序列高度同源,主要与菌株Citricoccus sp. TT3相关序列一致。获得的99个trzN序列可以分为Group Ⅰ和Ⅱ两类(图 6A)。Group Ⅰ由54个序列组成,主要与Arthrobacter sp. C3中的trzN基因高度一致,并在施化肥土壤U中占据优势;Group Ⅱ包括45个序列,与Nocardioides sp. DN36的trzN基因高度一致,在施猪粪土壤中占据优势(图 6B)。

|
图 6 trzN基因系统发育树(A)和在不同土壤中的比例(B) Fig. 6 Phylogenetic tree of trzN gene (A) and proportions in different soils (B) |
由于特殊的成土过程,红壤具有低pH和低肥力等特点[18]。本研究中涉及的两个不同施肥红壤,pH均小于6,土壤有机质1.20% ~ 1.39%[16],对土壤微生物群落及其功能可能产生影响[11-12]。Ren等[1]对潮土、黑土、水稻土、红壤的比较研究发现,红壤对多环芳烃的降解率最低;Shen等[2]发现,红壤对红霉素的矿化远低于黑土和潮土。类似地,本研究发现长期施化肥(U)或猪粪(M)的旱地红壤中阿特拉津的微生物降解过程十分缓慢,16周的累积矿化率均低于0.33%。这可能与逆境下阿特拉津降解菌生长缓慢、数量少、分解代谢活性低,以及阿特拉津生物有效性低的特点有关,导致阿特拉津的自然衰减能力严重不足[19-20]。此外,在两个土壤中,阿特拉津的富里酸结合态呈现U > M,而腐殖酸结合态呈现U < M的特征,这很可能与长期不同施肥导致的土壤有机质差异有关。因此,改良红壤、调节土壤理化性质、调控土壤微生物群落组成,可能是促进阿特拉津微生物降解的有效办法。
3.2 牡蛎壳粉调节下阿特拉津的微生物转化机制本研究中,牡蛎壳粉极大促进了阿特拉津的生物矿化,且对施化肥土壤(pH 5.13)的效果要好于施猪粪土壤(pH 6.20)。生物矿化的增加进而导致了不可提取残留态和提取态阿特拉津的明显下降。牡蛎壳粉可以改善土壤有机质、有效磷和交换性阳离子等养分平衡,为微生物生长提供了有利条件[21],但由于U-OS、M-OS处理中16S rRNA基因丰度均没有明显的增长,牡蛎壳粉的调控作用并不体现为对细菌数量的刺激。更有可能,牡蛎壳粉通过调节土壤pH[16]影响微生物群落多样性及组成,从而提高了微生物降解功能。例如,最适生长pH为7.0的Flavisolibacter,其在U-OS中的相对丰度达6.75%,远高于U-CK中的0.08%;不少结果表明相关OS处理土壤中富集的种类如Nitrospira、Micromonospora、Pseudarthrobacter的丰度与土壤pH呈负相关[22-23]。
部分在OS处理土壤中被富集的细菌可能参与阿特拉津代谢。由三元图和热图分析可见,在矿化率最高的U-OS处理中被显著富集的Gemmatimonadaceae、Micromonosporaceae等[24-25],在M-OS中被富集的Sphingomonadaceae和Bacillaceae,在M-OS+L中的Burkholderiaceae和Xanthobacteraceae等[26-27],据报道可以降解阿特拉津。阿特拉津降解功能基因的分析为牡蛎壳粉的刺激效应提供了进一步证据。在两种施肥土壤的OS处理中,均能检出atzC和trzN基因,直接证实阿特拉津降解菌的存在。TrzN基因的序列同源性差异提示,同样的pH调节措施,在施猪粪土壤中有利于诺卡氏菌属降解菌,而在施化肥土壤可能有利于节杆菌属降解菌,提示阿特拉津降解微生物的生态位差异。
3.3 木质素对阿特拉津环境归趋的影响木质素是具有有机污染物修复潜力的生物刺激材料[16, 28],已被证明可以有效促进多环芳烃类污染物的微生物降解。本研究中,在单一木质素处理下显著富集的Methylophilaceae、Hyphomicrobium、Sphingomonadaceae、Burkholderiaceae等细菌种属,均与木质素结构中甲基、芳香基团的降解过程有关。但是,这些微生物的丰度增加并没有促进阿特拉津的矿化。与牡蛎壳粉不同,木质素对阿特拉津的效果主要体现为土壤腐殖质结合态残留态的增加,这有助于减少污染物的有效浓度,从而降低生态和人体健康风险。Taverna等[29]的研究表明,木质素可以作为很好的农药控释材料,即使在高浓度溶液中也具有突出的阿特拉津吸附效果。这可能是因为木质素作为一种交联的酚类聚合物,具有丰富的官能团,可与有机污染物产生相互作用,以共价键、弱相互作用等方式将污染物固定下来,从而实现阿特拉津污染风险的有效控制[30]。
4 结论两种不同施肥方式下旱地红壤中阿特拉津的生物降解活性不足,导致了较低的污染物矿化率。土壤改良措施不同程度上改变土壤性质及微生物群落,并进一步影响了阿特拉津的环境行为。其中,牡蛎壳粉有效调节红壤pH,可能通过促进嗜中性阿特拉津降解微生物的生长增加阿特拉津的降解,主要体现为阿特拉津矿化的促进;木质素的加入,吸附固定了土壤中的阿特拉津,从而增加阿特拉津吸附残留态。本研究结果有助于阐明旱地红壤中阿特拉津的微生物降解规律,并为探究促进有机污染物在红壤中降解的方法提供科学依据。
| [1] |
Ren G D, Teng Y, Ren W J, et al. Pyrene dissipation potential varies with soil type and associated bacterial community changes[J]. Soil Biology and Biochemistry, 2016, 103: 71-85 DOI:10.1016/j.soilbio.2016.08.007 (  0) 0) |
| [2] |
Shen D H, Gu X, Zheng Y Y, et al. The fate of erythromycin in soils and its effect on soil microbial community structure[J]. Science of the Total Environment, 2022, 820: 153373 DOI:10.1016/j.scitotenv.2022.153373 (  0) 0) |
| [3] |
Dou R N, Sun J T, Deng F C, et al. Contamination of pyrethroids and atrazine in greenhouse and open-field agricultural soils in China[J]. Science of the Total Environment, 2020, 701: 134916 DOI:10.1016/j.scitotenv.2019.134916 (  0) 0) |
| [4] |
Shipitalo M J, Owens L B. Atrazine, deethylatrazine, and deisopropylatrazine in surface runoff from conservation tilled watersheds[J]. Environmental Science & Technology, 2003, 37(5): 944-950 (  0) 0) |
| [5] |
Lin K Y, Chu W. Simulation and quantification of the natural decay of a typical endocrine disrupting chemical Atrazine in an aquatic system[J]. Journal of Hazardous Materials, 2011, 192(3): 1260-1266 DOI:10.1016/j.jhazmat.2011.06.042 (  0) 0) |
| [6] |
Radosevich M, Traina S J, Tuovinen O H. Biodegradation of atrazine in surface soils and subsurface sediments collected from an agricultural research farm[J]. Biodegradation, 1996, 7(2): 137-149 DOI:10.1007/BF00114626 (  0) 0) |
| [7] |
Tillitt D E, Papoulias D M, Whyte J J, et al. Atrazine reduces reproduction in fathead minnow (Pimephales promelas)[J]. Aquatic Toxicology, 2010, 99(2): 149-159 DOI:10.1016/j.aquatox.2010.04.011 (  0) 0) |
| [8] |
Zaya R M, Amini Z, Whitaker A S, et al. Atrazine exposure affects growth, body condition and liver health in Xenopus laevis tadpoles[J]. Aquatic Toxicology, 2011, 104(3/4): 243-253 (  0) 0) |
| [9] |
叶新强, 鲁岩, 张恒. 除草剂阿特拉津的使用与危害[J]. 环境科学与管理, 2006, 31(8): 95-97 DOI:10.3969/j.issn.1673-1212.2006.08.033 (  0) 0) |
| [10] |
Barriuso E, Houot S. Rapid meneralization of the s-triazine ring of atrazine in soils in relation to soil management[J]. Soil Biology and Biochemistry, 1996, 28(10/11): 1341-1348 (  0) 0) |
| [11] |
Zhou J, Guan D W, Zhou B K, et al. Influence of 34-years of fertilization on bacterial communities in an intensively cultivated black soil in northeast China[J]. Soil Biology and Biochemistry, 2015, 90: 42-51 DOI:10.1016/j.soilbio.2015.07.005 (  0) 0) |
| [12] |
Guo Z C, Zhang Z B, Zhou H, et al. Long-term animal manure application promoted biological binding agents but not soil aggregation in a Vertisol[J]. Soil and Tillage Research, 2018, 180: 232-237 DOI:10.1016/j.still.2018.03.007 (  0) 0) |
| [13] |
付登强, 滕应, 骆永明, 等. 土壤pH、水分及温度对长期污染土壤中苯并[a]芘动态变化的影响初探[J]. 土壤, 2012, 44(3): 444-449 DOI:10.3969/j.issn.0253-9829.2012.03.014 (  0) 0) |
| [14] |
Wu Y C, Ding Q M, Zhu Q H, et al. Contributions of ryegrass, lignin and rhamnolipid to polycyclic aromatic hydrocarbon dissipation in an arable soil[J]. Soil Biology and Biochemistry, 2018, 118: 27-34 DOI:10.1016/j.soilbio.2017.11.022 (  0) 0) |
| [15] |
孙月. 多环芳烃污染土壤木质素共代谢修复的机制与应用潜力[D]. 南京: 中国科学院南京土壤研究所, 2020: 17–33.
(  0) 0) |
| [16] |
Chen W, Teng Y, Li Z G, et al. Mechanisms by which organic fertilizer and effective microbes mitigate peanut continuous cropping yield constraints in a red soil of South China[J]. Applied Soil Ecology, 2018, 128: 23-34 DOI:10.1016/j.apsoil.2018.03.018 (  0) 0) |
| [17] |
Douglass J F, Radosevich M, Tuovinen O H. Biomineralization of atrazine and analysis of 16S rRNA and catabolic genes of atrazine degraders in a former pesticide mixing site and a machinery washing area[J]. Journal of Soils and Sediments, 2016, 16(9): 2263-2274 DOI:10.1007/s11368-016-1416-3 (  0) 0) |
| [18] |
赵其国. 红壤物质循环及其调控[M].
科学出版社, 北京, 2002
(  0) 0) |
| [19] |
Fang H, Lian J J, Wang H F, et al. Exploring bacterial community structure and function associated with atrazine biodegradation in repeatedly treated soils[J]. Journal of Hazardous Materials, 2015, 286: 457-465 DOI:10.1016/j.jhazmat.2015.01.006 (  0) 0) |
| [20] |
Huang H, Zhang C L, Rong Q, et al. Effect of two organic amendments on atrazine degradation and microorganisms in soil[J]. Applied Soil Ecology, 2020, 152: 103564 DOI:10.1016/j.apsoil.2020.103564 (  0) 0) |
| [21] |
Lee C H, Lee D K, Ali M A, et al. Effects of oyster shell on soil chemical and biological properties and cabbage productivity as a liming materials[J]. Waste Management, 2008, 28(12): 2702-2708 DOI:10.1016/j.wasman.2007.12.005 (  0) 0) |
| [22] |
Wang C Y, Zhou X, Guo D, et al. Soil pH is the primary factor driving the distribution and function of microorganisms in farmland soils in northeastern China[J]. Annals of Microbiology, 2019, 69(13): 1461-1473 DOI:10.1007/s13213-019-01529-9 (  0) 0) |
| [23] |
Liu J J, Sui Y Y, Yu Z H, et al. High throughput sequencing analysis of biogeographical distribution of bacterial communities in the black soils of northeast China[J]. Soil Biology and Biochemistry, 2014, 70: 113-122 DOI:10.1016/j.soilbio.2013.12.014 (  0) 0) |
| [24] |
Luo S W, Ren L, Wu W J, et al. Impacts of earthworm casts on atrazine catabolism and bacterial community structure in laterite soil[J]. Journal of Hazardous Materials, 2022, 425: 127778 DOI:10.1016/j.jhazmat.2021.127778 (  0) 0) |
| [25] |
Meyer A H, Dybala-Defratyka A, Alaimo P J, et al. Cytochrome P450-catalyzed dealkylation of atrazine by Rhodococcus sp. strain NI86/21 involves hydrogen atom transfer rather than single electron transfer[J]. Dalton Transactions (Cambridge, England, 2014, 43(32): 12175-12186 DOI:10.1039/C4DT00891J (  0) 0) |
| [26] |
Espín Y, Aranzulla G, Álvarez-Ortí M, et al. Microbial community and atrazine-degrading genetic potential in deep zones of a hypersaline lake-aquifer system[J]. Applied Sciences, 2020, 10(20): 7111 DOI:10.3390/app10207111 (  0) 0) |
| [27] |
Sharma P, Chopra A, Cameotra S S, et al. Efficient biotransformation of herbicide diuron by bacterial strain Micrococcus sp. PS-1[J]. Biodegradation, 2010, 21(6): 979-987 DOI:10.1007/s10532-010-9357-9 (  0) 0) |
| [28] |
孙月, 潘彦硕, 曾军, 等. 木质素与蚯蚓对黑麦草生物量及土壤微生物群落的影响[J]. 土壤, 2021, 53(2): 313-320 (  0) 0) |
| [29] |
Taverna M E, Busatto C A, Lescano M R, et al. Microparticles based on ionic and organosolv lignins for the controlled release of atrazine[J]. Journal of Hazardous Materials, 2018, 359: 139-147 DOI:10.1016/j.jhazmat.2018.07.010 (  0) 0) |
| [30] |
Gao B Q, Li P, Yang R, et al. Investigation of multiple adsorption mechanisms for efficient removal of ofloxacin from water using lignin-based adsorbents[J]. Scientific Reports, 2019, 9: 637 DOI:10.1038/s41598-018-37206-1 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China
 2022, Vol. 54
2022, Vol. 54


