2. 中国科学院海岸带环境过程与生态修复重点实验室(烟台海岸带研究所), 山东烟台 264003;
3. 山东省农业科学院黄河三角洲现代农业研究院, 山东东营 257091
土壤盐渍化是造成滨海土壤质量下降的重要原因之一。滨海盐土高盐度、高pH的特征对土壤肥力和微生物的多样性及生态功能均有不利影响[1]。滨海盐土氮的有效性低、保水保肥性差,严重制约区域的土壤地力。解析滨海盐土氮循环微生物的活性、多样性及分布规律,能够为理解滨海土壤生态系统功能退化提供基础数据,对改善土壤性质,提高肥力,探索并最终形成盐渍化生态系统修复的技术体系具有重要意义。
大量研究表明,盐分会抑制氮的矿化作用。但也有部分研究显示,轻度盐渍化会促进氮的矿化,而重度盐渍化会抑制氮的矿化,尤其是当土壤中含盐量达到0.5% ~ 1.0% 时,土壤的硝化作用会被完全抑制[2-4]。硝化过程受微生物驱动,其中氨氧化过程是其限速步骤,由化能自养的氨氧化细菌(AOB)和氨氧化古菌(AOA)共同完成。这两种菌都含有编码催化氨氧化第一步反应的氨单加氧酶基因(amo)。利用氨单加氧酶α亚基基因(amoA)作为分子标记可研究AOB和AOA在环境中的多样性、群落组成及丰度特征[5]。盐度也是影响土壤氨氧化微生物功能和多样性的重要因子,高盐和低盐环境中,AOA和AOB的群落组成也差别迥异[6]。Sahan等[7]证实韦斯特谢尔德河口的AOB多样性在低盐区高于高盐区。Mosier和Francis[8]在对旧金山湾沉积物AOA的分析中发现,来自低盐河口区的AOA形成了独特的低盐群。滨海盐土除了具有明显的盐度梯度外,还有营养贫瘠、pH偏高等特征。然而目前针对这种土壤的AOA和AOB活性、组成、丰度及其环境调控机制尚不清楚。
莱州湾沿岸海水入侵面积超过4 300 km2,盐渍化面积达2 100 km2,西南岸盐渍化程度最高,土壤自沿海到陆地呈现明显的梯度盐渍化特征。前期研究发现,该环境盐度对蓝细菌的组成和分布具有强烈影响[9],但盐度梯度对氮循环微生物的影响并不清楚。由此,本研究拟利用地球化学、生物化学与微生物分子生态学交叉手段,研究莱州湾滨海盐渍土不同盐度梯度下AOA和AOB的多样性、群落组成、活性特征及其对环境因子的响应,以为深入研究盐渍化土壤氮素循环特征及其功能类群的适应机制提供理论依据。
1 材料与方法 1.1 样品采集及处理本研究在莱州湾西南岸(119°09′ ~ 119°36′ E,36°56′ ~ 37°46′ N)的黄河口(YR)、白浪河口(BR)、堤河口(DR)及胶莱河口(JR)布设4个样带断面、14个站位(图 1)进行样品采集。其中,黄河口断面5个站位(YR01 ~ YR05),白浪河口断面2个站位(DR01和DR02),堤河口断面3个站位(DR01 ~ DR03),胶莱河口断面4个站位(JR01 ~ JR04)。

|
图 1 莱州湾西南岸河口采样站位图 Fig. 1 Sampling sites along estuaries of southwestern coast of Laizhou Bay |
样品采集时间为2014年7月,五点取样法取表层0 ~ 5 cm土样混匀。样品冰上保存转移到实验室,一部分4℃保鲜并于48 h内进行氨氧化活性测定,另一部分–80℃冷冻,用于测定土壤环境因子和提取土壤DNA。
1.2 土壤理化因子的测定土壤pH测定采用电位法;土壤含水量测定采用烘干法;土壤盐度通过测定水土质量比为1∶5土壤溶液的电导率来获得。土壤经冷冻干燥后,2.5 g干土中加入25 ml 2 mol/L KCl溶液浸提,振荡1 h,过滤,利用连续流动分析仪测定土壤铵态氮(NH4+-N)、硝态氮(NO3–-N)和亚硝态氮(NO2–-N)含量。土壤全氮(TN)、总有机碳(TOC)含量利用元素分析仪测定;土壤粒径(GS)采用激光粒度仪分析。
1.3 土壤硝化潜势(nitrification potential,NP)的测定采用氯酸盐抑制法[10],以每小时每克干土产生的NO2–-N的量来表征。
1.4 土壤总DNA的提取与测定称取0.5 ~ 1.0 g新鲜土样,准确记录数值,通过土壤含水量换算为干土质量,以便后续基因拷贝数的计算。利用FastDNA®SPIN®(MP Biomedical,美国)土壤DNA提取试剂盒按说明书要求提取DNA。提取的DNA用微量紫外分光光度计(NanoDrop 2000c,美国)测定浓度及纯度,分装后于–80℃保存。
1) AOB和AOA丰度分析。采用荧光定量PCR技术测定AOB-amoA(amoA1F/amoA2R)和AOA-amoA (Arch-amoA-for/Arch-amoA-rev)基因的拷贝数。计算质粒拷贝数时,分别稀释AOA和AOB质粒至10–1 ~ 10–8,以拷贝数的对数为横坐标,CT值为纵坐标建立标准曲线。每个样品3次重复,并设不加模板的反应管为阴性对照。所有PCR反应的扩增效率均在90% 以上,相关系数(R2)均大于98%。
2) AOB和AOA群落结构分析。以土壤总DNA为模板,采用末端限制性片断长度多态性方法(T-RFLP)分析盐度梯度土壤中AOB(amoA1F/amoA2R)和AOA(Arch-amoAF/Arch-amoAR)的群落结构。其中每对引物的前引物5'端标记有荧光基团6-羧基荧光素(FAM)。AOA-amoA内切酶为RsaI和HhaI,AOB-amoA内切酶为RsaI和MspI,酶切产物送生工生物工程(上海)股份有限公司进行毛细管电泳检测。
1.5 数据处理与统计分析利用SPSS统计软件中的单因素方差分析(ANOVA)检验盐度梯度对硝化潜势、AOB和AOA的丰度及多样性的影响,并利用最小显著差异法(LSD)比较不同盐度间的差异;利用Spearman相关性分析检验硝化潜势、AOB和AOA的丰度及多样性与环境因子间的关系。通过群落生态分析软件PRIMER-6对AOA和AOB的群落结构进行非度量多维尺度(NMDS)排序,并利用ANOSIM检验盐度梯度对AOB和AOA群落结构的影响。利用CANOCO软件中的典范对应分析(CCA或RDA)探索氨氧化微生物群落结构与环境变量之间的关系。
2 结果与分析 2.1 土壤理化因子本研究获得的所有样品可划分为低盐度(盐度平均值6.8‰,变幅6.4‰ ~ 7.6‰)、中盐度(盐度平均值16.44‰,变幅12.5‰ ~ 23.9‰)、高盐度(盐度平均值44.47‰,变幅34.7‰ ~ 51.3‰)3个梯度[11], 其中低盐度包括站位YR05、JR01、DR01,中盐度包括站位YR01、YR04、BR01、BR02、DR03、JR02、JR03、JR04,高盐度包括YR02、DR02、YR03。pH范围为7.35 ~ 7.58,属于弱碱性土壤。无机氮营养盐中以NO3–-N为主,其中低、中、高盐度土壤NO3–-N含量平均值分别为6.05、26.37和23.25 mg/kg。NH4+-N和NO2–-N含量不同盐度梯度间差别不大。全氮含量范围为0.59 ~ 0.88 g/kg,总有机碳含量5.77 ~ 7.19 g/kg(表 1)。
|
|
表 1 土壤样品理化因子(n=3) Table 1 Physicochemical parameters of saline soils of southwestern coast of Laizhou Bay |
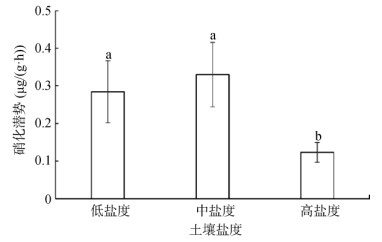
从图 2中可以看出,高盐度土壤硝化潜势平均为0.12 μg/(g·h),与低盐度(0.28 μg/(g·h))和中盐度(0.33 μg/(g·h))相比显著降低(P < 0.01),说明高盐度显著抑制了土壤的硝化潜势。
|
(柱图上方不同小写字母表示组间差异显著(P < 0.05),下同) 图 2 不同盐度梯度土壤的硝化潜势 Fig. 2 Nitrification potentials in soils under different salinity gradients |
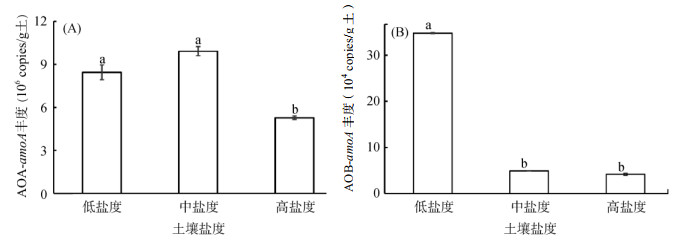
莱州湾滨海盐土中AOB的丰度为104 ~ 105 copies/g土,AOA的丰度为106 copies/g土(图 3)。所有样品中AOA-amoA基因丰度高出AOB-amoA约2个数量级,说明莱州湾滨海盐土中的氨氧化微生物群落以AOA为主。
|
(柱图上方不同小写字母表示组间差异显著(P < 0.05)) 图 3 不同盐度梯度间AOA(A)和AOB(B)amoA基因丰度的比较 Fig. 3 Abundances of AOA (A) and AOB (B) amoA in soils under different salinity gradients |
AOA-amoA基因丰度在中盐度土壤中的平均值最高,为9.92×106 copies/g土,其次是低盐度土壤(8.45×106 copies/g土),高盐度土壤中最低(5.28×106 copies/g土),其中高盐度土壤中AOA-amoA的丰度显著低于低、中盐度土壤(P < 0.05,图 3A)。
AOB-amoA基因丰度在盐度梯度间存在极显著性差异(P < 0.01,图 3B),其中低盐度土壤AOB-amoA基因丰度为3.48×105 copies/g土,显著高于中盐度土壤(4.90×104 copies/g土)和高盐度土壤(4.16×104 copies/g土)。
2.4 基于T-RFLP分析的土壤AOA和AOB多样性和群落结构除样品JR05的AOA-amoA基因没有获得理想的结果外,其他样品经T-RFLP分析发现,AOA-amoA和AOB-amoA的T-RF数目在低、中、高盐度土壤中均无显著性差异(表 3)。AOA的均匀度指数和Shannon指数在低、高盐度土壤中差异不显著(P > 0.05),但均显著高于中盐度土壤(P < 0.05)(表 3)。
|
|
表 3 基于T-RFLP分析的滨海盐土AOA和AOB的多样性指数 Table 3 Diversity indexes of AOA and AOB in saline soils based on T-RFLP analysis |
NMDS分析结果显示,所有样品的AOA类群可分为2个群组:A组(BR01、BR02、DR03、YR04、JR01、YR02和YR03)和B组(JR04、JR02、JR03、YR01和DR02)。低盐度样品DR01的AOA群落结构与其他样品差异较大(图 4A)。ANOSIM检验(表 4)发现,AOA的群落结构不受盐度梯度影响(P=0.23)。AOB的NMDS分析结果(图 4B)显示,所有样品被分为3个群组:A组包括DR01、DR02、DR03、JR01和BR01;B组包括YR01、YR02、YR03、YR05、JR03、和BR02;C组包括YR04和JR04。

|
图 4 AOA(A)和AOB(B)amoA基因群落结构的非度量多维标度(NMDS)分析 Fig. 4 NMDS analysis of community composition of AOA and AOB amoA genes in saline soils |
|
|
表 4 盐度梯度间AOA和AOB amoA基因群落结构的ANOSIM分析 Table 4 ANOSIM analysis for groupings of AOA and AOB amoA gene communities between salinity gradients |
从表 5可以看出,莱州湾滨海盐土的硝化潜势与盐度(ρ= –0.58)和pH(ρ= –0.55)显著负相关(P < 0.05),而与NO3–-N水平显著正相关(ρ=0.37,P < 0.05)。AOA的丰度与土壤pH显著正相关(ρ=0.39,P < 0.05),而与土壤全氮(ρ=–0.36)、总有机碳(ρ=–0.37)、NH4+-N(ρ= –0.45)和NO2–-N含量(ρ= –0.33)显著负相关(P < 0.05)。AOB的丰度与所有环境因子的相关性均不显著(P > 0.05)。另外,AOA/AOB比值与土壤pH显著正相关(ρ=0.36,P < 0.05),而与全氮含量(ρ=–0.39,P < 0.05)显著负相关。AOA和AOB的Shannon指数与所有环境因子均无显著相关性(P > 0.05)。典范对应分析发现,AOA和AOB的群落结构与所有环境因子均无显著性相关(P > 0.05)。
|
|
表 5 AOA和AOB丰度、多样性指数与环境因子间的Spearman相关性(ρ值) Table 5 Spearman's correlation coefficients (ρ) of nitrification potential, abundance and Shannon index of AOA and AOB with physicochemical factors |
将硝化潜势与微生物指标(amoA丰度、AOA/AOB比值、Shannon指数)进行Spearman相关分析发现,硝化潜势与AOA和AOB的amoA基因丰度并无显著相关(P > 0.05),但与AOA/AOB比值存在显著负相关关系(ρ=–0.35,P=0.04);另外,硝化潜势与AOA的Shannon指数也呈显著负相关关系(ρ=–0.68,P=0.008)。
3 讨论 3.1 莱州湾西南岸滨海盐土特性莱州湾河口区土壤具有明显的盐度梯度特征,盐度范围为6.4‰ ~ 51.3‰,跨度较大,总体沿入海方向呈升高趋势。土壤属弱碱性,肥力较低,无机氮(NH4+-N、NO3–-N和NO2–-N总和)含量在4.33 ~ 132.98 mg/kg,远远低于耕地的氮水平,有机碳含量也低于一般土壤水平[12]。
3.2 滨海盐土硝化潜力的特征及影响因素莱州湾滨海盐土的潜在硝化速率在0.11 ~ 0.51 μg/(g·h),处于大多数河口区硝化速率的低值区[13-14],可能的原因是这些河口区的研究对象为沉积物,其中氮含量相对较高,而本研究区域土壤NH4+-N含量非常低,平均仅为0.14 mg/kg,因此限制了硝化活性。将所有样品按盐度高(34.7‰ ~ 51.3‰)、中(12.5‰ ~ 23.9‰)、低(6.4‰ ~ 7.6‰)分组发现,土壤硝化潜势并不是简单地随盐度升高而降低,而是中盐度最高,但与低盐度差异不显著,高盐度最低(图 2)。该结果与以往的报道一致,比如Colne河口[14]、Randers Fjord河口[15]和Douro河口[16]。盐度对硝化潜势的影响机制还不明确。有研究认为,盐度升高会降低土壤对NH4+-N的吸附能力[17],使氨氧化反应的底物减少,因此限制了氨氧化活性。在低盐度情况下,土壤NH4+-N可利用性较高,高浓度NH4+-N可能会抑制很多氨氧化微生物类群[13],特别对AOA具有抑制作用[18];中盐度土壤的NH4+-N水平可能更适合氨氧化活性;而高盐度土壤中NH4+-N可利用性低,又限制了氨氧化活性[12]。同时有研究认为,盐度变化会影响氨氧化微生物的生理,改变氨氧化微生物的群落结构,进而影响土壤氨氧化活性[19]。
Spearman相关性分析显示(表 5),除盐度外,硝化潜势还与pH显著负相关。莱州湾西南岸土壤pH范围为7.11 ~ 7.94,属于弱碱性土壤。大量研究表明,土壤pH是影响硝化活性的关键因素,pH 7.5 ~ 8.5是土壤硝化活性的最佳pH范围,而酸性和碱性条件都会抑制土壤的硝化活性[20-21]。一方面可能是碱性和酸性条件下产生的自由NH3和亚硝酸对氨氧化微生物细胞的毒性作用限制了硝化活性[22];另一方面可能是酸性条件下,NH3被离子化变成NH4+,增加了氨氧化的能量需求[23]。按照这些假设,本研究中的pH范围应该比较适合土壤的硝化活性,然而结果却是硝化活性随土壤pH的升高而降低,推测其可能原因是,该区域土壤碱度升高是海水入侵导致的土壤盐渍化所致,因此,这种负相关可能是盐度和pH共同作用的结果。
3.3 滨海盐土氨氧化微生物的丰度特征和环境响应莱州湾滨海盐土所有样品中氨氧化微生物以AOA为主,这与国内外大多数河口环境的研究结果相一致[13, 24]。当然,也有例外,在Douro河口[16]和Cochin河口[25],AOB的丰度显著高于AOA,较高的NH4+-N水平被认为可能是造成这种特殊现象的主要原因。AOA-amoA基因丰度在中盐度土壤中较高,高盐度土壤中最低(图 3A),而AOB丰度对盐度的响应趋势与AOA不同,在中、高盐度土壤中均被显著抑制(图 3B)。AOA和AOB对盐度梯度的响应与很多河口类似[26],即相对于AOB,AOA对盐度的耐受能力更高。这可能是由于AOA和AOB对NH4+-N亲和力的不同所导致的[27],即AOB偏爱高NH4+-N环境,低盐促进土壤对NH4+-N的吸附,因而有利于AOB的生长;而AOA对NH4+-N的亲和力较高,偏爱低NH4+-N环境,中盐度土壤的NH4+-N水平可能比较适合AOA生长。当然,也有可能是AOA和AOB细胞对盐度的生理反应不同从而导致了这种生境选择[19]。AOA丰度与土壤pH显著正相关,与已有的认知“AOA在酸性环境中占主导,而AOB在中性和碱性土壤中占优势”相悖[20, 23]。在莱州湾西南岸盐土中,土壤pH在氨氧化微生物的适宜范围内,此时pH的影响比较弱,而有限的氮底物则可能是氨氧化微生物生长的限制因素,pH越高,越利于NH4+-N向NH3的转化,因而促进了AOA的生长。此外,AOA丰度与土壤肥力显著负相关(表 5)。一般情况下,AOA在肥力低的环境中贡献较大,主要是因为AOA对底物氨的亲和力远高于AOB[27],因此在低肥力土壤中更具竞争优势。白浪河口有效氮含量最低,因此,该区域AOA丰度明显高于其他河口,而AOB丰度则相反。
3.4 滨海盐土氨氧化微生物群落的分布特征盐度被认为是控制河口区AOB和AOA群落结构和多样性最主要的因素。Bernhard等[13]发现在低、中盐度样品中,AOB主要隶属于亚硝化螺菌属相关类群以及亚硝化单胞菌属,而在高盐度环境中,AOB群落结构演替为以亚硝化螺菌属为主。另外,在韦斯特谢尔德河口,低盐度站点AOB的多样性较高盐度站点高[28]。在对旧金山湾沉积物AOA的分析中发现,来自低盐度河口区的AOA形成了独特的低盐度类群[6]。然而本研究中,盐度对AOB和AOA的多样性和群落结构均无显著影响。
3 5硝化潜势与氨氧化微生物的关系硝化潜势与AOA或AOB的丰度均无显著相关性,而与AOA/AOB比值显著负相关(表 5)。这说明在莱州湾西南岸滨海盐土中,虽然AOA是优势氨氧化菌,但其丰度变化并不能很好地解释氨氧化活性的变化。该结果与之前本课题组在该区域碱土中(盐度0.52‰,pH 8.0)添加生物质炭后,硝化潜势与AOA丰度显著相关的结果不一致[29],暗示了环境因素(比如盐度及其造成的NH4+-N有效性差异,以及生物质炭添加干预)是调控该区域滨海盐土硝化潜势的主要因素。而且,即使该环境中AOA在丰度上占优势,这些AOA也不一定表现氨氧化活性。另外,AOA/AOB比值一般受土壤NH4+-N水平调控,随NH4+-N水平的升高而降低。在本研究贫瘠的土壤中,NH4+-N恰恰是硝化活性的限制因素,因此硝化潜势与AOA/AOB比值间的负相关关系,有可能是其对氮素需求的间接表现。
4 结论莱州湾西南岸滨海盐土是非常脆弱的生态系统,盐度高、pH高、营养匮乏。在这种环境中,盐度的波动对土壤氨氧化活性和功能微生物都会产生剧烈的影响。总体来说,中盐度(12.5‰ ~ 23.9‰)比较适宜土壤硝化活性,而高盐度会显著抑制硝化活性。AOA和AOB对盐度波动响应并不一致:AOA偏爱中盐度环境,而AOB则更喜低盐度环境。盐度和pH造成的土壤氮素有效性的变化可能是影响滨海盐土硝化活性和微生物丰度及群落组成的核心因素。
| [1] |
Dendooven L, Alcántara-Hernández R J, Valenzuela-Encinas C, et al. Dynamics of carbon and nitrogen in an extreme alkaline saline soil: A review[J]. Soil Biology and Biochemistry, 2010, 42(6): 865-877 DOI:10.1016/j.soilbio.2010.02.014 (  0) 0) |
| [2] |
张先富, 李卉, 洪梅, 等. 苏打盐碱土对氮转化的影响[J]. 吉林大学学报(地球科学版), 2012, 42(4): 1145-1150 DOI:10.13278/j.cnki.jjuese.2012.04.024 (  0) 0) |
| [3] |
Reddy N, Crohn D M. Effects of soil salinity and carbon availability from organic amendments on nitrous oxide emissions[J]. Geoderma, 2014, 235/236: 363-371 DOI:10.1016/j.geoderma.2014.07.022 (  0) 0) |
| [4] |
李红强, 姚荣江, 杨劲松, 等. 盐渍化对农田氮素转化过程的影响机制和增效调控途径[J]. 应用生态学报, 2020, 31(11): 3915-3924 DOI:10.13287/j.1001-9332.202011.023 (  0) 0) |
| [5] |
Gubry-Rangin C, Nicol G W, Prosser J I. Archaea rather than bacteria control nitrification in two agricultural acidic soils[J]. FEMS Microbiology Ecology, 2010, 74(3): 566-574 DOI:10.1111/j.1574-6941.2010.00971.x (  0) 0) |
| [6] |
Bernhard A E, Donn T, Giblin A E, et al. Loss of diversity of ammonia-oxidizing bacteria correlates with increasing salinity in an estuary system[J]. Environmental Microbiology, 2005, 7(9): 1289-1297 DOI:10.1111/j.1462-2920.2005.00808.x (  0) 0) |
| [7] |
Sahan E, Muyzer G. Diversity and spatio-temporal distribution of ammonia oxidizing archaea and bacteria in sediments of the Westerschelde estuary[J]. FEMS Microbiology Ecology, 2008, 64: 175-186 DOI:10.1111/j.1574-6941.2008.00462.x (  0) 0) |
| [8] |
Mosier A C, Francis C A. Relative abundance and diversity of ammonia-oxidizing Archaea and bacteria in the San Francisco Bay Estuary[J]. Environmental Microbiology, 2008, 10(11): 3002-3016 DOI:10.1111/j.1462-2920.2008.01764.x (  0) 0) |
| [9] |
李寒, 张晓黎, 郭晓红, 等. 滨海盐渍化土壤中蓝细菌多样性及分布[J]. 微生物学通报, 2015, 42(5): 957-967 DOI:10.13344/j.microbiol.china.140897 (  0) 0) |
| [10] |
Kurola J, Salkinoja-Salonen M, Aarnio T, et al. Activity, diversity and population size of ammonia-oxidizing bacteria in oil-contaminated landfarming soil[J]. FEMS Microbiology Letters, 2005, 250(1): 33-38 DOI:10.1016/j.femsle.2005.06.057 (  0) 0) |
| [11] |
В. А. 科夫达, В. С. 穆娜朵娃, В. В. 葉戈洛夫, В. П. 施特尔戈洛夫, 祝寿泉. 按盐渍化程度和性质并结合植物耐盐性而拟定的土壤分类[J]. 土壤, 1962(3): 59-62 (  0) 0) |
| [12] |
李二焕, 沈俊, 鞠靖, 等. 苏北滨海盐土区河流入海口土壤盐分及养分分布特征[J]. 中国水土保持科学, 2016, 14(1): 79-88 DOI:10.16843/j.sswc.2016.01.010 (  0) 0) |
| [13] |
Bernhard A E, Tucker J, Giblin A E, et al. Functionally distinct communities of ammonia-oxidizing bacteria along an estuarine salinity gradient[J]. Environmental Microbiology, 2007, 9(6): 1439-1447 DOI:10.1111/j.1462-2920.2007.01260.x (  0) 0) |
| [14] |
Li J L, Nedwell D B, Beddow J, et al. AmoA Gene abundances and nitrification potential rates suggest that benthic ammonia-oxidizing bacteria and not Archaea dominate N cycling in the Colne Estuary, United Kingdom[J]. Applied and Environmental Microbiology, 2015, 81(1): 159-165 DOI:10.1128/AEM.02654-14 (  0) 0) |
| [15] |
Meyer R L, Kjær T, Revsbech N P. Use of NOx- microsensors to estimate the activity of sediment nitrification and NOx- consumption along an estuarine salinity, nitrate, and light gradient[J]. Aquatic Microbial Ecology, 2001, 26: 181-193 DOI:10.3354/ame026181 (  0) 0) |
| [16] |
Magalhães C M, Joye S B, Moreira R M, et al. Effect of salinity and inorganic nitrogen concentrations on nitrification and denitrification rates in intertidal sediments and rocky biofilms of the Douro River Estuary, Portugal[J]. Water Research, 2005, 39(9): 1783-1794 DOI:10.1016/j.watres.2005.03.008 (  0) 0) |
| [17] |
Rysgaard S, Thastum P, Dalsgaard T, et al. Effects of salinity on NH4+ adsorption capacity, nitrification, and denitrification in Danish estuarine sediments[J]. Estuaries, 1999, 22(1): 21 DOI:10.2307/1352923 (  0) 0) |
| [18] |
Hatzenpichler R, Lebedeva E V, Spieck E, et al. A moderately thermophilic ammonia-oxidizing crenarchaeote from a hot spring[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(6): 2134-2139 DOI:10.1073/pnas.0708857105 (  0) 0) |
| [19] |
Bollmann A, Laanbroek H J. Influence of oxygen partial pressure and salinity on the community composition of ammonia-oxidizing bacteria in the Schelde Estuary[J]. Aquatic Microbial Ecology, 2002, 28: 239-247 DOI:10.3354/ame028239 (  0) 0) |
| [20] |
Jiang X J, Hou X Y, Zhou X, et al. pH regulates key players of nitrification in paddy soils[J]. Soil Biology and Biochemistry, 2015, 81: 9-16 DOI:10.1016/j.soilbio.2014.10.025 (  0) 0) |
| [21] |
Sahrawat K L. Factors affecting nitrification in soils[J]. Communications in Soil Science and Plant Analysis, 2008, 39(9/10): 1436-1446 (  0) 0) |
| [22] |
Halling-Sorensen B, Jorgensen S E. Studies in environmental science[M]. Elsevier, 1993: 55–118.
(  0) 0) |
| [23] |
Nicol G W, Leininger S, Schleper C, et al. The influence of soil pH on the diversity, abundance and transcriptional activity of ammonia oxidizing Archaea and bacteria[J]. Environmental Microbiology, 2008, 10(11): 2966-2978 DOI:10.1111/j.1462-2920.2008.01701.x (  0) 0) |
| [24] |
Yao H Y, Campbell C D, Chapman S J, et al. Multi-factorial drivers of ammonia oxidizer communities: Evidence from a national soil survey[J]. Environmental Microbiology, 2013, 15(9): 2545-2556 DOI:10.1111/1462-2920.12141 (  0) 0) |
| [25] |
Puthiya Veettil V, Abdulaziz A, Chekidhenkuzhiyil J, et al. Bacterial domination over Archaea in ammonia oxidation in a monsoon-driven tropical estuary[J]. Microbial Ecology, 2015, 69(3): 544-553 DOI:10.1007/s00248-014-0519-x (  0) 0) |
| [26] |
Bernhard A E, Landry Z C, Blevins A, et al. Abundance of ammonia-oxidizing Archaea and bacteria along an estuarine salinity gradient in relation to potential nitrification rates[J]. Applied and Environmental Microbiology, 2010, 76(4): 1285-1289 DOI:10.1128/AEM.02018-09 (  0) 0) |
| [27] |
Martens-Habbena W, Berube P M, Urakawa H, et al. Ammonia oxidation kinetics determine niche separation of nitrifying Archaea and Bacteria[J]. Nature, 2009, 461(7266): 976-979 (  0) 0) |
| [28] |
Sahan E, Muyzer G. Diversity and spatio-temporal distribution of ammonia-oxidizing Archaea and Bacteria in sediments of the Westerschelde Estuary[J]. FEMS Microbiology Ecology, 2008, 64(2): 175-186 (  0) 0) |
| [29] |
Song Y J, Zhang X L, Ma B, et al. Biochar addition affected the dynamics of ammonia oxidizers and nitrification in microcosms of a coastal alkaline soil[J]. Biology and Fertility of Soils, 2014, 50(2): 321-332 (  0) 0) |
2. Key Laboratory of Coastal Environmental Processes and Ecological Remediation, Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai, Shandong 264003, China;
3. Institute of Modern Agriculture on Yellow River Delta, Shandong Academy of Agricultural Sciences, Dongying, Shandong 257091, China
 2022, Vol. 54
2022, Vol. 54


