2. 江苏省农科院蔬菜所, 南京 210014
西瓜枯萎病的病原菌为半知菌亚门真菌尖孢镰刀菌Fusarium oxysporum[1],该病是西瓜生长中最严重的土传病害,发病率高达10% ~ 30%[2],可造成西瓜减产30% 以上甚至绝收,这对西瓜的生产和发展造成了十分严重的影响。目前尚无较好的化学防治方法,且化学防治存在一定的安全性问题[3],近年来越来越多的人着眼于调节其根际微生物群落的角度来研究西瓜枯萎病的解决方法[4-6]。
土传病害的病原菌来源于土壤,植物被病原菌侵染时会对周围土壤产生影响[7],以便适应生存环境。这些土壤特征包括土壤营养元素、土壤微生态等[8]。前期试验中,我们发现在耕匀的西瓜枯萎病病土中,植株的健康状态存在差异。植物根际微生物群落在抵御外来病原物侵染过程中起了十分重要的作用[9],了解病害发生过程中植物根际微生物的组成结构,是解析植物通过调节根际微生物组抵御病害的关键步骤。本研究对枯萎病病土中健康、轻微发病以及严重发病植株的根际土壤特征进行研究,通过检测其理化性质和微生物组,解析枯萎病菌的致病机制以及植物的反馈调节机制,并筛选出一些特征性真菌和细菌,为西瓜枯萎病的预防治理和生防资源筛选指明方向,也为通过菌群管理防治病害、改良土壤提供理论指导。
1 材料与方法 1.1 供试材料土壤来源于江苏省农科院南京六合区的试验基地大棚内,大棚内土壤为发病十年之久的西瓜枯萎病病土。西瓜品种为苏密518[10]。
1.2 试验设计用50 ~ 55 ℃[11]的温水浸泡西瓜种子15 min进行种子消毒,移入室温水中浸泡3 h左右置于28 ℃培养箱中保湿催芽24 h。挑取萌发种子移入48孔装满蛭石的穴盘中,每3 d浇1︰1 000稀释的花无缺2 L,一个月后移栽定植。枯萎病试验田每公顷地施22 500 kg优质有机肥和750 kg炭基土壤旋转耕匀。生长期间进行常规农事操作[12]。本试验于2020年3月20日移栽,在移栽当天(3月20日)采集空白土样,在病情指数到30左右时(5月4日)取不同发病程度西瓜根际土样,按照王汉荣等[13]对西瓜枯萎病的分级标准,取0级健康(无病症)、1 ~ 2级轻微发病(少数发黄或枯萎)、3 ~ 4级严重发病(整株生长状态不佳至死亡)植株的根际土壤,分别命名为JK-soil、QZ-soil、ZZ-soil。每3个同样健康程度的土壤样本混和后形成一个复合样本,过2 mm筛,每种健康程度共采取9个复合土壤样本。移栽当天取5个复合土壤样本作为空白对照,命名为Mock。将32个土壤样本置于冰上带回实验室,储存于–80 ℃用于微生态测定。同时在每个根际按照之前的分组采取根围土壤,混合均匀后每个处理取部分土样用于测定理化性质。
1.3 样品检测及数据分析微生物检测:对于采集的根围土壤,提取土壤DNA,用相应引物扩增,纯化后产物定量并制备文库。采用Omicsmart平台测序得到Raw Data,用Usearch软件对低质量Reads进行过滤,将双端Reads拼接为Tags,再次过滤后得到Effective Tags,以97% 的相似度进行聚类形成OTU并对其丰度、多样性等进行分析。
理化性质分析:有效磷、有效氮、有机质和有效钾采用TPY-6A型土壤测试仪测定,pH、EC值分别采用PHSJ-4F型酸度计和DDS-307A型电导率仪(上海雷磁)测定。采用Excel 2021、SPSS Statistics 20.0和DPS数据处理系统(5.0.2.8版本)对数据进行统计分析,使用最小显著差异法(least significant difference, LSD)检验进行多重比较(P < 0.05)。
1.4 图形绘制采用R语言TukeyHSD检验方法绘制α多样性指数箱线图。采用R语言,基于物种丰度表,计算pearson相关系数,以相关系数绝对值大于0.5且P < 0.05为阈值,筛选相关性绝对值top50的关系对,绘制物种相关性网络图。主坐标分析(principal co-ordinate analysis, PCoA):基于Bray-Curtis进行降维,以百分比(轴标题括号中的数字)评估各坐标轴对菌群结构总体差异的解释度,使用R语言Vegan包进行PCoA和NMDS分析。使用LEFSE软件进行LDA Effect Size分析(linear discriminant analysis Effect Size,LEfSe),kruskal-Wallis方法检验差异物种,通过wilcoxon检验,保留LDA≥3的结果,将差异映射到已知层级绘制进化分支图。
2 结果与分析 2.1 不同发病程度植株根围土壤基本性质表 1显示,移栽植物的根际土壤与不移栽植物的空白土壤(Mock)土壤性质具有显著差异,同时不同健康程度的植株根围土壤的性质差异显著,其中有机质、铵态氮含量和pH与病害严重度呈反比,有效磷含量、EC值与病害严重度呈正比,有效钾差异不显著。
|
|
表 1 西瓜枯萎病不同发病程度植株根围土壤基本性质 Table 1 Soil properties around watermelon roots under different degrees of Fusarium Wilt |
微生物活性、多样性和组成影响了植物的病害抵御情况。我们通过ITS、16S rRNA扩增子测序分析了不同发病程度植株的根围土壤根际微生物群落的组成。分析根际微生物的α多样性发现,相比于Mock,JK-soil、QZ-soil、ZZ-soil的真菌、细菌群落多样性(Shannon指数)和物种相对丰度(Chao1指数)均有所提升,且JK-soil、QZ-soil、ZZ-soil的真菌、细菌群落多样性和物种相对丰度存在显著差异。图 1A、1B结果表明,JK-soil的真菌群落多样性和物种相对丰度高于ZZ-soil,QZ-soil的真菌群落多样性和物种相对丰度略高于JK-soil。图 1C、1D结果表明,JK-soil与QZ-soil、ZZ-soil相比有更高的细菌群落多样性和物种相对丰度,QZ-soil与ZZ-soil的群落多样性和物种相对丰度差异不显著。另外,QZ-soil的真菌群落多样性和物种相对丰度高于JK-soil,细菌群落多样性和物种相对丰度低于JK-soil。
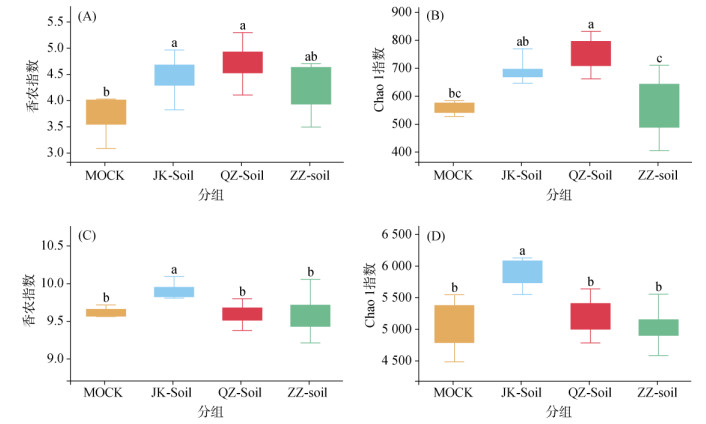
|
(A、B:基于ITS的α多样性分析;C、D:基于16S rRNA的α多样性分析。图形展示有效数据分布的最大值(直线顶端)、最小值(直线底端)、中位数(盒子中线)、上四分位数(盒子顶边)和下四分位数(盒子底边);小写字母不同表示差异达p < 0.05显著水平) 图 1 西瓜不同发病程度植株根际土壤的微生物群落α多样性差异 Fig. 1 α-diversity of microbial communities in watermelon rhizosphere soils under different degrees of disease |
为了更直观地展现组间差异,采用PCoA方法基于Bray-Curtis distance进行β多样性分析。结果表明(图 2),Mock、JK-soil、QZ-soil和ZZ-soil的真菌群落显著聚类区分(ANOSIM,R=0.504,P=0.001),细菌群落也显著聚类区分(ANOSIM,R=0.523,P=0.001),但是QZ-soil与JK-soil、ZZ-soil存在部分重叠。
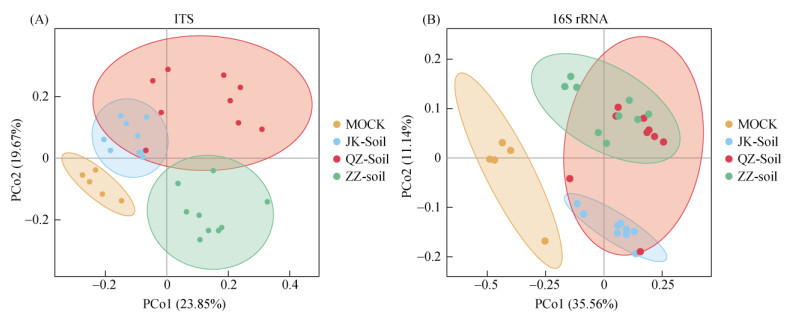
|
(图中不同的点表示不同的样本,平面上点距离越近,表示样本的群落组成越相似) 图 2 西瓜根际土壤的微生物群落聚类分析 Fig. 2 Cluster analysis of microbial community in watermelon rhizosphere soil |
PCoA图中,样本间距离越远,则群落组成差异越大。图 2中显示,与QZ-soil相比,JK-soil和ZZ-soil组内样本间距离较小,说明JK-soil和ZZ-soil组内样本间差异小、重复性好,即群落组成更为稳定;而QZ-soil组内样本间距离较大且与JK-soil、ZZ-soil的范围有部分重叠,说明QZ-soil的微生物群落重复性较差,即并不十分稳定,处于JK-soil和ZZ-soil的过渡状态。同时,JK-soil与ZZ-soil相比组内样本间距离更小,意味着JK-soil与ZZ-soil相比,群落组成更为稳定。原因可能是由于起始土壤相同,JK-soil趋向于富集某些特定的优势菌群,ZZ-soil形成了自己的优势菌群,JK-soil和ZZ-soil状态都趋于稳定,JK-soil的特异性富集作用较强,最终稳定性高于ZZ-soil。
2.4 西瓜枯萎病发病过程中物种组成变化为了进一步确定真菌、细菌群落在门水平上的物种分布和丰度特征,将测序到的所有ITS序列和16s rRNA序列分类为OTUs,通过物种堆叠图(图 3)展示。真菌OTUs主要分属于子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、鞭毛菌门(Mortierellomycota)(图 3A)。JK-soil中的子囊菌门、担子菌门、鞭毛菌门的丰度都低于ZZ-soil。细菌OTUs主要分属于变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、髌骨细菌门(Patescibacteria)、芽单胞菌门(Gemmatimonadetes)、拟杆菌门(Bacteroidetes)、绿弯曲门(Chloroflexi)、浮霉菌门(Planctomycetes)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)(图 3A)。JK-soil中放线菌门、绿弯曲门、浮霉菌门、酸杆菌门的相对丰度高于QZ-soil和ZZ-soil。变形菌门在QZ-soil的土壤中丰度更高,这可能是由于变形菌门细菌在抵御病害或者在促进有害菌群生长方面发挥了更大作用,由于最终变形菌门在JK-soil中的丰度低于ZZ-soil,推测后者可能性更大。
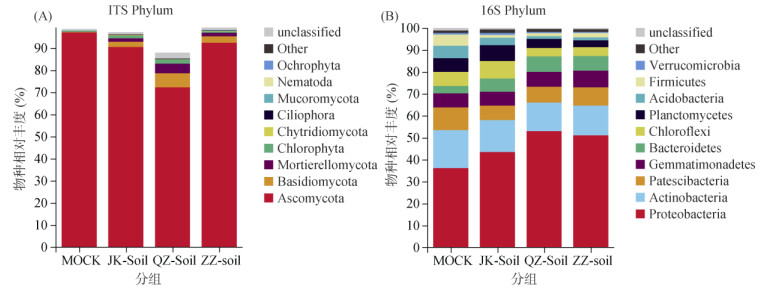
|
图 3 西瓜根际土壤真菌、细菌物种组成分布 Fig. 3 Species compositions and distributions of fungi and bacteria in watermelon rhizosphere soil |
在比较Mock、JK-soil、QZ-soil和ZZ-soil之间的群落多样性、物种丰度、群落组成等后,进一步对物种之间的相关性进行网络分析(图 4)。结果显示,JK-soil的细菌物种相关性网络复杂程度高于ZZ-soil,JK-soil的细菌物种之间联系更为紧密,表现出更多的正共生关系。然而,真菌物种相关性网络复杂程度的结果相反,ZZ-soil的真菌物种相关性网络复杂程度高于JK-soil,ZZ-soil物种之间联系更为紧密,表现出更多的正共生关系。QZ-soil的真菌、细菌网络复杂度和正共生关系数量均处于JK-soil和ZZ-soil之间。
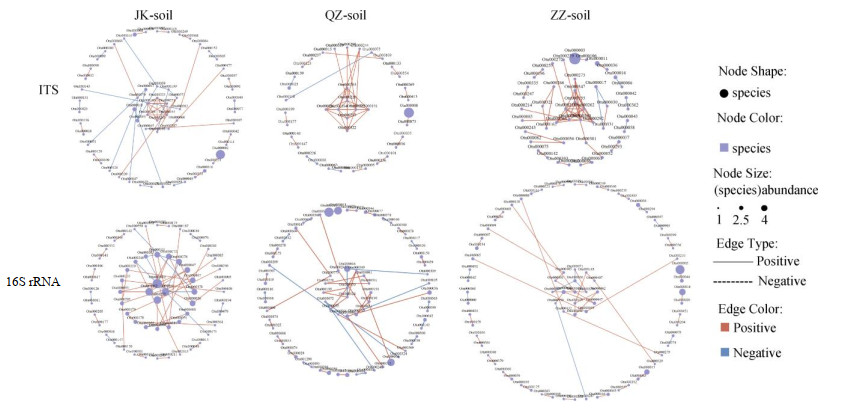
|
(每个节点代表一个OTU单元,红色直线表示物种间正相关,蓝色表示负相关) 图 4 西瓜根围土壤真菌、细菌物种相关性网络 Fig. 4 Species correlation network of fungi and bacteria in watermelon rhizosphere soil |
结合JK-soil细菌的群落多样性、丰度高于ZZ-soil,真菌的群落多样性、丰度低于ZZ-soil(图 1),样本间距离小于ZZ-soil(图 2)等得到:JK-soil细菌群落结构更稳定,ZZ-soil的真菌群落更稳定。这意味着JK-soil的细菌群落对外界有更高的承受能力,即根际以与枯萎病防控正相关的菌群占主导地位;而ZZ-soil中病原真菌及其有关的其他有害菌已经形成了对植物较强的致病能力,即根际以与枯萎病防控负相关的菌群占主导地位,此时进行调控难度较大,换言之,ZZ-soil真菌形成的物种网络结构对外界也同样拥有较高的承受能力,这与2.3的分析相一致。
2.6 特征性物种分析根际微生物群落结构解析后,为了更深地理解不同健康程度植株的根际微生物组特征,进一步探究了其根际的关键驱动菌群,发现JK-soil微生物群落中有更多的特有真菌OTUs(JK-soil 165个,QZ-soil 163个,ZZ-soil 104个),同时JK-soil也具有更多的特有细菌OTUs(JK-soil 687个,QZ-soil 251个,ZZ-soil 403个)。进一步通过LEfSe法对JK-soil、QZ-soil、ZZ-soil进行比较,选取LDA值> 3的绘制进化分支图,展示组间差异显著的特征物种及其进化关系(图 5)。细菌类别中,在属(Genus)水平上,JK-soil的特征性物种有气微菌属(Aeromicrobium sp.)、小梨形菌属(Pirellula sp.)、诺卡氏菌(Pir4 lineage sp.)、甲基芽胞杆菌属(Methylobacillus sp.)、Rubinisphaeraceae sp.、假诺卡氏菌属(Pseudonocardia sp.)、不动杆菌(Acinetobacter sp.)、放线异壁酸菌属(Actinoallomurus sp.)、出芽菌属(Gemmata sp.);QZ-soil的特征物种有独岛氏菌属(Dokdonella sp.)、窄食单胞菌属(Stenotrophomonas sp.)、生丝微菌(Hyphomicrobium sp.)、特吕珀菌属(Truepera sp.)、新鞘氨醇杆菌(Novosphingobium sp.)等;ZZ-soil有罗思河小杆菌属(Rhodanobacter sp.)、类诺卡氏菌(Nocardioides sp.)、草螺菌属(Herbaspirillum sp.)、Pelagibius sp.和慢生根瘤菌(Bradyrhizobium sp.)等。在种(Species)水平上,JK-soil种水平上的特征性细菌有浮霉菌(Planctomyces sp.)、醋酸钙不动杆菌(A. calcoaceticus)等,QZ-soil有嗜麦芽窄食单胞菌(S. maltophilia),ZZ-soil有富尔维红杆菌(R. fulvus)、大豆慢生型根瘤菌(B. japonicum)。
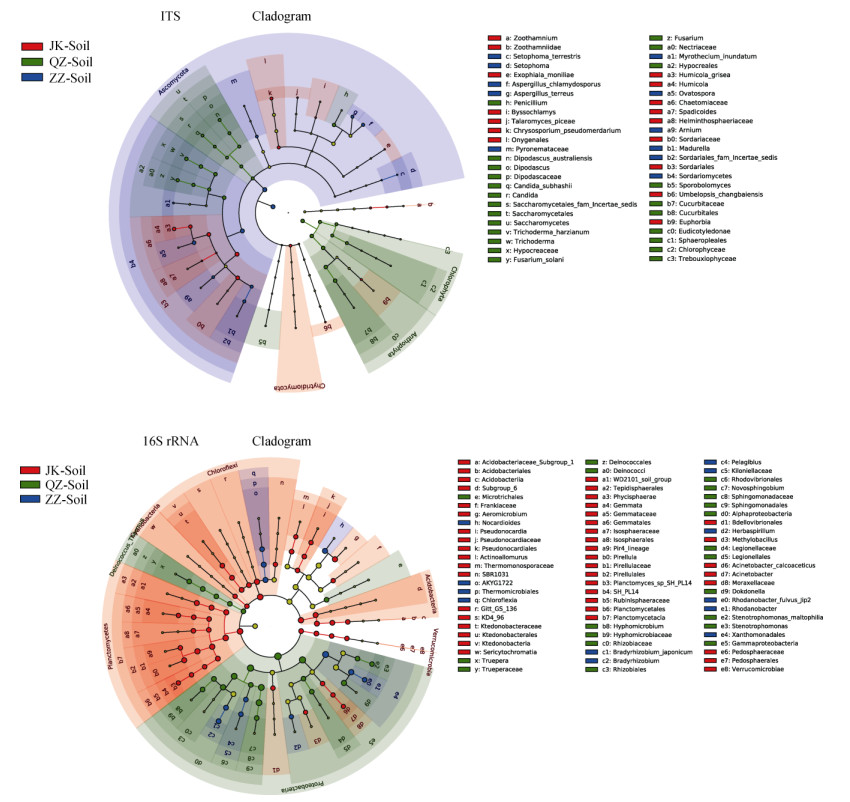
|
(进化树的圈代表从界到种不同的分类级别。进化树的每一个节点代表该水平上的一个类别,节点大小代表其相对丰度。黄色节点为各处理间无显著差异物种,差异显著物种以分组色表示。图中仅列出组间有显著差异的相关物种) 图 5 西瓜根围土壤LEfSe分析进化分支图 Fig. 5 Evolutionary branch diagram of LEfSe analysis in soil around watermelon root |
真菌类别中,在属(Genus)分类水平上,JK-soil上的特征性物种有丝衣霉属(Byssochlamys sp.)、暗色丝孢菌(Spadicoides sp.)、腐质霉(Humicola sp.);QZ-soil的西瓜土壤有掷孢酵母属(Sporobolomyces sp.)、念珠菌(Candida sp.)、Dipodascus sp.、镰刀菌(Fusarium sp.)、青霉属(Penicillium sp.)、木霉属(Trichoderma sp.);ZZ-soil的有Arnium sp.、Setophoma sp.、Madurella sp.马杜拉分支菌属。在种(Species)分类水平上,JK-soil的特征性物种有篮状菌(T. piceae)、长白伞形霉(U. changbaiensis)、外瓶霉(E. moniliae)、金孢霉(C. pseudomerdarium)、灰腐质霉(H. grisea);QZ-soil植株根际有白假丝酵母(C. subhashii)、D. australiensis、腐皮镰刀菌(F. solani)、哈茨木霉(T. harzianum);ZZ-soil的有泛生漆斑菌(M. inundatum)等。
2.7 土壤性质相关性分析Spearman's相关系数用于评价不同发病程度的植株根际土壤的α多样性(Shannon指数、chao1指数)与土壤特征之间的关系[14]。结果显示(表 2),植物根际土壤的细菌物种相对丰度(Chao1指数)与有机质、有效氮、pH显著正相关(P < 0.01),与有效磷、EC值显著负相关;细菌群落多样性(Shannon指数)与有效钾显著正相关。这意味着根际土壤中较高的细菌群落多样性和细菌物种相对丰度促进了植物对土壤营养元素有机质、氮、钾的吸收利用,进而引起根际土壤性质包括有机质、有效钾含量的提升,同时对酸性土壤pH具有显著升高作用,对电导率有显著降低作用。有效磷含量的下降意味着健康植株抵御枯萎病的过程可能需要消耗更多的磷元素。土壤化学性质与微生物多样性相关程度的分析提示,高效地管理植株的根际微生态不仅可以防治植物病害,还可以调节土壤性质,增加土壤营养元素,提高可持续发展能力。
|
|
表 2 土壤细菌α多样性指数与土壤理化性质的相关性 Table 2 Correlation between soil bacteria α-diversity index and physiochemical properties |
不移栽植物的土壤和移栽西瓜苗的土壤差异显著,同时健康植株、轻微发病和严重发病土壤在物种组成、多样性、结构等方面都存在显著的差异。这说明,西瓜枯萎病的侵染过程中会触发植物自身的防御,诱集有益菌群来改变根际微生物的组成和结构,这与王孝芳等[15]、Liu等[16]、Chapelle等[17]的研究结构相似。
本研究发现健康植株根际真菌和细菌群落的多样性明显上升,这在土壤营养结构上也有所体现,结合相关性分析可得出土壤细菌群落多样性提高促进了植物对土壤营养元素的吸收利用,进而引起根际土壤性质包括有机质、有效钾含量、pH的提升[18],同时对电导率有明显的降低作用。另外,健康土壤的真菌物种相关性网络复杂程度低于严重发病的土壤,细菌结果相反,这意味着健康土壤的细菌物种之间联系更为紧密,对外界有更高的承受能力[19];而严重发病的真菌物种间联系紧密,说明病原真菌诱导的其他真菌物种已经形成较强的致病能力,此时进行调控难度较大,换言之,真菌形成的物种相关网络对外界也同样拥有较高的承受能力。同时,在健康土壤周围关键特征性物种金孢霉(C. pseudomerdarium)、醋酸钙不动杆菌(A. calcoaceticus)等可能在西瓜枯萎病的防治中发挥着重要作用[20]。另外,轻微发病情况下植株根际真菌多样性甚至高于健康和严重发病的根际,结合聚类分析结果中轻微发病的物种距离有部分覆盖健康和严重发病的范围,说明轻微发病处于两种状态过渡状态,而又不单纯地处于两者中间状态。这涉及一些与健康和发病严重的植株都不具有明显相关性的物种[21],属水平细菌有窄食单胞菌属、新鞘氨醇杆等,真菌有青霉属、木霉属等;种水平有浮霉菌、醋酸钙不动杆菌、哈茨木等,这些轻微发病状态中出现的中间物种或为微生物的研究提供新的思路。
综合上述研究,结果表明西瓜枯萎病的侵染过程中会触发植物自身的防御,植物诱集有益菌群来改变根际微生物的组成和结构,健康、严重发病植株根际都形成了各自的较为稳定的有益、有害微生物网络,而在轻微发病根际致病菌、生防菌都出现特异性富集,其较高的微生物多样性提示,在生防菌的分离筛选时,选择轻微发病植株的根际土壤或许能获得丰度更高的生防资源。通过监测轻微发病的活跃菌群动态来提前预测枯萎病的发生,也为西瓜枯萎病的预防治理和生防资源筛选提供了一些理论指导。
| [1] |
甄银伟. 西瓜枯萎病的发病特征、发病原因及综合防治措施[J]. 乡村科技, 2021, 12(22): 64-66 DOI:10.3969/j.issn.1674-7909.2021.22.027 (  0) 0) |
| [2] |
马鹏程. 大棚西瓜枯萎病的发生特点及其绿色防治措施[J]. 中国农业文摘-农业工程, 2021, 33(1): 92-94, 96 (  0) 0) |
| [3] |
苏琴. 化学防治与生物防治的优缺点浅析[J]. 内蒙古农业科技, 2011, 39(6): 84-85, 132 (  0) 0) |
| [4] |
Wang X F, Wei Z, Yang K M, et al. Phage combination therapies for bacterial wilt disease in tomato[J]. Nature Biotechnology, 2019, 37(12): 1513-1520 DOI:10.1038/s41587-019-0328-3 (  0) 0) |
| [5] |
Ye X, Li Z, Luo X, et al. A predatory myxobacterium controls cucumber Fusarium wilt by regulating the soil microbial community[J]. Microbiome, 2020, 8(1): 49 DOI:10.1186/s40168-020-00824-x (  0) 0) |
| [6] |
Bai B, Liu W D, Qiu X Y, et al. The root microbiome: Community assembly and its contributions to plant fitness[J]. Journal of Integrative Plant Biology, 2022, 64(2): 230-243 (  0) 0) |
| [7] |
Wei Z, Hu J, Gu Y A, et al. Ralstonia solanacearum pathogen disrupts bacterial rhizosphere microbiome during an invasion[J]. Soil Biology and Biochemistry, 2018, 118: 8-17 DOI:10.1016/j.soilbio.2017.11.012 (  0) 0) |
| [8] |
Kwak M J, Kong H G, Choi K, et al. Rhizosphere microbiome structure alters to enable wilt resistance in tomato[J]. Nature Biotechnology, 2018, 36(11): 1100-1109 DOI:10.1038/nbt.4232 (  0) 0) |
| [9] |
Yuan J, Zhao J, Wen T, et al. Root exudates drive the soil-borne legacy of aboveground pathogen infection[J]. Microbiome, 2018, 6(1): 156 DOI:10.1186/s40168-018-0537-x (  0) 0) |
| [10] |
于利, 徐润芳, 吉加兵, 等. 抗病518西瓜的特性和栽培技术[J]. 江苏农业科学, 1999, 27(2): 56-57 (  0) 0) |
| [11] |
西瓜种子选择及处理[N]. 农业之友. [2018-06-08]. https://nyzy.com/xigua/268.html.
(  0) 0) |
| [12] |
薛新伟, 张亚丽. 塑料大棚西瓜栽培技术[J]. 农业科技与信息, 2021(11): 49-51 DOI:10.3969/j.issn.1003-6997.2021.11.019 (  0) 0) |
| [13] |
王汉荣, 方丽, 任海英, 等. 西瓜和砧木品种(系)抗枯萎病的鉴定与评价[J]. 北方园艺, 2010(8): 181-183 (  0) 0) |
| [14] |
钱晨坚. Spearman秩相关系数比较的假设检验及样本量估计新方法研究[D]. 广州: 南方医科大学, 2021.
(  0) 0) |
| [15] |
王孝芳, 梅新兰, 黄大鹏, 等. 生物质炭载体联合有益菌防控番茄土传青枯病的效果研究[J]. 土壤学报, 2022, 59(2): 536-544 (  0) 0) |
| [16] |
Liu H, Li J, Carvalhais L C, et al. Evidence for the plant recruitment of beneficial microbes to suppress soil-borne pathogens[J]. The New Phytologist, 2021, 229(5): 2873-2885 (  0) 0) |
| [17] |
Chapelle E, Mendes R, Bakker P A H, et al. Fungal invasion of the rhizosphere microbiome[J]. The ISME Journal, 2016, 10(1): 265-268 (  0) 0) |
| [18] |
杨璐, 杜岩新, 徐利娟, 等. 土壤微生态环境对樱桃树"黑疙瘩"病发生的影响[J]. 土壤, 2017, 49(2): 308-313 (  0) 0) |
| [19] |
桂莎, 刘芳, 张立丹, 等. 复合菌剂防控香蕉枯萎病的效果及其微生物学机制[J]. 土壤学报, 2020, 57(4): 995-1007 (  0) 0) |
| [20] |
沈宗专, 黄炎, 操一凡, 等. 健康与罹患青枯病的番茄土壤细菌群落特征比较[J]. 土壤, 2021, 53(1): 5-12 (  0) 0) |
| [21] |
Hu Q L, Tan L, Gu S S, et al. Network analysis infers the wilt pathogen invasion associated with non-detrimental bacteria[J]. Npj Biofilms and Microbiomes, 2020, 6: 8 (  0) 0) |
2. Institute of Vegetables, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China
 2022, Vol. 54
2022, Vol. 54


