2. 中国科学院大学, 北京 100049;
3. 平阳县自然资源和规划局, 浙江平阳 325400
由于集约化种植的发展以及农民对经济效益的一味追求,使得具有较高经济收益的作物被大规模连续种植,同时投入大量肥料以获得高产。这种不合理的农作方式不仅使得土壤养分失衡,土层结构破坏,而且造成土壤微生物群落结构失衡、功能下降,反过来致使土壤质量退化,农作物产量下降,从而引发土壤连作障碍,给我国农业生产造成了巨大损失[1-3]。通常,土传病害伴随着土壤连作障碍发生,青枯病是由茄科劳尔氏菌(Ralstonia solanacearum)引起的一种典型的细菌型土传病害,其危害性较强,易潜伏于土壤中,能侵染番茄、辣椒、茄子、烟草等200多种作物[4-6]。
抑病土的发现对土传病害发生及防治具有重要的意义。抑病土是长期土传病害爆发后经负反馈作用而形成的结果,其典型特征是具有或可迅速募集能抑制特定土传病原菌的有益微生物群落。与之相对应的是感病土,感病土是一类宿主植物对病害入侵抵抗性差、容易感染病害的土壤[7]。研究表明,相比于感病土,抑病土根际微生物群落多样性较高,并且根际富集有较多的有益微生物,如芽孢杆菌、假单胞菌和链霉菌等[8-9]。这些根际有益微生物可以通过直接拮抗病原菌或通过与病原菌竞争生态位与养分资源来间接抑制病原菌的生长与定殖,帮助宿主植物抵御土传病原菌的侵染,从而参与植物抗病[10-13]。
施肥是农业生产中重要的一环,对土壤的质量和农作物的生长有着重要作用。施用有机肥是设施农业生产中改善土壤地力的重要方式,能有效提高土壤有机质的含量,改善土壤物理结构,促进微生物生长繁育,提高土壤微生物活性[14-17]。有机肥与无机肥配合施用不仅有利于土壤团聚体的形成和土壤透气性的增强,而且能迅速提供作物所需的养分以促进作物生长[18]。此外,有机肥中含有较多氨基酸等化合物,可以促进芽孢杆菌等有益微生物的生长,从而有助于抵御土传病害发生[7]。
尽管目前关于抑病土的研究较多,但是主要集中在对微生物群落组成和多样性的影响上,而抑病土结合施肥措施对植物生长、土传病害防控以及土壤功能微生物群落的影响尚未明确。因此,本研究以番茄青枯病为研究对象,选择抑病土和感病土作为供试土壤,采用不施肥和有机无机配施两种施肥模式,通过温室盆栽试验,探讨抑病土在不同施肥措施下对土传病害和植株生长的影响机制,以为探索农业生产中的植物土传病害、功能性土壤微生物以及土壤养分的相互作用提供科学依据。
1 材料与方法 1.1 供试材料与试验设计供试番茄品种为合作903粉红番茄(Lycopersicon esculentum);供试土壤取自于江苏省南京市蔬菜花卉科学研究所(118°46′E, 31°43′N)长期种植番茄的耕作层(0 ~ 20 cm);供试的抑病土壤和感病土壤来源见实验室的前期研究[8],其理化性质如表 1所示;供试青枯菌(Ralstonia solonacearum) 的菌株编号为HX-RS201911(NCBI登录号:MZ267233)。
|
|
表 1 供试土壤的理化性质 Table 1 Physicochemical properties of tested soils |
盆栽试验于中国科学院南京土壤研究所的温室中进行。将供试土壤研磨过5 mm筛后进行装盆(盆钵尺寸为上口径15.5 cm,下口径12 cm,高14 cm),每盆1.5 kg风干土。试验共8个处理,具体包括2种土壤来源(感病土与抑病土)、2种施肥方式(不施肥与有机无机配施)以及2种接菌方式(接种病原菌与不接种病原菌),试验设计见表 2,每个处理3个重复。其中有机肥为常规商品有机肥(N︰P2O5︰K2O=2%︰1%︰2%),施用量为180 kg/hm2,其余化肥施用量为:尿素(含N 460 g/kg)43 kg/hm2,过磷酸钙(含P2O5 120 g/kg)84 kg/hm2,硫酸钾(含K2O 500 g/kg)17 kg/hm2。
|
|
表 2 试验设计方案说明 Table 2 Description of experimental design |
在番茄种子培育至三叶一心期时,选取生长健壮且长势相近的番茄幼苗进行移栽,每盆4株。一周后,接菌组每盆接种20 ml浓度为5×106 cfu/ml的青枯菌发酵液(对培养了36 h的培养液先进行离心,然后用氯化钠溶液洗3次,再用去离子水调整最终的浓度至5×106 cfu/ml)。番茄培养周期为45 d,其间定期对番茄进行浇水,并观察、记录番茄生长情况。
在番茄开花期时统计番茄青枯病的发病等级、株高以及测定植株生物量,并采集其根际土,一部分保存于–20℃低温冰箱用于提取土壤DNA,另一部分保存至4℃冰箱用于分析土壤微生物碳源代谢活性。病情指数的计算方法基于《植病研究方法》[19],根据番茄植株叶片的枯萎程度,对青枯病症状进行评估,评分等级为0、1、2、3和4。0级,整株无萎蔫叶片;1级,整株有0 ~ 25% 的叶片萎蔫;2级,整株有25% ~ 50% 的叶片萎蔫;3级,整株有50% ~ 75% 的叶片萎蔫;4级,整株有75% ~ 100% 的叶片萎蔫。病情指数(%)=100×∑(发病级数×发病级数对应的株数)/(最高级数×总株数)。
1.2 土壤理化性质测定土壤理化性质的测定指标包括土壤pH、速效氮、有效磷、速效钾、有机质、全氮、全磷、全钾,其测定参考鲁如坤[20]的方法。其中,土壤pH采用土水质量比1︰2.5浸提,pH计(SevenMulti Mettler Toledo,瑞士)测定;有机碳采用重铬酸钾氧化法测定;全氮采用氢氟酸–次氯酸消煮,凯氏定氮法测定;全磷与全钾采用氢氟酸–次氯酸消煮,钼蓝比色法与火焰光度法测定;速效氮采用碱解扩散法测定;有效磷采用0.5 mol/L NaHCO3提取,磷钼蓝比色法测定;土壤速效钾采用0.5 mol/L NH4Ac浸提,火焰光度法测定。
1.3 根际土壤微生物代谢活性测定采用BIOLOG生态板(Eco microplate,Matrix Technologies Corporation,美国)分析测定不同处理根际土壤微生物对不同碳源的代谢活性[21]。试验步骤如下:准确称量5 g新鲜土壤样品,将其加入盛有45 ml提前灭菌过的生理盐水(0.85%)的三角瓶中,在摇床中室温振荡30 min后取出,静置;吸取3 ml土壤悬浮液至27 ml上述生理盐水中,混匀,重复操作该步骤,最终得到浓度为10–3稀释液;用排枪将10–3稀释液均匀加至96孔生态板,每孔150 μl,在25℃恒温培养箱中避光培养,0、24、48、72、96、120、144、168、192和216 h后利用酶标仪在590 nm波长下测定吸光度值(OD590)。
通过对0 ~ 216 h的吸光值数据进行初步分析,发现培养120 h的微生物生长代谢处于旺盛时期,因此培养时间120 h的数据被选取进行后续分析。土壤微生物活性通过平均颜色变化率(AWCD)来反映,其计算公式为AWCD=∑OD590/31,其中OD590为波长为590 nm的吸光值,31为BIOLOG生态板上的碳源种类数。
1.4 根际土壤青枯菌定殖量的测定番茄根际土壤中青枯菌的丰度采用定量PCR方法进行测定,其特定引物为编码青枯菌鞭毛亚基的fliC基因,其中,正向引物为:5'-GAACGCCAACGGT GCGAACT-3',反向引物为:5'-GGCGGCCTTCAGGG AGGTC-3'。具体试验操作方法参照文献[22]。
1.5 土壤挥发性有机物抑菌效果试验在病害发生过程中土壤微生物群落往往能产生挥发性有机物来抵御病害发生[23]。为探讨抑病土和感病土中微生物的挥发性有机物对青枯菌生长的影响。本研究利用二分隔培养皿来进行该试验,其中培养皿一侧为CPG固体培养基(酸水解酪蛋白胨1 g/L,蛋白胨10 g/L,葡萄糖5 g/L,pH 7.0 ~ 7.2),并涂布有50 μl的1×103 cfu/ml的青枯菌悬液,另一侧均匀平摊10 g各处理的土壤。物料分装好后,盖上培养皿并用封口膜封住以防止挥发性有机物外泄。以上操作均在超净工作台中完成。随后将上述培养皿置于28℃恒温培养箱中避光培养48 h。试验共8个处理、1个对照,其中对照为不添加土壤的空白处理,每个处理4个重复。培养结束后,利用灭菌生理盐水(1ml/皿)洗脱培养基上的青枯菌,用酶标仪测定波长为600 nm下的吸光度,以此表征青枯菌的生长情况。
1.6 数据处理与统计分析利用Excel 2016进行数据统计,采用SPSS 20.0对各指标进行方差分析,用LSD法进行差异显著性检验,显著水平设为0.05。使用R3.6.1对微生物功能多样性与主要碳源的利用类型进行冗余分析,采用999次的蒙特卡罗排列检验(MonteCarlo permutation test,999 permutations,reduced model)进行显著性检验。使用R3.6.1的“vegan”包进行PERMANOVA分析,以揭示感病土/抑病土、施肥/不施肥、接菌/不接菌这3个因素对土壤微生物代谢功能的相对影响。
2 结果 2.1 不同处理下土壤化学性质的变化不同处理下土壤化学性质有所不同,如表 3所示,土壤中的有机碳、速效氮、有效磷和速效钾的含量依次为SCOF > SCOFR > CCOF > CCOFR > SCK > CCK > CCKR。与CCK处理相比,SCK处理的速效氮和有效磷含量明显提升,分别增加了25.77% 与20.49%,而进行有机无机配施处理(CCOF)后,有机碳、速效氮、有效磷、速效钾的含量分别增加了37.27%、1.24倍、1.83倍与1.51倍。整体来看,不论是在感病土中还是在抑病土中,有机无机配施均可提高土壤中有机碳、速效氮、有效磷、速效钾含量,而pH则有所下降(P < 0.05)。此外,接种病原菌与不接种病原菌对土壤的理化性质均无显著影响(P > 0.05)。
|
|
表 3 不同处理的土壤化学性质 Table 3 Soil chemical properties under different treatments |
不同处理下番茄的生长不同,如图 1所示,在抑病土和未接种病原菌的处理中番茄植物生长略优于感病土和接种病原菌的处理,但差异并未达到显著水平(P > 0.05),接种病原菌后番茄的株高和生物量有所降低。在抑病土中进行有机无机配施处理后,促进了番茄植株的株高和地上部鲜重(图 1),同样地,感病土也是如此。其中SCOF处理的番茄地上部鲜重最高,为28.99 g/株,与CCOF处理相比,显著增加了37.90%。

|
(图中小写字母不同表示处理间差异达P < 0.05显著水平,下同) 图 1 不同处理番茄植株的株高(A)和地上部鲜重(B) Fig. 1 Tomato plant heights (A) and shoot fresh weights (B) under different treatments |
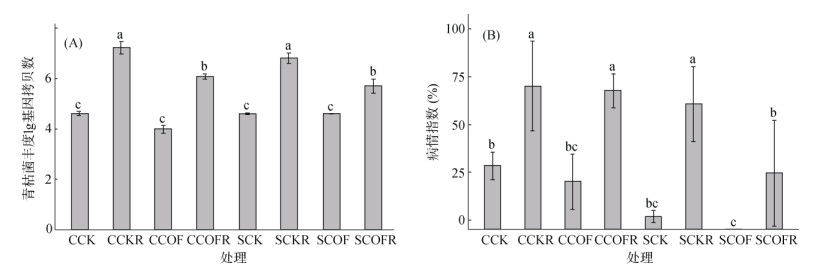
不论是感病土还是抑病土,接种病原菌的处理与未接种病原菌的处理中均能检测到病原菌(图 2A),不同处理中根际青枯菌的丰度依此为CCKR > SCKR > CCOFR > SCOFR > CCK > SCK > SCOF > CCOF,接种病原菌处理的根际能够检测到的病原菌丰度明显高于未接种病原菌处理,表明接种的病原菌能够适应该土壤环境并很好地定殖在宿主植物根际。不同施肥处理对青枯病的发生影响不一,在抑病土中进行有机无机配施(SCOF)能有效降低青枯病的发生(图 2B)。所有处理中CCKR处理的番茄植株青枯病病情指数最高,达到了74.81,其次是SCKR处理,而SCK和SCOF处理的青枯病病情指数较低,分别为0.066与0。
|
图 2 不同处理番茄根际土壤青枯病菌丰度(A)和青枯病病情指数(B) Fig. 2 Abundances of Ralstonia solanacearum in tomato rhizosphere soils (A) and disease indexes of bacterial wilt disease (B) under different treatments |
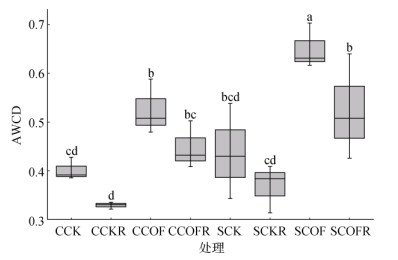
不同处理下番茄根际土壤微生物的代谢活性不同,如图 3所示。SCOF处理的根际土壤微生物活性最高,其次是CCOF、SCOFR、CCOFR处理,分别是CCKR处理的1.97倍、1.59倍、1.59倍与1.36倍。同样,抑病土中接种与未接种病原菌处理的土壤微生物活性也分别高于感病土中,但仅在SCOF处理中有显著影响(P < 0.05)。不同处理下番茄根际土壤的微生物对不同碳源类型的利用也不同,如表 4所示。不论是感病土还是抑病土,有机无机配施处理下的根际微生物对碳水化合物、多聚化合物和氨基酸类化合物的利用要高于不施肥处理,而羧酸类化合物与酚酸类化合物在接种病原菌处理中被微生物利用明显高于未接种病原菌处理,表现为SCOFR > SCOF,SCKR > SCK,CCOFR > CCOF,CCKR > CCK。
|
图 3 不同处理下根际土壤微生物的功能活性 Fig. 3 Microbial functional activities in rhizosphere soils under different treatments |
|
|
表 4 不同处理下根际微生物对主要碳源类型的利用情况 Table 4 Usage of main carbon sources by rhizosphere microorganisms under different treatments |
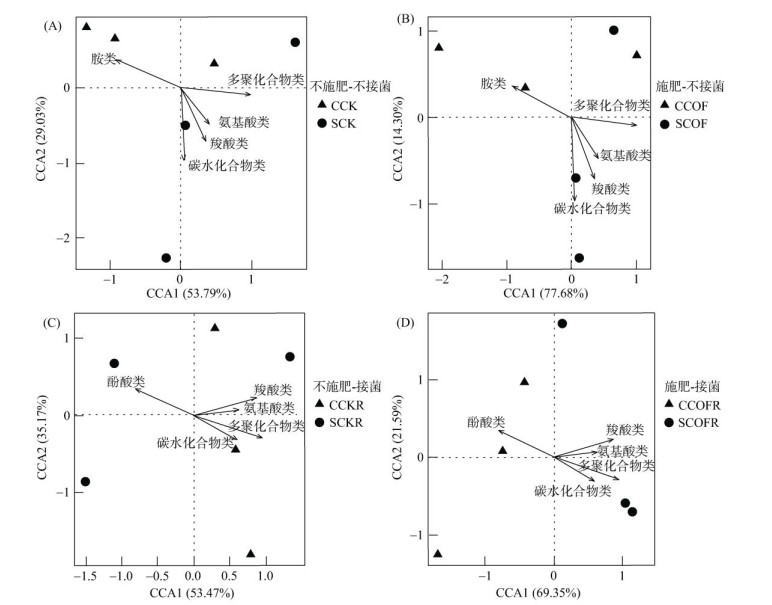
PERMANOVA分析揭示了不同处理对根际土壤微生物代谢功能差异的影响。本研究中有机无机配施处理对根际微生物代谢功能变异的解释度为36.9%,而接种病原菌处理对根际微生物代谢功能的影响程度为26.8%,并且这两个因子解释的根际微生物代谢功能差异均达到了极显著水平(P < 0.01),然而,土壤来源对根际微生物代谢差异的解释度仅为6.5%,且并未达到显著水平(P > 0.05)(表 5)。进一步对土壤微生物的代谢活性与其利用的碳源类型进行典型对应分析(CCA),探究感病土与抑病土中对土壤微生物代谢活性起主要作用的碳源因子,结果显示,在感病土中,不同施肥措施和病原菌接种下的根际土壤微生物功能明显区分,其中,轴一能够明显区分接种与未接种病原菌的土壤微生物功能,对根际微生物代谢功能变异的解释度为63.30%,利用羧酸类、酚酸类和胺类碳源的微生物种群的增多是造成病原菌接种(CCOFR、CCKR)处理下微生物功能群落变异的主要因素,而利用氨基酸类、碳水化合物类、多聚物化合物类的微生物种群与未接种病原菌(CCOF、CCK)处理下微生物代谢功能群落变异最为相关(图 4A)。同样地,在抑病土中也能得到类似的规律,轴一也能够明显区分接种与未接种病原菌的微生物功能群落,对根际微生物代谢功能变异的解释度为53.81%,并且利用羧酸类、酚酸类和胺类碳源的微生物种群的增多也是造成病原菌接种处理(SCOFR、SCKR)的微生物功能变异的主要因素,而利用氨基酸类、碳水化合物类、多聚化合物类的微生物种群的增多是造成未接种病原菌(SCOF、SCK)处理下的微生物功能群落变异的主要因素(图 4B)。类似地,本文探讨了施肥和接种病原菌处理对感病土与抑病土中土壤微生物代谢活性起主要作用的碳源因子,结果表明,不接种病原菌时胺类化合物是造成感病土功能差异的影响因素,而接种病原菌后造成感病土根际微生物代谢功能差异的影响因素是酚酸类化合物,而不论是何处理,造成抑病土根际微生物代谢功能差异的驱动因子是氨基酸类、碳水化合物类、多聚化合物类(图 5)。
|
|
表 5 各处理根际土壤微生物代谢功能PERMANOVA分析 Table 5 PERMANOVA analysis of rhizosphere microbial metabolic function under different treatments |

|
图 4 感病土(A)和抑病土(B)中土壤微生物功能变异及与主要碳源代谢的典型对应分析 Fig. 4 Canonical correspondence analysis (CCA) of soil microbial functions and metabolism of major carbon sources in disease-conductive soil (A) and disease-suppressive soil (B) |
|
图 5 施肥处理(A、B)与病原菌接种处理(C、D)下感病土与抑病土的土壤微生物功能变异及与主要碳源代谢的典型对应分析 Fig. 5 Canonical correspondence analysis (CCA) of soil microbial functions and metabolism of major carbon sources in disease-conductive and-suppressive soils under fertilization (A, B) and pathogen inoculation (C, D) |
不同处理下根际土壤对病原菌的生长影响不同,如图 6所示,无土壤对照处理(CK)的青枯菌生长最好,其次是CCKR、SCKR、CCOFR、SCOFR处理,而不论是感病土还是抑病土,有机无机配施处理下(CCOF和SCOF)的青枯菌生长明显受到了抑制(P < 0.05),分别为CK处理的76.98% 与79.32%。并且从整体上看,抑病土中青枯菌的生长略低于感病土(CCK > SCK、CCKR > SCKR、CCOF > SCOF),表明抑病土中可能存在某种对青枯菌的生长有抑制作用的挥发性有机物。

|
图 6 不同处理的青枯菌的生长情况 Fig. 6 Growth of Ralstonia solanacearum under different treatments |
通过分析土壤理化因子、微生物性质与番茄植株的病情指数、植株的生长以及根际病原菌丰度的相关性,探究对番茄青枯病害发生有显著影响的因子,结果(表 6)表明,土壤有机碳、速效氮、有效磷、速效钾含量与病情指数和病原菌丰度呈显著负相关关系,而与番茄株高呈显著正相关关系,说明较高的土壤有机质、速效氮、速效钾含量有助于减轻番茄土传病害的发生并促进番茄植株的生长。可供土壤微生物利用的碳源也受土壤理化性质的影响,尤其是碳水化合物类、氨基酸类以及酚酸类化合物,并且除了羧酸类化合物,其余碳源均与番茄植株的病情指数和根际病原菌丰度的变化明显相关。具体地,碳水化合物类、多聚化合物类和氨基酸类化合物的相对含量与病情指数和根际土壤的病原菌丰度呈显著负相关关系,与番茄株高呈显著正相关关系;而酚酸类与胺类化合物则正好相反,这说明碳水化合物类、多聚化合物类和氨基酸类化合物的增加能有效抑制青枯病菌的定殖,从而减轻番茄土传病害的发生以促进番茄植株的生长,而酚酸类与胺类化合物的增加则有利于青枯病菌的定殖,土传病害发生加剧,进而影响宿主植株的生长。
|
|
表 6 土壤理化性质、微生物性质与植物生长参数的相关性 Table 6 Correlations among soil physicochemical properties, microbial properties and plant growth parameters |
根际土壤的微生物群落多样性对维持土壤健康和植物健康具有重要意义[11]。抑病土常因其抑制病原菌侵染宿主植物的能力而备受关注。通过BIOLOG试验和生长试验,本研究比较了这两种土壤对外源接种病原菌后番茄的生长情况以及根际微生物性质,进一步揭示了土传病害的发生机制。在本研究中,相比于感病土,抑病土中番茄青枯病的病情指数降低,根际病原菌的丰度也较低,而接种病原菌后能够检测到较高丰度的病原菌,这些结果充分表明青枯病菌确实能够定殖于植物根际,并且能造成番茄植株青枯病害的发生。有机无机肥配合施用可以显著降低番茄植株的土传病害发生率、促进番茄植株的株高和增加番茄的地上部生物量(图 2),这可能是由于有机无机肥的配合施用改善了土壤的理化性质,优化了土层结构[14, 16]。相比于感病土,抑病土具有较高的有机碳、速效氮、有效磷和速效钾含量(图 1)。有机碳含量以及植物生长必需的有效氮、磷、钾养分含量较高的土壤中通常表现为较高的微生物生物量与活力,从而在土传病害抑制过程中发挥着关键作用[24]。同时,也有研究发现,土壤中有机质的提升有助于降低土传病原菌的数量,进而控制青枯病的发生[25]。有机无机配施处理的土壤pH显著下降,这可能是无机肥料中氮肥经硝化细菌的硝化作用被氧化为硝酸根同时释放H+以及过磷酸钙作为酸性肥料含有游离酸且易溶于水从而使土壤酸化加剧的缘故。然而有研究发现,芽孢杆菌等有益细菌分泌的拮抗物质如脂肽类物质等对pH的耐受范围较广[26],因而仍能保持一定的抑菌活性。另外,土壤pH降到5.3以下会使得病原菌的生长受限[19, 27],因此感病土与抑病土施肥后的病情指数会有所下降(CCOF < CCK,SCOF < SCK)。基于土壤理化性质与番茄植株的生长和青枯病病情指数的相关性分析表明,土壤中的有机碳、速效氮、有效磷和速效钾含量与番茄株高和地上部鲜重呈显著正相关,而与病情指数呈显著负相关关系(表 5)。这一方面可能是由于较高的有机碳含量提高了土壤中微生物的活性,并促使这些微生物加快降解并释放土壤中的矿质养分,从而为宿主植物的生长提供所需养分[25, 28-29];另一方面,较高含量的有效养分增加了土壤的微生物多样性,而这些微生物中不乏一些有益微生物,如芽孢杆菌、链霉菌以及假单胞菌等[30]。抑病土因其本身募集有益微生物的特性,其在遭受一定程度的土传病原菌入侵时能迅速响应,直接或间接抵御病害侵染,从而降低宿主番茄植株的病情指数以维持宿主植株的健康生长[7]。本研究中,抑病土中SCK、SCOF与SCOFR处理的病情指数小于相对应的感病中CCK、CCOF与CCOFR处理则恰好验证了这一推测。
抑病土除通过土壤养分来促进宿主植株的健康生长外,还可通过可供微生物利用的碳源来调控根际土壤微生物群落的代谢功能,从而影响番茄植株的生长。研究表明,不同碳源有助于偏好性微生物的生长,进而影响根际土壤微生物群落代谢特征[31-32]。根际微生物代谢功能活性在接种病原菌与未接种病原菌处理以及施肥处理中均存在一些差异,并且有机无机配施处理对土壤微生物代谢功能影响更大。有机无机配施促使番茄根际土壤微生物的活性显著提高(图 3),可能的原因是有机无机配合施用增加了根际土壤微生物生长所需的碳源丰度,提高了环境承载力,进而刺激了以偏好碳源的根际土壤微生物的活性[33-34]。基于根际土壤功能群落的典型对应分析结果表明,利用酚酸类和胺类化合物碳源的微生物是造成感病土根际微生物功能群落差异的驱动因子,而利用氨基酸类、碳水化合物类、多聚化合物类碳源的微生物则是造成抑病土根际微生物代谢功能变异的主要因素。根际土壤微生物碳源种类与番茄青枯病的相关性分析表明,番茄的病情指数和病原菌丰度都与碳水化合物类、氨基酸类以及多聚化合物类碳源的相对含量呈显著负相关关系,而与酚酸类和胺类化合物碳源的相对含量呈正相关关系(表 6)。基于根际土壤微生物挥发性有机物对青枯菌生长的结果(图 5)以及其与碳源种类的相关性结果可知,对病原菌生长有抑制作用的可能是碳水化合物类与氨基酸类化合物,而对病原菌生长有协同作用的可能是胺类与酚酸类化合物,其作为病原菌的营养来源,使之有利于病原菌的生长[23, 35-38]。本研究从微生物代谢功能的层面揭示了抑病土和感病土根际微生物代谢功能、土传病害发生与土壤理化性质的关系,今后的研究建议重点关注氨基酸类、胺类和酚酸类化合物,以便为进一步探明抑病土的抑病机制及为土传病原菌的防治提供科学依据。
4 结论在抑病土中配合施用有机无机肥,可明显抑制番茄植株青枯病害的发生,促进番茄生长,提高番茄根际微生物碳源代谢活性。病原菌的接种诱导了感病土中以酚酸类和胺类化合物为碳源的微生物的增多,从而进一步加剧病害的发生,而利用碳水化合物类、氨基酸类以及多聚化合物类等碳源的微生物种类的增加有助于帮助宿主植株耐受土传病害胁迫,维持宿主植物的健康生长。
| [1] |
黄新琦, 蔡祖聪. 土壤微生物与作物土传病害控制[J]. 中国科学院院刊, 2017, 32(6): 593-600 (  0) 0) |
| [2] |
朱兆良, 金继运. 保障我国粮食安全的肥料问题[J]. 植物营养与肥料学报, 2013, 19(2): 259-273 (  0) 0) |
| [3] |
王飞, 李世贵, 徐凤花, 等. 连作障碍发生机制研究进展[J]. 中国土壤与肥料, 2013(5): 6-13 (  0) 0) |
| [4] |
Peeters N, Guidot A, Vailleau F, et al. Ralstonia solanacearum, a widespread bacterial plant pathogen in the post-genomic era[J]. Molecular Plant Pathology, 2013, 14(7): 651-662 DOI:10.1111/mpp.12038 (  0) 0) |
| [5] |
Kwak M J, Kong H G, Choi K, et al. Rhizosphere microbiome structure alters to enable wilt resistance in tomato[J]. Nature Biotechnology, 2018, 36(11): 1100-1109 DOI:10.1038/nbt.4232 (  0) 0) |
| [6] |
Hayward A C. Biology and epidemiology of bacterial wilt caused by Pseudomonas solanacearum[J]. Annual Review of Phytopathology, 1991, 29: 65-87 DOI:10.1146/annurev.py.29.090191.000433 (  0) 0) |
| [7] |
Mendes R, Kruijt M, de Bruijn I, et al. Deciphering the rhizosphere microbiome for disease-suppressive bacteria[J]. Science, 2011, 332(6033): 1097-1100 DOI:10.1126/science.1203980 (  0) 0) |
| [8] |
刘洪, 董元华, 申民翀, 等. 番茄青枯病抑病土壤根际微生物群落特征及其抑制性传递机制[J]. 土壤学报, 2022, 59(4): 1125-1135 (  0) 0) |
| [9] |
Liu X J, Zhang S T, Jiang Q P, et al. Using community analysis to explore bacterial indicators for disease suppression of tobacco bacterial wilt[J]. Scientific Reports, 2016, 6: 36773 DOI:10.1038/srep36773 (  0) 0) |
| [10] |
Henry A W. The natural microflora of the soil in relation to the foot-rot problem of wheat[J]. Canadian Journal of Research, 1931, 4(1): 69-77 DOI:10.1139/cjr31-006 (  0) 0) |
| [11] |
韦中, 沈宗专, 杨天杰, 等. 从抑病土壤到根际免疫: 概念提出与发展思考[J]. 土壤学报, 2021, 58(4): 814-824 (  0) 0) |
| [12] |
Berendsen R L, Pieterse C M J, Bakker P A H M. The rhizosphere microbiome and plant health[J]. Trends in Plant Science, 2012, 17(8): 478-486 DOI:10.1016/j.tplants.2012.04.001 (  0) 0) |
| [13] |
张瑞福, 沈其荣. 抑病型土壤的微生物区系特征及调控[J]. 南京农业大学学报, 2012, 35(5): 125-132 (  0) 0) |
| [14] |
Tao C Y, Li R, Xiong W, et al. Bio-organic fertilizers stimulate indigenous soil Pseudomonas populations to enhance plant disease suppression[J]. Microbiome, 2020, 8(1): 137 DOI:10.1186/s40168-020-00892-z (  0) 0) |
| [15] |
杨天杰, 王玉鑫, 王佳宁, 等. 不同基质生物有机肥防控番茄土传青枯病及促生效果研究[J]. 土壤, 2021, 53(5): 961-968 DOI:10.13758/j.cnki.tr.2021.05.010 (  0) 0) |
| [16] |
Stewart W M, Dibb D W, Johnston A E, et al. The contribution of commercial fertilizer nutrients to food production[J]. Agronomy Journal, 2005, 97(1): 1-6 DOI:10.2134/agronj2005.0001 (  0) 0) |
| [17] |
张福锁, 王激清, 张卫峰, 等. 中国主要粮食作物肥料利用率现状与提高途径[J]. 土壤学报, 2008, 45(5): 915-924 (  0) 0) |
| [18] |
Zhang S T, Song X N, Li N, et al. Influence of high-carbon basal fertiliser on the structure and composition of a soil microbial community under tobacco cultivation[J]. Research in Microbiology, 2018, 169(2): 115-126 DOI:10.1016/j.resmic.2017.10.004 (  0) 0) |
| [19] |
方中达. 植病研究方法(3版)[M].
中国农业出版社, 北京, 1998
(  0) 0) |
| [20] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000
(  0) 0) |
| [21] |
Chojniak J, Wasilkowski D, et al. Application of biolog microarrays techniques for characterization of functional diversity of microbial community in phenolic-contaminated water[J]. International Journal of Environmental Research, 2015, 9: 785-794 (  0) 0) |
| [22] |
Schönfeld J, Heuer H, van Elsas J D, et al. Specific and sensitive detection of Ralstonia solanacearum in soil on the basis of PCR amplification of fliC fragments[J]. Applied and Environmental Microbiology, 2003, 69(12): 7248-7256 DOI:10.1128/AEM.69.12.7248-7256.2003 (  0) 0) |
| [23] |
王佳宁, 韦中, RAZA Waseem, 等. mVOCs在根际免疫中的研究进展及思考[J]. 农业环境科学学报, 2022, 41(4): 691-699 (  0) 0) |
| [24] |
Garbeva P, van Veen J A, van Elsas J D. Microbial diversity in soil: Selection microbial populations by plant and soil type and implications for disease suppressiveness[J]. Annual Review of Phytopathology, 2004, 42: 243-270 DOI:10.1146/annurev.phyto.42.012604.135455 (  0) 0) |
| [25] |
Satoh K, Toyota K. Comparison of disease suppressiveness of different soils with or without repeated application of organic matters toward bacterial wilt of tomato caused by Ralstonia solanacearum[J]. Microbes and Environments, 2004, 19(4): 310-314 DOI:10.1264/jsme2.19.310 (  0) 0) |
| [26] |
徐菱菱, 王丽, 陈龙男, 等. 1株广谱拮抗植物病原真菌的芽孢杆菌HNA3的鉴定及其活性成分分析[J]. 华中农业大学学报, 2013, 32(3): 21-27 DOI:10.3969/j.issn.1000-2421.2013.03.004 (  0) 0) |
| [27] |
王贻鸿. 酸碱度对烟草青枯菌(Ralstonia solanacearum)生长及其根部定殖的影响[D]. 北京: 中国农业科学院, 2017.
(  0) 0) |
| [28] |
Ozlu E, Kumar S. Response of soil organic carbon, pH, electrical conductivity, and water stable aggregates to long-term annual manure and inorganic fertilizer[J]. Soil Science Society of America Journal, 2018, 82(5): 1243-1251 DOI:10.2136/sssaj2018.02.0082 (  0) 0) |
| [29] |
Peacock A D, Mullen M D, Ringelberg D B, et al. Soil microbial community responses to dairy manure or ammonium nitrate applications[J]. Soil Biology and Biochemistry, 2001, 33(7/8): 1011-1019 (  0) 0) |
| [30] |
Wei Z, Yang X M, Yin S X, et al. Efficacy of Bacillus-fortified organic fertiliser in controlling bacterial wilt of tomato in the field[J]. Applied Soil Ecology, 2011, 48(2): 152-159 (  0) 0) |
| [31] |
李孝刚, 彭曙光, 靳志丽, 等. 有机物料对植烟土壤氮素矿化及微生物性质的影响[J]. 土壤学报, 2021, 58(1): 225-234 (  0) 0) |
| [32] |
Liu M Q, Hu F, Chen X Y, et al. Organic amendments with reduced chemical fertilizer promote soil microbial development and nutrient availability in a subtropical paddy field: The influence of quantity, type and application time of organic amendments[J]. Applied Soil Ecology, 2009, 42(2): 166-175 (  0) 0) |
| [33] |
Yang C L, Dong Y, Friman V P, et al. Carbon resource richness shapes bacterial competitive interactions by alleviating growth-antibiosis trade-off[J]. Functional Ecology, 2019, 33(5): 868-875 (  0) 0) |
| [34] |
Bonanomi G, Lorito M, Vinale F, et al. Organic amendments, beneficial microbes, and soil microbiota: Toward a unified framework for disease suppression[J]. Annual Review of Phytopathology, 2018, 56: 1-20 (  0) 0) |
| [35] |
Strobel G A, Dirkse E, Sears J, et al. Volatile antimicrobials from Muscodor albus, a novel endophytic fungus[J]. Microbiology (Reading, England), 2001, 147(Pt 11): 2943-2950 (  0) 0) |
| [36] |
Schulz-Bohm K, Gerards S, Hundscheid M, et al. Calling from distance: Attraction of soil bacteria by plant root volatiles[J]. The ISME Journal, 2018, 12(5): 1252-1262 (  0) 0) |
| [37] |
Raza W, Wang J C, Wu Y C, et al. Effects of volatile organic compounds produced by Bacillus amyloliquefaciens on the growth and virulence traits of tomato bacterial wilt pathogen Ralstonia solanacearum[J]. Applied Microbiology and Biotechnology, 2016, 100(17): 7639-7650 (  0) 0) |
| [38] |
Carrión V J, Perez-Jaramillo J, Cordovez V, et al. Pathogen-induced activation of disease-suppressive functions in the endophytic root microbiome[J]. Science, 2019, 366(6465): 606-612 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Pingyang Natural Resources and Planning Bureau, Pingyang, Zhejiang 325400, China
 2023, Vol. 55
2023, Vol. 55


