2. 文山苗乡三七科技有限公司, 云南文山 663000;
3. 江苏省土壤利用与农业可持续发展工程研究中心, 南京 210023;
4. 江苏省地理信息资源开发与利用协同创新中心, 南京 210023
三七(Panax notoginseng(Burk.)F. H. Chen),又名田七,是我国特有的名贵道地药材,具有入药历史久、用药范围广、市场需求量大等特征[1]。云南省文山州是三七的原产地和道地产区,当地已有400多年的三七栽培历史[2]。经过多年的发展,三七产业已成为文山州重要的经济支柱产业,2019年实现收入160亿元。但是,由于三七生长环境的特殊性和品种的单一性,规模化种植极易引起以土传病害为主要特征的三七连作障碍问题,且尚无行之有效的防控措施[3-4]。当前,文山州境内适宜三七生长的土地资源日益匮乏,一方面导致三七种植区不断外延,严重影响三七的品质和道地性;另一方面迫使农户通过大量使用化学农药来控制连作三七的土传病害问题,威胁道地三七的安全性。因此,解决三七连作障碍问题,对于保障道地三七产业的绿色可持续发展,重塑文山州道地三七产区地位至关重要。
研究表明,三七产生连作障碍的本质是前茬三七种植引起的土壤环境变化超越了其本身的适应能力,这种变化主要表现为土壤理化性质恶化、养分失衡、土传病原菌富集和化感自毒物质积累[5]。因此,明确三七种植对其障碍因子形成累积的影响是有效克服三七连作障碍的重要前提。Luo等[6]研究发现,三七生长过程中通过植物–土壤负反馈作用驱动根际微生态失衡,特别是土传病原菌如尖孢镰刀菌(Fusarium oxysporum)、腐皮镰刀菌(Fusarium solani)等种群数量不断增加,并伴随有益菌如木霉(Trichoderma)、枝顶孢霉(Acremonium)等种群数量下降。Yang等[5]研究表明三七生长过程中积累的皂苷类化感自毒物质是导致其再植失败的关键因素。Li等[7]进一步通过土壤纯培养添加试验揭示了皂苷类化感物质是促进三七土传病原菌富集、引起土壤真菌区系失衡的“罪魁祸首”,是导致三七产生连作障碍的重要驱动因素。可见,三七生长过程中通过根系分泌的一些特异性组分可能是介导其连作障碍形成的根本原因。
近年来,有一些研究发现,植物根际微生物代谢功能紊乱或缺失,特别是对某些有毒物质降解活性的下降是导致其积累并触发连作障碍的内在因素[8-9]。Dong等[8]研究表明邻苯二甲酸二异丁酯(diisobutyl phthalate,DiBP)降解菌丰度的下降是造成该物质在根际累积并引起人参再植失败的根本原因,而外源添加DiBP降解菌鞘氨醇杆菌(Sphingobacterium sp.)可显著降低再植人参的死亡率。付丽娜等[10]比较了健康和罹患根腐病三七根际微生物碳源代谢活性的差异,发现患病三七根际微生物代谢功能显著低于健康植株,但目前关于三七种植对根际微生物碳、氮代谢功能影响的认知仍不充分。因此,本研究以不同种植年限的健康三七根际土为研究对象,采用实时荧光定量PCR及Biolog微平板法等技术手段研究种植年限对健康三七根际氮素循环功能基因丰度、碳源代谢活性及其功能多样性的影响,旨在揭示三七种植与根际微生物代谢功能变化之间的关系,为进一步解析三七连作障碍的形成机理提供理论依据,并为定向开发特定措施缓解三七连作障碍提供线索和方向。
1 材料与方法 1.1 土壤样品采集及预处理本研究所需土壤样品采自云南省文山苗乡三七科技有限公司的三七种植园(23o42'N,104o16'E),园内有不同种植年限的三七大棚。在种植年限为1 a(Y1)和2 a(Y2)的三七大棚内,分别随机选取12株健康三七植株,小心挖出后抖去根表松软的土,将紧紧附着于根表的土壤视为根际土,每3株三七植株的根际土混合成为一个土样;对照土壤样品为未种植过三七的土壤(CK)。将采集的土壤样品装入自封袋,运回实验室过2 mm筛后分成两份,一份置于4 ℃冰箱保存,用于土壤微生物活性和碳源代谢功能的分析;一份置于–80 ℃冰箱保存,用于土壤DNA提取及氮素循环功能基因定量分析。
1.2 土壤微生物活性分析土壤微生物活性采用荧光素二乙酸酯(fluorescein diacetate,FDA)水解法进行分析[11]。称取2 g新鲜土样加入到已装有15 mL磷酸缓冲液(60 mmol/L,pH 7.6)和0.2 mL FDA溶液(1 mg/mL)的50 mL离心管中,在摇床上振荡反应20 min(30 ℃,100 r/min)后立即加入15 mL氯仿/甲醇(2︰1)溶液终止反应,2 000 r/min下离心3 min后取上清液过0.22 μm滤膜,滤液用分光光度计在490 nm处测定吸光值。标准曲线参照王宝英等[12]的方法构建。
1.3 土壤DNA提取及氮素循环功能基因定量分析称取0.5 g保存于–80 ℃冰箱的土壤,使用FastDNA® SPIN Kit for Soil(MP Biomedical,USA)按说明书步骤提取土壤总DNA,每个土壤样品提取两个重复,经NanoDrop ND-1000分光光度计(Thermo Scientific,DE,USA)质控后混合在一起,以降低DNA提取的偏差。
采用CFX96TM实时荧光定量PCR仪(Bio-Rad Laboratories Inc.,CA,USA)对氮素循环功能基因进行定量。PCR扩增体系包括10 μL SYBR® Premix Ex Taq ™ (2×,Takara,中国大连)、1 μL正向引物(10 μmol/L),1 μL反向引物(10 μmol/L),2 μL土壤DNA模板(20 ng/μL)以及6 μL无菌去离子水。用于定量固氮基因nifH (PolF/PolR)、氨氧化古菌amoA (Arch-amoAF/Arch-amoAR)和氨氧化细菌amoA (amoA1F*/ amoA2R)的引物及扩增条件如表 1所示。各功能基因的标准曲线参照Zhao等[13]的方法构建,均符合测定要求。
|
|
表 1 实时荧光定量PCR所用引物和扩增条件 Table 1 Primers and PCR conditions used in real-time PCR assay |
土壤微生物碳源代谢活性及功能多样性采用Biolog ECO微平板法进行测定[17]。具体步骤如下:称取相当于5 g干重的新鲜土样至内有45 mL灭菌的0.85% NaCl (m/V)溶液的250 mL三角瓶中,用封口膜封口,25 ℃、200 r/min条件下黑暗振荡30 min;振荡结束后静置30 min,取上清液按逐步稀释法得到10–3稀释液,将10–3稀释液接种到ECO板微孔中,每孔125 μL,随后将其置于恒温培养箱中25 ℃黑暗培养144 h,每隔24 h用Biolog读数仪在590 nm下测定吸光值。
1.5 Biolog数据处理和分析参照Huang等[18]的方法对Biolog数据进行处理和分析。其中,微生物总体碳源代谢活性用平均每孔颜色变化率(average well color development,AWCD)表示,其公式为:
| $ \mathrm{AWCD}=\sum\left(C_l-R_i\right) / 31 $ |
式中:Ci表示第i反应孔的吸光值,Ri表示对照孔的吸光值。若Ci–Ri为负数,则取为0。
同时,选取培养144 h时的吸光值,对底物类型代谢活性、碳源利用多样性指数、优势度指数和丰富度指数进行计算[19]。
1) 底物类型代谢活性(substrate average well color development,SAWCD),用于评估微生物对不同类型碳源的利用率。SAWCD = ∑ODi/N,其中ODi表示某一类型碳源第i反应孔的相对吸光值,N表示该类型碳源的数量。
2) McIntosh多样性指数(U),用于衡量土壤微生物群落碳源代谢功能多样性。
3) Shannon多样性指数(H),用于表征土壤微生物群落碳源代谢功能多样性。H = –ΣPilnPi,式中Pi表示第i反应孔的相对吸光值与所有反应孔相对吸光值总和的比值,Pi =(Ci–Ri)/∑(Ci–Ri)。
4) Simpson优势度指数(D),用于评估土壤微生物群落碳源代谢功能优势度。D=1–ΣPi2。
5) 丰富度指数(S),用于评估土壤微生物群落碳源代谢功能丰富度,即指利用的单一碳源总数,其中反应孔的相对吸光值大于0.2则认为该碳源被利用。
1.6 统计分析本试验为单因素试验,采用SPSS 19.0软件对数据进行方差分析(One-way ANOVA),并用Duncan氏新复极差法进行差异显著性检验(P < 0.05)。基于144 h时31种单一碳源的代谢活性,采用R软件(v3.1.2)对碳源利用特征进行主成分分析,并用置换多因素方差分析进行差异显著性检验(P < 0.05)。利用Spearman相关分析方法检验土壤微生物活性与氮素循环功能基因丰度、碳源代谢活性及其功能多样性之间的相关性。
2 结果与分析 2.1 种植年限对健康三七根际微生物活性的影响如图 1所示,与CK相比,三七种植能够显著(P < 0.05)提高根际土壤微生物的活性,且随着种植年限的增加,这种促进作用更加显著,其中Y1和Y2的根际微生物活性分别是CK的1.60倍和2.34倍。这可能与三七生长过程中通过根系分泌等方式持续为根际微生物提供碳、氮等养分有关。

|
(CK:未种植过三七的土壤;Y1:种植1 a的三七根际土壤;Y2:种植2 a的三七根际土壤。误差线表示标准误(n = 4),图柱上方小写字母不同表示土壤样品间差异显著(P < 0.05)。下同) 图 1 种植年限对健康三七根际微生物活性的影响 Fig. 1 Effects of planting years on rhizosphere microbial activities of healthy Sanqi ginseng |
由图 2可知,随着种植年限的增加,健康三七根际土壤中nifH基因的丰度也逐渐增加,其中Y2土样中nifH基因丰度较CK差异显著(P < 0.05),表明根际微生物的固氮能力随三七生长逐渐增强。古菌amoA基因在未种植过三七的土壤中丰度较高,达到3.94 × 106 copies/g(以干土计,下同),随三七种植年限呈现“U”形的变化规律,且Y2较CK无显著差异。细菌amoA基因在CK中的丰度较低,仅为1.07 × 105 copies/g,而三七种植能够大幅度(P < 0.05)提高细菌amoA基因丰度,且其随种植年限的增加变化不显著,Y1和Y2的细菌amoA基因丰度分别是CK的25.7倍和16.1倍,表明三七种植能够显著提高其根际细菌的氨氧化作用。综上,三七种植能够通过提高根际氮素循环功能基因的丰度以增强氮素养分的供应能力,这可能与三七生长过程中对氮的需求不断增加密切相关。
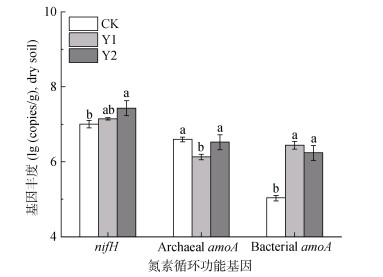
|
图 2 种植年限对健康三七根际微生物氮素循环功能基因丰度的影响 Fig. 2 Effects of planting years on abundances of rhizosphere microbial nitrogen functional genes of healthy Sanqi ginseng |
由图 3A可知,在培养24 h后,Y2土样的AWCD值显著(P < 0.05)高于CK和Y1,而Y1和CK间差异不显著,表明Y2的土壤微生物在短时间内即表现出较强的总体碳源代谢活性。随着培养时间的延长,CK的AWCD值仍处在较低的水平,且无明显变化;Y1的AWCD值则呈现逐渐增加的趋势,但增速较为缓慢;Y2的AWCD值在培养前期(24 ~ 72 h)快速增加,随后转为缓慢增加并逐渐趋于稳定,但在培养期内均显著高于Y1。由图 3B可知,在培养144 h以后,CK的土壤微生物对六类碳源的代谢能力均较弱,而三七种植能够显著(P < 0.05)提高根际微生物对六类碳源的代谢活性,且随着种植年限的增加,对碳水化合物类、羧酸类、氨基酸类、胺类和聚合物类碳源的代谢能力显著(P < 0.05)增强,而对酚酸类物质的代谢活性随着种植年限的增加变化不显著。结果表明:未种植过三七的土壤微生物碳源代谢活性很弱,三七种植能够显著提升土壤微生物的碳源代谢功能,且随着种植年限的增加,土壤微生物的碳源代谢功能不断增强。
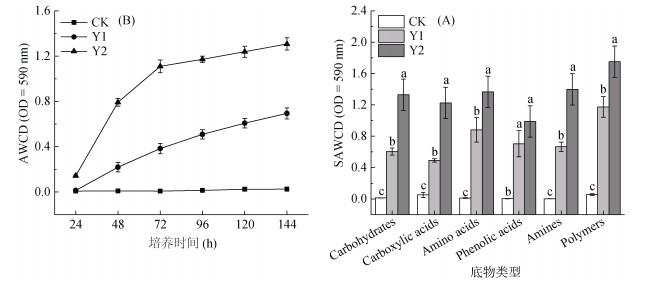
|
(Carbohydrates:碳水化合物;Carboxylic acids:羧酸;Amino acids:氨基酸;Phenolic acids:酚酸;Amines:胺类;Polymers:聚合物) 图 3 种植年限对健康三七根际微生物AWCD值(A)及六类碳源利用强度(B)的影响 Fig. 3 Effects of planting years on AWCD values of rhizosphere microbes (A) and utilization efficiencies of six types of carbon sources (B) |
PCA分析结果(图 4A)表明三七种植能够显著(P=0.003)改变土壤微生物碳源利用特征,且不同种植年限健康三七根际微生物的碳源利用特征存在差异。其中前两个主成分可分别解释85.7% 和6.3% 的处理间碳源利用变异度。进一步的分析发现,驱动不同处理在第一主成分中形成差异贡献最大的5种碳源分别是L-天冬酰胺酸、D-甘露醇、吐温80、ß-甲基D-葡萄糖苷和N-乙酰基-D-葡萄胺;而驱动不同处理在第二主成分中形成差异贡献最大的5种碳源分别是L-天冬酰胺酸、肝糖、L-精氨酸、吐温40和吐温80(表 2)。以上结果表明碳水化合物类、氨基酸类、聚合物类碳源利用能力的差异是导致不同种植年限健康三七根际微生物碳源利用特征差异的重要原因,其中L-天冬酰胺酸和吐温80是两个最关键的碳源。基于Bray-Curtis距离分析碳源利用相异度发现,三七种植可显著(P < 0.05)降低不同重复样品间的碳源利用差异性,且随着种植年限的增加,不同重复样品间的碳源利用差异程度更小(图 4B)。

|
图 4 种植年限对健康三七根际微生物碳源利用特征(A)及相似程度(B)的影响 Fig. 4 Effects of planting years on carbon source utilization patterns (A) and dissimilarities of rhizosphere microbes |
|
|
表 2 驱动碳源利用特征在前两个主成分中形成差异贡献最大的5种碳源 Table 2 Five carbon sources contributed most to first two PCs to drive differences in carbon source utilization pattern among soil samples |
由表 3可知,三七种植能够显著(P < 0.05)提高碳源利用的McIntosh多样性指数和Shannon多样性指数,随着种植年限的增加,McIntosh多样性指数显著增加;而碳源利用的Simpson优势度指数随着种植年限的增加而逐渐增加,其中Y2的Simpson优势度指数显著(P < 0.05)高于CK。此外,三七种植还能显著(P < 0.05)提高碳源利用的丰富度指数,且随着种植年限的增加而显著增加。结果表明,三七种植能够显著提高根际微生物的碳源代谢功能,特别是对不同单一碳源种类的代谢能力显著提升。
|
|
表 3 种植年限对健康三七根际微生物碳源利用多样性的影响 Table 3 Effects of planting years on rhizosphere metabolic diversity indices of healthy Sanqi ginseng |
Spearman相关性分析显示(表 4):土壤微生物活性与总体碳源代谢活性(AWCD)、六大类碳源的利用率及碳源利用多样性指数、优势度指数和丰富度指数均呈显著(P < 0.05)正相关关系,而其与nifH和细菌amoA的基因丰度也呈正相关,但不显著。结果表明,土壤微生物活性的提高是实现根际碳、氮功能提升的基础。
|
|
表 4 土壤微生物活性与氮素循环功能基因丰度、碳源代谢活性及其功能多样性之间的Spearman相关性分析 Table 4 Spearman correlation coefficients between soil microbial activity and nitrogen functional gene abundances, soil metabolic activity and functional diversity indices |
三七是极其珍贵的道地药材,其可持续生产对保障我国中药产业的稳定发展至关重要[20]。然而目前,连作障碍已成为制约我国道地三七产业健康可持续发展的主要瓶颈[1]。研究表明,根际微生态失衡和代谢功能紊乱是导致三七产生连作障碍的关键因素[3]。其中,根际化感自毒物质如酚酸、皂苷等降解能力不足或代谢活性下降可能是导致其积累并驱动根际微生态失衡的重要诱因[8]。因此,探明健康三七根际微生物活性及其代谢功能特征对于揭示三七连作障碍的形成机理具有十分重要的意义。
土壤微生物活性是评价土壤健康和功能的常用指标[21]。有研究表明,土壤抑病能力与土壤整体微生物活性密切相关,提高FDA水解酶活性能够有效降低土传根腐病的发生率[22-23]。因此,根际土壤微生物活性的高低在一定程度上决定着根际健康状况。本研究发现,健康三七根际土壤微生物的活性随其种植年限的增加而显著提高,这表明随着三七的生长,需要更高的土壤微生物活性才能维持其根际健康,以抵御土传病原菌的入侵和危害。同时,土壤养分的周转供应能力也是土壤健康的重要特征之一[22]。在本研究中,我们发现健康三七根际土壤中nifH和细菌amoA基因的丰度显著高于未种植过三七的对照土壤,表明三七种植能够有效提高土壤氮素养分的周转供应能力,而且随着种植年限的增加,根际土壤中nifH基因的丰度逐渐增加,在一定程度上表明根际固氮能力逐渐增强,这可能与三七自身生长和品质形成对氮的需求不断增加有关[24]。
土壤微生物的碳源代谢活性及其功能多样性是表征土壤功能的重要生物学指标[25]。本研究发现,三七种植能够有效提高土壤微生物的碳源代谢活性及其功能多样性,这可能与在三七根系分泌物的刺激下,根际微生物对多样化碳源的利用能力显著提升有关。随着种植年限的增加,健康三七根际土壤微生物对碳源的代谢利用能力以及利用强度均不断增强,这与付丽娜等[10]研究结果一致,其发现三年七健康根际土壤微生物的碳源代谢活性和碳源利用多样性指数显著高于二年七根际土壤,这表明随着三七生长年限的增加,其根际组装的微生物群落能够利用更多种类的碳源,具备更高的代谢功能多样性。在本研究中,我们还发现三七根际土壤微生物对碳水化合物类、氨基酸类和聚合物类碳源利用能力的差异是导致不同种植年限三七碳源代谢利用特征分异的主要原因,这与付丽娜等[10]的报道存在一定的差异,可能与我们两个研究中三七根际微生物的群落组成、结构及多样性不同有关[18]。相关性分析显示,土壤微生物活性与碳源代谢活性及其功能多样性指数均呈显著正相关关系,表明高活性的根际微生物群落是实现其代谢功能的基础[26]。此外,有研究报道[10,27],同一生长年限或同一种植区域的健康三七根际土壤微生物的碳源代谢活性显著高于患病根际土壤,这表明高效的碳源代谢功能对于三七根际健康至关重要。
酚酸是一类重要的植物化感物质,可通过根系分泌、雨雾淋溶、残体分解等方式进入土壤环境[9]。研究表明,当酚酸类物质在土壤中积累到一定浓度以后,不仅会抑制植物根系生长,降低根系酶活性,同时还会促进土传病原菌增殖,破坏根际微生态平衡,增加作物土传病害和连作障碍的发生风险[28-29]。本研究发现,三七根际土壤微生物对酚酸类物质的代谢利用能力并未随其种植年限的增加而显著增加,这表明随着三七的生长,根际土壤中的酚酸会因分解不及时而逐渐积累。Wang等[30]的研究结果印证了该推测,其发现二年七根际土壤中对香豆酸、阿魏酸、苯甲酸等酚酸类物质的含量显著高于一年七根际土壤。所以我们认为,根际微生物对特定化感自毒物质的代谢能力不足是导致三七产生连作障碍的重要原因。因此,明确并分离三七生长过程中参与特定化感自毒物质代谢的微生物类群,在厘清这些具备特定降解功能的微生物类群在土壤中的存活机理的基础上,研发相应的菌剂或生物肥料产品,可能能为保障三七根际健康,克服三七连作障碍提供新的思路和方向。
4 结论本研究发现,健康三七根际土壤微生物活性和功能随其种植年限的增加而不断提高,表明具有高活性和代谢功能的微生物群落对维持三七根际健康至关重要。然而,根际酚酸类物质的代谢能力并未随健康三七种植年限的增加而增强,这从侧面说明,根际微生物对化感物质如酚酸、皂苷等代谢能力的不足是引起这些物质积累,并介导三七根际微生态失衡和产生连作障碍的根本原因。因此,强化三七生长过程中根际微生物对化感自毒物质的降解活性对抑制其相对累积,保障三七根际微生态稳定和健康,实现三七可持续种植具有重要的意义。
| [1] |
孙雪婷, 李磊, 龙光强, 等. 三七连作障碍研究进展[J]. 生态学杂志, 2015, 34(3): 885-893 DOI:10.13292/j.1000-4890.2015.0119 (  0) 0) |
| [2] |
Guo H B, Cui X M, An N, et al. Sanchi ginseng (Panax notoginseng (Burkill) F. H. Chen) in China: Distribution, cultivation and variations[J]. Genetic Resources and Crop Evolution, 2010, 57(3): 453-460 DOI:10.1007/s10722-010-9531-2 (  0) 0) |
| [3] |
杨建忠, 官会林, 刘大会, 等. 三七连作障碍发生机理及消减技术研究[J]. 北方园艺, 2016(14): 160-163 (  0) 0) |
| [4] |
李云龙, 王宝英, 常亚锋, 等. 土壤强还原处理对三七连作障碍因子及再植三七生长的影响[J]. 土壤学报, 2019, 56(3): 703-715 (  0) 0) |
| [5] |
Yang M, Zhang X D, Xu Y G, et al. Autotoxic ginsenosides in the rhizosphere contribute to the replant failure of Panax notoginseng[J]. PLoS One, 2015, 10(2): e0118555 DOI:10.1371/journal.pone.0118555 (  0) 0) |
| [6] |
Luo L F, Guo C W, Wang L T, et al. Negative plant-soil feedback driven by re-assemblage of the rhizosphere microbiome with the growth of Panax notoginseng[J]. Frontiers in Microbiology, 2019, 10: 1597 DOI:10.3389/fmicb.2019.01597 (  0) 0) |
| [7] |
Li Y L, Dai S Y, Wang B Y, et al. Autotoxic ginsenoside disrupts soil fungal microbiomes by stimulating potentially pathogenic microbes[J]. Applied and Environmental Microbiology, 2020, 86(9): e00130-20 (  0) 0) |
| [8] |
Dong L L, Xu J, Li Y, et al. Manipulation of microbial community in the rhizosphere alleviates the replanting issues in Panax ginseng[J]. Soil Biology and Biochemistry, 2018, 125: 64-74 DOI:10.1016/j.soilbio.2018.06.028 (  0) 0) |
| [9] |
张重义, 林文雄. 药用植物的化感自毒作用与连作障碍[J]. 中国生态农业学报, 2009, 17(1): 189-196 (  0) 0) |
| [10] |
付丽娜, 魏兰芳, 王震铄, 等. 三七根际微生物群落组成及多样性研究[J]. 生物技术进展, 2017, 7(3): 211-216 (  0) 0) |
| [11] |
Adam G, Duncan H. Development of a sensitive and rapid method for the measurement of total microbial activity using fluorescein diacetate (FDA) in a range of soils[J]. Soil Biology and Biochemistry, 2001, 33(7/8): 943-951 (  0) 0) |
| [12] |
王宝英, 李金泽, 黄新琦, 等. 土壤强还原处理对连作芥蓝产量、微生物数量及活性的影响[J]. 土壤, 2019, 51(2): 316-323 (  0) 0) |
| [13] |
Zhao J, Ni T, Li J, et al. Effects of organic-inorganic compound fertilizer with reduced chemical fertilizer application on crop yields, soil biological activity and bacterial community structure in a rice-wheat cropping system[J]. Applied Soil Ecology, 2016, 99: 1-12 DOI:10.1016/j.apsoil.2015.11.006 (  0) 0) |
| [14] |
Poly F, Ranjard L, Nazaret S, et al. Comparison of nifH gene pools in soils and soil microenvironments with contrasting properties[J]. Applied and Environmental Microbiology, 2001, 67(5): 2255-2262 DOI:10.1128/AEM.67.5.2255-2262.2001 (  0) 0) |
| [15] |
Francis C A, Roberts K J, Beman J M, et al. Ubiquity and diversity of ammonia-oxidizing Archaea in water columns and sediments of the ocean[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(41): 14683-14688 DOI:10.1073/pnas.0506625102 (  0) 0) |
| [16] |
Stephen J R, Kowalchuk G A, Bruns M A V, et al. Analysis of β-subgroup proteobacterial ammonia oxidizer populations in soil by denaturing gradient gel electrophoresis analysis and hierarchical phylogenetic probing[J]. Applied and Environmental Microbiology, 1998, 64(8): 2958-2965 DOI:10.1128/AEM.64.8.2958-2965.1998 (  0) 0) |
| [17] |
Garland J L, Mills A L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization[J]. Applied and Environmental Microbiology, 1991, 57(8): 2351-2359 DOI:10.1128/aem.57.8.2351-2359.1991 (  0) 0) |
| [18] |
Huang X Q, Zhao J, Zhou X, et al. Differential responses of soil bacterial community and functional diversity to reductive soil disinfestation and chemical soil disinfestation[J]. Geoderma, 2019, 348: 124-134 (  0) 0) |
| [19] |
党雯, 郜春花, 张强, 等. Biolog法测定土壤微生物群落功能多样性预处理方法的筛选[J]. 中国农学通报, 2015, 31(2): 153-158 (  0) 0) |
| [20] |
崔秀明, 黄璐琦, 郭兰萍, 等. 中国三七产业现状及发展对策[J]. 中国中药杂志, 2014, 39(4): 553-557 (  0) 0) |
| [21] |
Anderson T H. Microbial eco-physiological indicators to asses soil quality[J]. Agriculture, Ecosystems & Environment, 2003, 98(1/2/3): 285-293 (  0) 0) |
| [22] |
龚明福, 贺江舟, 孙晓棠, 等. 土壤微生物与土壤抑病性形成关系研究进展[J]. 新疆农业科学, 2007, 44(6): 814-819 (  0) 0) |
| [23] |
Dita M, Barquero M, Heck D, et al. Fusarium wilt of banana: Current knowledge on epidemiology and research needs toward sustainable disease management[J]. Frontiers in Plant Science, 2018, 9: 1468 (  0) 0) |
| [24] |
Wei W, Ye C, Huang H C, et al. Appropriate nitrogen application enhances saponin synthesis and growth mediated by optimizing root nutrient uptake ability[J]. Journal of Ginseng Research, 2020, 44(4): 627-636 (  0) 0) |
| [25] |
Nannipieri P, Ascher J, Ceccherini M T, et al. Microbial diversity and soil functions[J]. European Journal of Soil Science, 2003, 54(4): 655-670 (  0) 0) |
| [26] |
Zhao J, Liu S Z, Zhou X, et al. Reductive soil disinfestation incorporated with organic residue combination significantly improves soil microbial activity and functional diversity than sole residue incorporation[J]. Applied Microbiology and Biotechnology, 2020, 104(17): 7573-7588 (  0) 0) |
| [27] |
付丽娜, 汪娅婷, 王星, 等. 三七连作根际微生物多样性研究[J]. 云南农业大学学报(自然科学), 2018, 33(2): 198-207 (  0) 0) |
| [28] |
田给林, 毕艳孟, 孙振钧, 等. 酚酸类物质在作物连作障碍中的化感效应及其调控研究进展[J]. 中国科技论文, 2016, 11(6): 699-705 (  0) 0) |
| [29] |
王爽, 郑世伟, 李笑, 等. 日光温室黄瓜长期连作自毒物质累积与土壤肥力因子的关系[J]. 应用生态学报, 2022, 33(3): 784-792 (  0) 0) |
| [30] |
Wang B Y, Xia Q, Li Y L, et al. Root rot-infected Sanqi ginseng rhizosphere harbors dynamically pathogenic microbiotas driven by the shift of phenolic acids[J]. Plant and Soil, 2021, 465(1): 385-402 (  0) 0) |
2. Miaoxiang Sanqi Technology Co., Ltd., Wenshan, Yunnan 663000, China;
3. Jiangsu Engineering Research Center for Soil Utilization & Sustainable Agriculture, Nanjing 210023, China;
4. Jiangsu Center for Collaborative Innovation in Geographical Information Resource Development and Application, Nanjing 210023, China
 2023, Vol. 55
2023, Vol. 55


