2. 中国科学院大学, 北京 100049
滨海湿地地处海洋与陆地的交汇地带,具有丰富的生物多样性和较高的生产力,在抵御洪水、调节径流、改善气候、控制污染和维护区域生态平衡等方面具有其他生态系统不可替代的作用[1]。同时,滨海湿地由于其独特的地理位置,既受陆地环境的影响又受海洋环境的影响,既受自然因素的控制又受人类活动的干扰[2],是生态环境条件变化最剧烈和生态系统最易被破坏的高脆弱生态系统[3]。
自工业革命以来,大气中CO2浓度不断升高,在18世纪中期工业革命之前,全球平均CO2含量约为280 μmol/mol,而到2022年达到418.98 μmol/mol (https://keelingcurve.ucsd.edu),同时,由此引发的全球升温,造成冰川融化,海平面也随之升高。滨海湿地对气候变化极为敏感,海平面的加速上升和大气CO2浓度的增加会对滨海湿地产生以下影响:①加大海岸地区的海潮和洪水,淹水增加,沿岸地区的湿地和低洼地带被淹没;②发生和加速新的海岸侵蚀;③海水入侵,改变湿地的水盐平衡;④改变湿地优势物种的产量和分布[4]。当前关于滨海湿地植被对大气CO2浓度升高和海平面上升的响应是主要的研究内容之一[5-8]。根系作为支撑植物地上部以及吸收水分及养分的重要器官[9],是维护及提升湿地海拔高度的重要贡献者[10]。地下部生物量也常作为一种关键参数被研究者用于探讨滨海湿地植被对CO2浓度升高和海平面上升的响应。但目前大多研究是分别探讨不同植被群落,如C3和C4植物对环境变化的响应。Saunders等[4]将C3和C4植物的根茎和根进行详细分类,并对这些不同种类的根茎和根的响应进行了研究;Erickson等[8]探讨了C3和C4植物的总地下生物量和氮含量在CO2浓度升高、海平面上升和不同盐度下的变化。
基于以上,本文主要是从群落整体出发,探索不同群落整体的根茎、根和总地下生物量对CO2浓度升高和海平面上升的响应。湿地通过生物–物理反馈维持其海拔高程,植物的地上部分通过减缓水流速度影响矿物质的沉积并在土壤表层添加有机质,而地下部的植物根系生长和分解直接向土壤增加有机质[10]。因此,了解地下生物量对非生物因素和生物因素的响应,有利于建立沿海湿地植被变化及其对土壤有机质积累影响的模型[4],并探究在未来海平面持续上升情况下湿地的稳定性。
1 材料与方法 1.1 研究地点本论文的数据来源于美国史密森尼环境研究中心开展的原位开顶式生长箱(open top chamber,OTC)试验。试验的研究地点位于美国马里兰州切萨皮克湾西岸罗德河的柯克帕特里克(Kirkpatrick)湿地(38°53′N,76°33′W),是一个典型的半咸水沼泽[11]。罗德河的潮汐幅度为30 cm,但风暴等可能会造成更极端的水位。土壤的盐度范围为1 ~ 20 g/L,春季最低,秋季最高。湿地以北1 km处的年平均降水量为120 cm,年平均气温为12 ℃[4]。该研究地点主要分布着一种C3植物(Schoeneplectus americanus)和两种C4植物(Spartina patens和Distichlis spicata)。湿地地表海拔的差异使得不同海拔处土壤环境存在差异,而C3和C4植物的分布受土壤环境的影响[7]。沿海拔梯度主要分布着3种植物群落,在低海拔处,土壤盐度较低,淹没频率较高,植物群落以C3植物为主;在中海拔处,植物群落是C3植物和C4植物混合群落;在高海拔,土壤盐度较高,淹没频率较低,植物群落以C4植物为主[12]。将这3个群落分别称为Scirpus群落(SC)、混合群落(MX)和Spartina群落(SP)。
1.2 试验方法利用OTC对3个植物群落进行CO2浓度升高试验。在每个群落中,按照随机区组设计设置5个区组,每个区组设置3个处理:①OTC气室内CO2浓度为环境背景值,即对照处理(A);②OTC气室内CO2浓度为对照浓度+ 340 μmol/mol CO2,即CO2浓度升高处理(E);③纯野外环境处理,即不设置OTC设施。植物的生长和衰老通过连续的、非破坏性的普查来监测[13]。地下生物量的测量是通过在每个小区中随机选取植物根系周围的土样,土样长度为70 cm,直径为5.1 cm,在2.5、5、7.5、12.5、15、22.5、25 cm深度处,将土壤芯切割成2.5 cm长度的土壤段;在35、45、55和65 cm的深度处将土壤芯切割成5 cm长度的土壤段,并使用数显卡尺测量土壤段的宽度。用1 mm筛网过筛土壤段,并将剩余的部分手工分离成根、根茎和杂乱的枯枝落叶部分。将大部分受损的根和根茎、较小根(长度1 ~ 2 cm)以及长度小于1 cm的所有根和根茎材料归类为凋落物部分。将根和根茎在60℃烘箱烘干至恒重后进行称重。每个土壤段的生物量除以段宽得到单位立方厘米的根和根茎生物量。通过插值整合0 ~ 65 cm深度的生物量剖面进行整合以估算每个样地的根和根茎生物量(单位为g/m2)[4],而总地下生物量为根和根茎生物量的总和。
总地下生物量=根茎生物量+根生物量
1.3 环境变量平均海平面的数据为相对于NOAA / NOS验潮仪的平均水位,取自于马里兰州安纳波利斯附近的美国海军学院(站点:8575512),以2000—2019年每年5—7月的海平面平均值作为每年生长季海平面值以观察试验期间海平面的变化情况。气温和降水数据来自于全球变化研究湿地(GCREW)附近的气象站,距离马里兰州安纳波利斯海军学院的GCREW站点13.5 km。当该站点数据缺失时,使用名为“Polices Bar”站点的数据,该站点也位于安纳波利斯。如果安纳波利斯的气象数据存在缺失,则利用距离GCREW站点13.5 km的巴尔的摩华盛顿机场站的数据填补。汇总每年5—7月的平均气温和总降水量数据。海平面和气象数据均取自于NOAA。盐度数据是柯特帕里克湿地20 cm深度处孔隙水5—7月的平均值。
1.4 数据处理与统计分析使用Origin 2021b作图并分析温度、降水、海平面和孔隙水盐度之间的相关性,利用R语言进行重复测量方差分析CO2浓度升高对根茎、根和总地下生物量的影响,根茎、根和总地下生物量年际差异以及CO2浓度和时间的交互作用。考虑到湿地植物生长参数的高变异性,P < 0.10即认定为显著[8]。
2 结果 2.1 环境变量变化由图 1可以看出,研究区2000—2019年植物生长季平均温度的变化(–5.8% ~ 9.8%)呈波动上升的趋势,范围为21 ~ 25 ℃。平均海平面随时间变化整体呈上升的趋势,在20年的试验过程中,平均海平面从5 cm上升至24 cm,增加了近20 cm。而降水量变化幅度(–4.4% ~ 7.6%)较大,范围为17 ~ 50 cm。温度与降水量显著负相关(r= –0.481 69,P < 0.05),与平均海平面显著正相关(r=0.498 34,P < 0.05),而降水与平均海平面显著负相关(r= –0.507,P < 0.05)。
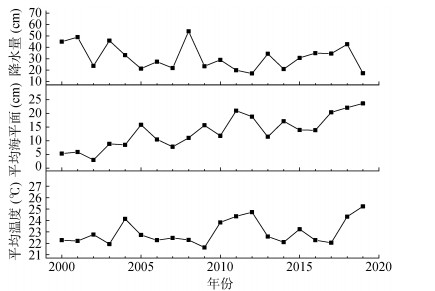
|
(图中平均气温和平均海平面取5—7月的平均值,而降水量为5—7月的总和) 图 1 2000—2019年季节性气候数据 Fig. 1 Seasonal climate data from 2000 to 2019 |
在3个群落中,除2002年SC和SP群落的盐度外,20 cm处孔隙水中盐度随着试验时间的延续呈上升趋势,其中SC和SP群落中的孔隙水盐度范围均在3 ~ 12 g/L,而MX群落中孔隙水的盐度变化范围较小,为3 ~ 7 g/L (图 2)。对照和CO2浓度升高处理孔隙水中盐度相近。
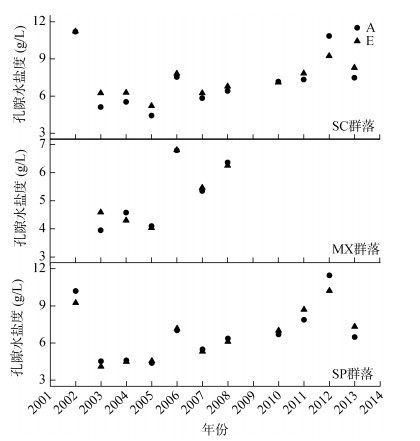
|
(图例中A为对照处理,E为CO2浓度升高处理) 图 2 2002—2013年SC、MX、SP群落20 cm深度处孔隙水盐度生长季(5 – 7月)变化 Fig. 2 Changes of porewater salinity at 20 cm of SC, MX and SP communities in growth season (May-July) from 2002 to 2013 |
CO2浓度升高总体上增加了SC、MX、SP三个群落中植物的根、根茎和总地下生物量。在SC群落中植物的根生物量和总地下生物量年际间变化较大,总体呈先上升后下降的趋势,且CO2处理和年份之间有交互作用;同时根茎生物量的年际间差异不显著,CO2处理和年份没有交互作用。在MX群落中,同样根和总地下生物量年际间差异显著,随试验时间的增加,先上升后下降,但是CO2处理和年份之间无交互作用;根茎生物量年际间变化没有达到显著性差异,同样CO2处理和年份无交互作用。在SP群落中,植物的根茎生物量和根生物量年际间有显著变化,但随试验时间无长期变化趋势,根茎生物量中CO2处理和年份的交互作用显著,而总地下生物量没有显著的年际间变化(图 3、表 1)。
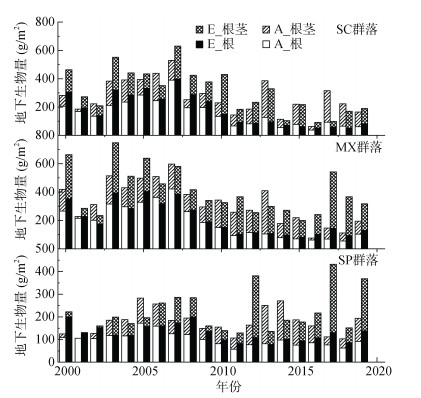
|
图 3 2000—2019年SC、MX、SP三个群落根茎、根生物量变化和总地下生物量的变化 Fig. 3 Changes of rhizome, root biomass and total underground biomass of SC, MX and SP communities from 2000 to 2019 |
|
|
表 1 重复测量方差分析CO2升高对SC、MX、SP群落根、根茎和总地下生物量的影响 Table 1 Repeated measurement variance analyses of effects of elevated CO2 on root, rhizome and total underground biomass of SC, MX and SP communities |
降水量对3个群落植物的根、根茎和总地下生物量无直接影响(P > 0.05)。在SC群落中,对照处理下的根生物量和高CO2浓度处理下的根生物量和总地下生物量与平均海平面显著负相关,相关系数r分别为–0.57(P < 0.01)、–0.58(P < 0.01)和–0.55(P < 0.05)。在MX群落中,对照处理下的根生物量、总地下生物量和高CO2浓度处理下的根生物量与平均海平面显著负相关,r分别为–0.62(P < 0.01)、–0.56(P < 0.05)和–0.55(P < 0.05)。而在SP群落中,除了高CO2浓度处理下根茎生物量与海平面呈显著正相关(r=0.57,P < 0.01),对照和高CO2浓度处理下的根生物量均与海平面显著负相关(P < 0.05)。温度的增加会降低两种处理下根生物量,但并未达到显著水平。盐度同样会对生物量产生影响,在盐度较低的年份中植物的地下生物量相对于盐度较高的年份更高一点。
2.4 盐度对CO2施肥作用的影响盐度的变化会影响湿地SC和MX群落中根茎、根和总地下生物量对CO2浓度升高的响应。在盐度较低的年份中,CO2浓度升高对根茎、根和总地下生物量的影响较高,在盐度较高的年份中,CO2升高对根茎、根和总地下生物量的影响较低,盐度与CO2施肥作用呈负相关。而在SP群落中,盐度的升高对CO2施肥作用没有明显影响,CO2施肥作用较为稳定(图 4)。
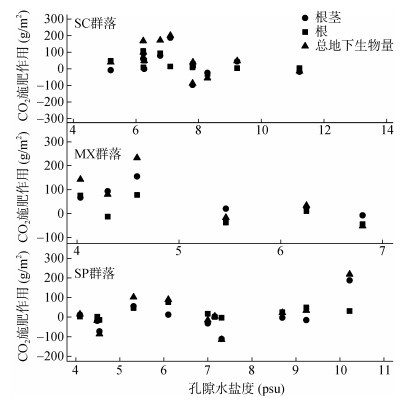
|
(CO2施肥作用=高CO2浓度处理下植物地下生物量–对照处理下植物地下生物量) 图 4 盐度变化下CO2对植物地下生物量促进作用的变化 Fig. 4 Effects of CO2 on plant underground biomass under different salinity |
在本研究中,SC、MX和SP群落中,CO2对根茎、根和总地下生物量的施肥作用持续存在(表 1)。CO2的施肥作用在不同的生态系统中是普遍存在的,无论是在草地[14]、森林[15]还是湿地[16]中都能观察到CO2浓度升高增加了植物的生物量。但是有研究发现,CO2的施肥效应会随时间逐渐降低甚至消失[17]。在本研究中,CO2的施肥作用在整个试验进程中都持续存在,这与Erickson等[8]的研究结果相同。但与Erickson等[8]以C4植物为主的SP群落对CO2响应的研究结果明显不同的是,本研究中CO2浓度升高显著增加了SP群落的地下生物量。这可能是因为在2000年以后,SP群落中C3植物的密度在逐年增加,从0株/m2增加到大约500株/m2,而C4植物的密度在逐渐降低,从4 000 ~ 5 000株/m2降至1 000株/m2左右,CO2浓度增加使得C3植物的地下生物量增加,从而整体的SP群落中植物的地下生物量增加。
3.2 海平面上升对植物根茎和根的影响除了CO2浓度升高,海平面上升也会对群落中植物的分布和地下生物量产生影响[8]。C3植物的通气组织相对于C4植物更为发达,能够将氧气从地上输入到根部分,因此C3植物更耐淹水,主要分布在低海拔处,而C4植物对淹水更为敏感,主要分布在高海拔处[12]。海平面上升推动C3植物向更高海拔处转移,使得MX群落中C3植物增加,MX和SP群落中C4植物降低[7]。但是,淹水也会对C3植物的生长有负面影响[5]。在本研究中,海平面上升主要是降低了SC、MX和SP群落中植物的根生物量,而且除了SP群落中高CO2浓度处理下植物的根茎生物量,海平面上升对根茎生物量无明显的影响。C3和C4植物的根茎大部分分布在土壤的上部15 cm处,而根的深度能够达到65 cm处,在SP群落中,C3植物的根茎分布会更浅,根分布会更深一些[4]。海平面的变化使湿地淹水的频率和时间也发生变化[8],在海平面上升的情况下,SC、MX和SP三个群落的淹水频率增加,淹水时间延长,因为根是分布在更深的厌氧环境土壤中,对于水位变化更为敏感[4],因此海平面上升主要降低了3个群落中植物的根生物量,而对根茎生物量无明显的影响。
3.3 CO2浓度升高能在一定程度上缓解盐度增加对C3植物的负面影响CO2浓度升高通过增加光合作用、降低光呼吸、减少蒸腾作用散失的水分缓解胁迫的负影响[5,18-19]。在本研究中,SC和MX群落中植物地下生物量对CO2浓度升高的响应随孔隙水盐度的增加而降低,SP群落中植物地下生物量对CO2浓度升高的响应在孔隙水盐度增加的情况下无明显变化。在SC和MX群落中,C3植物分布较多,盐度较低年份中C3植物地下生物量对CO2浓度升高的响应显著高于盐度较高年份[8]。而在SP群落中,尽管海平面上升使群落中C3植物增加,C4植物降低,但整体植物的分布还是以C4植物为主,而C4植物地下生物量对CO2浓度升高的响应不随盐度的变化而变化[8],因此SP群落中,在盐度升高的情况下,CO2浓度升高的影响无明显变化。
4 结论在以C3植物为主的群落和C3、C4植物混合群落中,海平面上升的情况下,对照和高CO2处理下植物的总地下生物量总体呈下降的趋势,这主要是由于海平面上升使得群落被淹没时间和频率增加,而且高盐度在一定程度上会降低植物的地下生物量,但是CO2浓度升高能部分缓解高盐分对植物总地下生物量的负面效应,虽然没有改变植物总地下生物量的下降趋势。在海平面上升加速的现实情况下,植物总地下生物量的下降可能会减少湿地土壤物质输入,从而限制湿地海拔持续增加的稳定性,而升高的CO2浓度虽然增加了植物的总地下生物量,但并不能够完全抵消海平面上升对植物生物量的负面影响。
致谢:感谢美国Smithsonian环境研究中心为本研究提供植物生物量数据支持。
| [1] |
崔保山, 杨志峰. 湿地学[M].
北京师范大学出版社, 北京, 2006
(  0) 0) |
| [2] |
陈增奇, 金均, 陈奕. 中国滨海湿地现状及其保护意义[J]. 环境污染与防治, 2006, 28(12): 930-933 DOI:10.3969/j.issn.1001-3865.2006.12.015 (  0) 0) |
| [3] |
徐东霞, 章光新. 人类活动对中国滨海湿地的影响及其保护对策[J]. 湿地科学, 2007, 5(3): 282-288 DOI:10.3969/j.issn.1672-5948.2007.03.013 (  0) 0) |
| [4] |
Saunders C J, Megonigal J P, Reynolds J F. Comparison of belowground biomass in C3- and C4-dominated mixed communities in a Chesapeake Bay brackish marsh[J]. Plant and Soil, 2006, 280(1/2): 305-322 (  0) 0) |
| [5] |
Cherry J A, McKee K L, Grace J B. Elevated CO2 enhances biological contributions to elevation change in coastal wetlands by offsetting stressors associated with sea-level rise[J]. Journal of Ecology, 2009, 97(1): 67-77 DOI:10.1111/j.1365-2745.2008.01449.x (  0) 0) |
| [6] |
Li J H, Erickson J, Peresta G, et al. Evapotranspiration and water use efficiency in a Chesapeake Bay wetland under carbon dioxide enrichment[J]. Global Change Biology, 2010, 16(1): 234-245 DOI:10.1111/j.1365-2486.2009.01941.x (  0) 0) |
| [7] |
Drake B G. Rising Sea level, temperature, and precipitation impact plant and ecosystem responses to elevated CO2 on a Chesapeake Bay wetland: Review of a 28-year study[J]. Global Change Biology, 2014, 20(11): 3329-3343 DOI:10.1111/gcb.12631 (  0) 0) |
| [8] |
Erickson J E, Megonigal J P, Peresta G, et al. Salinity and sea level mediate elevated CO2effects on C3? C4plant interactions and tissue nitrogen in a Chesapeake Bay tidal wetland[J]. Global Change Biology, 2007, 13(1): 202-215 DOI:10.1111/j.1365-2486.2006.01285.x (  0) 0) |
| [9] |
李慧卿, 马文元, 李慧勇. 沙冬青抗逆性及开发利用前景分析研究[J]. 世界林业研究, 2000, 13(5): 67-71 (  0) 0) |
| [10] |
Kirwan M L, Megonigal J P. Tidal wetland stability in the face of human impacts and sea-level rise[J]. Nature, 2013, 504(7478): 53-60 DOI:10.1038/nature12856 (  0) 0) |
| [11] |
Rasse D P, Peresta G, Drake B G. Seventeen years of elevated CO2 exposure in a Chesapeake Bay Wetland: sustained but contrasting responses of plant growth and CO2 uptake[J]. Global Change Biology, 2005, 11(3): 369-377 DOI:10.1111/j.1365-2486.2005.00913.x (  0) 0) |
| [12] |
Arp W J, Drake B G, Pockman W T, et al. Interactions between C3 and C4 salt marsh plant species during four years of exposure to elevated atmospheric CO2[J]. Vegetatio, 1993, 104/105(1): 133-143 DOI:10.1007/BF00048149 (  0) 0) |
| [13] |
Curtis P S, Drake B G, Leadley P W, et al. Growth and senescence in plant communities exposed to elevated CO2 concentrations on an estuarine marsh[J]. Oecologia, 1989, 78(1): 20-26 DOI:10.1007/BF00377193 (  0) 0) |
| [14] |
Zavaleta E S, Shaw M R, Chiariello N R, et al. Grassland responses to three years of elevated temperature, co2, precipitation, and N deposition[J]. Ecological Monographs, 2003, 73(4): 585-604 DOI:10.1890/02-4053 (  0) 0) |
| [15] |
Zak D R, Pregitzer K S, Kubiske M E, et al. Forest productivity under elevated CO2 and O3: Positive feedbacks to soil N cycling sustain decade-long net primary productivity enhancement by CO2[J]. Ecology Letters, 2011, 14(12): 1220-1226 DOI:10.1111/j.1461-0248.2011.01692.x (  0) 0) |
| [16] |
Erickson J E, Peresta G, Montovan K J, et al. Direct and indirect effects of elevated atmospheric CO2 on net ecosystem production in a Chesapeake Bay tidal wetland[J]. Global Change Biology, 2013, 19(11): 3368-3378 (  0) 0) |
| [17] |
Körner C, Asshoff R, Bignucolo O, et al. Carbon flux and growth in mature deciduous forest trees exposed to elevated CO2[J]. Science, 2005, 309(5739): 1360-1362 DOI:10.1126/science.1113977 (  0) 0) |
| [18] |
Hymus G J, Baker N R, Long S P. Growth in elevated CO2 can both increase and decrease photochemistry and photoinhibition of photosynthesis in a predictable manner. Dactylis glomerata grown in two levels of nitrogen nutrition[J]. Plant Physiology, 2001, 127(3): 1204-1211 DOI:10.1104/pp.010248 (  0) 0) |
| [19] |
Robredo A, Pérez-López U, de la Maza H S, et al. Elevated CO2 alleviates the impact of drought on barley improving water status by lowering stomatal conductance and delaying its effects on photosynthesis[J]. Environmental and Experimental Botany, 2007, 59(3): 252-263 DOI:10.1016/j.envexpbot.2006.01.001 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China
 2023, Vol. 55
2023, Vol. 55


