2. 甘肃省农业科学院土壤肥料与节水农业研究所, 兰州 730070
盐碱土是由多种自然环境因素和人为活动因素综合作用形成的不同程度盐碱化土壤的统称[1]。盐碱土盐分含量高,营养物质含量低,无法保证植物正常生理需求,对植物有毒害作用,影响其生长发育[2]。盐碱土改良剂可以降低土壤含盐量,增加土壤团聚体数量,增大土壤孔隙度,改善土壤结构[3];可以降低土壤pH及碱化度,提升土壤有机质、营养元素含量及土壤碳库管理指数[4],加快土壤微生物代谢速率,增加根系分泌物,促进根际微生物的生长和繁殖。研究发现,添加盐碱土改良剂可改变土壤细菌群落结构,显著提高细菌Chao1和Shannon多样性指数,增加盐渍土细菌OTUs和盐渍土中可观测物种数[5]。因此,研究不同盐碱土改良剂对细菌群落多样性的影响,有助于盐渍化土壤改良与修复的综合评价。
有关兰州新区土壤盐渍化改良研究已有文献报道。卢建男等[6]和彭晓莉等[7]研究表明,绿化植被和改良剂配合使用能够有效改善土壤肥力,降低土壤盐分和pH;唐让云等[8]在秦王川通过淋洗与植物作用耦合对盐渍化土壤进行改良,发现土壤全盐和盐分离子含量均有效降低;刘铁军[9]研究表明,在兰州新区盐碱土中施入不同土壤改良剂后均能改善土壤理化性质,提升草坪质量。目前有关兰州新区城市绿化带盐渍化土壤改良的研究少见报道。而近年来,生物质炭[10]、康地宝[11]、磷石膏[12]、禾康[13]等盐碱土改良剂在生产中被大量使用,并取得较好效果。因盐渍化土壤类型多样且受气候、地下水位的影响,不同改良剂在不同类型盐渍化土壤上的应用效果不同。为此,本研究以兰州新区城市绿化带盐渍化土壤为研究对象,探讨6种不同类型的改良剂对草坪根际土壤细菌多样性与群落结构的影响,以为兰州新区城市绿化带土壤改良提供科学依据。
1 材料与方法 1.1 供试材料供试土壤为兰州新区秦王川城市绿化带土壤,土壤类型为灰钙土,其电导率、pH、全盐、有机质、碱解氮、有效磷、速效钾含量分别为2.11 mS/cm、8.01、3.45 g/kg、9.18 g/kg、96.37 mg/kg、2.55 mg/kg和162.81 mg/kg。
供试6种土壤改良剂为:禾康(T1)、乳酸菌(T2)、磷石膏(T3)、炭基肥(T4)、免申耕(T5)、磷酸脲(T6)。其中,T1是一种专门用于盐碱地改良的液体化肥,可快速降低土壤含盐量和酸碱度,改善土壤理化性状,大幅提高作物产量和品质。T5在水分子的作用下释放阴离子或阳离子和土壤中的H+或OH–结合,起调节土壤酸碱性的作用,能增加土壤盐基交换量,增强土壤缓冲性能和保肥性能,提高土壤有效养分含量,提升作物吸收利用养分的能力。T6为尿素磷酸盐,CO(NH2)2·H3PO4。T1、T5、T6可从市场上购买。T4为复合菌剂,含磷酸二铵、尿素、硫酸钾和木炭粉,由甘肃金九月肥业有限公司提供;T3是化工磷肥的废渣,由甘肃省农业科学院土壤肥料与节水农业研究所提供;T2由安徽格拉特生物化学有限公司提供。
供试草坪草种为正义高羊茅(Festuca arundinacea Justice’)、派尼紫羊茅(Festuca rubra Penny)、绿宝石多年生黑麦草(Lolium perenne Emerald),由甘肃农业大学草业学院提供,播种量分别为40.0、10.0、20.0 kg/hm2,混播比例为4∶1∶2。
1.2 试验设计采用单因素完全随机设计进行盆栽试验,设7个处理,每个处理重复4次,共计28盆。其中CK为不施肥,T1为施用禾康75 L/hm2,T2为施用乳酸菌75 L/hm2,T3为施用磷石膏3 600 kg/hm2,T4为施用炭基肥1 800 kg/hm2,T5为施用免申耕75 L/hm2,T6为施用磷酸脲900 kg/hm2。
试验于2021年在甘肃省农科院温室进行。试验用盆上下部直径、盆高分别为33.3、23.0、44.5 cm,每盆装土30.0 kg。按试验设计,先将土壤与肥料混合均匀装入盆中,加适量水稳定1周后,即2021年5月18日每盆播种饱满、均匀、无病虫害的3种草种,播深1 ~ 2 cm,播后定期浇水。于2021年9月18日进行采样。采样时,抖掉根系外围土,用毛刷取紧贴在根系上的土壤,每个处理的4次重复混合后作为1个根际土样品,并将其分为3份,一份在–80 ℃冰箱中保存用于土壤微生物总DNA提取,一份在4 ℃下保存用于土壤微生物生物量及酶活性测定,一份自然风干过2 mm筛后用于土壤化学性质测定。
1.3 测定指标及方法土壤化学指标测定参考鲍士旦[14]的方法进行,其中碱解氮(AN)、有效磷(AP)、速效钾(AK)、有机质(SOM)含量分别采用碱解扩散法、0.5 mol/L NaHCO3浸提–钼锑抗比色法、NH4OAc浸提–火焰光度法、重铬酸钾容量法(外加热法)测定,pH为土水比1∶5(m/V)悬液用pHS-4智能酸度计测定,全盐(TDS)采用离子总量法计算。
土壤酶活性测定参考关松荫[15]的方法进行,其中土壤脲酶(UA)采用靛酚蓝比色法测定,碱性磷酸酶(APA)采用磷酸苯二钠比色法测定,过氧化氢酶(CA)采用高锰酸钾滴定法测定,脱氢酶(DHA)采用氯化三苯基四氮唑(TTC)比色法测定。
土壤微生物生物量碳(MBC)[16]、氮(MBN)[16]、磷(MBP)[17]含量采用氯仿熏蒸法测定,其中MBC =(熏蒸土壤有机碳质量分数–未熏蒸土壤有机碳质量分数)/0.38;MBN =(熏蒸土壤全氮质量分数–未熏蒸土壤全氮质量分数)/0.45;MBP =(熏蒸土壤全磷质量分数–未熏蒸土壤全磷质量分数)/0.4。
土壤基因组DNA的提取和PCR扩增:采用CTAB法对样本基因组DNA进行提取,用琼脂糖凝胶电泳检测DNA的纯度和浓度;取适量DNA于离心管中,用无菌水稀释样品至1 ng/μL,并以稀释后的基因组DNA为模板,使用带Barcode的特异引物,New England Biolabs公司的Phusion® High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶进行PCR,以确保扩增效率和准确性。用引物515F(5′-GTG CCAGCMGCCGCGGTAA-3′)与806R(5′-GGACTAC HVGGGTWTCTAAT-3′)对其V4区基因片段进行扩增,每个样品重复3次。反应产物用2%琼脂糖凝胶电泳检测。使用NEBNext® UltraTM IIDNA Library Prep Kit建库试剂盒进行文库构建后用NovaSeq6000进行上机测序(诺禾致源生物信息科技有限公司,北京)。下机数据经FLASH(V1.2.11,http://ccb.jhu.edu/software/FLASH/)[18]软件对样本的reads进行拼接,得到Raw Tags;用fastp软件对Raw Tags进行质控,得到Clean Tags;用Usearch软件将Clean Tags与数据库进行比对以检测嵌合体并进行去除[19],得到有效数据(Effective Tags),然后用QIIME2软件中的DADA2模块进行降噪并过滤去除丰度小于5的序列,得到ASVs(Amplicon Sequence Variants,即扩增子序列变异)[20]和特征表。
1.4 数据分析用Excel 2016进行数据统计,用SPSS 20.0软件对数据进行单因素方差分析(One-way ANOVA),用Duncan法对数据进行多重比较。采用QIIME2软件计算observed_otus、Shannon、Simpson、Chao1、goods coverage、dominance和Pielou’e指数,并绘制物种累积箱形图[21];采用CANOCO 4.0软件对丰度前10位的细菌门优势群落与土壤环境指标间的相互关系进行冗余分析(RDA),并采用Monte Carlo置换检验计算因子的重要性,其中置换次数设为999次,显著性水平为P < 0.05[22]。
2 结果与分析 2.1 根际土壤化学及生物学性质由表 1可知,不同盐碱土改良剂对草坪根际土壤化学及生物学性质影响显著(P < 0.05)。其中T2、T5处理的全盐含量显著小于CK处理,其余处理与CK处理差异不显著;T2、T6处理的速效钾含量显著小于CK处理,其余处理均显著大于CK处理;T1、T3处理的碱解氮含量显著小于CK处理,其余处理均显著大于CK处理;各改良剂处理的pH呈降低趋势,而脱氢酶活性呈增大趋势;T4、T6处理的过氧化氢酶活性显著小于CK处理,T2、T5处理显著大于CK处理,其余处理与CK处理差异不显著;T2、T3处理的脲酶活性显著大于CK处理,T6处理与CK处理差异不显著,其余处理均显著小于CK处理;各处理的有机质、速效磷、微生物生物量碳氮磷含量及碱性磷酸酶活性均显著高于CK处理。
|
|
表 1 盐碱土改良剂对草坪根际土壤化学及生物学性质的影响 Table 1 Effects of saline alkali soil amendments on chemical and biological properties of turf rhizosphere |
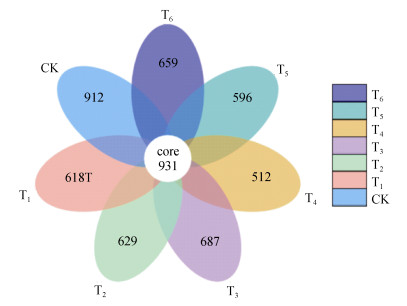
由表 2可知,经高通量测序并过滤去除低质量序列后,CK、T1、T2、T3、T4、T5、T6处理的有效序列在53 856 ~ 61 240范围内变动;各改良剂处理的OTUs数目、Chao1指数、Shannon-wiener指数均显著小于CK处理,Pielou’e和Simpson指数差异不显著;各处理文库的覆盖度均在99% 以上,结合样品箱形图(图 1)可知,测序数据样本量充分、物种丰富度较高,能够准确反映土壤细菌群落真实信息。由图 2可知,所有样品共有OTUs数目为931个,其中CK、T1、T2、T3、T4、T5、T6处理所特有的OTUs数目分别为912、618、629、687、512、596和659个。
|
|
表 2 样品序列数统计、丰富度与多样性指数 Table 2 Sample sequence numbers statistics, richness and diversity indices |

|
图 1 α-多样性的物种积累箱形图 Fig. 1 Species accumulation boxplot of α-diversity |
|
图 2 不同处理中OTUs分布花瓣图 Fig. 2 Petal map of OTUs distribution in different treatments |
由图 3可知,各处理细菌群落相对丰度从大到小位于前10位的细菌门分别为:变形菌门(Proteobacteria,26.9% ~ 38.2%)、拟杆菌门(Bacteroidetes,14.5% ~ 17.4%)、放线菌门(Actinobacteria,10.0% ~ 16.0%)、芽单胞菌门(Gemmatimonadetes,5.2% ~ 9.6%)、酸杆菌门(Acidobacteria,3.9% ~ 9.0%)、厚壁菌门(Firmicutes,3.1% ~ 6.8%)、绿弯菌门(Chloroflexi,3.5% ~ 5.2%)、疣微菌门(Verrucomicrobia,1.6% ~ 4.2%)、栖热菌门(Deinococcota,0.9% ~ 4.1%)、髌骨细菌门(Patescibacteria,1.9% ~ 3.0%),共占细菌总数的89.7% ~ 91.7%,且变形菌门、拟杆菌门、放线菌门、芽单胞菌门和酸杆菌门占细菌总数的70.5% ~ 76.1%,说明这5个门为细菌优势菌群。其中,变形菌门在T4、T6处理中的相对丰度显著高于CK处理(P < 0.05),其他处理与CK处理无明显差异;放线菌门在T2处理中的相对丰度显著高于CK处理,在T4处理中的相对丰度显著低于CK处理(P < 0.05),其他处理与CK处理差异不显著;芽单胞菌门在T1处理中的相对丰度显著大于CK处理,在T4处理中的相对丰度显著小于CK(P < 0.05),其他处理与CK处理差异不显著;酸杆菌门在T1处理中的相对丰度显著高于CK处理(P < 0.05),在T5处理中的相对丰度与CK处理差异不显著,其余处理均显著低于CK处理(P < 0.05)。

|
图 3 门分类水平下的细菌群落相对丰度 Fig. 3 Relative abundance of bacterial community at phylum level |
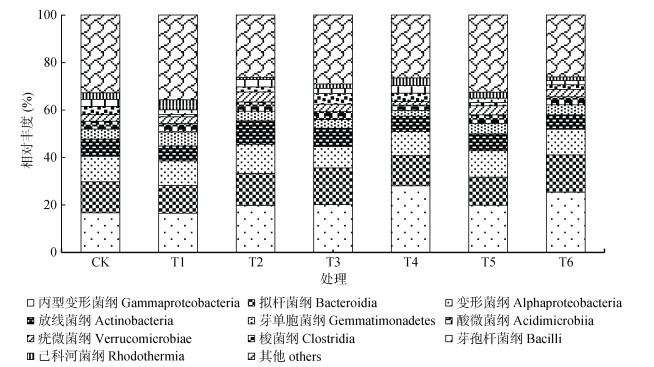
在纲分类水平上(图 4),各处理细菌群落相对丰度从大到小位于前10位的细菌纲分别为:丙型变形菌纲(Gammaproteobacteria)、拟杆菌纲(Bacteroidia)、变形菌纲(Alphaproteobacteria)、放线菌纲(Actinobacteria)、芽单胞菌纲(Gemmatimonadetes)、疣微菌纲(Verrucomicrobiae)、酸微菌纲(Acidimicrobiia)、梭菌纲(Clostridia)、芽孢杆菌纲(Bacilli)、己科河菌纲(Rhodothermia),均属于优势菌门细菌,共占细菌总数的64.8% ~ 73.9%,且丙型变形菌纲、拟杆菌纲、变形菌纲和放线菌纲占细菌总数的44.8% ~ 58.0%,说明这4个纲为细菌优势菌纲。其中,丙型变形菌纲在T4、T6处理中的相对丰度显著高于CK处理(P < 0.05),其他处理与CK处理差异不显著;放线菌纲在T2处理中的相对丰度显著高于CK处理(P < 0.05),其他处理与CK处理差异不显著;拟杆菌纲和变形菌纲各处理间相对丰度差异不显著。
|
图 4 纲分类水平下的细菌群落相对丰度 Fig. 4 Relative abundance of bacterial community at class level |
从细菌门水平对细菌群落结构与土壤环境因子进行冗余分析(图 5),结果表明,RDA1、RDA2分别解释总变异的42.88% 和12.51%。Monte Carlo置换检验的结果显示(表 4),速效磷、碱解氮是主导细菌群落变化的主要因子。

|
(Proteobacteria:变形菌门;Bacteroidota:拟杆菌门;Actinobacteriota:放线菌门;Gemmatimonadota:芽单胞菌门;Acidobacteriota:酸杆菌门;Firmicutes:厚壁菌门;Chloroflexi:绿弯菌门;Verrucomicrobiota:疣微菌门) 图 5 细菌群落与土壤环境因子冗余分析 Fig. 5 Redundancy analysis for bacterial community and soil environmental factors |
|
|
表 4 Monte Carlo置换检验结果 Table 4 Results of Monte Carlo permutation test |
土壤全盐量是表征土壤盐化程度的重要指标。本试验表明,施用乳酸菌改良剂(T2)土壤全盐含量最低,表明乳酸菌有较好的降盐作用。炭基肥(T4)处理速效钾和碱解效氮含量均高于其他处理,这与炭基肥本身含有一定数量的氮磷钾养分有关。土壤有机质是表征土壤肥力水平的重要指标,添加6种改良剂后土壤有机质、有效磷含量均升高,其中免申耕(T5)处理有机质含量提高最显著,磷酸脲(T6)处理有效磷含量增加最明显,这与磷酸脲含磷P量(P≥45%)高有关。
土壤酶活性可以反映不同土壤生物化学反应的相对强度和土壤养分状况,敏感地指示土壤质量的变化,可作为土壤养分循环、土壤质量及健康的重要指标[23]。本研究中,添加6种改良剂后土壤碱性磷酸酶活性均显著增加,脱氢酶活性有所升高,乳酸菌(T2)、磷石膏(T3)处理脲酶活性最高,乳酸菌(T2)、免申耕(T5)处理过氧化氢酶活性最高,这与Wang等[24]对土壤改良剂的研究结论一致,说明乳酸菌处理能够较好地促进微生物的新陈代谢,提高土壤酶活性。土壤微生物生物量碳、氮、磷能够敏感且及时地反映或预示土壤的变化。本研究表明,各处理土壤微生物生物量碳氮磷含量均较CK处理提高,说明添加6种改良剂后其对应的碳、氮、磷元素储量均增大,为微生物提供了碳源、氮源和磷源,促进了好气性细菌的生长和土壤微生物的繁殖与发育。
3.2 盐碱土改良剂对草坪根际土壤细菌群落组成的影响盐度和碱度是影响盐碱土微生物群落结构的主要因素。本研究表明,变形菌门、拟杆菌门、放线菌门、芽单胞菌门和酸杆菌门为优势菌门,这些均为嗜盐菌[25]。变形菌门中的变形菌纲是盐碱土壤的主要类群[26]。拟杆菌门具有溶磷作用,与磷素的转化利用密切相关,对高盐环境具有较强的抗性[27]。芽单胞菌门是盐碱胁迫下土壤生物地球化学转化的重要参与者[28]。放线菌门能显著抑制某些植物病原真菌的活性,并能促进种子萌发和植物根系生长[29]。不同盐碱土改良剂使土壤pH下降,有利于酸杆菌生存。
土壤微生物参与完成土壤中各种复杂的生化反应过程。本研究表明,施入改良剂后,土壤细菌群落Shannon-wiener和Chao1指数均低于CK处理,说明改良剂的施入会影响土壤细菌的丰富度和多样性,这可能与供试改良剂降低了土壤盐分和pH,抑制了部分嗜盐细菌的生长有关,而细菌对盐渍环境有很快的适应能力,这与Wang等[30]认为细菌对生存环境有较强适应性的研究结论相同。本研究中土壤优势菌门与化学因子间有一定的相关性,这与前人研究结果一致[31]。其中碱解氮、有效磷含量对土壤细菌群落结构影响较大,表明不同盐碱土改良剂导致的土壤化学性质的不同,改变了微生物物种组成及结构。
4 结论6种供试盐碱土改良剂对草坪根际土壤化学、生物学性质及细菌群落多样性均有显著影响。与对照相比,添加改良剂后根际土壤pH降低,有机质、有效磷、微生物生物量碳氮磷含量及碱性磷酸酶、脱氢酶活性增强;变形菌门、拟杆菌门、放线菌门、芽单胞菌门和酸杆菌门是优势细菌门,碱解氮和有效磷是主导土壤细菌群落结构产生变化的主要因子。
| [1] |
王遵亲, 祝寿泉, 俞仁培, 等. 中国盐渍土[M].
科学出版社, 北京, 1993
(  0) 0) |
| [2] |
刘奕媺, 于洋, 方军. 盐碱胁迫及植物耐盐碱分子机制研究[J]. 土壤与作物, 2018, 7(2): 201-211 (  0) 0) |
| [3] |
柳永强, 马廷蕊, 王方, 等. 马铃薯对盐碱土壤的反应和适应性研究[J]. 土壤通报, 2011, 42(6): 1388-1392 (  0) 0) |
| [4] |
冀拯宇, 周吉祥, 张贺, 等. 不同土壤改良剂对盐碱土壤化学性质和有机碳库的影响[J]. 农业环境科学学报, 2019, 38(8): 1759-1767 (  0) 0) |
| [5] |
迪力热巴·阿不都肉苏力, 穆耶赛尔·奥斯曼, 祖力胡玛尔·肉孜, 等. 盐碱土壤微生物多样性与生物改良研究进展[J]. 生物技术通报, 2021, 37(10): 225-233 (  0) 0) |
| [6] |
卢建男, 张琼, 刘铁军, 等. 不同改良剂对盐碱地土壤及草地早熟禾生长的影响[J]. 草业科学, 2017, 34(6): 1141-1148 (  0) 0) |
| [7] |
彭晓莉, 吴旺泽, 沈娟, 等. 城市绿化带植被覆盖度对盐碱地土壤盐分的调节[J]. 植物研究, 2022, 42(1): 62-70 (  0) 0) |
| [8] |
唐让云, 曹靖, 董放, 等. 淋洗与植物作用耦合对盐渍化土壤的改良效应[J]. 生态学报, 2015, 35(17): 5686-5694 (  0) 0) |
| [9] |
刘铁军. 兰州新区盐碱地改良绿化技术研究[D]. 兰州: 兰州大学, 2016.
(  0) 0) |
| [10] |
王世斌, 高佩玲, 赵亚东, 等. 生物炭、有机肥连续施用对盐碱土壤改良效果研究[J]. 干旱地区农业研究, 2021, 39(3): 154-161 (  0) 0) |
| [11] |
南江宽, 陈效民, 王晓洋, 等. 不同改良剂对滨海盐渍土盐碱指标及作物产量的影响研究[J]. 土壤, 2013, 45(6): 1108-1112 (  0) 0) |
| [12] |
郭全恩, 车宗贤, 曹诗瑜, 等. 地下水位上升条件下磷石膏改良剂对土壤盐分迁移的影响[J]. 水土保持学报, 2014, 28(6): 171-176 (  0) 0) |
| [13] |
刘易, 冯耀祖, 黄建, 等. 微咸水灌溉条件下施用不同改良剂对盐渍化土壤盐分离子分布的影响[J]. 干旱地区农业研究, 2015, 33(1): 146-152 (  0) 0) |
| [14] |
鲍士旦. 土壤农化分析(3版)[M].
中国农业出版社, 北京, 2000
(  0) 0) |
| [15] |
关松荫. 土壤酶及其研究法[M].
农业出版社, 北京, 1986
(  0) 0) |
| [16] |
Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry, 1987, 19(6): 703-707 (  0) 0) |
| [17] |
吴金水, 肖和艾, 陈桂秋, 等. 旱地土壤微生物磷测定方法研究[J]. 土壤学报, 2003, 40(1): 70-78 (  0) 0) |
| [18] |
Magoč T, Salzberg S L. FLASH: Fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011, 27(21): 2957-2963 (  0) 0) |
| [19] |
Haas B J, Gevers D, Earl A M, et al. Chimeric 16S rRNA sequence formation and detection in Sanger and 454-pyrosequenced PCR amplicons[J]. Genome Research, 2011, 21(3): 494-504 (  0) 0) |
| [20] |
Bokulich N A, Kaehler B D, Rideout J R, et al. Optimizing taxonomic classification of marker-gene amplicon sequences with QIIME 2's q2-feature-classifier plugin[J]. Microbiome, 2018, 6(1): 1-17 (  0) 0) |
| [21] |
Bolyen E, Rideout J R, Dillon M R, et al. Reproducible, interactive, scalable and extensible microbiome data science using QIIME 2[J]. Nature Biotechnology, 2019, 37(8): 852-857 (  0) 0) |
| [22] |
Sun R B, Dsouza M, Gilbert J A, et al. Fungal community composition in soils subjected to long-term chemical fertilization is most influenced by the type of organic matter[J]. Environmental Microbiology, 2016, 18(12): 5137-5150 (  0) 0) |
| [23] |
刘志平, 周怀平, 解文艳, 等. 长期氮磷配施对褐土细菌多样性及土壤酶活性的影响[J]. 干旱地区农业研究, 2022, 40(2): 163-171 (  0) 0) |
| [24] |
Wang X B, Zhou W, Liang G Q, et al. Characteristics of maize biochar with different pyrolysis temperatures and its effects on organic carbon, nitrogen and enzymatic activities after addition to fluvo-aquic soil[J]. Science of the Total Environment, 2015, 538: 137-144 (  0) 0) |
| [25] |
Nan L L, Guo Q E, Cao S Y, et al. Diversity of bacterium communities in saline-alkali soil in arid regions of Northwest China[J]. BMC Microbiology, 2022, 22(1): 11 (  0) 0) |
| [26] |
孟春梅, 王开勇, 樊华, 等. 棉粕对盐碱环境下土壤微生物多样性及土壤结构的影响[J]. 土壤, 2020, 52(1): 207-212 (  0) 0) |
| [27] |
李明, 马飞, 张俊华. 种稻年限对盐渍化土壤理化性质和细菌群落多样性的影响[J]. 干旱地区农业研究, 2021, 39(4): 194-202 (  0) 0) |
| [28] |
Fierer N, Leff J W, Adams B J, et al. Cross-biome metagenomic analyses of soil microbial communities and their functional attributes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(52): 21390-21395 (  0) 0) |
| [29] |
Liu Z, Shang H G, Han F, et al. Improvement of nitrogen and phosphorus availability by Pseudoalteromonas sp. during salt-washing in saline-alkali soil[J]. Applied Soil Ecology, 2021, 168: 104117 (  0) 0) |
| [30] |
Wang J J, Yang D M, Zhang Y, et al. Do patterns of bacterial diversity along salinity gradients differ from those observed for macroorganisms?[J]. PLoS One, 2011, 6(11): e27597 (  0) 0) |
| [31] |
刘平静, 肖杰, 孙本华, 等. 长期不同施肥措施下土细菌群落结构变化及其主要影响因素[J]. 植物营养与肥料学报, 2020, 26(2): 307-315 (  0) 0) |
2. Soil Fertilizer and Water-saving Institute, Gansu Academy of Agricultural Sciences, Lanzhou 730070, China
 2023, Vol. 55
2023, Vol. 55


