2. 申能环境科技有限公司, 杭州 311100
酶活性反映了土壤元素(包括碳、氮、磷、硫)循环与物质转化、积累、分解等生物地球化学过程,是评估土壤生态功能的重要指标[1-4]。通常,研究者将土壤酶活性改变归因于微生物贡献[5-7]。然而,有研究发现,灭菌甚至500℃高温后的土壤仍有较强的氧化活性,表明除微生物、植物分泌的酶之外,土壤矿物颗粒也具有类似催化剂的强氧化活性[8]。最新研究也表明,当矿物粒径小到一定程度(如纳米)时则具备了类似天然酶的催化活性,被称为纳米酶[9-11]。纳米酶已被广泛应用于医学、食品、化工、环境等多个领域,其发现改变了以往人们认为无机纳米材料是一种生物惰性物质的传统观念[12-13]。严格意义上,纳米酶并不是传统意义上的酶促反应,其催化活性来源于表面活性位点,因此更类似于矿物表面介导的氧化还原反应[9,13]。例如,铁矿物(如Fe3O4)纳米颗粒已被发现具备固有过氧化物酶(peroxidase,POD)活性,该类酶活性是在过氧化氢(H2O2)存在条件下铁矿物与底物发生的氧化还原反应[10-11],将无色3,3′,5,5′-四甲基联苯胺(TMB)底物氧化为蓝色产物(TMBox),同时释放出水的过程,如方程(1)所示。
| $ {\text{H}}_{\text{2}}{\text{O}}_{\text{2}}{\text{+2H}}^{\text{+}}\text{+2TMB}\stackrel{铁矿物}{\to }{\text{2H}}_{\text{2}}\text{O+2TMBox} $ | (1) |
鉴于土壤纳米级矿物颗粒的丰度和活性[14],研究农业施肥措施下的土壤纳米酶活性对于深入理解活性矿物介导的土壤碳储存、矿物–有机复合体形成和养分周转具有重要意义[15]。通常,土壤纳米颗粒以黏土矿物、金属氧化物、硫化物等形式广泛存在[10,14]。研究表明,土壤中存在大量的纳米级矿物颗粒[16]可被农业施肥措施调控[13-15]。Wen等[15]发现,除富含铁铝氧化物的酸性红壤外,施用有机肥也提高了东北黑土和新疆灰漠土中的非晶型铁氧化物含量。Huang等[16]也发现,有机无机配施明显增加了金坛水稻土中非晶形铁氧化物含量及其结合碳能力。除了结合碳和促进矿物–有机复合体形成,非晶型铁氧化物的提升也显著降低了土壤孔隙数量、路径和孔隙度,进而减少了土壤中氧气的扩散,有利于土壤有机碳储存[17]。
过氧化物酶对土壤有机质合成和分解具有重要意义,其活性对土壤碳循环具有重要影响[6]。为了探究土壤类型和农业措施对土壤类过氧化物酶活性的影响,本研究选择富含铁矿物的红壤和富含钙矿物的灰漠土2种类型土壤,以2个长期(> 30年)定位试验站不同施肥处理土壤为研究对象,分析了土壤类过氧化物酶活性及其对长期施肥处理的响应,探讨了类过氧化物酶活性与土壤养分周转和矿质元素循环的关联;并结合祁阳实验站历史留存样品,研究了土壤过氧化物酶活性随施肥时间的演变特征;同时借助高温和γ辐射灭菌方法消除了植物和微生物代谢产生天然酶的干扰[8],进而提出了土壤类酶活性假说。本研究结果可为农业管理措施对土壤酶活性的影响机制研究提供参考。
1 材料与方法 1.1 供试土样供试土样来自2个国家土壤肥力与肥料效益长期定位监测试验点,新疆农业科学院国家现代农业科技示范园区(以下简称新疆试验站) (43°95'26″N,87°46'45″E)[18-19]和中国农业科学院祁阳红壤试验站(以下简称祁阳试验站) (26°45'12"N,111°52'32"E)[20],两站均始于1990年。新疆试验站土壤类型为灰漠土,容重1.25 g/cm3,黏粒含量283 g/kg,有机碳含量8.8 g/kg,pH 7.95;祁阳试验站土壤类型为红壤,容重1.05 g/cm3,黏粒含量614 g/kg,有机碳含量6.1 g/kg,pH 5.7。2018年选取两个试验站4个不同施肥处理土壤,包括对照处理(CK)、化肥处理(NPK)、化肥配施有机肥处理(NPKM)、有机肥处理(M)作为研究对象。其中新疆和祁阳试验站施用有机肥分别为羊粪和猪粪。新疆试验站氮、磷、钾肥分别为尿素、磷酸二铵、硫酸钾;祁阳试验站分别为尿素、过硫酸钙、氯化钾。两站前茬作物均为玉米,待玉米收获后,于2018年7月底和9月底分别采集祁阳和新疆试验站土壤样品。采样时,采用对角线取样方法,以直径为5 cm不锈钢土钻采集0 ~ 20 cm表层土壤,每个处理小区采集10个样点土样混合。样品采集后挑除枝棒、叶片、石子等异物,充分混匀后用真空冷冻干燥仪进行脱水,冻干后充分研磨过0.25 mm筛后备用。此外,为了探明施肥时间对土壤类过氧化物酶活性的影响,祁阳试验站1995年、2000年和2010年历史留存土壤也用于分析类过氧化物酶活性。两试验站土壤基本理化性质见表 1。
|
|
表 1 试验站基本信息与土壤理化性质 Table 1 Basic information of stations and soil physicochemical properties |
称取2 mg 100目风干土样,将0.2 mol/L、pH为3.0的NaAc-HAc缓冲液和20 µL 3, 3′, 5, 5′-四甲基联苯胺(TMB)溶液(10 mg/mL,溶剂为DMSO,购于北京索莱宝科技有限公司)的1 mL混合液加入2 mL离心管中并混合均匀。TMB溶液在黑暗中处理,现配现用。天然酶选用辣根过氧化物酶(horseradish peroxidase,HRP),该酶由无色的酶蛋白和深棕色的铁卟啉结合而成,糖含量18%,具有比活性高、稳定、分子量(44 000 Da)小、易制备的特性,广泛运用于免疫类(ELISA)试剂盒。为了使HRP表现出最佳催化活性,将反应混合物置于恒温(37 ℃)水浴中,并在黑暗条件下培养1 min,随后加入最终浓度为0.625 mol/L的新鲜H2O2。另准备不添加H2O2空白溶液作为对照进行测定,方法同上。最后,测定652 nm处吸光度,每25 s测定1次,测定时长共计30 min。纳米酶(类过氧化物酶)活性计算公式如下:
| $ {b_{{\rm{nanozyme}}}} = V/(\varepsilon \times l) \times ({\rm{ }}\Delta A/\Delta t) $ | (2) |
式中:bnanozyme指类过氧化物酶催化活性(U);V为反应溶液总体积(μL);ε为底物摩尔吸收系数,本研究TMB在652 nm处摩尔吸收系数为39 000 L/(mol·cm);l为光在比色皿中传播路径长度(cm);ΔA为减去空白值后的吸光度;而ΔA/Δt为652 nm处吸光度初始变化率[21]。
1.3 土壤理化指标测定和灭菌处理土壤pH用酸度计测定(水土质量比2.5∶1),土壤有机碳、全氮采用元素分析仪测定。土壤水分散胶体提取方法参照Yu等[23]方法,过0.45 μm滤膜后,滤液用于测定可溶性有机碳和可溶性矿质元素。土壤可溶性有机碳及硅、镁测定方法参照Schumacher等[22]和Yu等[23]的方法。土壤灭菌采用高温灭菌方法,将土样瓶包扎好通气封口膜,置于高温高压灭菌锅内,于121℃条件下灭菌2 h。随后用无菌水调节含水量至土壤饱和含水量的60%。灭菌后土壤用于土壤类过氧化物酶活性分析
1.4 统计分析试验数据采用Excel 2021、Origin 2021b、SPSS 25.0软件进行统计分析,显著性检验设P < 0.05。
2 结果与分析 2.1 长期施肥下土壤类过氧化物酶活性与HRP相似(图 1A),土壤也具有经典的过氧化物酶催化颜色反应(图 1B)。总体而言,灰漠土和红壤类过氧化物酶活性范围为0.4 ~ 1.0 U/kg。对于灰漠土,CK处理具有最低的类过氧化物酶活性(0.4 U/kg),NPK和NPKM处理具有相似的类过氧化物酶活性(0.53 ~ 0.63 U/kg),比CK处理分别增加38%和64%;M处理具有最高的类过氧化物酶活性(0.76 U/kg),比CK处理增加97%(图 1C)。对于红壤,与CK处理(0.41 U/kg)相比,NPK处理类过氧化物酶活性(0.38 U/kg)没有表现出显著差异,而M处理(0.70 U/kg)和NPKM处理(0.76 U/kg)类过氧化物酶活性显著提高,分别增加69% 和86%(图 1D)。CK、M和NPKM处理红壤类过氧化物酶活性与灰漠土相似,而NPK处理红壤过氧化物酶活性明显偏低。
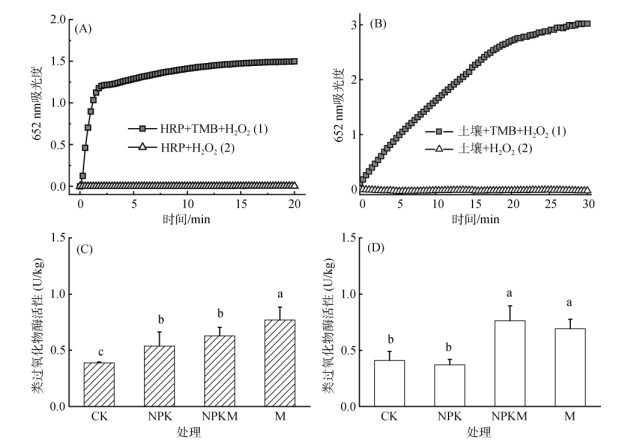
|
(A:天然辣根过氧化物酶;B:施用有机肥红壤;C:灰漠土;D:红壤;柱图上方不同小写字母表示处理间差异显著(P < 0.05)) 图 1 天然过氧化物酶与长期施肥土壤类过氧化物酶活性 Fig. 1 Activities of horseradish peroxidase and soil POD-like under different long-term fertilization |
为了探明施肥时间影响,研究了祁阳试验站历史留存土壤的类过氧化物酶活性(图 2)。结果表明,与施肥5 a (1995年) 时相比,施肥10 a (2000年)和20 a (2010年)时CK和NPK处理类过氧化物酶活性并无显著差异(图 2A),NPKM处理在施肥20年时略有增加;而M处理类过氧化物酶活性则随施肥时间线性增加(R2 = 0.74,P < 0.01)。综上,长期施肥显著改变了土壤类过氧化物酶活性,而以施用有机肥土壤类过氧化物酶活性为最高。
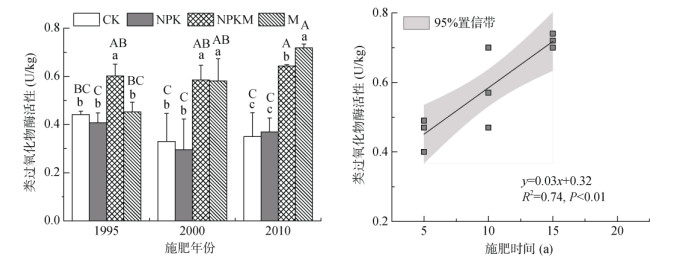
|
(图中不同大写字母和小写字母分别表示不同施肥年限和处理间差异显著(P < 0.05)) 图 2 施肥时间对红壤类过氧化物酶活性的影响 Fig. 2 Effect of fertilization time on red soil POD-like activities under different long-term fertilization |
由图 3A可知,灭菌对灰漠土类过氧化物酶活性没有显著影响。在4个不同施肥处理中,与未灭菌相比,高温灭菌后CK、NPK、NPKM处理类过氧化物酶活性略有提高,但并无显著差异。然而,经高温灭菌后,M处理类过氧化物酶活性却有所下降,但仍没有显著差异。由图 3B可知,灭菌后红壤和灰漠土表现有较大不同。其中,灭菌后NPK处理类过氧化物酶活性显著提高,与未灭菌相比提高1.57倍。而对于其他3个施肥处理,灭菌后土壤类过氧化物酶活性则呈下降趋势,但仅有CK处理差异显著。因此,灭菌对土壤类过氧化物酶活性的影响程度取决于土壤类型和施肥处理。此外,长期施用有机肥红壤类过氧化物酶活性较稳定,而施用化肥和不施肥红壤过氧化物酶活性稳定性较差。
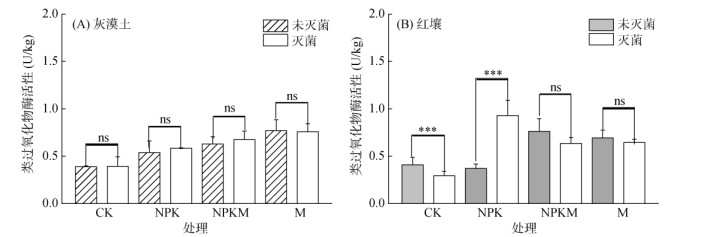
|
(ns表示处理间无显著性差异,***表示处理间差异显著(P < 0.001)) 图 3 灭菌处理对长期施肥土壤类过氧化物酶活性的影响 Fig. 3 Effects of sterilization on soil POD-like activities underdifferent long-term fertilization |
与CK和NPK处理相比,M处理增加了土壤有机碳(SOC)和全氮(TN)含量,但降低了土壤C/N比;同时,M处理对灰漠土pH影响较小,而对红壤pH有较大提升作用(表 1)。除土壤全量指标外,M处理也明显增加了土壤可溶性矿质元素如硅、镁、铁和可溶性有机碳(SOC)含量(表 2)。为探讨土壤类过氧化物酶活性与可溶性碳、硅和镁循环的关联,进一步进行皮尔森相关性分析(图 4)。结果表明,类过氧化物酶活性与可溶性硅和镁含量显著正相关(P < 0.05),且类过氧化物酶活性与可溶性有机碳和铁含量也呈正相关关系。据此推测,土壤类过氧化物酶活性可能与硅和镁循环相关。
|
|
表 2 长期施肥土壤可溶性矿质元素和可溶性有机碳含量(mg/L) Table 2 Concentrations of dissolved mineral elements and dissolved organic carbon under long-term fertilization |
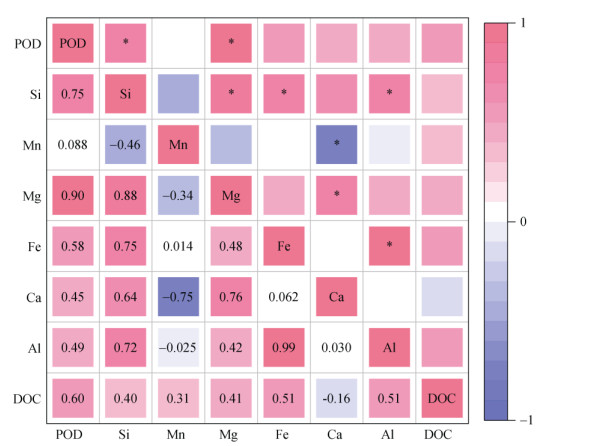
|
(*表示在P < 0.05水平显著相关) 图 4 土壤类过氧化物酶活性与碳氮周转和矿质元素的关联 Fig. 4 Correlation between POD-like activity with turnover of C, N and mineral elements |
土壤中矿物纳米颗粒主要包括纳米矿物(如水铁矿、水铝英石和伊毛缟石)和矿物纳米颗粒(如黏土矿物、硫化物)[14]。然而,纳米矿物颗粒类酶活性研究主要聚焦在纯矿物的实验室阶段[9-13]。目前,土壤类过氧化物酶活性及其对养分循环的影响鲜见报道。本研究发现,与天然酶和纯矿物类似[9,11],富含铁矿物的红壤和富含碳酸钙的灰漠土均具有类过氧化物酶活性,且其活性相近(图 1C、1D),表明土壤本身具有纳米酶(类过氧化物酶)催化活性。Chacon等[24]证实了矿物–有机物互作机制与矿物种类有关,即氧化还原活性水钠锰矿可以分解矿物吸附的蛋白质和β-葡糖苷酶,而非氧化还原活性高岭石则仅吸附蛋白质和β-葡糖苷酶,并不能将其氧化分解。因此,由于土壤组分的复杂性,纯矿物培养的催化结果并不一定能代表实际的土壤。
同时本研究表明,长期施用有机肥显著提高了土壤类过氧化物酶活性(图 1C、1D),且灰漠土类过氧化物酶活性几乎不受施肥影响,而不施肥和施化肥显著影响了红壤类过氧化物酶活性。由于红壤中高含量活性铁矿物(如水铁矿)[15]易受高温脱水老化,矿物活性降低[8],据此推测长期不施肥和施化肥红壤有机质含量低(表 1),导致其铁矿物更易老化;而长期施用有机肥红壤有机质含量高(表 1),阻止了矿物老化[23]。高温灭菌后施用化肥红壤类过氧化物酶活性提高了1.57倍,而有机无机配施和施用有机肥土壤类过氧化物酶活性无显著差异(图 3)。这可能是源于施用化肥土壤活性矿物含量显著低于有机无机配施和施用有机肥土壤[15,23],且施用化肥土壤有机质含量(表 1)和可溶性金属离子含量(表 2)低,在水热(即高温灭菌)变化条件下,矿物种类改变导致其矿物活性变化幅度较大所致。在今后的研究中需进一步测定土壤理化指标验证该推测。
3.2 土壤类过氧化物酶活性对碳氮循环和矿质元素周转的潜在影响本研究发现,类过氧化物酶活性与可溶性硅和镁含量显著正相关(P < 0.05,图 4),说明土壤类过氧化物酶活性可能影响可溶性硅和镁生物地球化学循环。由于样本量较少,因此类过氧化物酶活性与可溶性有机碳和矿质元素(硅、锰、镁、铁、钙、铝)含量虽呈正相关关系,但并未在统计意义上达显著水平(P > 0.05)。在活性氧自由基(ROS)转化过程中,类过氧化物酶起到关键作用[9-13]。因此,本研究中“农业措施有效调控土壤类过氧化物酶”的发现,有望在土壤碳氮循环和矿质元素周转方面发挥重要作用。据统计,土壤中分别有120亿t和70亿t真菌和细菌生物量(以C计)[25],且微生物可产生不同水平超氧化物(O2·−),在酶作用下形成过氧化氢(H2O2)[26]。由于施用有机肥和化肥措施改变了土壤纳米矿物或矿物纳米颗粒丰度,故土壤微生物和矿物协同驱动的ROS也将受农业措施影响。尽管ROS在土壤中存在时间较短[27],但螯合剂介导的芬顿反应在土壤中可持续发生[28]。由于土壤类过氧化物酶活性明显低于天然酶或纯矿物(如水铁矿)[29] (图 1),因此土壤矿物主要起吸附、固持有机碳和养分的作用[22]。但在强降雨或有机物输入时,土壤局域厌氧形成Fe2+和ROS[30],土壤矿物(尤其是具有氧化还原活性的铁矿物)则作为类过氧化物酶而催化分解有机质。
4 结论1) 与HRP相似,土壤也具有经典的类过氧化物酶催化颜色反应。长期施肥显著改变了土壤类过氧化物酶活性,其中以施用有机肥土壤类过氧化物酶活性为最高。
2) 高温灭菌对土壤类过氧化物酶活性影响程度取决于土壤类型和施肥处理。长期施用有机肥红壤类过氧化物酶活性较稳定,而施用化肥和不施肥红壤类过氧化物酶活性不稳定,可能与其矿物纳米颗粒含量低、易受水热波动影响有关。
致谢: 中国农业科学院祁阳红壤试验站王伯仁研究员和新疆农业科学院土壤肥料与农业节水研究所刘骅研究员为本研究提供土壤样品,谨致谢意。
| [1] |
Jian S Y, Li J W, Chen J, et al. Soil extracellular enzyme activities, soil carbon and nitrogen storage under nitrogen fertilization: A meta-analysis[J]. Soil Biology and Biochemistry, 2016, 101: 32-43 DOI:10.1016/j.soilbio.2016.07.003 (  0) 0) |
| [2] |
曹慧, 孙辉, 杨浩, 等. 土壤酶活性及其对土壤质量的指示研究进展[J]. 应用与环境生物学报, 2003, 9(1): 105-109 DOI:10.3321/j.issn:1006-687X.2003.01.025 (  0) 0) |
| [3] |
陆雅海, 傅声雷, 褚海燕, 等. 全球变化背景下的土壤生物学研究进展[J]. 中国科学基金, 2015, 29(1): 19-24 DOI:10.16262/j.cnki.1000-8217.2015.01.006 (  0) 0) |
| [4] |
敦宇, 许嘉文, 白雪山, 等. 地下水灌溉对华北平原农田土壤碳库转化影响[J]. 环境科学研究, 2021, 34(5): 1187-1195 DOI:10.13198/j.issn.1001-6929.2021.01.13 (  0) 0) |
| [5] |
李春越, 郝亚辉, 薛英龙, 等. 长期施肥对黄土旱塬农田土壤微生物量碳、氮、磷的影响[J]. 农业环境科学学报, 2020, 39(8): 1783-1791 (  0) 0) |
| [6] |
鄢紫薇, 高璟赟, 张秀玲, 等. 不同水分处理对华中地区稻田土壤酶活性的影响[J]. 农业环境科学学报, 2022, 41(1): 91-98 (  0) 0) |
| [7] |
王文锋, 李春花, 黄绍文, 等. 不同施肥模式对设施菜田土壤酶活性的影响[J]. 应用生态学报, 2016, 27(3): 873-882 DOI:10.13287/j.1001-9332.201603.015 (  0) 0) |
| [8] |
Blankinship J C, Becerra C A, Schaeffer S M, et al. Separating cellular metabolism from exoenzyme activity in soil organic matter decomposition[J]. Soil Biology and Biochemistry, 2014, 71: 68-75 DOI:10.1016/j.soilbio.2014.01.010 (  0) 0) |
| [9] |
Gao L Z, Zhuang J, Nie L, et al. Intrinsic peroxidase-like activity of ferromagnetic nanoparticles[J]. Nature Nanotechnology, 2007, 2(9): 577-583 DOI:10.1038/nnano.2007.260 (  0) 0) |
| [10] |
池志濑, 余光辉. 矿物纳米酶介导的元素生物地球化学循环及环境效应[J]. 中国科学: 地球科学, 2021, 51(8): 1203-1213 (  0) 0) |
| [11] |
Chi Z L, Yu G H. Nanozyme-mediated elemental biogeochemical cycling and environmental effects[J]. Science China Earth Sciences, 2021, 64(7): 1015-1025 DOI:10.1007/s11430-020-9756-5 (  0) 0) |
| [12] |
焦健, 范克龙, 胡志刚, 等. 纳米酶的发展态势与优先领域分析[J]. 中国科学: 化学, 2019, 49(12): 1442-1453 (  0) 0) |
| [13] |
Wei H, Wang E K. Nanomaterials with enzyme-like characteristics (nanozymes): Next-generation artificial enzymes[J]. Chemical Society Reviews, 2013, 42(14): 6060-6093 DOI:10.1039/c3cs35486e (  0) 0) |
| [14] |
Hochella M F Jr, Mogk D W, Ranville J, et al. Natural, incidental, and engineered nanomaterials and their impacts on the Earth system[J]. Science, 2019, 363(6434): eaau8299 DOI:10.1126/science.aau8299 (  0) 0) |
| [15] |
Wen Y L, Liu W J, Deng W B, et al. Impact of agricultural fertilization practices on organo-mineral associations in four long-term field experiments: Implications for soil C sequestration[J]. Science of the Total Environment, 2019, 651: 591-600 DOI:10.1016/j.scitotenv.2018.09.233 (  0) 0) |
| [16] |
Huang X L, Kang W J, Guo J J, et al. Highly reactive nanomineral assembly in soil colloids: Implications for paddy soil carbon storage[J]. Science of the Total Environment, 2020, 703: 134728 DOI:10.1016/j.scitotenv.2019.134728 (  0) 0) |
| [17] |
Yu G H, Chen C M, He X H, et al. Unexpected bulk density and microstructures response to long-term pig manure application in a Ferralic Cambisol Soil: Implications for rebuilding a healthy soil[J]. Soil and Tillage Research, 2020, 203: 104668 DOI:10.1016/j.still.2020.104668 (  0) 0) |
| [18] |
刘骅, 佟小刚, 马兴旺, 等. 长期施肥下灰漠土矿物颗粒结合有机碳的含量及其演变特征[J]. 应用生态学报, 2010, 21(1): 84-90 DOI:10.13287/j.1001-9332.2010.0049 (  0) 0) |
| [19] |
刘骅, 林英华, 张云舒, 等. 长期施肥对灰漠土生物群落和酶活性的影响[J]. 生态学报, 2008, 28(8): 3898-3904 DOI:10.3321/j.issn:1000-0933.2008.08.049 (  0) 0) |
| [20] |
Zhang H M, Wang B R, Xu M G, et al. Crop yield and soil responses to long-term fertilization on a red soil in Southern China*1[J]. Pedosphere, 2009, 19(2): 199-207 DOI:10.1016/S1002-0160(09)60109-0 (  0) 0) |
| [21] |
Jiang B, Duan D M, Gao L Z, et al. Standardized assays for determining the catalytic activity and kinetics of peroxidase-like nanozymes[J]. Nature Protocols, 2018, 13(7): 1506-1520 DOI:10.1038/s41596-018-0001-1 (  0) 0) |
| [22] |
Schumacher M, Christl I, Scheinost A C, et al. Chemical heterogeneity of organic soil colloids investigated by scanning transmission X-ray microscopy and C-1s NEXAFS microspectroscopy[J]. Environmental Science & Technology, 2005, 39(23): 9094-9100 (  0) 0) |
| [23] |
Yu G H, Xiao J, Hu S J, et al. Mineral availability as a key regulator of soil carbon storage[J]. Environmental Science & Technology, 2017, 51(9): 4960-4969 (  0) 0) |
| [24] |
Chacon S S, García-Jaramillo M, Liu S Y, et al. Differential capacity of kaolinite and birnessite to protect surface associated proteins against thermal degradation[J]. Soil Biology and Biochemistry, 2018, 119: 101-109 DOI:10.1016/j.soilbio.2018.01.020 (  0) 0) |
| [25] |
Bar-On Y M, Phillips R, Milo R. The biomass distribution on earth[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(25): 6506-6511 DOI:10.1073/pnas.1711842115 (  0) 0) |
| [26] |
Yu G H, Chi Z L, Kappler A, et al. Fungal nanophase particles catalyze iron transformation for oxidative stress removal and iron acquisition[J]. Current Biology, 2020, 30(15): 2943-2950.e4 DOI:10.1016/j.cub.2020.05.058 (  0) 0) |
| [27] |
Eastwood D C, Floudas D, Binder M, et al. The plant cell wall-decomposing machinery underlies the functional diversity of forest fungi[J]. Science, 2011, 333(6043): 762-765 DOI:10.1126/science.1205411 (  0) 0) |
| [28] |
Tamaru Y, Yoshida M, Eltis L D, et al. Multiple iron reduction by methoxylated phenolic lignin structures and the generation of reactive oxygen species by lignocellulose surfaces[J]. International Journal of Biological Macromolecules, 2019, 128: 340-346 DOI:10.1016/j.ijbiomac.2019.01.149 (  0) 0) |
| [29] |
Yu G H, Kuzyakov Y. Fenton chemistry and reactive oxygen species in soil: Abiotic mechanisms of biotic processes, controls and consequences for carbon and nutrient cycling[J]. Earth-Science Reviews, 2021, 214: 103525 DOI:10.1016/j.earscirev.2021.103525 (  0) 0) |
| [30] |
Yu G H, Kuzyakov Y, Luo Y, et al. Molybdenum Bioavailability and Asymbiotic Nitrogen Fixation in Soils are Raised by Iron (Oxyhydr)oxide-Mediated Free Radical Production[J]. Environmental Science & Technology, 2021, 55(21): 14979-14989 (  0) 0) |
2. Shenergy Environmental Technology Co. ltd., Hangzhou 311100, China
 2023, Vol. 55
2023, Vol. 55


