2. 福建三明森林生态系统国家野外科学观测研究站, 福建三明 365000
自工业革命以来,由于世界范围内化石燃料燃烧以及人造氮肥的生产和使用,全球的氮循环大规模加速,导致大气氮输入量显著增加[1]。过量的氮输入会深刻影响并改变森林生态系统的功能结构和元素循环[2]。而土壤碳库作为生态系统中最大并且最活跃的碳库[3],其微小变化即会引起全球气候变化。同时由于碳氮循环被视为是牢固耦合的,氮输入增加会改变森林生态系统碳循环及其对气候变化的反馈[4-5]。因此,研究氮输入增加背景下森林生态系统碳循环是十分重要的。
土壤有机碳矿化指土壤微生物利用土壤有机质作为能量和营养来源,并向外界释放CO2、CH4等温室气体的过程[6]。它能够反映土壤碳循环动态,是构成陆地碳循环的重要组成部分[7],极易受营养物质输入、土壤理化性质和微生物等因素的影响,其中氮输入是重要因素之一[8]。国内外有关氮输入对森林生态系统影响的研究始于20世纪80年代[9]。在过去的几十年中,氮输入对森林土壤有机碳矿化的影响已开展大量的研究,其主要表现为促进[10]、抑制[11]或无影响[12]。例如,Nottingham等[13]在巴拿马对森林土壤进行100 mg/kg NH4NO3的添加试验后,发现氮添加后土壤激发效应显著增强,促进了土壤有机碳的矿化;Wang等[14]在沈阳农田进行154 mg/kg NH4NO3的添加试验后,发现由于NH4+浓度迅速增加,导致土壤微生物“氨中毒”,从而抑制了有机碳矿化;而Micks等[15]对美国马萨诸塞州哈佛森林人工红松林和阔叶混交林进行的120 mg/kg NH4NO3施氮试验,发现由于土壤微生物活动受碳限制,氮添加后土壤微生物生物量和微生物活性没有发生变化,导致氮添加对土壤碳矿化无影响。这些研究结果的差异可能是由于生态系统类型、氮添加形态和不同添加量等因素所引起的[10-11]。此外,目前大部分氮添加对有机碳矿化影响的研究主要集中于欧洲与北美的北方森林与温带森林[10]。与温带地区土壤受氮限制不同,本团队前期研究表明亚热带地区土壤主要受土壤磷限制[16]。因此,亚热带地区土壤矿化对于氮沉降的响应可能与温带地区不同,探讨亚热带地区森林生态系统土壤有机碳矿化对氮添加的响应有助于了解未来氮沉降背景下有机碳矿化的潜在影响机制。
杉木(Cunninghamia lanceolata)人工林是我国最重要的商品木材来源,其种植面积和蓄积量分别占全国人工林的1/4和1/3,是我国人工种植面积最大的速生林之一[17]。以往氮沉降增加对杉木人工林生态系统影响的研究主要集中在对杉木生长[9]、土壤养分[18]和凋落物[19]等方面,有关氮沉降对亚热带杉木人工林土壤有机碳矿化影响的研究报道较少[20]。本研究通过模拟氮沉降,以杉木人工林土壤为研究对象,探讨氮输入增加下土壤有机碳矿化的动态变化,旨在为研究未来氮沉降对土壤碳矿化影响提供依据。
1 材料与方法 1.1 研究区概况研究区位于福建三明森林生态系统与全球变化国家野外科学观测研究站(26°11′N,117°28′E)内,试验地海拔为315 m,2014年年均气温19.4 ℃,年均降雨量1 700 mm,属于亚热带季风气候,土壤为黑云母花岗岩发育的红壤,表层疏松,土层深厚,且多呈酸性。该地分布着中国面积最大的常绿阔叶林,研究区内的杉木人工林原是格氏栲(Castanopsis kawakamii)天然林。1975年原有的格氏栲天然林皆伐后,对林地进行炼山整地,挖穴处理,1976年1月用1年生杉木裸根苗定植,造林初始密度为1 494株/hm2。2014年林分平均树高为9.33 m,平均胸径为9.9 cm[21],现林下植被主要有杜茎山(Maesa japonica)、粗叶榕(Ficus hirta)、芒萁(Dicranopteris dichotoma)等。
1.2 土壤样品采集2014年1月在杉木人工林内设置3个20 m × 20 m的样地,采用多点混合采样法,采集0 ~ 10 cm土壤样品。样品采集后带回室内,挑出石块、植物根系及杂质后,过2 mm筛,后将样品分为两部分,一部分用于室内培养及理化指标测定;一部分风干后,过0.149 mm筛用于pH和土壤碳氮测定。土壤理化性质见表 1。
|
|
表 1 土壤理化性质 Table 1 Soil physicochemical properties |
2014年试验地的年平均温接近20 ℃,氮沉降背景为39.8 kg/(hm2·a)[22],因此本试验培养温度设为20 ℃,设3个氮添加水平处理N0(0 mg/kg)、N10(100 mg/kg)、N25(250 mg/kg),每个处理5个重复。试验开始时,称取相当于50 g风干土样的鲜土置于500 mL的培养瓶中(PE材料),将土壤含水量调节为田间持水量(WHC)的60%[23];用保鲜膜将瓶口封上,并留些气孔以利于通气,将土壤样品置于20 ℃培养箱黑暗条件下预培养14 d,使其达到稳定状态。预培养结束后,根据试验设计添加相应的NH4NO3溶液到培养瓶中,N0处理用去离子水代替,使含水量达到田间持水量的60%,将培养瓶置于20 ℃的培养箱中培养117 d。于培养开始时(0)、3、7、12、17、22、27、37、47、57、72、87、102、117 d采集气体样品;采集气体样品前用高纯空气洗气后立即收集气体作为空白,密闭培养2 h后再次采集气体,用GC2014气相色谱(GC-2014,Shimadzu,kyoto,日本)测定CO2浓度。培养期间每5 d对培养瓶补水,使其含水量保持在田间持水量的60%。在培养0、57、117 d取样测定SOC、DOC、MBC及微生物群落结构等指标。
1.4 土壤理化性质测定SOC、TN采用碳氮元素分析仪(Elementar Vario EL Ⅲ,Elementar,德国)测定;pH采用水土质量比为4︰1,通过玻璃电极pH计(STARTER 300,OHAUS,美国)测定;NH4+-N、NO3–-N采用2 mol/L KCl进行浸提,连续流动分析仪(Skalar san++,Skalar,荷兰)测定[24],Min-N为NH4+-N、NO3–-N之和。DOC、DON采用去离子水浸提10 g鲜土,水土质量比为4︰1,25 ℃、260 r/min振荡30 min,25℃、4 000 r/min离心10 min,经0.45 μm滤膜抽滤,分别用总有机碳分析仪(TOC-VCPH/CPN,Shimadzu,日本)和连续流动分析仪测定。MBC、MBN采用氯仿熏蒸–硫酸钾浸提法[25],称取5 g鲜土用20 mL 0.5 mol/L K2SO4溶液浸提,25 ℃、260 r/min振荡30 min,25 ℃、4 000 r/min离心10 min,经0.45 μm滤膜抽滤,分别用总有机碳分析仪和连续流动分析仪测定。MBC、MBN含量计算公式:
| $B=\Delta E / k$ | (1) |
式中:B为MBC或MBN含量;ΔE为熏蒸与未熏蒸土壤SOC或TN含量的差值;k为转换系数,其中MBC为0.45,MBN为0.54[24]。
1.5 土壤微生物群落结构测定土壤微生物群落结构采用磷脂脂肪酸(PLFA)法表示。磷脂脂肪酸测定:采用White等[26]方法进行提取,称量5 g冷冻干燥土壤,加入23 mL提取液(由5 mL磷酸缓冲液、6 mL CH3Cl、12 mL CH3OH组成),振荡2 h,在4 000 r/min下离心10 min,将上清液倒入分液漏斗,重复此过程后,静置过夜;取上清液氮气吹干后,用CH3Cl清洗过硅胶小柱,用CH3OH收集,氮气吹干;再使用1 mL 0.2 mol/L KOH溶液进行皂化,最后用色谱纯正己烷进行萃取,最后氮气吹干待测。上机前,用正十九烷酸甲酯作为内部溶液,用气相色谱(Agilent GC7890N,美国)和MIDI(MINDI Inc,Newark,德国)系统进行磷脂脂肪酸的鉴定。本研究采用Frostegård等[27]的方法对磷脂脂肪酸标志物进行分类,见表 2。
|
|
表 2 微生物群落中的磷脂脂肪酸标志物 Table 2 Phospholipid fatty acid markers in microbial communities |
SOC矿化速率计算:
| $F=k \times V / m \times \Delta c / \Delta t \times 273 /(273+T)$ | (2) |
式中:F为CO2排放速率(mg/(kg·d));k为常数,取1.964;Δc/Δt表示单位时间CO2浓度变化率(mg/d);V是培养瓶的体积(m3);m是土壤干重(kg);T是培养温度(℃)。
数据处理采用Excel 2016和SPSS 24.0软件。采用单因素方差分析(one-way ANOVA)对氮添加后土壤理化性质及微生物群落组成的变化进行分析;利用重复测量方差分析(MANOVA of repeated measuring)检验氮添加水平和培养时间对土壤有机碳矿化速率和有机碳矿化累积量的影响。应用Canoco5对微生物群落结构进行主成分分析(PCA)并绘图。利用R中的corrplot包对有机碳矿化速率进行相关性分析并绘制相关性热图。最后通过Smart-PLS 3软件根据相关性分析结果,将GP、B、F/B、Total PLFAs归为微生物群落结构指标,NH4+-N、NO3–-N、Min-N和DON归为土壤氮指标,SOC归为土壤碳指标,MBC、MBN归为土壤微生物生物量指标进行PLS路径分析,通过信度和效度的评估,有效评估PLS-SEM模型的可信度。内部一致性的信度采用Cronbach’s Alpha (CA)进行评价,一般认为该信度大于0.7,不小于0.6;使用平均方差提取(AVE)来验证收敛效度,要求收敛效度大于0.5;方差膨胀因子(VIF)被用来检测5个潜变量的多重共线性,本文所有的变量负荷均满足结构效度的要求[28]。
2 结果与分析 2.1 氮添加对土壤有机碳矿化速率及累积矿化量的影响由图 1A可以看出,各处理的土壤有机碳矿化速率在培养前期(0 ~ 57 d)最大值出现在培养开始时(0 d)随后便呈快速下降趋势,而培养后期(57 ~ 117 d)基本趋于稳定。培养期间,最大值为培养开始时(0 d)N25处理的13.42 mg/(kg·d),随后各处理的矿化速率在0 ~ 57 d间快速降低,N0、N10和N25处理分别下降了44%、45%、47%。同时整个培养期间,这3个处理的土壤有机碳矿化平均速率分别为9.97、9.27、8.89 mg/(kg·d),表明氮添加显著降低土壤有机碳矿化速率,且随氮添加量的增加而增加,而培养时间、培养时间和氮添加的交互作用对土壤有机碳矿化速率均无显著影响。

|
(N0、N10、N25分别为氮添加0、100、250 mg/kg处理;*、**、***分别表示重复测量方差分析在P < 0.05、P < 0.01、P < 0.001水平影响显著;ns表示P > 0.05,影响不显著;下同) 图 1 氮添加对杉木人工林土壤有机碳矿化速率(A)和累积矿化量(B)的影响 Fig. 1 Effects of N addition on soil organic carbon mineralization rate (A) and accumulation (B) of Chinese fir plantation |
由图 1B可以看出,各处理土壤有机碳矿化累积量随培养时间显著增加,同时与N0处理相比,N10和N25处理土壤有机碳矿化累积量平均值分别降低了3.4% 和7.4%,即氮添加显著降低土壤有机碳矿化累积量,且随氮添加量的增加矿化累积量降低的幅度增加,培养时间和氮添加的交互作用对土壤矿化累积量也有显著影响。
2.2 氮添加对于土壤理化性质的影响由表 3可以看出,培养57 d时,N10、N25处理MBC、Min-N含量显著降低,分别降低了20% 和7%;而NH4+ -N含量显著增加,增加了13%。同时N10处理显著增加了DOC含量、MBC/MBN比,显著降低了MBN含量;N25处理则显著增加了土壤MBN含量,显著降低了DOC含量、MBC/MBN比。
|
|
表 3 氮添加对土壤理化性质的影响 Table 3 Effects of N addition on soil physicochemical properties after 57 days and 117 days |
培养117 d时,N10、N25处理显著增加了NH4+- N、NO3–-N、Min-N和MBN含量,显著降低了MBC、SOC含量。其中NH4+-N、NO3–-N和Min-N含量分别增加了61%、22% 和34%,SOC、MBC含量分别降低了3% 和22%。N10处理使C/N比显著降低,N25处理则使其显著增加。
随培养时间的延长(表 3),DOC、NH4+-N、NO3–-N和Min-N含量显著增加。其中,培养117 d时的DOC、NH4+-N、NO3–-N和Min-N含量比57 d时分别增加了9%、31%、10% 和23%。除N10处理外,随培养时间的延长MBC含量、MBN含量比57 d时分别降低了12%、43%,MBC/MBN比则比57 d时增加了43%。培养时间和氮添加水平对MBC含量存在显著的交互作用,而其余理化性质没有显著的交互作用。
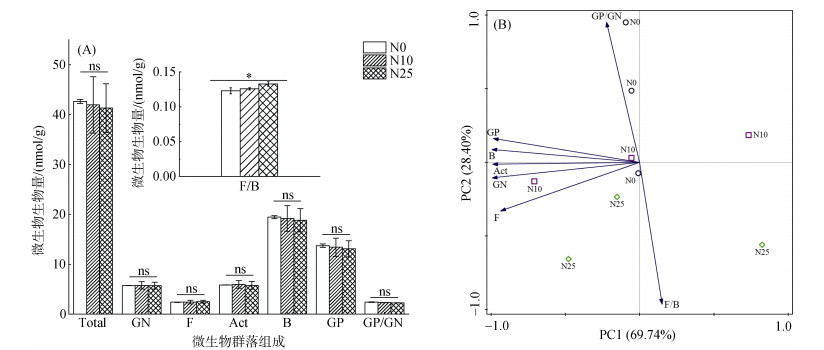
2.3 氮添加对土壤微生物群落组成的影响由图 2A可以看出,氮添加短期内(57 d和117 d)对微生物总量(Total PLFAs)、革兰氏阳性菌(GP)、革兰氏阴性菌(GN)、细菌(B)、真菌(F)、放线菌(Act)生物量及GP/GN比均无显著影响,但F/B比随氮添加水平的增加而增加。由主成分分析(图 2B)可以看出,第一主成分解释了微生物群落结构变化的69.74%,第二主成分解释了微生物群落结构变化的28.4%,氮添加对微生物群落组成没有显著影响。
|
(*表示处理间差异显著(P < 0.05);ns表示处理间无显著差异(P > 0.05)) 图 2 微生物群落组成(A)在氮添加下的变化和微生物PLFAs(B)的主成分分析 Fig. 2 Microbial community composition (A) changes under N addition and principal component analysis of microbial PLFAs (B) |
由表 4可以看出,土壤有机碳矿化累积量与SOC、MBC、GP、B、pH、Total PLFAs存在显著的正相关关系,而与MBN、DON、NH4+-N、NO3–-N、Min-N、F/B、C/N呈显著负相关关系。
|
|
表 4 土壤有机碳矿化速率与各个影响因子的相关性 Table 4 Correlation between soil organic carbon mineralization rate and various influencing factors |
由图 3可以看出,微生物群落结构(R2=0.325)、微生物生物量(R2=0.877)、土壤碳(R2=0.616)和土壤氮(R2=0.708)能解释土壤有机碳累积矿化量变化的84.7%,而氮添加对微生物群落结构、微生物生物量、土壤碳和土壤氮变化的解释度较好(R2 > 0.5)分别为0.368、0.877、0.616和0.708,其中Min-N、DON、NH4+-N、NO3–-N对氮添加有正向显著反应,同时氮添加与土壤碳和有机碳矿化有显著负相关关系,与土壤氮则有显著正相关关系。

|
(单向箭头表示有联系的方向,实线和虚线箭头分别表示正、负关系,线条的宽度与关系的强度成正比,黑色加粗数字为路径系数,斜体数字为潜变量的R2。) 图 3 土壤有机碳矿化PLS路径分析 Fig. 3 PLS path analysis diagram of soil organic carbon mineralization |
本研究结果表明,氮添加后土壤有机碳矿化速率在培养开始时(0 d)即达到最大值而后快速下降,而培养后期(57 ~ 117 d)基本趋于稳定,这与廖畅[29]和刘静等[30]的研究结果基本一致。其主要原因可能是培养初期土壤中可被微生物利用的易分解碳含量较高,有利于微生物的生长和繁殖,进而提高了土壤有机碳矿化速率[31];在培养中期,土壤NH4+-N、NO3–-N显著增加,过量的氮可能抑制土壤微生物的活性,降低MBC含量[32],进而降低了土壤有机碳矿化速率;培养后期,随底物有效性的逐渐降低,微生物可利用的易分解碳减少,难分解有机碳占据主导地位导致微生物活动相对减缓[33],使得矿化速率趋于稳定。
从总体上看,氮添加抑制了土壤有机碳的矿化速率,导致矿化累积量显著降低,这与Chen等[34]、方熊等[35]的研究结果一致。一方面可能是由于供试土壤的C/N比(13.98)较低,而当土壤C/N比低于20时微生物主要受到碳限制[36],氮添加后土壤C/N比进一步下降使土壤的碳限制加剧,进而影响微生物的数量及活性。另一方面可能是氮添加后土壤中的氮释放增加,即NH4+-N、NO3–-N、Min-N含量显著增加,从而增强了土壤氮矿化,为土壤硝化作用提供了更加充足的氮源,而硝化作用增强会“毒害”土壤微生物使其数量和活性降低[37],降低土壤有机碳的矿化速率,进而抑制有机碳矿化累积量。结合路径分析(图4)发现,氮添加后主要会影响微生物群落结构、土壤碳、土壤氮及微生物生物量,其中氮添加显著影响土壤碳、土壤氮,而土壤氮、微生物群落结构和微生物生物量对土壤有机碳矿化累积量有更进一步的影响。
3.2 微生物群落对土壤有机碳矿化的影响土壤微生物是土壤有机碳矿化的主要驱动者,也是土壤有机碳矿化的三大影响因子之一[38]。氮添加能够直接或间接地影响土壤微生物活性及群落结构组成,进而影响土壤有机碳矿化过程[8]。本研究表明,氮添加增加后Total PLFAs、GP、GN、B、F、Act生物量和GP/GN比没有显著的变化,但基本呈降低的趋势,这与Li等[39]的研究结果一致。一方面可能是由于本次试验时间较短且土壤本底氮含量相对较高,导致短期内氮添加对土壤微生物影响较小[40];另一方面可能是由于MBC/MBN比降低即土壤微生物在氮添加后主要受碳限制影响[41],而本试验中SOC含量变化不大,因此微生物群落结构在氮添加后没有显著的改变。
本研究中,F/B比在氮添加后有增加的趋势,这与Wang等[42]的研究结果不一致,其研究表明氮添加增加了土壤有效氮的含量,可能导致分配到细根进行真菌定殖的植物碳减少使得真菌生物量下降,从而降低F/B比。前人研究表明,土壤MBC/MBN比越大真菌所占的相对比例越高,适宜真菌生长的MBC/MBN比通常位于5 ~ 15,细菌则位于3 ~ 6[43],本研究中的土壤MBC/MBN比较高,主要位于5 ~ 13,从而导致真菌所占比例增大,最终使F/B比增加。而MBC/MBN比降低表明,土壤微生物在氮添加后主要受到碳限制;SOC含量随氮添加的增加而减少则表明土壤碳减少微生物的活性也会随之降低[4],从而限制土壤有机碳矿化。
4 结论氮添加对杉木人工林土壤有机碳矿化有显著的抑制作用,并随氮添加水平增加而增加。在氮添加后,土壤微生物群落结构无显著变化,但其生物量基本呈降低趋势,只有F/B比随氮添加增加而增加。相关性分析及路径分析表明,杉木人工林中氮添加主要是通过改变土壤中碳、氮的含量抑制土壤有机碳矿化,以SOC、NH4+-N、NO3–-N和Min-N含量显著变化为主,即氮添加后土壤中碳、氮养分含量的变化是影响有机碳矿化的主要原因,而微生物群落结构变化则不是主要原因。可见,在未来氮沉降加剧情景下,亚热带杉木人工林土壤中的SOC含量下降及土壤氮含量增加会显著抑制土壤有机碳的矿化作用。
| [1] |
Zhao Y H, Zhang L, Chen Y F, et al. Atmospheric nitrogen deposition to China: A model analysis on nitrogen budget and critical load exceedance[J]. Atmospheric Environment, 2017, 153: 32-40 DOI:10.1016/j.atmosenv.2017.01.018 (  0) 0) |
| [2] |
Liu X J, Zhang Y, Han W X, et al. Enhanced nitrogen deposition over China[J]. Nature, 2013, 494(7438): 459-462 DOI:10.1038/nature11917 (  0) 0) |
| [3] |
Sanaullah M, Chabbi A, Girardin C, et al. Effects of drought and elevated temperature on biochemical composition of forage plants and their impact on carbon storage in grassland soil[J]. Plant and Soil, 2014, 374(1): 767-778 (  0) 0) |
| [4] |
Gu B J, Ju X T, Wu Y Y, et al. Cleaning up nitrogen pollution may reduce future carbon sinks[J]. Global Environmental Change, 2018, 48: 56-66 DOI:10.1016/j.gloenvcha.2017.10.007 (  0) 0) |
| [5] |
Greaver T L, Clark C M, Compton J E, et al. Key ecological responses to nitrogen are altered by climate change[J]. Nature Climate Change, 2016, 6(9): 836-843 DOI:10.1038/nclimate3088 (  0) 0) |
| [6] |
Walker T W N, Kaiser C, Strasser F, et al. Microbial temperature sensitivity and biomass change explain soil carbon loss with warming[J]. Nature Climate Change, 2018, 8(10): 885-889 DOI:10.1038/s41558-018-0259-x (  0) 0) |
| [7] |
陈仕奇, 吕盛, 高明, 等. 缙云山不同林分下土壤有机碳及矿化特征[J]. 环境科学, 2019, 40(2): 953-960 DOI:10.13227/j.hjkx.201805073 (  0) 0) |
| [8] |
Li L J, Zhu-Barker X, Ye R Z, et al. Soil microbial biomass size and soil carbon influence the priming effect from carbon inputs depending on nitrogen availability[J]. Soil Biology and Biochemistry, 2018, 119: 41-49 DOI:10.1016/j.soilbio.2018.01.003 (  0) 0) |
| [9] |
Yu L, Dong T F, Lu Y B, et al. Ecophysiological responses of Cunninghamia lanceolata to nongrowing-season warming, nitrogen deposition, and their combination[J]. Photosynthetica, 2016, 54(4): 598-610 DOI:10.1007/s11099-016-0647-2 (  0) 0) |
| [10] |
Wang Q K, Wang S L, He T X, et al. Response of organic carbon mineralization and microbial community to leaf litter and nutrient additions in subtropical forest soils[J]. Soil Biology and Biochemistry, 2014, 71: 13-20 DOI:10.1016/j.soilbio.2014.01.004 (  0) 0) |
| [11] |
Qiao N, Xu X L, Hu Y H, et al. Carbon and nitrogen additions induce distinct priming effects along an organic- matter decay continuum[J]. Scientific Reports, 2016, 6: 19865 DOI:10.1038/srep19865 (  0) 0) |
| [12] |
朱依凡, 孙兆林, 王清奎. 生物炭和氮添加对亚热带常绿阔叶林土壤有机碳分解与平衡的影响[J]. 生态学杂志, 2020, 39(9): 2851-2859 DOI:10.13292/j.1000-4890.202009.009 (  0) 0) |
| [13] |
Nottingham A T, Turner B L, Stott A W, et al. Nitrogen and phosphorus constrain labile and stable carbon turnover in lowland tropical forest soils[J]. Soil Biology and Biochemistry, 2015, 80: 26-33 DOI:10.1016/j.soilbio.2014.09.012 (  0) 0) |
| [14] |
Wang H, Hu G Q, Xu W H, et al. Effects of nitrogen addition on soil organic carbon mineralization after maize stalk addition[J]. European Journal of Soil Biology, 2018, 89: 33-38 DOI:10.1016/j.ejsobi.2018.10.002 (  0) 0) |
| [15] |
Micks P, Aber J D, Boone R D, et al. Short-term soil respiration and nitrogen immobilization response to nitrogen applications in control and nitrogen-enriched temperate forests[J]. Forest Ecology and Management, 2004, 196(1): 57-70 DOI:10.1016/j.foreco.2004.03.012 (  0) 0) |
| [16] |
Turner B L, Yavitt J B, Harms K E, et al. Seasonal changes and treatment effects on soil inorganic nutrients following a decade of fertilizer addition in a lowland tropical forest[J]. Soil Science Society of America Journal, 2013, 77(4): 1357-1369 DOI:10.2136/sssaj2012.0128 (  0) 0) |
| [17] |
国家林业和草原局. 2017年度中国林业和草原发展报告[M].
中国林业出版社, 北京, 2018
(  0) 0) |
| [18] |
邱岭军, 胡欢甜, 林宝平, 等. 不同林龄杉木养分重吸收率及其C︰N︰P化学计量特征[J]. 西北林学院学报, 2017, 32(4): 22-27 DOI:10.3969/j.issn.1001-7461.2017.04.04 (  0) 0) |
| [19] |
费裕翀, 叶义全, 郑宏, 等. 外源氮素调控C/N比对杉木林凋落叶细菌群落结构的影响[J]. 生态学报, 2021, 41(5): 2011-2023 (  0) 0) |
| [20] |
Huang Z Q, Wan X H, He Z M, et al. Soil microbial biomass, community composition and soil nitrogen cycling in relation to tree species in subtropical China[J]. Soil Biology and Biochemistry, 2013, 62: 68-75 DOI:10.1016/j.soilbio.2013.03.008 (  0) 0) |
| [21] |
Huang J X, Lin T C, Xiong D C, et al. Organic carbon mineralization in soils of a natural forest and a forest plantation of southeastern China[J]. Geoderma, 2019, 344: 119-126 DOI:10.1016/j.geoderma.2019.03.012 (  0) 0) |
| [22] |
史顺增, 熊德成, 邓飞, 等. 土壤增温、氮添加及其交互作用对杉木幼苗细根生产的影响[J]. 植物生态学报, 2017, 41(2): 186-195 (  0) 0) |
| [23] |
Vanhala P. Seasonal variation in the soil respiration rate in coniferous forest soils[J]. Soil Biology and Biochemistry, 2002, 34(9): 1375-1379 DOI:10.1016/S0038-0717(02)00061-5 (  0) 0) |
| [24] |
Gregorich E G, Wen G, Voroney R P, et al. Calibration of a rapid direct chloroform extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry, 1990, 22(7): 1009-1011 DOI:10.1016/0038-0717(90)90148-S (  0) 0) |
| [25] |
Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry, 1987, 19(6): 703-707 DOI:10.1016/0038-0717(87)90052-6 (  0) 0) |
| [26] |
White D C, Davis W M, Nickels J S, et al. Determination of the sedimentary microbial biomass by extractible lipid phosphate[J]. Oecologia, 1979, 40(1): 51-62 DOI:10.1007/BF00388810 (  0) 0) |
| [27] |
Frostegård Å, Tunlid A, Bååth E. Use and misuse of PLFA measurements in soils[J]. Soil Biology and Biochemistry, 2011, 43(8): 1621-1625 DOI:10.1016/j.soilbio.2010.11.021 (  0) 0) |
| [28] |
Hair J F, Risher J J, Sarstedt M, et al. When to use and how to report the results of PLS-SEM[J]. European Business Review, 2019, 31(1): 2-24 DOI:10.1108/EBR-11-2018-0203 (  0) 0) |
| [29] |
廖畅. 外源碳氮输入对不同纬度森林土壤有机碳矿化和固持的影响[D]. 武汉: 中国科学院大学(中国科学院武汉植物园), 2020.
(  0) 0) |
| [30] |
刘静, 孙涛, 程云云, 等. 氮沉降和土壤线虫对落叶松人工林土壤有机碳矿化的影响[J]. 生态学杂志, 2017, 36(8): 2085-2093 (  0) 0) |
| [31] |
聂二旗, 张心昱, 郑国砥, 等. 氮磷添加对杉木林土壤碳氮矿化速率及酶动力学特征的影响[J]. 生态学报, 2018, 38(2): 615-623 (  0) 0) |
| [32] |
王晶晶, 樊伟, 崔珺, 等. 氮磷添加对亚热带常绿阔叶林土壤微生物群落特征的影响[J]. 生态学报, 2017, 37(24): 8361-8373 (  0) 0) |
| [33] |
Michel K, Matzner E, Dignac M F, et al. Properties of dissolved organic matter related to soil organic matter quality and nitrogen additions in Norway spruce forest floors[J]. Geoderma, 2006, 130(3/4): 250-264 (  0) 0) |
| [34] |
Chen J G, Xiao W, Zheng C Y, et al. Nitrogen addition has contrasting effects on particulate and mineral-associated soil organic carbon in a subtropical forest[J]. Soil Biology and Biochemistry, 2020, 142: 107708 DOI:10.1016/j.soilbio.2020.107708 (  0) 0) |
| [35] |
方熊, 刘菊秀, 张德强, 等. 降水变化、氮添加对鼎湖山主要森林土壤有机碳矿化和土壤微生物碳的影响[J]. 应用与环境生物学报, 2012, 18(4): 531-538 (  0) 0) |
| [36] |
Dong W Y, Zhang X Y, Liu X Y, et al. Responses of soil microbial communities and enzyme activities to nitrogen and phosphorus additions in Chinese fir plantations of subtropical China[J]. Biogeosciences, 2015, 12(18): 5537-5546 DOI:10.5194/bg-12-5537-2015 (  0) 0) |
| [37] |
Lu M Z, Cheng S L, Fang H J, et al. Organic nitrogen addition causes decoupling of microbial nitrogen cycles by stimulating gross nitrogen transformation in a temperate forest soil[J]. Geoderma, 2021, 385: 114886 (  0) 0) |
| [38] |
Liang C, Schimel J P, Jastrow J D. The importance of anabolism in microbial control over soil carbon storage[J]. Nature Microbiology, 2017, 2: 17105 (  0) 0) |
| [39] |
Li J, Li Z A, Wang F M, et al. Effects of nitrogen and phosphorus addition on soil microbial community in a secondary tropical forest of China[J]. Biology and Fertility of Soils, 2015, 51(2): 207-215 (  0) 0) |
| [40] |
郝亚群, 谢麟, 陈岳民, 等. 中亚热带地区氮沉降对杉木幼林土壤细菌群落多样性及组成的影响[J]. 应用生态学报, 2018, 29(1): 53-58 (  0) 0) |
| [41] |
Fan Y X, Lin F, Yang L M, et al. Decreased soil organic P fraction associated with ectomycorrhizal fungal activity to meet increased P demand under N application in a subtropical forest ecosystem[J]. Biology and Fertility of Soils, 2018, 54(1): 149-161 (  0) 0) |
| [42] |
Wang C, Lu X K, Mori T, et al. Responses of soil microbial community to continuous experimental nitrogen additions for 13 years in a nitrogen-rich tropical forest[J]. Soil Biology and Biochemistry, 2018, 121: 103-112 (  0) 0) |
| [43] |
梁儒彪, 梁进, 乔明锋, 等. 模拟根系分泌物C: N化学计量特征对川西亚高山森林土壤碳动态和微生物群落结构的影响[J]. 植物生态学报, 2015, 39(5): 466-476 (  0) 0) |
| [44] |
沈芳芳, 徐晋, 陈官鹏. 长期氮沉降对杉木人工林土壤微生物生物量和群落组成的影响[J]. 南昌工程学院学报, 2019, 38(4): 29-35 (  0) 0) |
2. Sanming Forest Ecosystem National Observation and Research Station, Sanming, Fujian 365000, China
 2023, Vol. 55
2023, Vol. 55



