2. 中国科学院南京土壤研究所土壤与环境分析测试中心, 南京 210008
根系分泌物是植物生长过程中根系不同部位向生长介质中分泌或释放的种类繁多的碳活性物质,包括相对低分子质量的有机物质、高分子质量的黏胶物质、根细胞脱落物及其分解产物以及气体、质子和养分离子等[1]。迄今为止,已鉴定的根系分泌物有300多种,主要包括碳水化合物、氨基酸、有机酸、酶和其它化合物等,详见表 1[2–9]。根系分泌物不仅数量可观,而且作用巨大,是保持根际微生态系统活力的关键因素,也是根际物质循环的重要组成部分。但是不透明的复杂土壤环境给分泌物研究带来了重重困难,研究人员仍需进一步研究根系分泌物对农、林生态系统乃至全球生态系统的影响,这就强烈依赖于分析技术的不断发展以提供更深入、便捷、准确的分析手段和途径,来揭示根系分泌物对根际土壤生态环境的调控机制,为相关行业生产管控提供科学的理论支撑。
|
|
表 1 根系分泌物组分及其作用 Table 1 Organic components and roles of root exudates |
土壤有机质(SOM)是指土壤中的有机碳化合物,来源于植物的凋落物和死根、死的土壤生物、土壤生物和植物的排泄物或分泌物、人为有机肥和废物等。SOM对维持农业、林业等生态系统生产力具有重要意义[10],其中SOM矿化被认为是调节全球碳循环的关键过程[11],也是植物生长过程中主要养分来源。但植物只有在生物或非生物降解作用下才能直接吸收来自SOM的矿化营养物质。Nardi等[12]发现农林植物根系分泌物中琥珀酸具有较高的类生长素活性,脂肪酸C14COOH、C15COOH和C17COOH的同分异构体活性最高,结合之前Piccolo等[13–14]的研究,他们认为有机酸可进入腐殖质胶束内部并改变其立体疏水结构,生物分子是由根系分泌物中的有机酸从大部分土壤中驱动起来的,植物可以介导根际的发育和生理活动,并进一步验证了根系分泌物对SOM的生物活性、打破腐殖质交联和释放激素类活性物质的重要作用。Nardi等[15]还通过有机酸提取物对玉米苗代谢特别是对氮同化的影响测试,发现农田土壤提取物比森林土壤提取物表现出更高的类激素活性,应是刺激了氮通路所致。Wang等[16]将3种分泌物模拟物(即葡萄糖、甘氨酸和草酸)添加到200年历史的云杉、冷杉林土壤中,证实不同组分的根系分泌物通过不同的生物和非生物启动机制深刻调节了土壤碳动态和土壤碳储量。
1.2 提高土壤生态系统中养分利用率SOM作为微生物底物在化学上难以降解或在能量上无法激活[17],但植物可以通过释放刺激微生物生长、活动和周转的根系分泌物来加速根际氮循环[18],如分泌物刺激微生物生长,诱导微生物释放胞外酶进而促进氮循环,并通过启动效应解聚SOM[19]。森林土壤中SOM含量远高于农业土壤,在森林土壤中酚和蛋白复合物可驱动沉积在慢循环SOM库中的可激活有机氮[20–21]。因此,植物通过释放根系分泌物,为微生物提供能量,促使其产生胞外酶,从SOM中掘取氮[22–23]。如果大部分的氮可由缓慢循环的SOM启动,那么森林生态系统就会有几乎取之不尽的氮供应,而不再受氮的限制。Meier等[24]发现,在红松人工林根际原位添加模拟分泌物增强了快速降解、循环氮库酶的特定活性,增加了微生物对氮降解化合物的分配;并推测根系分泌物能刺激微生物分解不稳定的SOM并释放氮,若在富氮土壤中植物能激发这种功能,其作用可能更大。经Yin等[25]推算,在两种外生菌根和两种丛枝菌根树种的森林中,根系每年分泌物质量占净初级生产力(NPP)总量的2.5%,而该分泌量引起的微生物氮循环变化可能占总净氮矿化量的18% 左右。而陆玉芳和施卫明[6]及Lu等[26]确认根系还会分泌一些特定的化合物——生物硝化抑制剂,其能够抑制硝化作用,提高根际氮循环中氮的利用率。Strickland等[27]发现在森林土壤有机碳和微生物碳中,分泌物葡萄糖(13C标记)迅速升高,表明根系分泌物可以刺激微生物和动物群的活动,以获取营养。在缺氮条件下,玉米通过主动调节根系分泌物的组成,增加与根际细菌的相互作用,以刺激水解酶的产生和活性,并改变它们的根际范围,在更大的土壤体积中调动氮和碳[28]。而根系分泌物中有机酸的分泌使得低肥力土壤中氮的矿化增加[29]。
磷(P)是植物生长最重要的营养物质之一,也是植物生长过程中最重要的限制养分之一。许多农业系统强烈地依赖于肥料磷的连续输入;与此相反,在森林生态系统中,生物群具有高效驱动、吸收、回收和再利用磷的途径[30]。因此,在森林土壤中,应充分研究植物从有机磷和矿物磷中获取可用磷的策略,即无机磷增溶和有机磷矿化。33P同位素稀释法被用于研究根系分泌物对微生物总有机磷矿化的促进作用,结果发现,添加丙氨酸和葡萄糖可以刺激微生物的总磷矿化和磷酸酶活性,根系分泌物的结构和化学计量比可以显著影响微生物的刺激程度,因此根系分泌物对非菌根微生物的刺激可能是植物提高土壤中磷有效性的重要途径[31]。Zhang等[32]研究发现,根系共生的丛枝菌根真菌分泌的果糖不仅是一种碳源,而且可作为信号分子触发细菌介导的有机磷矿化过程,可使根系获得可靠的磷。白羽扇豆(Lupinus albus) 等植物在低磷胁迫下会形成大量排根,排根能分泌柠檬酸等有机酸来活化土壤中的难溶性磷[33]。青藏高原东部亚高山森林根际土壤速效磷含量明显高于非根际,并与柠檬酸含量高度相关,可能是柠檬酸通过解吸或配体交换有效调节了土壤中的磷[34]。
1.3 改变温室气体排放通量根际土壤环境中活性碳、氮化合物通常来自根系分泌物,一般是低分子量的碳化合物,包括糖、有机酸和氨基酸等,可为大部分微生物的生长和活动提供能量,并占土壤呼吸总量的30%[35–36]。Strickland等[27]使用低分子量的葡萄糖(13C标记)追踪位于美国南卡罗莱纳州3个牧场和3个森林土壤的主要碳轨迹,72 h后,葡萄糖中13C在微生物生物量碳和土壤有机碳中所占比例最大,其次是CO2、溶解性有机碳和微节肢动物;进入地下系统的低分子量碳化合物可能通过土壤食物链迅速传播。因此,丰富的根系分泌物可以诱导更多的CO2排放。
湿地(包括泥炭地)在全球碳循环中发挥着至关重要的作用,其CH4 (甲烷)排放量占全球甲烷排放总量的20% ~ 39%;泥炭地作为巨大的碳储存地,是植物和土壤呼吸产生CO2的重要来源,也是缺氧条件下有机物降解产生CH4的重要来源[37]。将根模拟分泌物(糖和有机酸组成的混合物)加入泥炭中以评估CO2和CH4的排放,结果显示,CO2和CH4排放量增加,其响应的幅度和持续时间取决于添加的不稳定碳混合物的成分而不是添加的碳的量或泥炭的源植物。所以,同样证实了根系分泌物成分在调节温室气体通量中的重要性;且原位植物物种的变化,特别是那些与土地利用变化相关的变化,可能解释了由于物种特有的根系分泌物组成而带来的CO2和CH4通量的小规模空间变化[38]。
在农田生态系统中,不同C/N比的模拟根系分泌物添加对水稻土CO2的排放均有影响,增加分泌物C/N比会加剧CO2排放[39]。同样,模拟根系分泌物(草酸、丝氨酸和葡萄糖)添加到培养的农田土壤中加剧了氧化亚氮(N2O)的排放,高浓度葡萄糖处理下N2O排放量最高,低浓度草酸处理下N2O排放量最高,且根系分泌物浓度越高,即土壤所提供的碳源越多,越促进异养微生物作用下的反硝化过程,对N2O的贡献越大[40]。而根系分泌的1,9-癸二醇等生物硝化抑制剂还能通过抑制硝化作用而降低土壤N2O的排放[26]。
2 根系分泌物对植物种间竞争与共生的影响根系分泌物的化学成分因物种和植物发育阶段以及当时的环境条件而异,但应包括不稳定的糖、有机酸和氨基酸等。因此,植物可根据食物——糖的分类来选择微生物群落和动物群,以达到植物与生物之间和谐共生,相互促进[41–42]。但是与植物的其他碳输入(如淍落物等)相比,根系分泌物的碳浓度较低,微生物对其利用却很快。不同的植物根系分泌物(可能是有机酸)可能是植物物种间长期共生的养分获取途径。
但有些植物会分泌有害的有机化合物(化感物质),这些化合物可以杀死对其敏感的植物,将其从小环境中排除,这种排他作用也可能通过影响土壤微生物群落来实现[43–44]。Fernandez等[45]用栎树或Molinia草的根系分泌物来浇灌橡树苗,发现Molinia草根系分泌物显著降低了橡树的生物量增长,栎根分泌物则有利于橡树生长,因此种植橡树时应减少橡树幼苗附近的Molinia草,以帮助减少其化感作用和缓解资源竞争。Xia等[46]将阔叶树种与杉木混交种植,发现与香樟混交后,香樟根系分泌的化感物质抑制杉木的生长,且土壤主要微生物类群发生变化;而与栎树混交后,杉木生长得以持续促进,主要表现在其促进杉木根的生长和改变根的行为,这为杉木人工林的管控提供了重要的启示。而根据Vyvyan[47]对作物分泌物的研究,一些有害物质或化感物质甚至可以被认为是新型除草剂或农药,植物可通过根系分泌、叶片挥发、凋落物降解淋滤等方式,释放对其他植物有害的物质到周围的环境中,以减少其他植物竞争生长的机会。
3 根系分泌物对土壤微生物的影响植物在自然环境中的健康依赖于由宏观微生物和微生物组成的复杂动态群落的相互作用,其生长量和产量取决于大量的与细菌和真菌的相互作用[48–49]。但是根际微生物群落结构和组成又受植物物种、土壤性质等影响,且在植物的不同发育阶段具有不同的根系分泌物和根际效应[50–51],进而微生物群落也会随着植物的年龄而变化,甚至会受到特定根系分泌物的调控而被选择性修饰。Liu等[52]研究发现,刺槐造林后根际土壤和细根特性高度诱导了主要细菌菌属和真菌菌属的变异量,土壤可利用磷和细根总磷是调节根际土壤微生物群落的关键,根际微生物群落组成受细根和土壤性质的协同影响。肉桂酸是一种抑制土壤微生物、促进根系生长的化感物质,Mehmood等[53]等证实肉桂酸降低了玉米根系生长和次生代谢产物的分泌,还可能影响其吸引促进植物生长的内生真菌的能力。Yuan等[54]发现,香蕉根分泌物中的酚酸可能增强了淀粉芽孢杆菌njk-6 (一种高效的拮抗真菌)的根定植和抑菌能力。Shi等[55]发现,一年生草本植物Avena fatua始终抑制根凋落物的分解速率,通过建立概念模型确认了两种主要机制:一是细菌和真菌的根际种群在遗传上可能比不与根系相关的种群更能利用小分子量分泌物,而更不可能使用复杂的大分子;二是植物蒸散和土壤干燥速率高,可能会降低微生物的整体功能潜力,从而抑制分解活动。该机制解释了植物诱导的分解主因的大小(甚至方向)是如何由根系对微生物功能基因的影响驱动的。同样,Huang等[56]证实,拟南芥根三萜类代谢物主导了根内、根际微生物组的建成与维持,塑造了根际的微生物群落,以满足其生长需求。Wen等[57]推测,易感品种的黄瓜倾向于通过根系分泌更多的有机酸(柠檬酸、丙酮酸、琥珀酸和富马酸)来组装有益微生物。
根分泌物在豆科植物与根瘤菌的共生关系中也起着重要作用。Sasse等[58]认为,植物遗传因素特别是根的形态和根系分泌物是形成根瘤菌的主因,宿主基因型、驯化和植物发育明显影响根瘤菌的组成。Wang等[59]证实,真菌内生菌Ph. liquidambars接种至花生,改变了花生的根分泌物酚酸、黄酮类化合物、有机酸和氨基酸的浓度,并诱导了根瘤菌的趋化行为;其中有机酸(柠檬酸和草酸)和氨基酸(谷氨酸和氨基酸)起了诱导作用,甘氨酸和谷氨酰胺在较高浓度下可促进根瘤菌生长和生物膜形成:根分泌物的改变有助于Ph. liquidambaris介导的花生根瘤菌结瘤增强。
此外,根系代谢产物和根际微生物群落的共生结合也是植物克服重金属胁迫、养分胁迫的关键适应机制,即拮抗作用以减轻环境胁迫带来的生长不良影响[3–4,60];或通过改变根际土壤中细菌、真菌的种群数量及其群落结构所营造的根际微生态环境,以促进有机氯降解而缓解外源毒性[61]。
4 根系分泌物对土壤酶活性的影响土壤酶是由生物体(包括土壤微生物、土壤动物、部分植物)产生的、具有高度催化作用的一类蛋白质,参与了土壤的发生、发育以及土壤肥力的形成和演化的全过程。不同酶活性可以反映微生物对土壤中不同底物的分解强度[62],常被作为表征SOM中碳、氮分解的敏感指标[63]。
由于大量输入易降解的低分子量有机物,即根系分泌物,微生物在根际更活跃,产生更多的酶[64]。在大多数植物中,低分子量有机物的主要形式是糖、氨基酸和羧酸[65],所以根际微生物活性取决于根系分泌物的组成,特别是糖、羧酸和氨基酸的比例,其同样也影响土壤酶的活性。Zhang等[66]采用特殊的方法模拟根系分泌物释放对分别含有碳、氮、磷、硫元素的5种微生物酶的影响,即含碳的β-葡糖苷酶和纤维二糖水解酶、含氮的亮氨酸氨基肽酶、含磷的磷酸酶和含硫的硫酸酯酶,发现含磷、含氮和含硫相关酶活性在人工根附近较高,随着离根距离的增加而逐渐降低;碳循环酶的形态是均匀的,与根系分泌物的组成无关;磷酸酶是对根系分泌物成分最敏感的酶,任何影响根系分泌物成分的因素都会对磷循环产生强烈的影响。司鹏等[67]同样证实小分子有机物(葡萄糖、甘油和甘氨酸)对土壤酶活性和土壤微生物的影响,发现葡萄糖对土壤过氧化氢酶活性影响显著高于对照、甘油和甘氨酸处理,而对碱性磷酸酶活性影响显著低于其他处理;且不同种类的小分子有机物对土壤酶活性的影响各不相同。张亮等[68]研究发现,半夏块茎提取液显著降低细菌和放线菌数量,显著降低土壤微生物群落的多样性、均匀性和优势度指数,而对土壤酶活性的影响表现出多样性,如提高蔗糖酶活性,降低脲酶和磷酸酶活性等。因此,根系分泌物可能改变土壤微生物种群结构,改变土壤酶活性,其中的化感物质甚至会造成连作障碍等。
Wang等[69]发现,不同林分密度下杉木人工林中土壤因子的变化可导致表层(0 ~ 20 cm)土壤酶活性及真菌群落丰富度和多样性的变化,而微生物和胞外酶对土壤有机碳随林龄变化较为敏感,5月和9月土壤有机碳组分、酶活性和微生物活性均高于1月,应是根系分泌物在土壤微环境中起了关键的调节作用。王小平等[70]通过原位收集连香树根系分泌物的方式,同样证实连香树根系分泌物碳和氮分泌速率夏季最高,冬季最低,根际土壤微生物碳、氮及土壤酶活性显著高于非根际,根系分泌物输入是驱动根际微生物活性的重要因子。与纯樟子松林相比,樟子松杨树混交林分下樟子松根系分泌物使土壤有机碳、氮磷钾、土壤酶活性和土壤微生物数量均得以显著提升[71]。
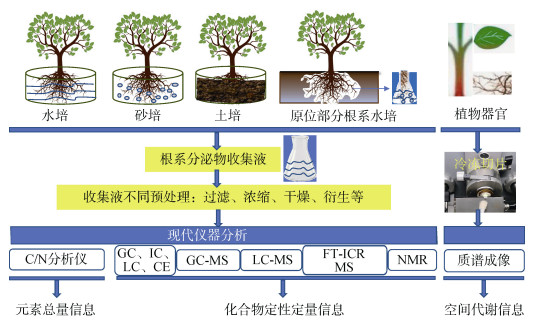
5 根系分泌物解析技术进展根系分泌物取样多采用实验室砂培、水培、土培植物收集[2,72–73],因这3种方式容易实现,故应用广泛。原位收集[25,73]通常是将原位挖出的部分根系放入合适的容器中进行水培而获得,因野外实施难度较大,对根系要求较高,故应用较少。但原位收集更能体现根系分泌物的实际代谢过程,所以多用于较大型木本植物的根系分泌物收集。
根系分泌物中发现的化合物已证实了植物与环境之间的相互作用[74]。但根系分泌物解析过程复杂,挑战性极强,极大程度依赖于分析技术的发展。早期,对根系分泌物中总糖、有机酸等的分析主要依赖于分光光度法和滴定法,代谢物碳、氮等的分析则依赖于C/N分析仪、流动分析仪等,表征总量信息[27,72]。目前,随着色谱、质谱等仪器的快速发展,收集到的分泌物经合适的方式进行富集或浓缩等预处理,可由GC (气相色谱仪)、GC-MS (气相色谱–质谱联用仪)[72–73]、HPLC (液相色谱仪)[9,73]、IC (离子色谱仪)[65]、CE (毛细管电泳仪)[5]、LC-MS (液相色谱–质谱仪)[26,75]、NMR (核磁共振波谱仪)、FT-ICR MS (傅立叶变换–离子回旋共振质谱仪)等进行分析,由此可获得准确的多种代谢物信息。随着空间代谢组学研究的发展,近几年质谱成像系统已用于植物中代谢物空间分析,如对根进行分析,可发现根横切面上特异性代谢物的分泌位置;对茎、叶等不同部位进行质谱成像分析,可发现特异性代谢物的主要富集部位,结合LC-MS、FT-ICR MS等仪器解析结果,可为植物中代谢物合成、运输和积累提供信息[76–77]。以上结果与土壤特性、微生物类群分析等综合考量后,可揭示根系分泌物中特征物质在根际土壤生态环境中的调控作用,或与其他生物间的相互影响,为实际生产提供理论与实践性支撑。图 1为根系分泌物解析技术参考图。
|
图 1 根系分泌物解析技术参考图 Fig. 1 Reference for analytical technique of root exudates |
以杉木的根系分泌物研究为例,学者们采用GC、GC-MS、HPLC、LC-MS等对杉木的根系分泌物、林下土壤或枝体提取物进行了分析,确认了环境或营养胁迫下根系分泌物组成特征[78–80]。熊德成等[81]在LC-TOFMS (液相色谱–飞行时间质谱联用仪)帮助下具体分析了杉木的根系分泌物成分,发现增温后杉木细根分泌物的抗逆境物质明显增加,如用于抵御干旱环境的脱落酸、氨基酸类物质(胱氨酸)及酚酸类物质(山奈酚);用于活化土壤矿质养分的相关物质分泌也显著增加,如柠檬酸、肉桂酸;有利于植物对抗外界伤害和病原菌侵染的一些物质也会增加,如茉莉酸、水杨酸及黄酮类物质(槲皮黄酮):证实植物在遭受根际高温胁迫时会分泌一些特定的物质以有利于抵御环境的变化。环二肽是学者采用2D-NMR (二维–核磁共振波谱仪)和质谱技术在杉木凋落物、根系分泌物和连作土壤中发现的一种化感物质,并经证实其影响了相应的微生物群落组成,积累了潜在致病性真菌,阻碍了杉木根系的生长;而从杉木林下土壤中检测到的酚酸类物质在自然浓度下并没有抑制杉木幼苗的生长,反而有促进作用[82–83]。这些都为杉木的连栽障碍管控提供了宝贵的理论依据。
6 研究展望在全球范围内,环境因素对微生物多样性的影响大于植物多样性,但在局域内,植物多样性越高,凋落物和根系分泌物的差异越大,土壤微生物群落多样性就越高,植物代谢产物是影响微生物群落的重要因素[84]。因此,在土壤这个“黑箱子”中,急需分析和识别多种根系化学信号物质[4],识别地下生物相互作用中最重要的化学特征,在此特征基础上,探究代谢物对植物根际土壤生物学性质的影响机制。而实现这些目标的根本在于对根系分泌物的精准解析,更依赖于分泌物解析技术的发展,笔者认为主要需从3个方面切入,一是寻找最能代表植物根系真实代谢过程的根系分泌物收集方法,且须涵盖草本类植物;二是确认可通用的精准的代谢物联合分析技术;三是揭示根系信号物质[4]在土壤生态环境中对种间、生物间的相互影响与调控途径,以达到为相关行业生产管控提供技术支撑。
| [1] |
周健民, 沈仁芳. 土壤学大辞典[Z]. 北京: 科学出版社, 2013.
(  0) 0) |
| [2] |
刘芷宇, 李良谟, 施卫明. 根际研究法[M].
江苏科学技术出版社, 南京, 1997
(  0) 0) |
| [3] |
徐炜杰, 郭佳, 赵敏, 等. 重金属污染土壤植物根系分泌物研究进展[J]. 浙江农林大学学报, 2017, 34(6): 1137-1148 (  0) 0) |
| [4] |
赵宽, 周葆华, 马万征, 等. 不同环境胁迫对根系分泌有机酸的影响研究进展[J]. 土壤, 2016, 48(2): 235-240 DOI:10.13758/j.cnki.tr.2016.02.004 (  0) 0) |
| [5] |
陆玉芳, 施卫明. 根际化学信号物质与土壤养分转化[J]. 生物技术通报, 2020, 36(9): 14-24 DOI:10.13560/j.cnki.biotech.bull.1985.2020-0703 (  0) 0) |
| [6] |
陆玉芳, 施卫明. 生物硝化抑制剂的研究进展及其农业应用前景[J]. 土壤学报, 2021, 58(3): 545-557 (  0) 0) |
| [7] |
Subbarao G V, Nakahara K, Ishikawa T, et al. Biological nitrification inhibition (BNI) activity in sorghum and its characterization[J]. Plant and Soil, 2013, 366(1): 243-259 (  0) 0) |
| [8] |
Zakir H A K M, Subbarao G V, Pearse S J, et al. Detection, isolation and characterization of a root-exuded compound, methyl 3-(4-hydroxyphenyl) propionate, responsible for biological nitrification inhibition by Sorghum (Sorghum bicolor)[J]. The New Phytologist, 2008, 180(2): 442-451 DOI:10.1111/j.1469-8137.2008.02576.x (  0) 0) |
| [9] |
Subbarao G V, Nakahara K, Hurtado M P, et al. Evidence for biological nitrification inhibition in Brachiaria pastures[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(41): 17302-17307 DOI:10.1073/pnas.0903694106 (  0) 0) |
| [10] |
Zhao S C, Li K J, Zhou W, et al. Changes in soil microbial community, enzyme activities and organic matter fractions under long-term straw return in north-central China[J]. Agriculture, Ecosystems & Environment, 2016, 216: 82-88 (  0) 0) |
| [11] |
Bellamy P H, Loveland P J, Bradley R I, et al. Carbon losses from all soils across England and Wales 1978–2003[J]. Nature, 2005, 437(7056): 245-248 DOI:10.1038/nature04038 (  0) 0) |
| [12] |
Nardi S, Concheri G, Pizzeghello D, et al. Soil organic matter mobilization by root exudates[J]. Chemosphere, 2000, 41(5): 653-658 DOI:10.1016/S0045-6535(99)00488-9 (  0) 0) |
| [13] |
Piccolo A, Nardi S, Concheri G. Macromolecular changes of humic substances induced by interaction with organic acids[J]. European Journal of Soil Science, 1996, 47(3): 319-328 DOI:10.1111/j.1365-2389.1996.tb01405.x (  0) 0) |
| [14] |
Piccolo A, Nardi S, Concheri G. Micelle-1ike conformation of humic substances as revealed by size exclusion chromatography[J]. Chemosphere, 1996, 33(4): 595-602 DOI:10.1016/0045-6535(96)00210-X (  0) 0) |
| [15] |
Nardi S, Sessi E, Pizzeghello D, et al. Biological activity of soil organic matter mobilized by root exudates[J]. Chemosphere, 2002, 46(7): 1075-1081 DOI:10.1016/S0045-6535(01)00160-6 (  0) 0) |
| [16] |
Wang Q T, Yuan Y S, Zhang Z L, et al. Exudate components mediate soil C dynamic through different priming mechanisms in forest soils[J]. Applied Soil Ecology, 2021, 160: 103855 DOI:10.1016/j.apsoil.2020.103855 (  0) 0) |
| [17] |
Kemmitt S J, Lanyon C V, Waite I S, et al. Mineralization of native soil organic matter is not regulated by the size, activity or composition of the soil microbial biomass—a new perspective[J]. Soil Biology and Biochemistry, 2008, 40(1): 61-73 DOI:10.1016/j.soilbio.2007.06.021 (  0) 0) |
| [18] |
Jackson L E, Burger M, Cavagnaro T R. Roots, nitrogen transformations, and ecosystem services[J]. Annual Review of Plant Biology, 2008, 59: 341-363 DOI:10.1146/annurev.arplant.59.032607.092932 (  0) 0) |
| [19] |
Cheng W X, Parton W J, Gonzalez-Meler M A, et al. Synthesis and modeling perspectives of rhizosphere priming[J]. The New Phytologist, 2014, 201(1): 31-44 DOI:10.1111/nph.12440 (  0) 0) |
| [20] |
Rillig M C, Caldwell B A, Wösten H A B, et al. Role of proteins in soil carbon and nitrogen storage: Controls on persistence[J]. Biogeochemistry, 2007, 85(1): 25-44 DOI:10.1007/s10533-007-9102-6 (  0) 0) |
| [21] |
Majuakim L, Kitayama K. Influence of polyphenols on soil nitrogen mineralization through the formation of bound protein in tropical montane forests of Mount Kinabalu, Borneo[J]. Soil Biology and Biochemistry, 2013, 57: 14-21 DOI:10.1016/j.soilbio.2012.07.008 (  0) 0) |
| [22] |
Phillips R P, Meier I C, Bernhardt E S, et al. Roots and fungi accelerate carbon and nitrogen cycling in forests exposed to elevated CO2[J]. Ecology Letters, 2012, 15(9): 1042-1049 DOI:10.1111/j.1461-0248.2012.01827.x (  0) 0) |
| [23] |
Kuzyakov Y, Xu X L. Competition between roots and microorganisms for nitrogen: Mechanisms and ecological relevance[J]. The New Phytologist, 2013, 198(3): 656-669 DOI:10.1111/nph.12235 (  0) 0) |
| [24] |
Meier I C, Finzi A C, Phillips R P. Root exudates increase N availability by stimulating microbial turnover of fast-cycling N pools[J]. Soil Biology and Biochemistry, 2017, 106: 119-128 DOI:10.1016/j.soilbio.2016.12.004 (  0) 0) |
| [25] |
Yin H J, Wheeler E, Phillips R P. Root-induced changes in nutrient cycling in forests depend on exudation rates[J]. Soil Biology and Biochemistry, 2014, 78: 213-221 DOI:10.1016/j.soilbio.2014.07.022 (  0) 0) |
| [26] |
Lu Y F, Zhang X N, Jiang J F, et al. Effects of the biological nitrification inhibitor 1, 9-decanediol on nitrification and ammonia oxidizers in three agricultural soils[J]. Soil Biology and Biochemistry, 2019, 129: 48-59 DOI:10.1016/j.soilbio.2018.11.008 (  0) 0) |
| [27] |
Strickland M S, Wickings K, Bradford M A. The fate of glucose, a low molecular weight compound of root exudates, in the belowground foodweb of forests and pastures[J]. Soil Biology and Biochemistry, 2012, 49: 23-29 DOI:10.1016/j.soilbio.2012.02.001 (  0) 0) |
| [28] |
Hao C K, Dungait J A J, Wei X M, et al. Maize root exudate composition alters rhizosphere bacterial community to control hotspots of hydrolase activity in response to nitrogen supply[J]. Soil Biology and Biochemistry, 2022, 170: 108717 DOI:10.1016/j.soilbio.2022.108717 (  0) 0) |
| [29] |
Liu Y, Evans S E, Friesen M L, et al. Root exudates shift how N mineralization and N fixation contribute to the plant-available N supply in low fertility soils[J]. Soil Biology and Biochemistry, 2022, 165: 108541 DOI:10.1016/j.soilbio.2021.108541 (  0) 0) |
| [30] |
Wardle D A, Walker L R, Bardgett R D. Ecosystem properties and forest decline in contrasting long-term chronosequences[J]. Science, 2004, 305(5683): 509-513 DOI:10.1126/science.1098778 (  0) 0) |
| [31] |
Spohn M, Ermak A, Kuzyakov Y. Microbial gross organic phosphorus mineralization can be stimulated by root exudates–A 33P isotopic dilution study[J]. Soil Biology and Biochemistry, 2013, 65: 254-263 DOI:10.1016/j.soilbio.2013.05.028 (  0) 0) |
| [32] |
Zhang L, Feng G, Declerck S. Signal beyond nutrient, fructose, exuded by an arbuscular mycorrhizal fungus triggers phytate mineralization by a phosphate solubilizing bacterium[J]. The ISME Journal, 2018, 12(10): 2339-2351 DOI:10.1038/s41396-018-0171-4 (  0) 0) |
| [33] |
Dinkelaker B, Romheld V, Marschner H. Citric acid excretion and precipitation of calcium citrate in the rhizosphere of white lupin (Lupinus albus L.)[J]. Plant, Cell and Environment, 1989, 12(3): 285-292 DOI:10.1111/j.1365-3040.1989.tb01942.x (  0) 0) |
| [34] |
Zhu H, Bing H J, Wu Y H, et al. Low molecular weight organic acids regulate soil phosphorus availability in the soils of subalpine forests, eastern Tibetan Plateau[J]. CATENA, 2021, 203: 105328 DOI:10.1016/j.catena.2021.105328 (  0) 0) |
| [35] |
van Hees P A W, Jones D L, Finlay R, et al. The carbon we do not see—The impact of low molecular weight compounds on carbon dynamics and respiration in forest soils: A review[J]. Soil Biology and Biochemistry, 2005, 37(1): 1-13 DOI:10.1016/j.soilbio.2004.06.010 (  0) 0) |
| [36] |
Boddy E, Hill P W, Farrar J, et al. Fast turnover of low molecular weight components of the dissolved organic carbon pool of temperate grassland field soils[J]. Soil Biology and Biochemistry, 2007, 39(4): 827-835 DOI:10.1016/j.soilbio.2006.09.030 (  0) 0) |
| [37] |
Laanbroek H J. Methane emission from natural wetlands: Interplay between emergent macrophytes and soil microbial processes. A mini-review[J]. Annals of Botany, 2010, 105(1): 141-153 DOI:10.1093/aob/mcp201 (  0) 0) |
| [38] |
Girkin N T, Turner B L, Ostle N, et al. Root exudate analogues accelerate CO2 and CH4 production in tropical peat[J]. Soil Biology and Biochemistry, 2018, 117: 48-55 DOI:10.1016/j.soilbio.2017.11.008 (  0) 0) |
| [39] |
Liu Y H, Shahbaz M, Ge T D, et al. Effects of root exudate stoichiometry on CO2 emission from paddy soil[J]. European Journal of Soil Biology, 2020, 101: 103247 DOI:10.1016/j.ejsobi.2020.103247 (  0) 0) |
| [40] |
庄姗, 林伟, 丁军军, 等. 不同根系分泌物对土壤N2O排放及同位素特征值的影响[J]. 中国农业科学, 2020, 53(9): 1860-1873 (  0) 0) |
| [41] |
Urbanová M, Šnajdr J, Baldrian P. Composition of fungal and bacterial communities in forest litter and soil is largely determined by dominant trees[J]. Soil Biology and Biochemistry, 2015, 84: 53-64 DOI:10.1016/j.soilbio.2015.02.011 (  0) 0) |
| [42] |
Gartzia-Bengoetxea N, Kandeler E, Martínez de Arano I, et al. Soil microbial functional activity is governed by a combination of tree species composition and soil properties in temperate forests[J]. Applied Soil Ecology, 2016, 100: 57-64 DOI:10.1016/j.apsoil.2015.11.013 (  0) 0) |
| [43] |
Shi S J, Richardson A E, O'Callaghan M, et al. Effects of selected root exudate components on soil bacterial communities[J]. FEMS Microbiology Ecology, 2011, 77(3): 600-610 DOI:10.1111/j.1574-6941.2011.01150.x (  0) 0) |
| [44] |
Kong C H, Chen L C, Xu X H, et al. Allelochemicals and activities in a replanted Chinese fir (Cunninghamia lanceolata (Lamb.) Hook) tree ecosystem[J]. Journal of Agricultural and Food Chemistry, 2008, 56(24): 11734-11739 DOI:10.1021/jf802666p (  0) 0) |
| [45] |
Fernandez M, Malagoli P, Gallet C, et al. Investigating the role of root exudates in the interaction between oak seedlings and purple moor grass in temperate forest[J]. Forest Ecology and Management, 2021, 491: 119175 DOI:10.1016/j.foreco.2021.119175 (  0) 0) |
| [46] |
Xia Z C, Yu L, He Y, et al. Broadleaf trees mediate chemically the growth of Chinese fir through root exudates[J]. Biology and Fertility of Soils, 2019, 55(7): 737-749 DOI:10.1007/s00374-019-01389-0 (  0) 0) |
| [47] |
Vyvyan J R. Allelochemicals as leads for new herbicides and agrochemicals[J]. Tetrahedron, 2002, 58(9): 1631-1646 DOI:10.1016/S0040-4020(02)00052-2 (  0) 0) |
| [48] |
Schmidt J E, Bowles T M, Gaudin A C M. Using ancient traits to convert soil health into crop yield: Impact of selection on maize root and rhizosphere function[J]. Frontiers in Plant Science, 2016, 7: 373 (  0) 0) |
| [49] |
Xun W B, Shao J H, Shen Q R, et al. Rhizosphere microbiome: Functional compensatory assembly for plant fitness[J]. Computational and Structural Biotechnology Journal, 2021, 19: 5487-5493 DOI:10.1016/j.csbj.2021.09.035 (  0) 0) |
| [50] |
Chaparro J M, Badri D V, Vivanco J M. Rhizosphere microbiome assemblage is affected by plant development[J]. The ISME Journal, 2014, 8(4): 790-803 DOI:10.1038/ismej.2013.196 (  0) 0) |
| [51] |
Schreiter S, Ding G C, Heuer H, et al. Effect of the soil type on the microbiome in the rhizosphere of field-grown lettuce[J]. Frontiers in Microbiology, 2014, 5: 144 (  0) 0) |
| [52] |
Liu J L, Ha V N, Shen Z, et al. Response of the rhizosphere microbial community to fine root and soil parameters following Robinia pseudoacacia L. afforestation[J]. Applied Soil Ecology, 2018, 132: 11-19 DOI:10.1016/j.apsoil.2018.08.004 (  0) 0) |
| [53] |
Mehmood A, Hussain A, Irshad M, et al. Cinnamic acid as an inhibitor of growth, flavonoids exudation and endophytic fungus colonization in maize root[J]. Plant Physiology and Biochemistry, 2019, 135: 61-68 DOI:10.1016/j.plaphy.2018.11.029 (  0) 0) |
| [54] |
Yuan J, Wu Y C, Zhao M L, et al. Effect of phenolic acids from banana root exudates on root colonization and pathogen suppressive properties of Bacillus amyloliquefaciens NJN-6[J]. Biological Control, 2018, 125: 131-137 DOI:10.1016/j.biocontrol.2018.05.016 (  0) 0) |
| [55] |
Shi S J, Herman D J, He Z L, et al. Plant roots alter microbial functional genes supporting root litter decomposition[J]. Soil Biology and Biochemistry, 2018, 127: 90-99 DOI:10.1016/j.soilbio.2018.09.013 (  0) 0) |
| [56] |
Huang A C, Jiang T, Liu Y X, et al. A specialized metabolic network selectively modulates Arabidopsis root microbiota[J]. Science, 2019, 364(6440): eaau6389 DOI:10.1126/science.aau6389 (  0) 0) |
| [57] |
Wen T, Yuan J, He X M, et al. Enrichment of beneficial cucumber rhizosphere microbes mediated by organic acid secretion[J]. Horticulture Research, 2020, 7: 154 DOI:10.1038/s41438-020-00380-3 (  0) 0) |
| [58] |
Sasse J, Martinoia E, Northen T. Feed your friends: Do plant exudates shape the root microbiome?[J]. Trends in Plant Science, 2018, 23(1): 25-41 DOI:10.1016/j.tplants.2017.09.003 (  0) 0) |
| [59] |
Wang H W, Ma C Y, Xu F J, et al. Root endophyte- enhanced peanut-rhizobia interaction is associated with regulation of root exudates[J]. Microbiological Research, 2021, 250: 126765 DOI:10.1016/j.micres.2021.126765 (  0) 0) |
| [60] |
Kalu C M, Oduor Ogola H J, Selvarajan R, et al. Fungal and metabolome diversity of the rhizosphere and endosphere of Phragmites australis in an AMD-polluted environment[J]. Heliyon, 2021, 7(3): e06399 DOI:10.1016/j.heliyon.2021.e06399 (  0) 0) |
| [61] |
潘声旺, 雷志华, 吴云霄, 等. 根系分泌物在有机氯农药残留降解过程中的作用[J]. 云南大学学报(自然科学版), 2017, 39(4): 669-676 (  0) 0) |
| [62] |
Cusack D F, Silver W L, Torn M S, et al. Changes in microbial community characteristics and soil organic matter with nitrogen additions in two tropical forests[J]. Ecology, 2011, 92(3): 621-632 DOI:10.1890/10-0459.1 (  0) 0) |
| [63] |
Burns R G, DeForest J L, Marxsen J, et al. Soil enzymes in a changing environment: Current knowledge and future directions[J]. Soil Biology and Biochemistry, 2013, 58: 216-234 DOI:10.1016/j.soilbio.2012.11.009 (  0) 0) |
| [64] |
Dennis P G, Miller A J, Hirsch P R. Are root exudates more important than other sources of rhizodeposits in structuring rhizosphere bacterial communities?[J]. FEMS Microbiology Ecology, 2010, 72(3): 313-327 DOI:10.1111/j.1574-6941.2010.00860.x (  0) 0) |
| [65] |
Oburger E, Jones D L. Sampling root exudates–mission impossible?[J]. Rhizosphere, 2018, 6: 116-133 DOI:10.1016/j.rhisph.2018.06.004 (  0) 0) |
| [66] |
Zhang X C, Dippold M A, Kuzyakov Y, et al. Spatial pattern of enzyme activities depends on root exudate composition[J]. Soil Biology and Biochemistry, 2019, 133: 83-93 DOI:10.1016/j.soilbio.2019.02.010 (  0) 0) |
| [67] |
司鹏, 邵微, 于会丽, 等. 小分子有机物对土壤酶活性及微生物多样性的影响[J]. 中国土壤与肥料, 2019(2): 75-82 (  0) 0) |
| [68] |
张亮, 夏文静, 周惠, 等. 半夏块茎提取液对土壤微生物和酶活性的影响[J]. 贵州师范大学学报(自然科学版), 2019, 37(2): 87-92 (  0) 0) |
| [69] |
Wang C Q, Xue L, Dong Y H, et al. Effects of stand density on soil microbial community composition and enzyme activities in subtropical Cunninghamia lanceolate (Lamb.) Hook plantations[J]. Forest Ecology and Management, 2021, 479: 118559 DOI:10.1016/j.foreco.2020.118559 (  0) 0) |
| [70] |
王小平, 肖肖, 唐天文, 等. 连香树人工林根系分泌物输入季节性变化及其驱动的根际微生物特性研究[J]. 植物研究, 2018, 38(1): 47-55 (  0) 0) |
| [71] |
李军, 赵彩平. 不同林分下樟子松根系分泌物对土壤环境及微生物的影响[J]. 山东农业大学学报(自然科学版), 2022, 53(3): 380-385 (  0) 0) |
| [72] |
Proctor C, He Y H. Quantifying root extracts and exudates of sedge and shrub in relation to root morphology[J]. Soil Biology and Biochemistry, 2017, 114: 168-180 DOI:10.1016/j.soilbio.2017.07.006 (  0) 0) |
| [73] |
Williams A, Langridge H, Straathof A L, et al. Comparing root exudate collection techniques: An improved hybrid method[J]. Soil Biology and Biochemistry, 2021, 161: 108391 DOI:10.1016/j.soilbio.2021.108391 (  0) 0) |
| [74] |
Lu H N, Sun J T, Zhu L Z. The role of artificial root exudate components in facilitating the degradation of pyrene in soil[J]. Scientific Reports, 2017, 7(1): 1-10 DOI:10.1038/s41598-016-0028-x (  0) 0) |
| [75] |
Bi B Y, Tong Q, Wan C Y, et al. Pinus sylvestris var. mongolica mediates interspecific belowground chemical interactions through root exudates[J]. Forest Ecology and Management, 2022, 511: 120158 DOI:10.1016/j.foreco.2022.120158 (  0) 0) |
| [76] |
Li S L, Zhu N L, Tang C P, et al. Differential distribution of characteristic constituents in root, stem and leaf tissues of Salvia miltiorrhiza using MALDI mass spectrometry imaging[J]. Fitoterapia, 2020, 146: 104679 DOI:10.1016/j.fitote.2020.104679 (  0) 0) |
| [77] |
Li B, Neumann E K, Ge J Y, et al. Interrogation of spatial metabolome of Ginkgo biloba with high-resolution matrix- assisted laser desorption/ionization and laser desorption/ ionization mass spectrometry imaging[J]. Plant, Cell & Environment, 2018, 41(11): 2693-2703 (  0) 0) |
| [78] |
张腾. 马尾松和杉木对植物的化感作用研究[D]. 杭州: 浙江大学, 2016.
(  0) 0) |
| [79] |
俞元春, 余健, 房莉, 等. 缺磷胁迫下马尾松和杉木苗根系有机酸的分泌[J]. 南京林业大学学报(自然科学版), 2007, 31(2): 9-12 (  0) 0) |
| [80] |
朱旭恒. 不同逆境胁迫对杉木幼苗生理指标及根系分泌物的影响[D]. 福州: 福建农林大学, 2009.
(  0) 0) |
| [81] |
熊德成, 黄锦学, 杨智杰, 等. 增温对杉木幼树细根分泌物的影响研究初报[J]. 亚热带资源与环境学报, 2016, 11(4): 85–88, 92 (  0) 0) |
| [82] |
Xia Z C, Kong C H, Chen L C, et al. Allelochemical- mediated soil microbial community in long-term monospecific Chinese fir forest plantations[J]. Applied Soil Ecology, 2015, 96: 52-59 DOI:10.1016/j.apsoil.2015.07.012 (  0) 0) |
| [83] |
Chen L C, Wang S L, Wang P, et al. Autoinhibition and soil allelochemical (cyclic dipeptide) levels in replanted Chinese fir (Cunninghamia lanceolata) plantations[J]. Plant and Soil, 2014, 374(1): 793-801 (  0) 0) |
| [84] |
黄龙, 包维楷, 李芳兰, 等. 土壤结构和植被对土壤微生物群落的影响[J]. 应用与环境生物学报, 2021, 27(6): 1725-1731 (  0) 0) |
2. Soil and Environment Analysis Center, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China
 2023, Vol. 55
2023, Vol. 55


