2. 中国科学院大学, 北京 100049
稻田土壤由于长期处于淹水状态,导致土壤溶解氧含量极低,因此大量好氧过程被强烈抑制,同时缺氧致使土壤当中氧化还原电位降低,导致大量还原性物质浓度上升,进而毒害水稻根系[1]。淹水缺氧是稻田障碍因子之一,为了应对缺氧造成的不利影响,水稻根系形成通气组织向根外分泌释放氧气,在根际形成氧化圈来缓解水稻缺氧胁迫从而维持水稻正常生长。本课题组以往的研究发现,高产水稻品种通气组织发育比低产品种更加完善,表现为高产品种根孔隙度(表征通气组织发育程度)显著高于低产品种,能够为根系提供更充足的氧气供应,进而促进根系生长。高产品种由于根系发达,通气组织发育更加完善,径向泌氧量更大,根际土壤氧气含量也相应较高[2]。通过进一步的研究发现,根际好氧环境能够有效地促进水稻根表和根际土壤硝化作用,使得根际硝态氮含量较高,从而水稻根吸收硝态氮的量也高。由于水稻对硝态氮吸收量的差异最终可能导致水稻生长及氮素利用率的差异[3]。基于以上研究,水稻形成通气组织一方面可以形成根际氧化圈缓解淹水造成的氧胁迫,另一方面也可以影响微生物介导的根际养分形态转化过程,如从铵态氮到硝态氮的转化。因此,水稻根系泌氧及根际硝化作用与水稻生长和氮素营养应该是密切相关的。孔妤等[4]的研究表明,乙烯利可有效刺激水稻幼苗通气组织发育,且随浓度的升高其促进效果更加显著。Yamauchi等[5]在对小麦幼苗抵御低氧胁迫的研究中发现,乙烯和活性氧参与了小麦幼苗通气组织的发育,同时提高了其对缺氧条件的适应能力。有研究发现水稻接种内生真菌枫香拟茎点霉(Phomopsis liquidambari)后,通过促进通气组织信号物质乙烯的生物合成,刺激水稻根系通气组织形成及根系发育,提高了水稻在淹水条件下的产量[6]。这些研究结果表明,可以通过人为调控水稻根系通气组织发育从而改善根际氧环境并最终促进水稻生长及提高氮素吸收,但根系通气组织发育程度与水稻苗期生长及氮素吸收之间的定量关系尚未见报道。
目前对于定量化刺激剂对促进水稻根系通气组织发育程度的相关研究相对较少,因此本研究对于刺激剂的筛选原则主要为:①目前已报道的能够促进水稻根系通气组织发育或提高泌氧能力的刺激剂;②可有效提高水稻根际环境中氧化还原电位的刺激剂。参照上述通气组织发育刺激剂筛选原则,同时考虑刺激剂的易获取性等因素,本研究选择硝普钠、亚硒酸钠和硫氢化钠为试验使用的通气组织刺激剂。硝普钠为NO供体,通过增加水稻的抗氧化物含量或抗氧化物酶活性来增强水稻抗氧化能力,同时能够关闭植物气孔来降低蒸腾作用[7];亚硒酸钠为硒供体,可以显著提高水稻根际氧含量,促进根表铁膜的生成[8];而硫氢化钠作为硫供体,其添加量与水稻根系通气组织的发育程度呈正相关[9]。本研究拟通过外源添加不同种类及不同浓度刺激剂调控通气组织发育,从而定量化阐明根系通气组织发育程度对水稻生长及氮素吸收的影响。
1 材料与方法 1.1 试验材料供试水稻(Oryza sativa L.)武育粳3号为常规粳稻品种,购于江苏省常州市武进区农业科学研究所。
1.2 试验设计试验于中国科学院南京土壤研究所光照培养室中进行,昼夜温度为28 ℃/25 ℃,湿度为65%,每日光照14 h。试验采用水培方式,每3 d更换一次营养液。营养液选用Kimura B,主要成分(mmol/L)为:0.5 (NH4)2SO4,0.18 KH2PO4,0.54 MgSO4·7H2O,0.18 KCl,0.25 Ca(NO3)2·4H2O,0.11 CaCl2·2H2O,4×10–4 CuSO4·5H2O,1×10–3 MnCl2·4H2O,8×10–3 ZnSO4·7H2O,6×10–3 H3BO3,2×10–3 (NH4)6Mo7O24·4H2O,0.08 Na2EDTA-Fe。营养液pH为5.8,同时添加0.1 g/L MES作为pH缓冲液。试验用塑料盆内径11 cm,高11 cm,每盆装营养液1 kg,种植水稻4株。稻种用10% H2O2消毒30 min,蒸馏水冲洗后浸泡24 h。在装有0.5 mmol/L CaCl2溶液的周转箱上固定漂浮的网筛,并将种子平铺于其上,置于黑暗条件下催芽。催芽3 d后将萌发的种子置于1/2浓度的Kimura B营养液中于弱光下(荧光灯,100 µmol/(m2·s))培养一周。培养至第2周后,开始使用全量浓度的Kimura B营养液。为避免通气对试验结果的干扰,整个培养期间无任何增氧措施。
试验设置10个处理:不添加刺激剂(CK)、硝普钠(A)、亚硒酸钠(B)、硫氢化钠(C),A、B、C处理分别设置低、中、高3个浓度梯度(表 1)。每个处理设3个重复,随机排列。
|
|
表 1 不同处理对应的刺激剂及其浓度 Table 1 Stimulants and their concentrations corresponding to different treatments |
当水稻生长至第30天时,每次更换营养液时添加刺激剂,并分别在水稻苗期生长第36天(采样期Ⅰ)和第42天(采样期Ⅱ)时进行采样,即刺激剂处理时长分别为6 d和12 d。在第36天更换营养液前,测定营养液pH,更换营养液12 h后,测定营养液溶解氧含量。测定完成后,将每盆水稻洗净后随机选取其中2株置于烘箱中105 ℃下杀青30 min,70 ℃烘干后称量干物质量,粉碎后用作氮含量分析测定。再将其余水稻根洗净后分析测定根系形态指标,然后选取新生根进行根系孔隙度测定以及根通气组织电镜观测切片。采样期Ⅱ与采样期Ⅰ样品采集步骤相同。由于营养液每3 d更换一次,且水稻根系本身对于根际氧含量及pH均有影响,因此本试验没有测定刺激剂本身对于营养液氧含量及pH的影响。
1.4 样品分析水稻生物量的测定采用烘干称重法。利用WinRHIZO根系分析系统(Regent Instruments Inc,Canada)扫描分析根系样品,测定采样期Ⅱ根系指标。选取根系长度均为4 ~ 6 cm的新生根,按照常规方法制作水稻根系冷冻切片,用冷冻切片机(Thermo NX70)进行切片(厚度45 μm),切片位置在距根尖20 ~ 30 mm处,荧光显微镜(Nikon Ti-S)观察采样期Ⅱ根系通气组织发育程度并拍照。地上部及根系氮含量的测定采用钒钼黄比色法(H2SO4-H2O2消煮)。营养液溶解氧浓度采用丹麦Unisense微电极原位测定系统(OX50,ø=40 ~ 60 μm)测定。采用pH计(plus FE28)测定营养液pH。水稻根孔隙度(porosity of root,POR)测定参照并改进Kludze等[10]的方法:将水稻根用去离子水冲洗干净后,用吸水纸将其表面水分彻底吸干;选取新长出的水稻根,并将每条根切成2 ~ 2.5 cm小段之后备用;将50 mL比重瓶装满抽真空24 h的去离子水后称重,称取0.5 g左右的根,置于装满水的比重瓶中后,称重;将装入根的比重瓶抽真空2 h后,将根取出并置于干燥的研钵中研磨至糊状;将研磨好的根重新放入比重瓶中并称重。POR计算公式如下:
| $ \operatorname{POR}(\%)=[(P g r-P r) /(r+P-P r)] \times 100 $ |
式中:POR为根孔隙度(%),Pgr为研磨后的根和装满水的比重瓶的总重量(g),Pr为未经研磨的根和装满水的比重瓶的总重量(g),r为根重(g),P为充满水的比重瓶重量(g)。
1.5 数据处理所有数据采用SPSS 26.0进行方差分析(ANOVA),LSD法比较处理间的差异显著性。图表绘制采用Origin 2022软件。
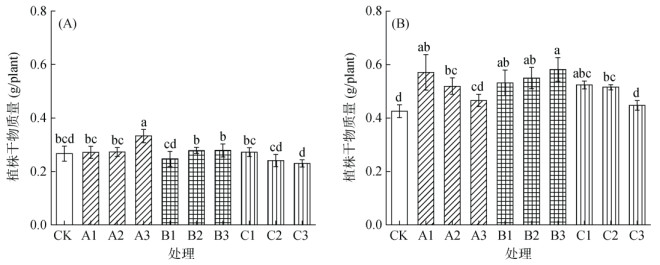
2 结果与分析 2.1 不同种类刺激剂对水稻生长发育的影响不同种类刺激剂对整株水稻生长发育影响存在差异,且存在浓度依赖性,即同一刺激剂在不同浓度条件下对水稻生物量影响显示出不同的变化趋势。采样期Ⅰ(36 d)时,由于水稻植株较小且对刺激剂的响应时间相对较短(刺激时长6 d),仅高浓度硝普钠处理水稻生物量与CK处理相比显著增加,其余处理均与CK无显著性差异(图 1A)。采样期Ⅱ(42 d)时,不同种类刺激剂对水稻生长发育均有促进作用,且亚硒酸钠处理显示出随添加浓度增加促生作用更强,而硝普钠和硫氢化钠则显示出相反趋势(图 1B)。与CK相比,不同浓度亚硒酸钠处理均表现出生物量显著增加,而高浓度硝普钠和硫氢化钠处理则无显著性差异。所有处理中高浓度亚硒酸钠处理效果最佳,低浓度硝普钠处理次之。高浓度亚硒酸钠处理的水稻生物量比CK增加36.7%,而低浓度硝普钠处理的水稻生物量增加了34.1%(图 1B)。
|
(图中小写字母不同表示同一采样期不同处理间差异显著(P < 0.05),下同) 图 1 不同种类刺激剂对水稻在采样期Ⅰ(A)和采样期Ⅱ(B)时植株干物质量的影响 Fig. 1 Effects of different stimulants on rice dry weights during sampling periods I (A) and II (B) |
由表 2所示,采样期Ⅱ时,不同种类通气组织刺激剂均可有效促进水稻根系外部形态结构发育,其中亚硒酸钠对提高水稻根系外部形态发育的效果最明显。与CK相比,高浓度亚硒酸钠处理的根物质量、总根长、根表面积、根直径、根体积和根尖数分别增加了69.5%、62.4%、48.9%、10.9%、53.3% 和79.7%。同时,高浓度的硝普钠和硫氢化钠对水稻根系外部形态发育中的促进效果较低浓度有所下降,甚至在诸如根干物质量、总根长、根表面积、根体积及根尖数这些参数上出现抑制现象。与CK相比,高浓度硫氢化钠处理根干物质量、总根长、根表面积、根体积和根尖数分别降低6.10%、17.2%、27.6%、24.4% 和7.82%(表 2)。
|
|
表 2 不同种类刺激剂对水稻苗期根系外部形态发育的影响 Table 2 Effects of different stimulants on external morphological development of rice roots at seedling stage |
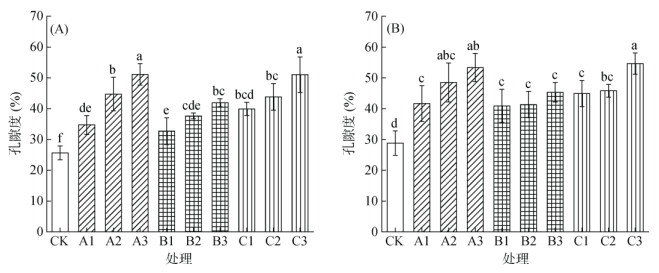
水稻根系孔隙度大小均随水稻生育期呈上升趋势,不添加刺激剂的水稻根系孔隙度在苗期大约维持在20% ~ 30% 的范围内(图 2)。采样期Ⅰ时,添加不同种类通气组织刺激剂处理与CK相比,孔隙度均已有显著促进作用,说明刺激剂能够有效促进水稻根系通气组织提早发育,且孔隙度随刺激剂添加量提高而增加(图 2A)。采样期Ⅱ时,孔隙度发育的促进效果与采样期Ⅰ相似,但随刺激剂浓度增加程度没有采样期Ⅰ那么明显。其中硝普钠和硫氢化钠对水稻通气组织发育的促进作用最明显,亚硒酸钠处理的促进作用次之。高浓度硝普钠处理相较于CK处理,其孔隙度显著增加了85.0%,而高浓度硫氢化钠处理相较于CK处理孔隙度显著增加了89.5%(图 2B)。
|
图 2 不同种类刺激剂对水稻在采样期Ⅰ(A)和采样期Ⅱ(B)时根系孔隙度的影响 Fig. 2 Effects of different stimulants on rice root porosity during sampling periods I (A) and II (B) |
根系通气组织切片结果与根孔隙度结果相一致,即孔隙度越大,根系通气组织(空腔)越发达。不同种类通气组织刺激剂添加后,水稻苗期(42 d)根系在距根尖20 ~ 30 mm处皮层薄壁细胞均出现不同程度崩溃离解现象,由残余细胞壁构成纵向薄壁将离解的薄壁细胞分隔成连接中柱和外皮层的气腔,形成类似车轮辐条状的辐射状通气组织,但不同刺激剂添加后对于根系通气组织刺激发育程度存在差异(图 3)。高浓度硝普钠和硫氢化钠处理后的水稻幼苗根系通气组织存在过度发育现象,可能是导致根系生长受到抑制(表 2)的主要原因。

|
图 3 不同种类刺激剂对水稻苗期根系通气组织结构发育的影响 Fig. 3 Effects of different stimulants on aerenchyma development of rice root at seedling stage |
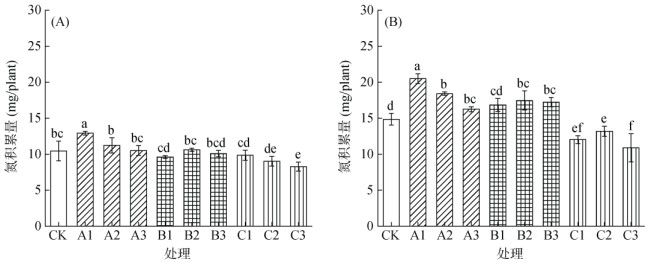
由图 4可以看出,采样期Ⅰ时,由于水稻较小,除低浓度硝普钠处理氮积累量显著高于CK,中浓度及高浓度硫氢化钠处理显著低于CK外,不同种类刺激剂对水稻氮积累量均无显著性影响(图 4A)。采样期Ⅱ时,硝普钠、亚硒酸钠对水稻氮素积累均有促进作用。其中低浓度硝普钠处理水稻氮积累促进效果最佳,水稻氮积累量与CK相比显著增加38.0%;亚硒酸钠对水稻氮积累同样具有促进效果,高浓度亚硒酸钠处理较CK显著增加16.1%。硫氢化钠处理对水稻苗期氮积累具有抑制作用,其中高浓度硫氢化钠处理较CK相比氮积累量显著下降26.6%(图 4B)。
|
图 4 不同种类刺激剂对水稻在采样期Ⅰ(A)和采样期Ⅱ(B)时氮素积累的影响 Fig. 4 Effects of different stimulants on rice nitrogen accumulation during sampling periods I (A) and II (B) |
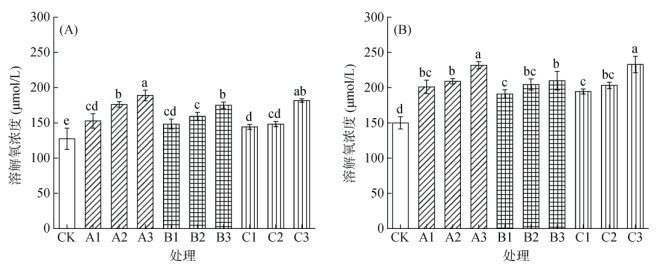
随着水稻的生长,其对根际氧环境的改善能力进一步提升。不同种类刺激剂添加后,均能显著提高营养液中的氧气含量,且随添加量增加而增加。采样期Ⅰ时,高浓度通气组织刺激剂硝普钠、亚硒酸钠和硫氢化钠处理营养液溶解氧浓度分别较CK处理增加48.4%、37.5% 和42.6%(图 5A);采样期Ⅱ时,营养液溶解氧浓度则分别提高54.5%、39.9% 和55.2% (图 5B)。本研究不同处理营养液的pH均无显著变化(图 6),即刺激剂添加改变根际营养吸收特性受根际环境酸碱度影响较小。
|
图 5 不同种类刺激剂对采样期Ⅰ(A)和采样期Ⅱ(B)时营养液溶解氧浓度的影响 Fig. 5 Effects of stimulants on dissolved oxygen contents in nutrient solutions during sampling period I (A) and II (B) |
|
图 6 不同种类刺激剂对采样期Ⅰ(A)和采样期Ⅱ(B)时营养液pH的影响 Fig. 6 Effects of stimulants on pH values in nutrient solution during sampling periods I (A) and II (B) |
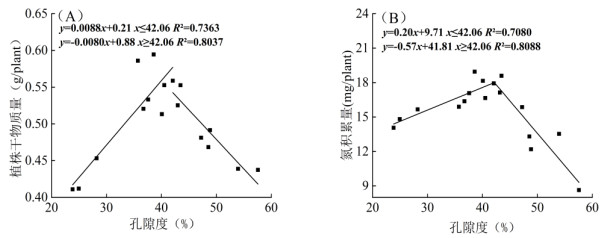
由于根系孔隙度可以有效表征水稻根系通气组织发育程度,利用线性回归分析以根系孔隙度为横坐标,水稻生物量及氮积累量为纵坐标分别进行双线性拟合(图 7)。结果显示:无论是生物量还是氮积累均与通气组织发育程度存在一个明显的突变阈值,即当孔隙度低于这一阈值时,生物量和氮积累量随孔隙度增加而增加,而当孔隙度高于阈值时,二者随孔隙度增加而迅速降低。从图 7A可以看出,水稻苗期时当孔隙度小于阈值(42%)时,随着孔隙度每增加1% 时,单株水稻生物量显著增加8.8 mg;而当孔隙度大于42% 时,植株干物质量迅速降低。从图 7B可以看出,当孔隙度小于阈值(42%)时,随着孔隙度每增加1% 时,单株水稻氮积累量增加0.2 mg;而当孔隙度大于42% 时,植株氮积累量迅速降低。综上,对于苗期水稻而言,通气组织并非越发达越好,而是存在一定的阈值范围。
|
图 7 水稻根孔隙度与生物量(A)和氮积累量(B)的关系 Fig. 7 Relationship between rice root porosity with biomass (A) and nitrogen accumulation (B) |
植物通气组织是植物薄壁组织中一些气室以及围绕气室的细胞集合。在缺氧条件下(如淹水),植物体内的一些细胞会死亡解体从而形成通气组织[11]。当植物根系完全被水淹没,根层土壤与大气间气体交换受到限制,根系氧气供应不足是淹水及过湿环境给植物带来的主要伤害[12–13]。湿地植物体内在长期进化过程中构成性地形成通气组织,为体内气体贮藏和运输创造了空间,氧气从植物茎端到根部的内部运输能够有效地缓解由淹水环境造成的缺氧伤害,维持湿地植物根系的正常生理代谢功能,通气组织按照其形成方式可分为裂生型与溶生型两种[14–15]。多数研究中涉及的水稻通气组织属于溶生型通气组织,源于一些活细胞的程序性死亡和溶解[11]。这些细胞程序性死亡过程是由植物的遗传特性所决定的,同时也受外部环境的影响。各种生物和非生物胁迫均能够影响溶生型通气组织的形成,如缺氧、高温、干旱或者某些营养元素的缺乏,乙烯、活性氧(ROS)、Ca2+等均参与调控通气组织的形成[16–17]。
以往衡量通气组织发达程度(大小)的方式主要有孔隙度、通气组织中空腔所占根系横切面积比例等,近期Yamauchi等人[18–19]认为根系中乙烯和ROS含量也与通气组织大小密切相关。本试验中,采用孔隙度来表征通气组织的大小。以往的研究表明,大麦根系孔隙度约为3.6%,玉米根系孔隙度约9.5%,红树林根系孔隙度约30.0%[20–21]。同时Li等[22]通过测定18种水生植物孔隙度发现不同植物间存在显著性差异,如铜钱草的孔隙度达到了63.5%,而皇冠草的孔隙度仅有8.2%。Colmer[23]利用盆栽试验研究了12种不同基因型水稻品种通气组织发育差异,发现旱稻、水稻和深水稻在低氧条件下均能形成通气组织,但孔隙度差异不显著,范围在31.2% ~ 40.8%。Mei等[24]测定了25种水稻品种在苗期时的孔隙度差异,发现其范围在21.3% ~ 33.3%。本研究发现,水稻在不添加刺激剂情况下,苗期根系孔隙度维持在20% ~ 30% (图 2),与前人结果一致。尽管本试验选择的3种刺激剂,只有硫氢化钠为前人报道过的通气组织刺激剂,而提高水稻抗氧化能力的硝普钠和提高根系泌氧的亚硒酸钠添加后,也均能显著增加水稻苗期根系孔隙度,且孔隙度随刺激剂添加量提高而增加(图 2)。因此说明3种刺激剂均具有促进水稻根系通气组织发育的作用。添加刺激剂后水稻苗期根系孔隙度范围扩大至32.7% ~ 54.6%,且能够有效促进水稻根系通气组织提早发育(图 2A)。
本课题组以往的研究发现,通气组织发育程度可表征水稻产量潜能,在对不同产量水稻品种苗期根孔隙度的研究中发现,高产品种在播种后40、50和60 d根孔隙度分别为25.0%、31.2% 和37.5%,而低产品种根孔隙度则仅为18.4%、25.7% 和29.2%[2]。陈贵等[25]选择氮素吸收效率高的籼粳杂交水稻甬优12、嘉优中科6号以及氮素吸收效率相对较低的常规粳稻秀水134为研究材料,发现在低氮供应水平下籼粳杂交稻根孔隙度及径向泌氧量均显著高于常规粳稻品种。本研究拟通过添加通气组织刺激剂的方式,人为调控水稻苗期根系通气组织发育从而改善根际氧环境并最终促进水稻生长及提高氮素吸收。本研究发现水稻苗期孔隙度并非越大越好,而是和水稻生物量及氮积累量之间存在阈值(42%)。当孔隙度小于该阈值时,随着孔隙度每增加1% 时,单株水稻生物量显著增加8.8 mg(图 7A),氮积累量增加0.2 mg (图 7B);而当孔隙度大于阈值时,植株干物质量及氮积累量则迅速降低。因此,尽管苗期根系通气组织越发达水稻表现出更好的长势,但过度刺激通气组织发育反而会抑制水稻生长,尤其首先表现为对根系生长的抑制作用(表 2)。水稻根系通气组织发育是细胞程序性死亡的结果,如果通气组织过度发育(孔隙度大于42%)将意味着更多细胞程序性死亡而导致根系发育不良,并会进一步抑制水稻的生长发育及氮吸收利用。除此之外,本试验发现,添加刺激剂后水稻根孔隙度和营养液氧含量与CK相比,在采样期Ⅰ时已存在显著差异(图 2A,5A),而生物量在采样期Ⅱ时才出现显著性差异(图 1B),说明生物量变化较通气组织及根际氧含量对刺激剂的响应存在滞后现象。
胡继杰等[26]通过水培试验,将水稻分别种植在低氧(1 mg/L)、自然生长氧(CK,1.6 ~ 2.3 mg/L)、适度增氧(3 mg/L)、高氧(5.5 mg/L)、饱和氧5种氧环境下发现,不同氧环境处理下水稻产量、植株生物量及氮积累量均表现为适度增氧 > CK > 低氧 > 高氧 > 饱和氧。本试验中营养液氧含量与水稻生物量的关系与此一致,即对于水稻而言,根际氧含量并非越高越好,而是存在一定的氧适宜范围。试验结果表明,不同种类刺激剂均能显著提高营养液溶解氧含量,其中A3、C3处理(42 d)营养液溶解氧含量最高,分别达231.8和232.7 μmol/L,相当于7.42和7.45 mg/L,而其生物量最低且与CK无显著差异;B3和A1处理营养液溶解氧含量尽管仅为209.9和201.1 μmol/L,相当于6.72和6.44 mg/L,但其生物量则分别是所有处理中最高,且与CK存在显著性差异(图 1B,5B)。3种物质刺激后溶解氧浓度的不同主要是由水稻根系泌氧差异造成的。除氧气含量外,土壤pH也是影响稻田养分形态转化的关键因素之一[27]。本研究结果表明,3种刺激剂加入营养液后,营养液的pH均无变化(图 6),即并非通过改变根际环境酸碱度的方式改变根际营养吸收特性。
通气组织形成一方面为水稻根系生长提供了充足的氧气,另一方面大量薄壁细胞的崩溃降低了根系内部的耗氧量,使得更多的氧气能够释放到根际形成氧化圈。本课题组以往利用氧电极(直径25 μm)原位测定距水稻根表不同距离及不同深度的土壤氧含量,构建了水稻根际氧化圈立体空间分布图。研究发现淹水层氧气含量维持在270 ~ 280 µmol/L,而水土界面氧气含量则急剧下降,至土表 4.8 ~ 6.1 mm处时已下降为0,因此根际氧化圈范围实际上是非常微小的。但土壤氧气与氨化、硝化和反硝化作用等土壤氮转化过程密切相关,因此水稻泌氧能力大小也直接影响其对氮素的吸收利用。赵峰等[28]在探究溶解氧与水稻根系特征关系的试验中发现增氧处理较对照的根系数量明显增多、体积增大、干物质量显著提高。王瑞等[29]发现水培条件下增氧(30% 过氧化脲代替尿素)能够显著提高上海青总根长、根表面积、根粗、根体积及根尖数。Ashraf等[30]在玉米水培种植过程中添加20 mg/L硒,玉米根的鲜物质量和干物质量分别增加17.5% 和29.3%。本研究发现亚硒酸钠对水稻根系形态的变化有显著影响,其中0.01 mmol/L亚硒酸钠处理12 d后的水稻较CK相比,总根长、根表面积、根直径、根体积、根尖数分别增加62.4%、48.9%、10.9%、53.3% 和79.7%。这可能也是水稻添加通气组织刺激剂后氮素积累量增加的重要原因之一,但究竟是刺激剂本身对根系的刺激作用还是由于刺激剂添加后增加根际氧气造成的根系生长促进作用还需要进一步试验证明。基于本研究优化出的刺激剂类型及浓度基础上,后期将继续进行土培试验,研究不同氮水平及氮形态供应下,水稻通气组织发育响应及其与水稻氮素营养之间的关系。同时熊旭梅等人[31]在探究氧气对氨氧化过程的影响中发现,高氧条件下的硝化通量高于低氧,且氨氧化古菌(AOA)主导了氨氧化过程,因此土壤氮形态转化及其微生物过程也是下一步需要研究的重点。
4 结论不同种类通气组织刺激剂均可通过刺激根系通气组织发育提高根系泌氧,以及促进通气组织早发从而缓解水稻苗期根际缺氧限制生长的问题。水稻苗期根孔隙度为20% ~ 30%,而添加通气组织刺激剂后根系孔隙度达到32.7% ~ 54.6%。同时本研究发现,水稻苗期通气组织并非越发达越好,而是存在一定阈值(42%)。当低于该阈值时,通气组织越发达,水稻生长及氮素积累量也越高;但当刺激过度后,水稻生长将受到抑制。通过定量化水稻苗期通气组织发育程度与水稻生物量及氮素积累量之间的关系,对于利用通气组织刺激剂人为调控水稻生长及氮素高效吸收利用提供了理论依据。
| [1] |
Colmer T D, Pedersen O. Oxygen dynamics in submerged rice (Oryza sativa)[J]. The New Phytologist, 2008, 178(2): 326-334 DOI:10.1111/j.1469-8137.2007.02364.x (  0) 0) |
| [2] |
李奕林. 水稻根系通气组织与根系泌氧及根际硝化作用的关系[J]. 生态学报, 2012, 32(7): 2066-2074 (  0) 0) |
| [3] |
Li Y L, Wang X X. Root-induced changes in radial oxygen loss, rhizosphere oxygen profile, and nitrification of two rice cultivars in Chinese red soil regions[J]. Plant and Soil, 2013, 365(1): 115-126 (  0) 0) |
| [4] |
孔妤, 王忠, 顾蕴洁, 等. 乙烯利诱导水稻根内通气组织形成的研究[J]. 中国水稻科学, 2009, 23(1): 65-70 (  0) 0) |
| [5] |
Yamauchi T, Watanabe K, Fukazawa A, et al. Ethylene and reactive oxygen species are involved in root aerenchyma formation and adaptation of wheat seedlings to oxygen-deficient conditions[J]. Journal of Experimental Botany, 2014, 65(1): 261-273 DOI:10.1093/jxb/ert371 (  0) 0) |
| [6] |
Hu L Y, Li D, Sun K, et al. Mutualistic fungus Phomopsis liquidambari increases root aerenchyma formation through auxin-mediated ethylene accumulation in rice (Oryza sativa L.)[J]. Plant Physiology and Biochemistry, 2018, 130: 367-376 DOI:10.1016/j.plaphy.2018.07.018 (  0) 0) |
| [7] |
Pucciariello C, Perata P. New insights into reactive oxygen species and nitric oxide signalling under low oxygen in plants[J]. Plant, Cell & Environment, 2017, 40(4): 473-482 (  0) 0) |
| [8] |
Huang G X, Ding C F, Li Y S, et al. Selenium enhances iron plaque formation by elevating the radial oxygen loss of roots to reduce cadmium accumulation in rice (Oryza sativa L.)[J]. Journal of Hazardous Materials, 2020, 398: 122860 DOI:10.1016/j.jhazmat.2020.122860 (  0) 0) |
| [9] |
孟冬梅. 水稻根系通气组织的泌氧能力研究[D]. 北京: 北京林业大学, 2008.
(  0) 0) |
| [10] |
Kludze H K, DeLaune R D, Patrick W H Jr. Aerenchyma formation and methane and oxygen exchange in rice[J]. Soil Science Society of America Journal, 1993, 57(2): 386-391 DOI:10.2136/sssaj1993.03615995005700020017x (  0) 0) |
| [11] |
Evans D E. Aerenchyma formation[J]. New Phytologist, 2004, 161(1): 35-49 DOI:10.1046/j.1469-8137.2003.00907.x (  0) 0) |
| [12] |
Voesenek L A C J, Rijnders J H G M, Peeters A J M, et al. Plant hormones regulate fast shoot elongation under water: From genes to communities[J]. Ecology, 2004, 85(1): 16-27 DOI:10.1890/02-740 (  0) 0) |
| [13] |
Rich S M, Pedersen O, Ludwig M, et al. Shoot atmospheric contact is of little importance to aeration of deeper portions of the wetland plant Meionectes brownii; submerged organs mainly acquire O2 from the water column or produce it endogenously in underwater photosynthesis[J]. Plant, Cell & Environment, 2013, 36(1): 213-223 (  0) 0) |
| [14] |
樊明寿, 张福锁. 植物通气组织的形成过程和生理生态学意义[J]. 植物生理学通讯, 2002, 38(6): 615-618 (  0) 0) |
| [15] |
Schussler E E, Longstreth D J. Aerenchyma develops by cell lysis in roots and cell separation in leaf petioles in sagittaria lancifolia (Alismataceae)[J]. American Journal of Botany, 1996, 83(10): 1266-1273 DOI:10.1002/j.1537-2197.1996.tb13910.x (  0) 0) |
| [16] |
Drew M C, Jackson M B, Giffard S C, et al. Inhibition by silver ions of gas space (aerenchyma) formation in adventitious roots of Zea mays L. subjected to exogenous ethylene or to oxygen deficiency[J]. Planta, 1981, 153(3): 217-224 DOI:10.1007/BF00383890 (  0) 0) |
| [17] |
Subbaiah C C, Sachs M M. Molecular and cellular adaptations of maize to flooding stress[J]. Annals of Botany, 2003, 91(2): 119-127 DOI:10.1093/aob/mcf210 (  0) 0) |
| [18] |
Yamauchi T, Shimamura S, Nakazono M, et al. Aerenchyma formation in crop species: A review[J]. Field Crops Research, 2013, 152: 8-16 DOI:10.1016/j.fcr.2012.12.008 (  0) 0) |
| [19] |
Yukiyoshi K, Karahara I. Role of ethylene signalling in the formation of constitutive aerenchyma in primary roots of rice[J]. AoB PLANTS, 2014, 6: plu043 (  0) 0) |
| [20] |
戴闽玥. 外源磷对红树植物抗镉胁迫的调控机制[D]. 厦门: 厦门大学, 2018.
(  0) 0) |
| [21] |
Jensen C R, Luxmoore R J, VanGundy S D, et al. Root air space measurements by a pycnometer Method1[J]. Agronomy Journal, 1969, 61(3): 474-475 DOI:10.2134/agronj1969.00021962006100030045x (  0) 0) |
| [22] |
Li H, Ye Z H, Wei Z J, et al. Root porosity and radial oxygen loss related to arsenic tolerance and uptake in wetland plants[J]. Environmental Pollution, 2011, 159(1): 30-37 DOI:10.1016/j.envpol.2010.09.031 (  0) 0) |
| [23] |
Colmer T D. Aerenchyma and an inducible barrier to radial oxygen loss facilitate root aeration in upland, paddy and deep-water rice (Oryza sativa L.)[J]. Annals of Botany, 2003, 91(2): 301-309 DOI:10.1093/aob/mcf114 (  0) 0) |
| [24] |
Mei X Q, Ye Z H, Wong M H. The relationship of root porosity and radial oxygen loss on arsenic tolerance and uptake in rice grains and straw[J]. Environmental Pollution, 2009, 157(8/9): 2550-2557 (  0) 0) |
| [25] |
陈贵, 陈梅, 朱静娜, 等. 籼粳杂交稻高效吸收氮素的相关机理研究[J]. 土壤, 2020, 52(6): 1113-1119 (  0) 0) |
| [26] |
胡继杰, 钟楚, 胡志华, 等. 溶解氧浓度对水稻分蘖期根系生长及氮素利用特性的影响[J]. 中国农业科学, 2021, 54(7): 1525-1536 (  0) 0) |
| [27] |
田美洁, 郭俊丽, 黎娟, 等. 长期施肥对水稻土剖面氨氧化古菌和细菌丰度及组成的影响[J]. 土壤学报, 2022, 59(1): 285-296 (  0) 0) |
| [28] |
赵锋, 徐春梅, 张卫建, 等. 根际溶氧量与氮素形态对水稻根系特征及氮素积累的影响[J]. 中国水稻科学, 2011, 25(2): 195-200 (  0) 0) |
| [29] |
王瑞, 李奕林, 喻敏, 等. 过氧化脲及尿素配比对水培上海青生长及品质的影响[J]. 土壤, 2022, 54(2): 240-246 (  0) 0) |
| [30] |
Ashraf M A, Akbar A, Parveen A, et al. Phenological application of selenium differentially improves growth, oxidative defense and ion homeostasis in maize under salinity stress[J]. Plant Physiology and Biochemistry, 2018, 123: 268-280 (  0) 0) |
| [31] |
熊旭梅, 周雪, 郭佳, 等. 不同pH和氧气条件下土壤古菌与海洋古菌的竞争适应机制[J]. 土壤学报, 2022, 59(3): 833-843 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China
 2023, Vol. 55
2023, Vol. 55


