铁(氢)氧化物普遍存在于陆地、水生环境和大气气溶胶中[1-2]。目前已知的铁(氢)氧化物种类有16种, 环境中存在12种, 其中针铁矿、赤铁矿、水铁矿、纤铁矿和磁铁矿较为常见[3]。铁(氢)氧化物颗粒尺寸小、比表面积大、活性位点丰富、表面反应性强, 在控制营养元素和污染物的形态、转化和归趋方面有重要作用[1, 3-6]。因其具有成本低、环境友好、净化效率高等优点, 铁(氢)氧化物在环境污染修复方面有较高的应用潜力[7-9], 亦广泛用于生物医学[10]、电池电极材料[11]、传感器[12]和催化材料[13]等领域。土壤中的铁(氢)氧化物极少以纯相存在, 由于Al3+自然丰度高、与Fe3+性质相近, Al3+易替代铁(氢)氧化物晶格中的Fe3+发生铝同晶替代现象[1]。随土壤风化程度加深, 铝同晶替代量增加, 最高可达33%[1, 14-15]。铝同晶替代可改变铁(氢)氧化物结晶度、晶胞参数、颗粒尺寸、形貌、羟基位点类型和密度等性质, 从而影响其表面电荷特性和反应活性[16]。
铝同晶替代铁(氢)氧化物的相关研究已从多方面展开, 从铝替代对铁(氢)氧化物晶体结构[17-18]、磁性[19-20]、溶解性[21]等矿物性质的影响, 到近年来越来越关注其对界面反应过程, 尤其是营养元素(如P)[22-24]和污染物质(如As、Cr等)[16, 25-32]吸附行为的影响。然而, 有关铝同晶替代影响铁(氢)氧化物性质的不同研究之间结果相差较大或结论相悖, 使结论不具普适性。此外, 现有研究对铝同晶替代如何影响铁(氢)氧化物的界面过程及其机制缺乏解释或解释不全, 难以准确理解和预测铁(氢)氧化物的环境行为。因此, 本文综述了铝同晶替代对铁(氢)氧化物晶体结构、表面电荷和界面过程的影响, 比较、分析了不同研究结果异同点及原因, 解析铝同晶替代影响铁(氢)氧化物表面反应活性的机制, 并对未来研究方向提出几点思考, 有助于深入理解土壤中铁(氢)氧化物的矿物学特性及其对土壤中营养元素和污染物质地球化学行为的影响。
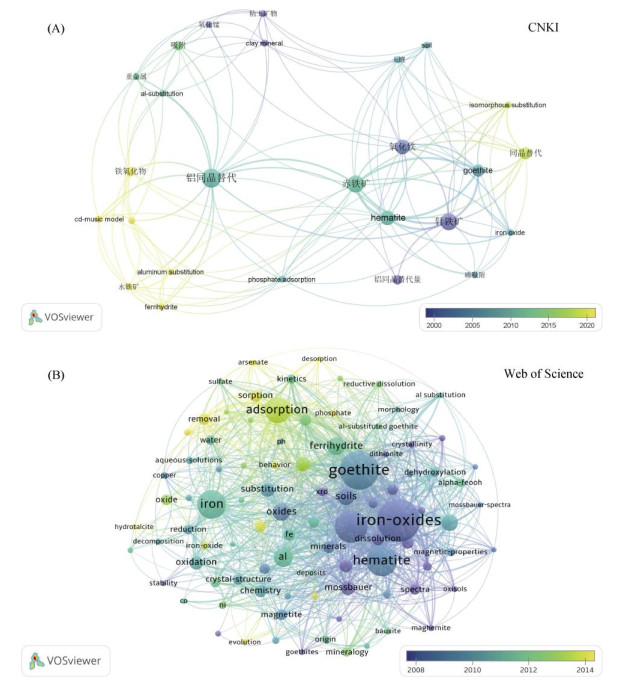
1 文献调研和可视化分析以“SU%=(氧化铁or铁氧化物or铁(氢)氧化物or针铁矿or赤铁矿or水铁矿or纤铁矿)AND(铝同晶替代or Al同晶替代)”和“TS=(goethite OR hematite OR ferrihydrite OR iron oxide OR iron hydroxide OR lepidocrocite OR magnetite OR maghemite) AND TS=Al substitut*”为检索式, 分别检索CNKI数据库和Web of Science核心合集数据库的中、英文文献, 相关文献数分别为15和710篇。CNKI中出现2次及以上的关键词29个, Web of Science中出现10次及以上的关键词102个, 以此为数据源, 利用文献计量分析软件VOSviewer可视化分析该领域关键词密度和共现网络, 如图 1所示。CNKI的高频词是: 铝同晶替代、针铁矿、赤铁矿、氧化铁等, Web of Science核心数据库的高频词为iron-oxides、goethite、aluminum、hematite、iron、adsorption等, 表明相关研究对象主要是针铁矿和赤铁矿; 英文文献还对水铁矿、磁铁矿展开研究, 且研究对象多在实验室合成。研究方法涉及X射线衍射光谱、穆斯堡尔谱、同步辐射等光谱技术, 研究内容包括铝同晶替代铁(氢)氧化物的晶体学特性、溶解性、热稳定性、磁性等矿物学性质以及吸附、氧化、还原等界面过程。时间维度上, Web of Science近十年关键词分别为ferric compounds、adsorption、aluminum、arsenic、chromium、soil pollutants, 说明近年研究聚焦铝同晶替代铁(氢)氧化物对环境污染物(如As、Cr等)的吸附固定, 探讨其对污染物形态、迁移和转化的影响, 以期依靠天然矿物为土壤污染治理提供策略。
|
图 1 CNKI (A)和Web of Science (B)中铝同晶替代铁(氢)氧化物相关研究的关键词共现密度与网络可视化分析 Fig. 1 Visualization of keyword density and network of studies on Al-substituted iron (hydr) oxides in the database of CNKI (A) and Web of Science (B) |
铝同晶替代可改变铁(氢)氧化物的结晶度、比表面积、晶体生长取向及晶面组成等结构特性, 且对不同类型铁(氢)氧化物影响程度不同, 探究铝同晶替代铁(氢)氧化物结构特征是深入理解其表面活性的基础。
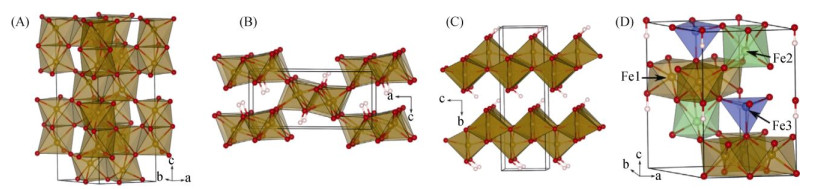
2.1 晶体学性质铁(氢)氧化物结构中, O2–和/或OH–以六方或立方紧密堆积, Fe(Ⅲ) 或Fe(Ⅱ) 填充于其八面体和/或四面体中心位点, 形成铁氧化物基本结构单元FeO6、FeO3(OH)3或FeO4。结构单元通过共角、共边、共面及其组合连接的方式形成铁(氢)氧化物[1]。几种常见铁(氢)氧化物的晶体结构如图 2所示, 赤铁矿(图 2A)、针铁矿(图 2B)和纤铁矿(图 2C)等晶质铁(氢)氧化物的结构相对清楚, 而水铁矿的化学式和晶体结构存在争论。现有研究多参考Michel等[33]提出的单相结构模型(图 2D), 其中水铁矿包含Fe1、Fe2和Fe3 3种类型位点Fe, Fe1和Fe2在理想结构中分别占60% 和20%, 具有八面体配位结构, 而Fe3原子(约占20%)为四面体配位。Al3+进入铁(氢)氧化物结构中, 形成AlO6八面体, 对水铁矿而言, Al3+主要替代Fe1位置[34-36]。在铝–铁(氢)氧化物体系中, Al3+除同晶替代单个Fe3+外, 还可能形成单独铝相和/或在铁(氢)氧化物结构内形成晶簇等[34, 37-38]。由于铁(氢)氧化物合成条件、研究方法等差异, Al3+的局部配位环境仍有争议。如Kim等[38]借助27Al核磁共振波谱(NMR)得出高于95% Al3+以同晶替代方式进入针铁矿、纤铁矿晶格, 其余少量生成铝杂质; Bazilevskaya等[37]通过密度泛函理论(Density Functional Theory, DFT)计算表明Al3+在针铁矿中更易形成类水铝石晶簇, 尤其铝含量高于8 mol% (Al/(Al+Fe)摩尔比)时几乎不发生同晶替代; Ducher等[39]结合光谱和DFT计算表明, 10 mol% Al左右时, 铝在针铁矿结构中孤立分布, 高于25 mol% Al时产生晶簇。
|
图 2 赤铁矿(A)、针铁矿(B)、纤铁矿(C)和水铁矿(D)的晶体结构示意图[36] Fig. 2 Calculated bulk crystal structures of hematite (A), goethite (B), lepidocrocite (C), and ferrihydrite(D) |
由于Al3+半径(0.535 Å)小于Fe3+半径(0.645 Å)[40], 且形成的Al-O键比Fe-O键短[29], Al3+替代Fe3+后使铁(氢)氧化物晶体面网间距减小、晶格扭曲、晶胞收缩[1, 17], 导致纤铁矿(除(020)特征峰外)、赤铁矿、针铁矿等晶质铁(氢)氧化物的X射线衍射(XRD)特征峰向高衍射角偏移[16, 23, 41-42], 而弱结晶水铁矿衍射峰位置无明显变化[34, 43]。铝同晶替代也会引起铁(氢)氧化物结晶度的变化, 结晶度越高, 衍射峰峰强越高[44]。随铝替代量由0% 增加至30%, Liang等[27]研究结果表明水铁矿峰强与峰型未发生明显变化, 其峰强较弱, 峰型较宽, 这与其结晶尺寸小、结晶度弱密切相关。也有研究认为铝同晶替代使水铁矿峰强减弱, 结晶度降低[45-46]。针铁矿衍射峰峰强随铝含量增加而减弱, 结晶度降低, 半峰宽增加[22, 47]。Yin等[48]则认为针铁矿衍射峰和半峰宽无明显变化。总体而言, 铝同晶替代导致铁(氢)氧化物的结晶度减弱或无明显变化。不同研究结果的差异一方面是由于铁(氢)氧化物合成方法不同, 另一方面XRD样品制样、测试与分析过程也影响衍射峰峰强[49]。
铝同晶替代影响铁(氢)氧化物的晶胞参数。Rietveld结构精修结果表明, 针铁矿、纤铁矿、赤铁矿等铁(氢)氧化物的晶胞参数(a、b、c)均随铝含量增加而有不同程度降低, 晶胞体积相应减小[17, 22-23, 41-42, 44]。在理想固溶体中, 晶胞参数的变化符合Vegard定律, 即铁(氢)氧化物的晶胞参数与铝替代量呈线性相关关系。如赤铁矿(Al% ≤ 9.23%)的a、c值, 纤铁矿(Al% ≤ 18.5%)的a、b、c值与铝含量呈相应的线性关系, 符合Vegard定律[41, 50]; 针铁矿的晶胞参数b、c基本符合Vegard定律, 但a值会发生一定程度偏离[17, 23]。晶胞参数偏离Vegard定律可能源于非理想Fe/Al混合而导致的晶体缺陷[34]。此外, 水铁矿结晶性差, 利用六方水铝石作为其结构类似物, 计算铝同晶替代水铁矿的晶胞参数可得, a值符合Vegard定律, 但由于空位、缺陷, c值有一定偏离[34, 46]。
2.2 矿相转化铝同晶替代影响铁(氢)氧化物的转化速率、路径和产物。水铁矿是Fe2+快速氧化或Fe3+水解的最初产物, 在环境中难以稳定存在, 常作为前驱物转化为针铁矿、赤铁矿等热力学稳定的晶质铁(氢)氧化物, 铝同晶替代可抑制该转化过程[51-53]。不同铁(氢)氧化物形成路径有差异, 铝的影响也有不同。水铁矿转化为针铁矿的主要机制为溶解–再沉淀, 铝虽不影响针铁矿的结晶机制, 但降低了水铁矿溶解度, 使针铁矿的结晶和生长速率降低; 纳米针铁矿还存在定向聚集过程, 铝通过抑制该过程使针铁矿晶体生长受阻, 尺寸减小, 结晶度降低。此外, 在环境条件(环境温度、pH 5、低Fe浓度)下, 2 mol% Al可抑制针铁矿直接从溶液中析出[54-55]。赤铁矿的主要形成机制为溶解–再沉淀和固相转变[52], 与pH、温度、老化时间和合成方式等因素密切相关[1]。Liu等[52]研究了pH 9、Fe(Ⅱ) 存在条件下铝对水铁矿转化为赤铁矿的影响, 无铝条件下主要机制为固相转化, 低铝时溶解–再沉淀和固相转化均会发生, 随铝含量增加, 固相转化机制的贡献降低。李葳等[56]将铝影响赤铁矿转化的机制解释为: ①改变水铁矿表面电荷, 抑制水铁矿颗粒聚集, 阻碍赤铁矿的生成; ②降低水铁矿溶解度, 从而抑制赤铁矿的Ostwald熟化过程。此外, 铝同晶替代还影响水铁矿的转化产物。随铝替代量增加, 水铁矿转化率降低, 转化产物中针铁矿比例降低, 赤铁矿增加[53-54, 56]。Fe(Ⅱ) 存在下, 铝同晶替代可阻碍纤铁矿形成、磁铁矿成核, 针铁矿比例升高[51]。
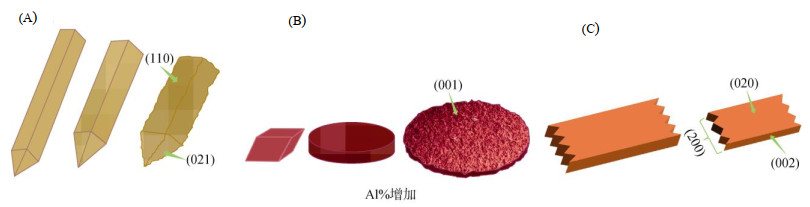
2.3 形貌和比表面积弱结晶的水铁矿纳米颗粒形貌几乎不受铝同晶替代影响, 均保持不规则团聚状, 以细小的类球形颗粒聚集体存在, 颗粒尺寸约为3 ~ 4 nm[27, 46, 57]。铝同晶替代能显著影响晶质铁(氢)氧化物形貌, 随铝替代量增加, 针铁矿由长针状向短棒状转变, 即(110)晶面比例降低, (021)面增加(图 3A)[23]; 菱块状赤铁矿逐渐向圆片状转化[16, 29, 50], (001)晶面占比由44.0% 增加至84.8%(图 3B)[16]; 纤铁矿仍呈板条状, 主要暴露晶面为(020)、(200)和(002), 铝同晶替代导致纤铁矿变短、变薄, 长宽比变小(图 3C)[41]。此外, 铝同晶替代还导致针铁矿、赤铁矿颗粒表面和边缘粗糙度增加[16-17, 23]。铝同晶替代对铁(氢)氧化物形貌的改变可用布拉维法则解释, 即晶体生长过程中, 面网原子密度差异引起体系中颗粒间吸引力变化, 导致与之相关的晶面生长速率不同, 原子密度较大的晶面通常生长较慢, 更有可能保留下来[58]。铝同晶替代使铁(氢)氧化物面网间距减小, 不同晶面原子密度变化程度不一致, 生长速率变化不同步, 导致颗粒形态转变。例如, 纤铁矿垂直于a轴(长)(200)面的原子密度较垂直于c轴(宽)(002)面的更小, 所以a轴方向生长更快; 当Al3+替代Fe3+后, (200)面和(002)面原子密度均增加, 晶面生长均受抑制, (200)面增加程度大于(002)面, 生长抑制程度更大。因此, 长条状纤铁矿随铝同晶替代量增加, 长度与宽度均减小, 且长宽比减小。同理, (020)面生长受到抑制, 晶体变薄[41]。
|
图 3 铝同晶替代对针铁矿(A)、赤铁矿(B)和纤铁矿(C)形貌的影响 Fig. 3 Effect of Al substitution on morphology of goethite (A), hematite (B) and lepidocrocite (C) |
铁(氢)氧化物的比表面积(Specific Surface Area, SSA)通常采用Brunauer-Emmett-Teller(BET)-N2法测定。铝同晶替代通过影响铁(氢)氧化物的结晶度、形貌、表面粗糙度等性质, 改变其SSA。水铁矿结晶弱、颗粒尺寸小, 且受铝同晶替代影响较小, 使铝同晶替代水铁矿的SSA无明显规律, 一般在300 m2/g左右[27, 46, 57]。随铝含量增加, 纤铁矿结晶度和结晶尺寸显著降低, SSA呈线性增加[41]; 赤铁矿SSA呈增大或先减小后增大的趋势, 主要是赤铁矿表面粗糙度增加与形貌变化所致[16, 29, 50]; 针铁矿SSA由147 m2/g增加至288 m2/g[59], Zhu等[60]则得出由70 m2/g降至50 m2/g, 而Xu等[23]观察到铝替代针铁矿SSA均在60 m2/g左右。针铁矿SSA变化差异显著的原因可能是: ①针铁矿合成方法不同, 形貌、结晶度等有差异, 影响SSA; ②铝同晶替代针铁矿表面羟基含量增加, 极性提高, 非极性分子N2吸附受阻, 导致BET-N2法测定的SSA偏低[61]。
3 铝同晶替代对铁(氢)氧化物表面电荷的影响近年来, 纯相铁(氢)氧化物表面电荷特性研究较为成熟, 铝同晶替代铁(氢)氧化物也有不同程度的研究, 研究对象主要为针铁矿、赤铁矿和水铁矿。
3.1 表面电荷密度铁(氢)氧化物表面羟基位点的质子化和去质子化反应使其带可变电荷, 电荷密度与其形貌(晶面组成)、表面粗糙度有关, 且受pH、离子强度等外界环境条件影响[62]。其中形貌主要决定位点组成与密度, 表面粗糙度影响双电层电容和位点密度。
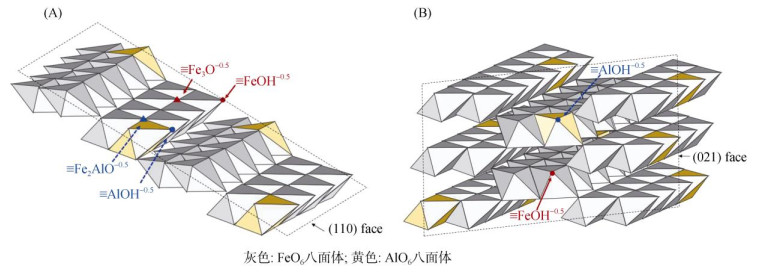
铝同晶替代改变铁(氢)氧化物的位点组成与密度。根据与O原子配位的Fe原子数目, 铁(氢)氧化物表面羟基位点分为3类: 单配位、双配位和三配位羟基位点[1]。其中双配位羟基位点在pH 2 ~ 12范围内不发生质子化和去质子化反应, 被认为是惰性或低活性位点, 其对表面电荷的贡献可忽略不计, 而单配位和三配位羟基位点分别为低、高质子亲和位点, 其质子亲和常数分别为7.5 ~ 9.0和10.5 ~ 11.9[27, 63-64]。Al3+替代Fe3+后, 产生了含Al羟基位点(图 4), 其中单配位Al羟基位点的质子亲和常数约为10.0[23, 27, 42], 高于单配位Fe羟基位点。由于铁(氢)氧化物不同晶面的位点组成和密度不同, 铝同晶替代通过影响铁(氢)氧化物的晶面组成来改变其表面位点组成与密度。例如, 纯相针铁矿(110)晶面上单配位和三配位羟基位点有效位点密度均为3.03 sites/nm2(图 4A); (021)面无三配位位点, 单配位位点密度为7.5 sites/nm2(图 4B)。随铝替代量增加, 针铁矿(110)/(021)晶面比例降低, 使单配位羟基位点密度增加, 三配位羟基位点数量减少, 总位点密度增加[23, 42]。此外, 铝同晶替代引起缺陷增加活性位点密度。如赤铁矿(001)面比例可随铝含量增加而增大[16], 完美结晶的(001)面只存在双配位羟基位点[65], 但铝同晶替代一方面产生铁原子空位使双配位羟基位点被“激活”为单配位和三配位羟基位点, 另一方面引起表面粗糙度增加使位点密度增加, 最终导致赤铁矿表面活性位点密度和表面电荷增加[16, 31]。
|
图 4 铝同晶替代铁(氢)氧化物表面羟基位点类型[23] Fig. 4 Surface sites of Al-substituted iron (hydr)oxides |
铝同晶替代影响铁(氢)氧化物表面静电双电层。铁(氢)氧化物表面越粗糙, 位点密度越高, 稳定反离子的能力越强, 双电层厚度越小, 电容值越高, 可吸附更多质子[64, 66]。随铝替代量增加, 铁(氢)氧化物表面粗糙度增加, 电容值增加, 表面电荷密度增加[23, 27, 43, 67]。综上, 铝同晶替代增加表面电荷的机制包含: ①通过影响晶面组成而影响位点组成和密度; ②引起表面缺陷增加活性位点数量; ③表面粗糙度增加使双电层电容值增加; ④引入质子亲和能力较高的Al位点。
3.2 零电荷点铁(氢)氧化物零电荷点(Point of Zero Charge, PZC)指表面正、负电荷相等时的溶液pH, 是反映铁(氢)氧化物表面特性的重要参数[68]。当溶液pH < PZC时, 铁(氢)氧化物表面带正电, 正电荷量随pH升高而降低; pH > PZC时表面带负电。一般而言, 纯相水铁矿PZC多在8 ~ 9[69]; 针铁矿和赤铁矿PZC一般在9.0 ~ 9.4, 也有很多文献报道较低的PZC, 一方面源于铁(氢)氧化物的合成方法与PZC测定方法(如电位滴定法、Zeta电位法)的差异, 另一方面由CO2污染所致[70-71]。随铝替代量增加, 水铁矿和赤铁矿PZC分别由8.72、9.01增至8.98和9.21[27, 72], 而针铁矿PZC无显著变化[23, 42]。铁(氢)氧化物的PZC与羟基位点的质子亲和常数有关, 铝同晶替代通过改变位点组成影响铁(氢)氧化物PZC, 即: ①Al羟基位点质子亲和常数略高于Fe羟基位点, 因此铝同晶替代可增大PZC; ②位点数量改变, 如质子亲和能力较强的三配位羟基位点数量增加也会引起PZC增大[69], 反之则减小。因此, Al羟基位点增加是水铁矿、赤铁矿PZC增加的主要原因; 而Al羟基位点增加的同时, 三配位羟基位点减少, 导致针铁矿PZC无明显变化。
4 铝同晶替代对铁(氢)氧化物界面过程的影响铝同晶替代引起铁(氢)氧化物晶体结构、形貌、表面电荷等性质改变, 必然也影响铁(氢)氧化物的界面过程, 相关研究主要涉及吸附特性和机理, 包括磷酸根、砷酸根、铬酸根等含氧阴离子和Cd(Ⅱ)、Pb(Ⅱ)等阳离子等。
4.1 离子吸附容量铝同晶替代对铁(氢)氧化物表面吸附容量的影响如表 1所示, 受铁(氢)氧化物类型、铝替代量、SSA等性质以及pH、离子强度等环境条件影响[73]。随铝替代量增加, 针铁矿、水铁矿对Pb(Ⅱ)、Cd(Ⅱ)吸附量降低[27, 42, 74-75], 而赤铁矿对Pb(Ⅱ)吸附量则增加[16]。单位质量纯相针铁矿Gα-FeOOH对Ni(Ⅱ) 的吸附容量(61.55 mg/g)明显低于铝同晶替代针铁矿GAl-FeOOH (94.52 mg/g), 对应单位SSA的吸附量则相反[76]。对于磷酸根、砷酸根、铬酸根和F–等阴离子, 多数研究表明, 铝同晶替代可提高其在铁(氢)氧化物表面吸附容量[24-25, 42-43, 67, 77-80], 也有研究未观测到铝替代量与吸附容量相关性[22, 29, 32, 46]。对于同一类型铁(氢)氧化物, 铝同晶替代的影响与铁(氢)氧化物合成方法、实验条件等因素有关, 如Tufo等[30]研究表明铝同晶替代针铁矿的砷酸根吸附量低于纯相针铁矿, 而Liang等[31]得出针铁矿的砷酸根吸附量随铝替代量增加而增大, Silva等[32]则发现砷酸根吸附量随铝替代量增加呈先增大后降低趋势。综上, 铝同晶替代可影响铁(氢)氧化物对阴阳离子的吸附容量, 但其如何影响需结合不同离子类型、矿物性质、环境条件等综合考虑。此外, 铁(氢)氧化物对放射性核素(如Eu、Sr、U等)吸附容量随铝替代量增加而增大[81-83](表 1), 为治理放射性废水提供思路。
|
|
表 1 铝同晶替代对铁(氢)氧化物表面阴阳离子吸附容量的影响 Table 1 Effects of Al substitution on adsorption capacities of anions and cations onto iron (hydr)oxides |
离子在土壤中的移动性、有效性与其形态密切相关, 现有研究对铝同晶替代铁(氢)氧化物表面离子吸附量的研究较多, 对吸附形态关注较少。离子可选择性地与铁(氢)氧化物特定羟基位点类型结合, 形成不同类型的络合物。铝同晶替代通过改变铁(氢)氧化物表面活性羟基位点的类型、组成和密度影响离子的吸附形态。随着光谱技术、化学形态模型、DFT等在界面反应形态解析中的广泛应用, 越来越多研究证实铝同晶替代影响铁(氢)氧化物表面离子的吸附形态, 主要表现为: ①在Fe/Al位点的选择性吸附, 如铬酸根离子更易与铝同晶替代针铁矿表面的Al位点结合[45], 磷酸根也更易与Al位点成键, 也可能对Fe/Al位点无选择性[24]; ②改变内圈/外圈络合物比例, Johnston和Chrysochoou[84]利用衰减全反射–傅里叶变换红外光谱(ATR-FTIR)研究了铝同晶替代对水铁矿表面铬酸根、硫酸根和硒酸根的吸附机制, 结果表明外圈络合物比例随铝替代量增加而显著增大, 使Cr、S和Se元素移动性增强; ③改变不同内圈络合物比例, 磷酸根主要与铁(氢)氧化物表面单配位羟基位点结合形成单齿和双齿络合物, 铝同晶替代提高了双齿络合物比例, 降低单齿络合物占比[23, 43], 前者的结合能低于后者, 吸附更稳定且不易被解吸, 由此推断铝同晶替代使铁(氢)氧化物对P的固定能力增强, P的迁移性与可利用性降低。同一反应体系、不同研究之间结论也有不同。如张佩[74]和Liang等[42]均利用电荷分布–多位点表面络合(Charge Distribution-Multisite Complexation, CD-MUSIC)模型研究了铝同晶替代对针铁矿表面Pb(Ⅱ)吸附形态的影响, 前者表明铝替代使Pb(Ⅱ)的表面形态由双齿、三齿共存变为以双齿络合物为主, 后者则认为铝替代对Pb(Ⅱ)吸附形态影响较小, 以上差异可能源于针铁矿晶体结构的微小差异影响了CD-MUSIC模型建模过程, 使模型计算结果产生偏差。
4.3 影响机制铝同晶替代对铁(氢)氧化物表面离子的吸附容量与吸附形态的影响机制可从以下几个方面解释:
1) 静电作用。铝同晶替代使铁(氢)氧化物表面正电荷增多[23, 27, 43, 67], 导致铁(氢)氧化物对阳离子的静电斥力增大而抑制吸附, 对阴离子静电引力增大则利于吸附。如Liang等[42]研究了pH 5.0时铝同晶替代针铁矿对Pb(Ⅱ)和砷酸根的吸附, 表明针铁矿对Pb(Ⅱ)的吸附量随铝同晶替代量增加而增大, 而对砷酸根吸附呈相反趋势(表 1)。
2) 比表面积。比表面积增大可在一定程度上增加铁(氢)氧化物表面位点数目, 增加吸附量。如朱朝菊等[67]研究表明, 铝同晶替代针铁矿结晶度减弱、尺寸减小、比表面积增大, 对F–的吸附容量增大(表 1); Liao等[41]也认为铝同晶替代纤铁矿SSA增加是磷酸根吸附量增加的原因之一。
3) 表面活性位点组成与密度。铁(氢)氧化物不同晶面羟基位点组成和密度不同, 形貌分析表明铝同晶替代可改变铁(氢)氧化物的晶面组成, 从而影响铁(氢)氧化物电荷和吸附特性。如纤铁矿(020)面主要官能团为低活性双配位羟基位点, 其比例随铝替代量增加而降低, 高活性晶面比例增加使纤铁矿对磷酸根的吸附速率和吸附量均增加[41]; Jiang等[29]认为赤铁矿中铝替代导致非活性(001)面比例增加是赤铁矿表面铬酸根吸附密度降低的重要原因; Li等[22]认为(110)面比例降低可能是铝替代针铁矿对磷酸根吸附亲和力降低的主要原因。
4) Fe、Al羟基位点亲和力差异。Fe羟基位点对铬酸根的亲和力高于Al位点可能是铬酸根在铝同晶替代赤铁矿表面吸附密度降低的又一原因[29]。Xu等[23]研究表明, 针铁矿表面含Al位点上磷酸根双齿络合物的亲和常数高于Fe位点, 单齿络合物则相反, 因此磷酸根在铝同晶替代针铁矿表面更易形成双齿络合物。
5) 晶体缺陷。铝同晶替代引起铁(氢)氧化物晶格扭曲, 缺陷的形成有助于释放晶格应力并产生更多活化羟基位点, 增加铁(氢)氧化物的表面活性, 增大吸附容量。如铝同晶替代导致赤铁矿表面正电荷密度增加, 理论上对Pb(Ⅱ)静电斥力增加而抑制吸附, 但实际上Pb(Ⅱ)的吸附容量不降反增, 原因在于铝同晶替代引起赤铁矿晶体缺陷, 增大了其表面羟基位点数目, 从而吸附更多Pb(Ⅱ) [16, 72]。此外, 铝同晶替代产生的结构缺陷也导致铬酸根在针铁矿表面吸附容量[25]、砷酸根在水铁矿表面吸附密度增加[46](表 1)。
5 展望本文从铁(氢)氧化物晶体结构、表面电荷和界面过程出发, 归纳与总结了现阶段铝同晶替代铁(氢)氧化物的研究进展。总体而言, 铝同晶替代影响铁(氢)氧化物的晶胞参数、矿相转化、形貌、比表面积等性质, 改变了表面羟基位点组成和密度、双电层电容, 从而影响表面电荷密度与PZC, 进而影响阴阳离子在铁(氢)氧化物表面的吸附容量和吸附形态。针对已有工作, 未来相关研究应着眼于以下几个方面:
1) 构建铁(氢)氧化物铝替代量–结构–反应活性定量关系。铝同晶替代铁(氢)氧化物制备方法和条件的差异是不同研究之间所得结论相差较大甚至相悖的重要原因。先前已有文献建立了针铁矿表面活性参数与SSA之间的线性关系, 并借助CD-MUSIC模型成功预测了不同环境条件下H+、亚硒酸根和Cd(Ⅱ)在一系列合成针铁矿表面的吸附行为[66], 这为解决该问题提供了思路。因此, 深入探究铝同晶替代铁(氢)氧化物的形成转化机制, 掌握其性质变化规律, 构建铁(氢)氧化物铝替代量–结构–反应活性定量关系, 是揭示与预测其界面反应过程与内在机制的基础。
2) 探究铝同晶替代铁(氢)氧化物不同晶面上的界面机制。铝同晶替代能影响铁(氢)氧化物的晶面组成, 而不同晶面上界面机制有差异。已有研究多将铁(氢)氧化物颗粒表面视为整体, 获得所有结晶面的平均配位信息, 受形貌影响较大, 难以准确描述和预测不同形貌铝同晶替代铁(氢)氧化物界面机制及其环境条件变化响应。因此, 可借助同步辐射X射线吸收光谱、ATR-FTIR、原子力显微镜和基于自旋回波序列的NMR等高精度的结构和形态分析技术, 结合化学形态模型、DFT等模拟计算方法, 从定性到定量解析铝同晶替代铁(氢)氧化物不同晶面界面机制, 探究铝同晶替代影响铁(氢)氧化物反应活性的主要机制, 揭示和预测不同铝替代量铁(氢)氧化物界面行为及其环境条件变化响应, 有助于准确评估不同风化土壤中元素的化学形态与有效性。
3) 研究对象由实验室合成过渡到天然铝同晶替代铁(氢)氧化物, 研究体系由单一实验室体系趋向于实际土壤环境。一方面, 现有研究的对象多为实验室合成铁(氢)氧化物, 其研究结果在多大程度上能真实反映天然铁(氢)氧化物的界面化学过程有待进一步明确。另一方面, 实际土壤环境中多种物质并存, 不仅存在吸附反应, 还伴随解吸、氧化–还原、溶解–沉淀等物理化学过程, 也有微生物参与下的生物地球化学过程, 综合影响着铁(氢)氧化物的界面反应过程, 在此情况下, 铝同晶替代对元素的形态、迁移转化的影响尚未可知。因此, 在单一体系基础上考虑共存物质(如共存离子、腐殖质、微生物等)和多种界面过程, 使研究体系更趋近于实际土壤环境, 从而更准确地描述和预测铁(氢)氧化物在元素地球化学循环中的作用。
| [1] |
Cornell R M, Schwertmann U. The iron oxides: structure, properties, reactions, occurrences, and uses[M]. 2nd, completely rev. and extended ed. Weinheim: Wiley-VCH, 2003.
(  0) 0) |
| [2] |
Navrotsky A, Mazeina L, Majzlan J. Size-driven structural and thermodynamic complexity in iron oxides[J]. Science, 2008, 319(5870): 1635-1638 DOI:10.1126/science.1148614 (  0) 0) |
| [3] |
王小明. 几种亚稳态铁氧化物的结构、形成转化及其表面物理化学特性[D]. 武汉: 华中农业大学, 2015.
(  0) 0) |
| [4] |
黄金兰, 蒋代华, 王明释, 等. 广西富硒土壤中氧化铁对Se(Ⅳ)吸附解吸的影响机制[J/OL]. 土壤学报, 2022: 1–13. (2022-03-22). https://kns.cnki.net/kcms/detail/32.1119.P.20220321.0933.004.html.
(  0) 0) |
| [5] |
王锐, 方敦, 牛鹏举, 等. Mn2+掺杂对晶质氧化铁结构与红外光谱特征的影响[J]. 土壤学报, 2020, 57(4): 898-907 (  0) 0) |
| [6] |
严玉鹏, 王小明, 胡震, 等. 磷酸根在矿物表面的吸附-解吸特性研究进展[J]. 土壤, 2021, 53(3): 439-448 (  0) 0) |
| [7] |
周敏, 徐则林, 刘新, 等. 蒙脱石-氧化铁二元复合胶体吸附钨的研究[J]. 土壤, 2022, 54(4): 810-816 (  0) 0) |
| [8] |
Sun Y B, Wang Q, Yang S T, et al. Characterization of nano-iron oxyhydroxides and their application in UO22+ removal from aqueous solutions[J]. Journal of Radioanalytical and Nuclear Chemistry, 2011, 290(3): 643-648 DOI:10.1007/s10967-011-1325-2 (  0) 0) |
| [9] |
Vasques I C F, de Mello J W V, Veloso R W, et al. Effectiveness of ferric, ferrous, and aluminum (hydr)oxide coprecipitation to treat water contaminated with arsenate[J]. Journal of Environmental Quality, 2018, 47(6): 1339-1346 DOI:10.2134/jeq2018.01.0014 (  0) 0) |
| [10] |
刘军, 黄春艳, 贺全国. 磁性铁氧化物纳米粒子在药剂学上的应用[J]. 化学通报, 2014, 77(1): 19-29 DOI:10.3969/j.issn.0441-3776.2014.01.004 (  0) 0) |
| [11] |
郑时有, 董飞, 庞越鹏, 等. 纳米金属氧化物基锂离子电池负极材料研究进展[J]. 无机材料学报, 2020, 35(12): 1295-1306 (  0) 0) |
| [12] |
Zhang J X, Li H Y, Li Y, et al. A Eu3+-decorated α-Fe2O3 microflower composite film as a fast-response, low-temperature, and sensitive acetone sensor[J]. Journal of Materials Science: Materials in Electronics, 2020, 31(3): 2699-2707 DOI:10.1007/s10854-019-02810-y (  0) 0) |
| [13] |
Yuan Y T, Xing G W, Garg S, et al. Mechanistic insights into the catalytic ozonation process using iron oxide-impregnated activated carbon[J]. Water Research, 2020, 177: 115785 DOI:10.1016/j.watres.2020.115785 (  0) 0) |
| [14] |
Martín-García J M, Sánchez-Marañón M, Calero J, et al. Iron oxides and rare earth elements in the clay fractions of a soil chronosequence in southern Spain[J]. European Journal of Soil Science, 2016, 67(6): 749-762 DOI:10.1111/ejss.12377 (  0) 0) |
| [15] |
Corrêa de Medeiros P S, do Nascimento P C, Inda A V, et al. Genesis and classification of soils from granitic hills in southern Brazil[J]. Journal of South American Earth Sciences, 2020, 98: 102494 DOI:10.1016/j.jsames.2019.102494 (  0) 0) |
| [16] |
Liang Y, Wang M X, Xiong J, et al. Al-substitution-induced defect sites enhance adsorption of Pb2+ on hematite[J]. Environmental Science: Nano, 2019, 6(5): 1323-1331 DOI:10.1039/C8EN01221K (  0) 0) |
| [17] |
Schulz D G. The influence of aluminum on iron oxides. Ⅷ. unit-cell dimensions of Al-substituted goethites and estimation of Al from them[J]. Clays and Clay Minerals, 1984, 32(1): 36-44 DOI:10.1346/CCMN.1984.0320105 (  0) 0) |
| [18] |
Schwertmann U, Carlson L. Aluminum influence on iron oxides: XVII. unit-cell parameters and aluminum substitution of natural goethites[J]. Soil Science Society of America Journal, 1994, 58(1): 256-261 DOI:10.2136/sssaj1994.03615995005800010039x (  0) 0) |
| [19] |
Golden D C, Bowen L H, Weed S B, et al. Mössbauer studies of synthetic and soil-occurring aluminum-substituted goethites[J]. Soil Science Society of America Journal, 1979, 43(4): 802-808 DOI:10.2136/sssaj1979.03615995004300040038x (  0) 0) |
| [20] |
Cao S S, Kang F F, Yang X, et al. Influence of Al substitution on magnetism and adsorption properties of hematite[J]. Journal of Solid State Chemistry, 2015, 228: 82-89 DOI:10.1016/j.jssc.2015.04.034 (  0) 0) |
| [21] |
Schwertmann U. The influence of aluminium on iron oxides: Ⅸ. Dissolution of Al-goethites in 6 M HCl[J]. Clay Minerals, 1984, 19(1): 9-19 DOI:10.1180/claymin.1984.019.1.02 (  0) 0) |
| [22] |
Li W, Wang L J, Liu F, et al. Effects of Al3 + doping on the structure and properties of goethite and its adsorption behavior towards phosphate[J]. Journal of Environmental Sciences, 2016, 45: 18-27 DOI:10.1016/j.jes.2015.12.013 (  0) 0) |
| [23] |
Xu J L, Koopal L K, Wang M X, et al. Phosphate speciation on Al-substituted goethite: ATR-FTIR/2D-COS and CD-MUSIC modeling[J]. Environmental Science: Nano, 2019, 6(12): 3625-3637 DOI:10.1039/C9EN00539K (  0) 0) |
| [24] |
Hsu L C, Tzou Y M, Ho M S, et al. Preferential phosphate sorption and Al substitution on goethite[J]. Environmental Science: Nano, 2020, 7(11): 3497-3508 DOI:10.1039/C9EN01435G (  0) 0) |
| [25] |
Ni C Y, Liu S, Wang H L, et al. Studies on adsorption characteristics of Al-free and Al-substituted goethite for heavy metal ion Cr(Ⅵ)[J]. Water, Air, & Soil Pollution, 2017, 228(1): 40 (  0) 0) |
| [26] |
Bahashi J, Bi E P. Effects of Al substitution on sorption of diclofenac to Fe(Ⅲ) (hydr)oxides: Roles of phase transition and sorption mechanisms[J]. Environmental Science and Pollution Research International, 2022, 29(15): 21314-21327 DOI:10.1007/s11356-021-16992-8 (  0) 0) |
| [27] |
Liang Y, Jin J Z, Wei Z Y, et al. Complexation mechanism of Pb2+ at the ferrihydrite-water interface: The role of Al-substitution[J]. Chemosphere, 2022, 307(Pt 1): 135627 (  0) 0) |
| [28] |
Freitas E T F, Stroppa D G, Montoro L A, et al. Arsenic entrapment by nanocrystals of Al-magnetite: The role of Al in crystal growth and As retention[J]. Chemosphere, 2016, 158: 91-99 DOI:10.1016/j.chemosphere.2016.05.044 (  0) 0) |
| [29] |
Jiang S Q, Yan X R, Peacock C L, et al. Adsorption of Cr(Ⅵ) on Al-substituted hematites and its reduction and retention in the presence of Fe2+ under conditions similar to subsurface soil environments[J]. Journal of Hazardous Materials, 2020, 390: 122014 DOI:10.1016/j.jhazmat.2019.122014 (  0) 0) |
| [30] |
Tufo A E, dos Santos Afonso M, Sileo E E. Arsenic adsorption onto aluminium-substituted goethite[J]. Environmental Chemistry, 2016, 13(5): 838 DOI:10.1071/EN15154 (  0) 0) |
| [31] |
Liang Y, Jin J Z, Xiang Y J, et al. Insights into the improving mechanism of defect-mediated As(Ⅴ) adsorption on hematite nanoplates[J]. Chemosphere, 2021, 280: 130597 DOI:10.1016/j.chemosphere.2021.130597 (  0) 0) |
| [32] |
Silva J, Mello J W V, Gasparon M, et al. The role of Al-Goethites on arsenate mobility[J]. Water Research, 2010, 44(19): 5684-5692 DOI:10.1016/j.watres.2010.06.056 (  0) 0) |
| [33] |
Michel F M, Ehm L, Antao S M, et al. The structure of ferrihydrite, a nanocrystalline material[J]. Science, 2007, 316(5832): 1726-1729 DOI:10.1126/science.1142525 (  0) 0) |
| [34] |
Cismasu A C, Michel F M, Stebbins J F, et al. Properties of impurity-bearing ferrihydrite I. Effects of Al content and precipitation rate on the structure of 2-line ferrihydrite[J]. Geochimica et Cosmochimica Acta, 2012, 92: 275-291 DOI:10.1016/j.gca.2012.06.010 (  0) 0) |
| [35] |
Li F Y, Koopal L, Tan W F. Effect of citrate on the species and levels of Al impurities in ferrihydrite[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2018, 539: 140-147 (  0) 0) |
| [36] |
Pinney N, Morgan D. Thermodynamics of Al-substitution in Fe-oxyhydroxides[J]. Geochimica et Cosmochimica Acta, 2013, 120: 514-530 DOI:10.1016/j.gca.2013.05.045 (  0) 0) |
| [37] |
Bazilevskaya E, Archibald D D, Aryanpour M, et al. Aluminum coprecipitates with Fe (hydr)oxides: Does isomorphous substitution of Al3+ for Fe3+ in goethite occur?[J]. Geochimica et Cosmochimica Acta, 2011, 75(16): 4667-4683 DOI:10.1016/j.gca.2011.05.041 (  0) 0) |
| [38] |
Kim J, Ilott A J, Middlemiss D S, et al. 2H and 27Al solid-state NMR study of the local environments in Al-doped 2-line ferrihydrite, goethite, and lepidocrocite[J]. Chemistry of Materials: a Publication of the American Chemical Society, 2015, 27(11): 3966-3978 (  0) 0) |
| [39] |
Ducher M, Blanchard M, Vantelon D, et al. Probing the local environment of substitutional Al\(^{3+}\) in goethite using X-ray absorption spectroscopy and first-principles calculations[J]. Physics and Chemistry of Minerals, 2016, 43(3): 217-227 DOI:10.1007/s00269-015-0788-z (  0) 0) |
| [40] |
Shannon R D. Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides[J]. Acta Crystallographica Section A, 1976, 32(5): 751-767 DOI:10.1107/S0567739476001551 (  0) 0) |
| [41] |
Liao S, Wang X M, Yin H, et al. Effects of Al substitution on local structure and morphology of lepidocrocite and its phosphate adsorption kinetics[J]. Geochimica et Cosmochimica Acta, 2020, 276: 109-121 DOI:10.1016/j.gca.2020.02.027 (  0) 0) |
| [42] |
Liang Y, Yu D H, Jin J Z, et al. Microstructure of Al-substituted goethite and its adsorption performance for Pb(Ⅱ) and As(Ⅴ)[J]. The Science of the Total Environment, 2021, 790: 148202 DOI:10.1016/j.scitotenv.2021.148202 (  0) 0) |
| [43] |
张志恒. 铝同晶替代水铁矿的磷吸附特性及CD-MUSIC模拟[D]. 武汉: 华中农业大学, 2021.
(  0) 0) |
| [44] |
Liu H B, Chen T H, Frost R L, et al. Effect of aging time and Al substitution on the morphology of aluminous goethite[J]. Journal of Colloid and Interface Science, 2012, 385(1): 81-86 DOI:10.1016/j.jcis.2012.07.016 (  0) 0) |
| [45] |
Ni C Y, Liu S, Cui L J, et al. Adsorption performance of Cr(ⅵ) onto Al-free and Al-substituted ferrihydrites[J]. RSC Advances, 2016, 6(71): 66412-66419 DOI:10.1039/C6RA09465A (  0) 0) |
| [46] |
Souza T G F, Freitas E T F, Mohallem N D S, et al. Defects induced by Al substitution enhance As(Ⅴ) adsorption on ferrihydrites[J]. Journal of Hazardous Materials, 2021, 420: 126544 DOI:10.1016/j.jhazmat.2021.126544 (  0) 0) |
| [47] |
Jiang Z X, Liu Q S, Colombo C, et al. Quantification of Al-goethite from diffuse reflectance spectroscopy and magnetic methods[J]. Geophysical Journal International, 2014, 196(1): 131-144 DOI:10.1093/gji/ggt377 (  0) 0) |
| [48] |
Yin H, Wang Q A, Li Z H, et al. Effect of Cd and Al coincorporation on the structures and properties of goethite[J]. ACS Earth and Space Chemistry, 2018, 2(12): 1283-1293 DOI:10.1021/acsearthspacechem.8b00159 (  0) 0) |
| [49] |
陈涛, 宋友桂, 曾蒙秀, 等. 影响XRD衍射谱形态的实验条件分析[J]. 地球环境学报, 2013, 4(2): 1249-1254 (  0) 0) |
| [50] |
Li W, Liang X L, An P F, et al. Mechanisms on the morphology variation of hematite crystals by Al substitution: The modification of Fe and O reticular densities[J]. Scientific Reports, 2016, 6: 35960 DOI:10.1038/srep35960 (  0) 0) |
| [51] |
Hansel C M, Learman D R, Lentini C J, et al. Effect of adsorbed and substituted Al on Fe(Ⅱ)-induced mineralization pathways of ferrihydrite[J]. Geochimica et Cosmochimica Acta, 2011, 75(16): 4653-4666 DOI:10.1016/j.gca.2011.05.033 (  0) 0) |
| [52] |
Liu H, Cao F L, Li P, et al. The formation of discoid hematite particles from Al-doped ferrihydrite: The effect of trace Fe(Ⅱ) and the introduction procedures of Al(Ⅲ)[J]. Chemical Engineering Journal, 2010, 157(1): 254-262 DOI:10.1016/j.cej.2009.12.018 (  0) 0) |
| [53] |
Ye C J, Ariya P A, Fu F L, et al. Influence of Al(Ⅲ) and Sb(Ⅴ) on the transformation of ferrihydrite nanoparticles: Interaction among ferrihydrite, coprecipitated Al(Ⅲ) and Sb(Ⅴ)[J]. Journal of Hazardous Materials, 2021, 408: 124423 DOI:10.1016/j.jhazmat.2020.124423 (  0) 0) |
| [54] |
Schwertmann U, Friedl J, Stanjek H, et al. The effect of Al on Fe oxides. ⅩⅨ. Formation of Al-substituted hematite from ferrihydrite at 25 ℃ and pH 4 to 7.[J]. Clays and Clay Minerals, 2000, 48: 159-172 DOI:10.1346/CCMN.2000.0480202 (  0) 0) |
| [55] |
Bazilevskaya E, Archibald D D, Martínez C E. Rate constants and mechanisms for the crystallization of Al nano-goethite under environmentally relevant conditions[J]. Geochimica et Cosmochimica Acta, 2012, 88: 167-182 DOI:10.1016/j.gca.2012.04.026 (  0) 0) |
| [56] |
李葳, 王文涛, 殷辉. 铝同晶替代对水铁矿向赤铁矿转化的影响[J]. 华中农业大学学报, 2021, 40(6): 75-83 DOI:10.13300/j.cnki.hnlkxb.2021.06.010 (  0) 0) |
| [57] |
Namayandeh A, Kabengi N. Calorimetric study of the influence of aluminum substitution in ferrihydrite on sulfate adsorption and reversibility[J]. Journal of Colloid and Interface Science, 2019, 540: 20-29 DOI:10.1016/j.jcis.2019.01.001 (  0) 0) |
| [58] |
Prywer J. On the crystal geometry influence on the growth of fast-growing surfaces[J]. Journal of Physics and Chemistry of Solids, 2002, 63(3): 491-499 DOI:10.1016/S0022-3697(01)00186-X (  0) 0) |
| [59] |
Ruan H D, Gilkes R J. Dehydroxylation of aluminous goethite: Unit cell dimensions, crystal size and surface area[J]. Clays and Clay Minerals, 1995, 43(2): 196-211 DOI:10.1346/CCMN.1995.0430207 (  0) 0) |
| [60] |
Zhu S, Zhang P, Liang Y, et al. Effects of aluminum substitution on the surface charge of colloidal goethite particles: Experiments and MUSIC modeling[J]. Environmental Science and Pollution Research International, 2020, 27(31): 38397-38406 DOI:10.1007/s11356-020-07793-6 (  0) 0) |
| [61] |
Yin H, Feng X H, Qiu G H, et al. Characterization of Co-doped birnessites and application for removal of lead and arsenite[J]. Journal of Hazardous Materials, 2011, 188(1/2/3): 341-349 (  0) 0) |
| [62] |
Boily J F, Kozin P A. Particle morphological and roughness controls on mineral surface charge development[J]. Geochimica et Cosmochimica Acta, 2014, 141: 567-578 DOI:10.1016/j.gca.2014.06.016 (  0) 0) |
| [63] |
Venema P, Hiemstra T, Weidler P G, et al. Intrinsic proton affinity of reactive surface groups of metal (hydr)oxides: Application to iron (hydr)oxides[J]. Journal of Colloid and Interface Science, 1998, 198(2): 282-295 DOI:10.1006/jcis.1997.5245 (  0) 0) |
| [64] |
Boily J F, Lützenkirchen J, Balmès O, et al. Modeling proton binding at the goethite (α-FeOOH)-water interface[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2001, 179(1): 11-27 (  0) 0) |
| [65] |
Barrón V, Torrent J. Surface hydroxyl configuration of various crystal faces of hematite and goethite[J]. Journal of Colloid and Interface Science, 1996, 177(2): 407-410 DOI:10.1006/jcis.1996.0051 (  0) 0) |
| [66] |
Han J, Katz L E. Capturing the variable reactivity of goethites in surface complexation modeling by correlating model parameters with specific surface area[J]. Geochimica et Cosmochimica Acta, 2019, 244: 248-263 DOI:10.1016/j.gca.2018.09.008 (  0) 0) |
| [67] |
朱朝菊, 向文军, 罗和青, 等. 铝掺杂针铁矿的制备、表征及吸附氟的特性[J]. 无机化学学报, 2017, 33(12): 2215-2224 DOI:10.11862/CJIC.2017.266 (  0) 0) |
| [68] |
Gulicovski J J, Čerović L S, Milonjić S K. Point of zero charge and isoelectric point of alumina[J]. Materials and Manufacturing Processes, 2008, 23(6): 615-619 DOI:10.1080/10426910802160668 (  0) 0) |
| [69] |
Antelo J, Fiol S, Pérez C, et al. Analysis of phosphate adsorption onto ferrihydrite using the CD-MUSIC model[J]. Journal of Colloid and Interface Science, 2010, 347(1): 112-119 DOI:10.1016/j.jcis.2010.03.020 (  0) 0) |
| [70] |
Antelo J, Avena M, Fiol S, et al. Effects of pH and ionic strength on the adsorption of phosphate and arsenate at the goethite-water interface[J]. Journal of Colloid and Interface Science, 2005, 285(2): 476-486 DOI:10.1016/j.jcis.2004.12.032 (  0) 0) |
| [71] |
Kosmulski M. The pH-dependent surface charging and points of zero charge[J]. Journal of Colloid and Interface Science, 2011, 353(1): 1-15 DOI:10.1016/j.jcis.2010.08.023 (  0) 0) |
| [72] |
梁雨. 铝同晶替代铁氧化物表面铅吸附机制及CD-MUSIC模拟[D]. 武汉: 华中农业大学, 2021.
(  0) 0) |
| [73] |
严玉鹏, 王小明, 刘凡, 等. 有机磷与土壤矿物相互作用及其环境效应研究进展[J]. 土壤学报, 2019, 56(6): 1290-1299 (  0) 0) |
| [74] |
张佩. 铝同晶替代对针铁矿吸附Pb(Ⅱ)的影响及其CD-MUSIC模拟[D]. 武汉: 华中农业大学, 2015.
(  0) 0) |
| [75] |
万娟, 薛哲, 张舵. 铝同晶替代针铁矿对Cd2+吸附性能的影响研究[J]. 四川化工, 2021, 24(3): 11-14 DOI:10.3969/j.issn.1672-4887.2021.03.003 (  0) 0) |
| [76] |
Ma M H, Gao H Y, Sun Y B, et al. The adsorption and desorption of Ni(Ⅱ) on Al substituted goethite[J]. Journal of Molecular Liquids, 2015, 201: 30-35 DOI:10.1016/j.molliq.2014.11.024 (  0) 0) |
| [77] |
Adra A, Morin G, Ona-Nguema G, et al. Arsenate and arsenite adsorption onto Al-containing ferrihydrites. Implications for arsenic immobilization after neutralization of acid mine drainage[J]. Applied Geochemistry, 2016, 64: 2-9 DOI:10.1016/j.apgeochem.2015.09.015 (  0) 0) |
| [78] |
李成. 铝同晶替代赤铁矿形貌演化机制及其对磷的吸附特征研究[D]. 武汉: 华中农业大学, 2017.
(  0) 0) |
| [79] |
Tufo A E, Larralde A L, Villarroel-Rocha J, et al. Synthesis and characterization of pure and Al-substituted akaganeites and evaluation of their performance to adsorb As(Ⅴ)[J]. Journal of Environmental Chemical Engineering, 2018, 6(6): 7044-7053 DOI:10.1016/j.jece.2018.10.009 (  0) 0) |
| [80] |
方敦, 王锐, 许海娟, 等. 硅/铝掺杂纤铁矿的表面性质及对F-的吸附性能[J]. 环境污染与防治, 2020, 42(3): 287-292 (  0) 0) |
| [81] |
Sun Y B, Yang S B, Wang Q, et al. Sequestration of uranium on fabricated aluminum co-precipitated with goethite (Al-FeOOH)[J]. Radiochimica Acta, 2014, 102(9): 797-804 DOI:10.1515/ract-2013-2204 (  0) 0) |
| [82] |
Li M X, Liu H B, Chen T H, et al. Adsorption of europium on Al-substituted goethite[J]. Journal of Molecular Liquids, 2017, 236: 445-451 DOI:10.1016/j.molliq.2017.04.046 (  0) 0) |
| [83] |
Li M X, Liu H B, Zhu H J, et al. Kinetics and mechanism of Sr(Ⅱ) adsorption by Al-Fe2O3: Evidence from XPS analysis[J]. Journal of Molecular Liquids, 2017, 233: 364-369 DOI:10.1016/j.molliq.2017.03.045 (  0) 0) |
| [84] |
Johnston C P, Chrysochoou M. Mechanisms of chromate, selenate, and sulfate adsorption on Al-substituted ferrihydrite: Implications for ferrihydrite surface structure and reactivity[J]. Environmental Science & Technology, 2016, 50(7): 3589-3596 (  0) 0) |
 2023, Vol. 55
2023, Vol. 55


