2. 中国农业科学院麻类研究所, 长沙 410205;
3. 江苏省土壤利用与农业可持续发展工程研究中心, 南京 210023;
4. 江苏省地理信息资源开发与利用协同创新中心, 南京 210023
酚酸是高等植物最丰富的次生代谢产物之一,也是一类重要的植物化感物质,可通过根系分泌、残体和凋落物分解、雨雾淋溶等方式进入土壤环境[1]。研究表明,当酚酸类物质在土壤中积累到一定浓度以后,就会抑制植物根系生长,降低根系酶活性,影响激素合成和光合作用,进而导致其生长不良,甚至发病和死亡,这在经济作物如花生、黄瓜等连作系统中较为常见[2-3]。还有一些研究发现,酚酸类物质能够促进土传病原菌增殖,破坏土壤微生态平衡,增加作物土传病害和连作障碍的发生风险[4-5]。因此,酚酸类物质被认为是驱动作物产生连作障碍的关键诱因。
强还原土壤处理(Reductive Soil Disinfestation, RSD)是在作物种植前,通过向土壤中施用以易分解有机物料为主要原料制成的产品,灌溉至土壤水分饱和,覆膜2 ~ 4周,快速创造土壤强还原环境,短期内实现土传病害防控和退化土壤修复的方法[6]。大量应用实践表明,RSD处理在消除黄瓜、青椒、芹菜、芥蓝等蔬菜作物以及洋桔梗、非洲菊等花卉作物的连作障碍上取得了显著的效果[7-8]。作物秸秆、植物残渣以及农产品加工副产物因含有丰富的易分解有机碳,是RSD处理重要的有机物料来源。然而,秸秆和植物残渣等有机物料中通常富含酚酸类物质[9-10],研究表明其提取液或腐解液对玉米、水稻等幼苗生长具有明显的化感自毒效应[11-12]。因此,我们认为以秸秆或植物残渣为主要原料的RSD处理会增加土壤中酚酸的含量,但目前其对土壤酚酸的增加效应以及后续土壤酚酸随再植作物生长的动态变化规律还缺乏相应的研究报道。
研究表明,外源施用微生物菌剂能够促进土壤中酚酸类物质的分解,降低土壤酚酸的含量并进而缓解作物连作障碍[13-14]。陈冉等[15]研究发现贝莱斯芽孢杆菌XC1菌株可有效降低苹果连作土壤中根皮苷、根皮素、阿魏酸、肉桂酸等酚类物质的含量。因此,外源添加具有酚酸降解功能的微生物菌剂可在一定程度上消减因秸秆类有机物料RSD处理带来的土壤酚酸水平增加所引起的负面效应。本课题组前期的研究发现以农产品加工副产物为原料制成的液体有机物料和以植物残渣为原料制成的固体有机物料RSD处理均可有效消除土传根腐病菌、杂草等再植龙牙百合生长不利因子[16]。本研究拟在此基础上,首先分析不同有机物料RSD处理对土壤酚酸类物质组成及含量的影响,并通过在龙牙百合再植过程中设置枯草芽孢杆菌Y25的添加试验,研究土壤酚酸谱在龙牙百合生长过程中的动态变化以及枯草芽孢杆菌施用对其含量和组成的影响,旨在从植物酚酸自毒作用角度对RSD处理的潜在应用风险进行科学评估,并为通过施用具有酚酸降解功能的微生物菌剂来缓解因土壤酚酸增加引起的作物再植风险提供依据,为RSD处理技术的科学应用及其配套措施的研发提供理论基础。
1 材料与方法 1.1 研究区概况田间试验设置于中国农业科学院麻类研究所沅江试验基地(28°51′ N,112°11′ E),该地区属亚热带湿润季风气候,年均气温16.9 ℃,年均降水量为1 322 mm。试验前该基地已种植龙牙百合一年,其0 ~ 20 cm土壤基本性质为pH 4.7,电导率81.2 μS/cm,有机碳12.0 g/kg,全氮1.3 g/kg,有效磷150.4 mg/kg,有效钾313.7 mg/kg,尖孢镰刀菌和腐皮镰刀菌数量分别为2.2 × 107和2.3 × 106 copies/g(以干土计)。
1.2 试验材料RSD处理所用有机物料购自云南丽然农业科技发展有限公司,其中制糖发酵废液的有机碳含量为347.8 g/kg,全氮含量为16.8 g/kg,C/N为20.7;植物残渣的有机碳含量为442.4 g/kg,全氮含量为4.7 g/kg,C/N为94.1。制糖发酵液、植物残渣以及处理前土壤的酚酸含量见表 1,其中土壤中的酚酸含量不高,仅为6.8 μg/g(以干土计,下同),制糖发酵液中酚酸含量为707.7 μg/g,而植物残渣中的酚酸含量高达11 494.8 μg/g。枯草芽孢杆菌(Bacillus subtilis)Y25由中国农业科学院南方经济作物研究中心种质资源研究室提供,纯培养实验研究发现该菌株对阿魏酸、丁香酸等酚酸具有较好的降解作用。
|
|
表 1 试验前土壤及RSD处理所用有机物料的酚酸含量(μg/g) Table 1 Phenolic acid contents of soil before treatment and organic materials used in RSD treatment |
田间试验采用裂区试验设计,主区为土壤处理,分别为:①CK,不做任何土壤处理的对照;②MO,添加以制糖发酵液为主要有机物料的RSD处理(6 t/hm2);③SB,添加以植物残渣为主要有机物料的RSD处理(15 t/hm2)。副区为菌剂施用处理,包括施用枯草芽孢杆菌Y25和不加菌的对照。以随机区组排列主区试验,在主区内随机排列副区试验,共6个处理,分别为CK、CK_Y25、MO、MO_Y25、SB和SB_Y25,3次重复,18个小区,每个小区面积25 m2。具体试验过程如下,首先对连作龙牙百合土壤进行RSD处理,其田间操作流程参照王宝英等[8]的方法,共处理35 d,处理结束后揭开塑料薄膜自然落干二周,随后选取大小一致、外观良好的龙牙百合二代种球进行栽种;待来年百合齐苗后,将各土壤处理裂区成两部分,一半于百合茎基部浇淋枯草芽孢杆菌Y25,另一半作为不加菌的对照。Y25菌株按照1 × 108 cfu/mL的浓度,每亩(15亩=1 hm2)100 kg浇施两次,于2020年3月25日第一次浇施后相隔两星期再次浇施。
分别在RSD处理后(2019年9月29日)、百合生长期(2020年4月30日)和收获期(2020年7月15日)采集土壤样品。样品采集时,用直径为2.5 cm的土钻在各小区按“S”形路线随机选取8个0 ~ 20 cm的土芯合并为1个土壤样品,本研究共获得45个土壤样品(土体土),其中9个样品于RSD处理后采集,另外36个样品于百合生长期和收获期采集。所有样品剔除植物残根和杂质后过2 mm筛并分装,一部分–80 ℃保存,用于土壤总DNA的提取;一部分土样自然风干,研磨并过50目筛,用于土壤酚酸类物质的提取。
1.4 研究方法 1.4.1 土壤和有机物料中酚酸类物质的提取土壤酚酸的提取参照Wang等[17]的方法。称取10 g风干土样(50目)置于50 mL离心管中,加入20 mL 2 mol/L NaOH溶液,摇床振荡提取12 h(30 ℃,220 r/min)后离心(3 000 r/min,3 min)并收集上清液,然后用5 mol/L HCl溶液调节上清液pH至2.5后用等量乙酸乙酯萃取3次,合并萃取液。利用旋转蒸发仪将萃取液蒸发至干(45 ℃),所得残渣用5 mL甲醇重新溶解,用0.22 μm有机系滤膜过滤后保存于–20 ℃冰箱中备用。按照上述方法提取制糖发酵废液和植物残渣中的酚酸类物质。
1.4.2 提取液中酚酸类物质的测定根据预试验结果,选择对香豆酸、阿魏酸、对羟基苯甲酸、苯甲酸、丁香酸、香草酸、肉桂酸、水杨酸和香兰素9种酚酸物质为测定指标。称取此9种酚酸物质标准品(购自北纳生物,纯度≥98%)各1 mg,加入10 mL甲醇溶解配制成100 μg/mL的标准溶液,所得标准溶液用0.22 μm有机系滤膜过滤后各吸取1 mL配制成混合标准溶液,然后梯度稀释混合标准液配制标准曲线。利用高效液相色谱(High Performance Liquid Chromatography, HPLC)Waters e2695系统的PDA检测器对标准溶液和上述土壤浸提液中的酚酸进行测定,色谱柱为Waters C18(250 mm×4.6 mm,5 μm),流动相由甲醇(A)和0.16% 的乙酸水溶液(B)组成,其梯度设置为:0 min,流动相A为5%,流动相B为95%;5 min,流动相A为20%,流动相B为80%;10 min,流动相A为35%,流动相B为65%;21 min,流动相A为45%,流动相B为55%;30 min,流动相A为60%,流动相B为40%;33 min,流动相A为5%,流动相B为95%;35 min,流动相A为5%,流动相B为95%。流速0.6 mL/min,波长280 nm,柱温40 ℃;进样量10 μL。以标准样品的保留时间为依据,对浸提液中的酚酸类物质进行鉴定,并根据标准曲线和各酚酸物质的峰面积计算其含量。
1.4.3 土壤DNA提取及芽孢杆菌属的定量使用FastDNA® SPIN Kit for Soil(MP Biomedicals,USA)提取土壤基因组DNA,经过DS-11超微量分光光度计(DeNovix,USA)质控后–80 ℃保存待用。芽孢杆菌属的荧光定量PCR在QuanStudio 3 Real-Time PCR system(Applied Biosystems,USA)上进行,混合体系(20 μL)包括10 μL 2×SYBR® Green Pro Taq HS Premix (ROX plus)(艾科瑞生物,中国湖南),1 μL正向引物(Bs16S1:5’-ATGTTAGCGGCGGACGGGTGAG-3’,10 μmol/L)和1 μL反向引物(Bs16SR:5’-AAGTTCCCCAGTTTCCAATGACC-3’,10 μmol/L)[18],6 μL ddH2O和2 μL DNA,反应条件为95 ℃预变性1 min,随后95 ℃变性5 s、60 ℃退火延伸30 s、39个循环。参照Zhao等[19]的方法构建芽孢杆菌属定量的标准曲线,并根据该标准曲线计算土壤中芽孢杆菌属的丰度。
1.5 数据处理利用SPSS 22.0进行统计分析,采用单因素方差分析(One-way ANOVA)配合Duncan事后多重比较检验多处理间酚酸含量均值差异的显著性,采用T检验比较各土壤处理下添加枯草芽孢杆菌与不添加对土壤酚酸含量影响的显著性;利用R语言prcomp函数对不同处理的9种酚酸进行主成分分析(Principal Component Analysis,PCA),并采用置换多因素方差分析(Permutational Multivariate Analysis of Variance,PERMANOVA)检验多处理间酚酸谱差异的显著性,利用ggplot2包绘制主成分分析图;利用相对降解率表示枯草芽孢杆菌Y25添加在各土壤处理的基础上对酚酸含量的影响,以MO处理为例,其具体计算方法为:Y25的相对降解率(%)=(MO土壤处理的平均酚酸含量–MO_Y25的酚酸含量)/MO处理的平均酚酸含量×100。
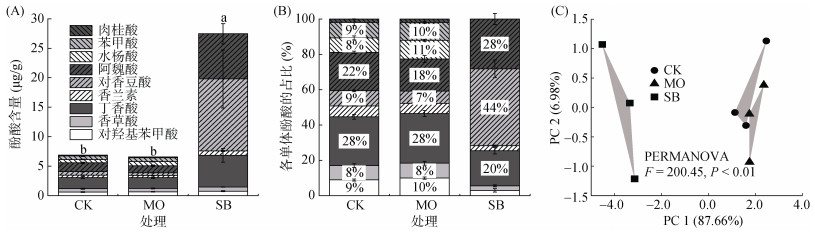
2 结果 2.1 RSD处理对土壤酚酸类物质的影响HPLC检测结果显示,与CK相比,MO处理对土壤酚酸类物质的组成和含量均无显著影响,而SB处理土壤中虽未检测到水杨酸、苯甲酸和肉桂酸,但其酚酸类物质的总含量显著(P < 0.05)增加,达到27.46 μg/g (图 1A)。与CK和MO处理相比,SB处理显著(P < 0.05)增加了土壤中对香豆酸、阿魏酸、丁香酸和香兰素的含量,其中对香豆酸和阿魏酸增加最多,对香豆酸的含量分别达到CK和MO处理的20.6倍和26.8倍,阿魏酸的含量分别为CK和MO处理的5.1倍和6.4倍,而RSD处理对对羟基苯甲酸和香草酸的含量均无显著影响。RSD处理对各单体酚酸占比的影响较其含量有所不同,与CK和MO处理相比,SB处理显著(P < 0.05)增加了土壤中对香豆酸和阿魏酸的占比(对香豆酸:SB 44%,CK 9%,MO 7%;阿魏酸:SB 28%,CK 22%,MO 18%),而丁香酸、香兰素、对羟基苯甲酸和香草酸的占比则显著(P < 0.05)下降(图 1B)。PCA分析显示(图 1C),MO和CK处理的土壤酚酸谱较为相似,而SB处理显著(P < 0.01)改变了土壤酚酸谱。结果表明,RSD处理对土壤酚酸类物质的影响与所用有机物料类型密切相关,其中植物残渣类有机物料的RSD处理能够显著增加土壤酚酸含量,改变土壤酚酸谱特征。
|
CK,对照;MO,添加以制糖发酵液为主要有机物料的RSD处理;SB,添加以植物残渣为主要有机物料的RSD处理。误差棒表示标准差,柱上方不同字母表示处理间总酚酸含量差异显著(P < 0.05)。下同 图 1 RSD处理对土壤酚酸含量(A)、各单体酚酸占比(B)及其排序(C)的影响 Fig. 1 Effects of RSD treatment on content (A), proportion (B), and ordination (C) of soil phenolic acids |
由图 2可知,随着再植龙牙百合的生长,CK处理土壤中酚酸含量略有增加,但变化并不显著;MO处理土壤中酚酸含量呈先显著(P < 0.05)增加后逐渐趋于平稳的变化规律;而SB处理土壤中酚酸含量先增加后快速(P < 0.05)下降。此外,再植百合在生长前期对RSD处理土壤中酚酸含量的增加效应显著(P < 0.05)大于CK处理,这可能与RSD处理后再植龙牙百合的长势明显优于CK处理,进而向土壤环境中分泌释放更多的酚酸有关。

|
图 2 不同土壤处理下总酚酸含量的动态变化 Fig. 2 Dynamic changes of total phenolic acid contents under different soil treatments |
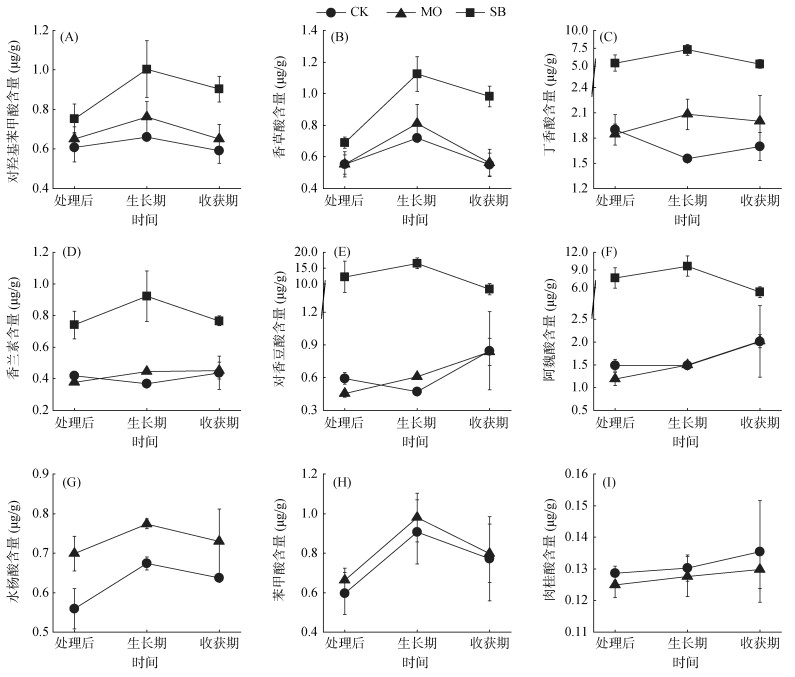
如图 3A ~ 3F所示,SB处理中各酚酸单体(对羟基苯甲酸、香草酸、丁香酸、香兰素、对香豆酸和阿魏酸)的含量与其总量随龙牙百合生长的变化规律一致,即呈现先增加后降低的趋势,且其含量在百合生长期和收获期均显著(P < 0.05)高于CK和MO处理。然而,在龙牙百合生长过程中,CK和MO处理中各酚酸单体含量的变化规律与其总量有所差异,其中MO处理土壤中的对羟基苯甲酸、香草酸、丁香酸、水杨酸和苯甲酸的含量先增加后减少,而香兰素、对香豆酸、阿魏酸和肉桂酸的含量呈现逐渐增加的趋势(图 3);在CK处理中,对羟基苯甲酸、香草酸、水杨酸和苯甲酸的含量随百合生长呈现先增加后减少的趋势,与丁香酸、香兰素和对香豆酸的含量变化正好相反,而阿魏酸和肉桂酸的含量在百合生长前期较为稳定,随着百合的进一步生长,其含量略有增加(图 3)。此外,再植百合生长对不同RSD处理土壤中酚酸单体含量的变化幅度存在一定的影响,如SB处理土壤中对羟基苯甲酸、香草酸以及香兰素的含量变化幅度在百合生长前期大于MO处理。结果表明,龙牙百合再植过程中土壤总酚酸及各单体酚酸含量的动态变化不仅与RSD处理所用有机物料类型及酚酸种类有关,还与土壤处理后再植龙牙百合的长势及其根系分泌物特征有关。
|
图 3 不同土壤处理下各单体酚酸含量的动态变化 Fig. 3 Dynamic changes of phenolic acid contents under different soil treatments |
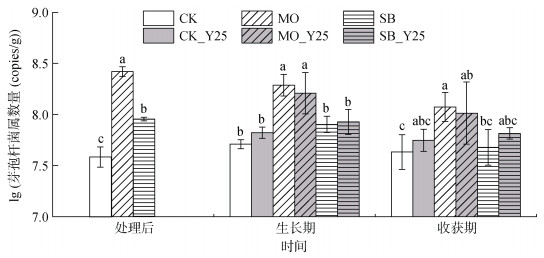
RSD处理均能显著(P < 0.05)提高土壤中芽孢杆菌属的数量,且MO处理土壤中芽孢杆菌属的数量显著(P < 0.05)高于SB处理(图 4),表明RSD处理能够重建健康的土壤微生物区系。在龙牙百合生长期和收获期,添加枯草芽孢杆菌Y25对土壤中芽孢杆菌属的数量无显著影响(图 4),这可能与添加前土壤中芽孢杆菌属的丰度较高有关。
|
CK_Y25,MO_Y25和SB_Y25分别表示在CK,MO和SB处理的基础上于百合齐苗后裂区浇施枯草芽孢杆菌Y25,下同 图 4 不同处理下芽孢杆菌属数量变化 Fig. 4 Changes in population of Bacillus genus under different treatments |
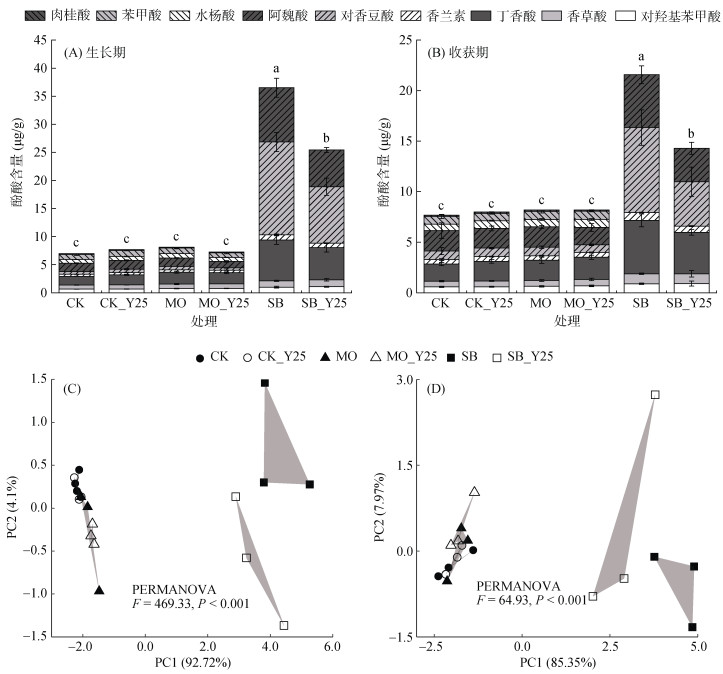
如图 5A、5B所示,添加枯草芽孢杆菌Y25可显著(P < 0.05)降低SB处理土壤中总酚酸及丁香酸、对香豆酸和阿魏酸的含量,且这种效应不会随着龙牙百合生长而变弱,而对CK和MO处理土壤中酚酸类物质的含量无显著影响。PCA分析结果同样发现(图 5C、5D),添加枯草芽孢杆菌Y25可显著(P < 0.001)改变SB处理土壤的酚酸谱特征,而对CK和MO处理的土壤酚酸谱特征影响不大。进一步分析发现,不管是龙牙百合生长期还是收获期,枯草芽孢杆菌Y25对SB处理土壤中总酚酸的相对降解率均可达30% 以上,其中对对香豆酸的降解效果最为显著,分别为39.2% 和47.8%,高于阿魏酸(32.3%,36.7%)、丁香酸(21.0%,22.4%)和香兰素(13.9%,20.6%)(表 2)。在龙牙百合生长期,枯草芽孢杆菌Y25对MO处理土壤中的酚酸类物质也具有一定的降解作用,但这种效应随着百合的生长逐渐下降甚至转变为促进(表 2)。结果表明,外源添加枯草芽孢杆菌Y25能够有效降低土壤中酚酸类物质的含量,但这种降解效应与土壤本底酚酸含量的高低密切相关。
|
图 5 再植龙牙百合生长期和收获期土壤酚酸含量(A,B)及其排序特征(C,D) Fig. 5 Content (A, B) and ordination characteristics (C, D) of soil phenolic acids at growing and harvest stage of replanted Longya Lily |
|
|
表 2 枯草芽孢杆菌Y25添加对土壤酚酸的相对降解率(%) Table 2 Relative degradation effects of B. subtilis Y25 on soil phenolic acids |
酚酸是一类重要的化感物质,广泛存在于高等植物的根系分泌物和残体中[20-21]。研究发现,随着作物连作年限的增加,土壤中对羟基苯甲酸、香草酸、对香豆酸、肉桂酸等酚酸类物质含量越来越高,当其积累到一定浓度以后,就会对连作作物的生长产生毒害作用,严重时可致其死亡[22-23]。同时,作为提高土壤有机质含量常用的农业措施,秸秆还田同样也会增加土壤中对香豆酸、香草醛、对羟基苯甲酸等酚酸浓度,并进而对下茬作物产生化感效应,是导致其根系生长不良、养分吸收速率下降的“罪魁祸首”[9, 24]。本研究发现以植物残渣为主要有机物料的SB处理显著提高了土壤酚酸水平,其中阿魏酸和对香豆酸的含量增加最显著,达到7.65 μg/g和12.23 μg/g,分别是CK处理的5.1倍和20.6倍,这是因为植物残渣中含有大量的阿魏酸(1 574.5 μg/g)和对香豆酸(9 002.2 μg/g),而RSD处理促进了植物残渣的分解以及酚酸物质的释放。此外,研究发现植物残渣中的木质素等难降解物质在土壤中可进一步腐解转化为酚酸类物质[25],因此RSD处理结束后土壤酚酸水平仍可能有所提高,本试验结果与此一致。
研究表明,对香豆酸和阿魏酸均具有较强的化感活性,能够抑制植物体内酶活性、影响光合作用、改变根系功能等[26-27]。Abenavoli等[28]的研究发现,当对香豆酸的浓度为10 ~ 300 μmol/L(1.64 ~ 49.25 μg/mL)时,能显著抑制玉米幼苗的生长和根系养分吸收;而沈玉聪等[29]研究发现不同浓度阿魏酸(0.01、0.1、1、10、50、100 mg/L)处理均能显著降低三七幼苗的苗高和POD酶活性。在本课题组前期的应用推广过程中,确实存在RSD处理后再植作物仍出现生长发育不良的现象,这可能与再植作物对酚酸的耐受程度较低以及长时间暴露在较高酚酸水平的土壤环境中所引起的化感效应有关[1]。除对植物产生直接的化感自毒作用以外,对香豆酸、阿魏酸等酚酸物质对土壤微生物群落结构组成及其功能也有负面影响[30]。Zhou等[5]和Jin等[3]研究发现添加对香豆酸、阿魏酸能够降低黄瓜根际土壤细菌多样性及有益微生物(如溶杆菌)的相对丰度,刺激植物病原微生物(如镰刀菌)的生长,加剧植物–土壤负反馈作用,并进而抑制黄瓜幼苗的生长。因此,本研究SB处理土壤中对香豆酸、阿魏酸等酚酸含量显著增高,可能会导致病原菌迅速增殖和微生物区系恶化问题,并进而对再植龙牙百合的健康产生威胁。综上,在利用RSD处理缓解对酚酸敏感的作物连作障碍问题时,应慎重使用以秸秆或植物残渣等原料制成的有机物料。
降低土壤中酚酸类物质含量是有效降低其负面效应的关键,而某些微生物类群因具备漆酶、DyP型过氧化物酶、芳香醇氧化酶等的编码功能,可实现对含酚环化合物的代谢[21]。Duan等[31]研究发现,施用解淀粉芽孢杆菌QSB-6制成的生物有机肥能够显著降低肉桂酸、苯甲酸、阿魏酸、香兰素、对羟基苯甲酸、咖啡酸等酚酸类物质,缓解苹果再植病害的发生。王洁等[32]研究表明,恒温培养7 d后,芽孢杆菌ZD-4对对羟基苯甲酸、水杨酸、苯甲酸等的降解率可达到80% 以上。本研究结果发现添加枯草芽孢杆菌Y25能够显著降低SB处理土壤中总酚酸的含量,其对对香豆酸和阿魏酸的降解率分别高达39.2% 和32.3%,这与前人报道的枯草芽孢杆菌可利用阿魏酸及其降解的中间产物香兰素、香草酸和原儿茶酸的结果相类似[33]。此外,本研究发现枯草芽孢杆菌Y25的降解能力并未随再植百合的生长而下降,这可能与RSD处理形成的土壤环境有利于其定殖和功能发挥有关。因此,外源添加具备酚酸降解功能的微生物菌株可在一定程度上消减因秸秆或植物残渣类物料RSD处理引起的土壤酚酸水平提高带来的化感效应。所以,在RSD推广应用过程中,可将添加酚酸降解功能微生物作为该处理的配套措施,以缓解或消除因其带来的再植作物化感自毒风险。但是,关于外源添加的菌株对不同作物土壤中酚酸降解能力的稳定性以及其是否协同其他土著微生物实现酚酸降解功能还需进一步研究。
4 结论本研究证实以植物残渣为主要有机物料的RSD处理会显著提高土壤酚酸类物质的含量,其中对香豆酸和阿魏酸的增加尤为显著,而添加具有酚酸降解功能的枯草芽孢杆菌Y25可有效降低土壤中对香豆酸、阿魏酸等酚酸物质的含量。因此,在应用以秸秆或植物残渣为有机物料进行RSD处理修复连作障碍土壤时,应关注由此可能带来的因土壤酚酸增加引起的再植作物化感自毒风险,而外源施用酚酸降解功能微生物有望成为缓解或消除该风险的有效配套措施。本研究结果对进一步提高RSD处理的科学应用以及促进相关配套措施的研发具有重要的意义,为保障RSD处理在推广应用过程中的稳定有效奠定了更为扎实的基础。
| [1] |
谢星光, 陈晏, 卜元卿, 等. 酚酸类物质的化感作用研究进展[J]. 生态学报, 2014, 34(22): 6417-6428 (  0) 0) |
| [2] |
王爽, 郑世伟, 李笑, 等. 日光温室黄瓜长期连作自毒物质累积与土壤肥力因子的关系[J]. 应用生态学报, 2022, 33(3): 784-792 (  0) 0) |
| [3] |
Jin X, Wu F Z, Zhou X G. Different toxic effects of ferulic and p-hydroxybenzoic acids on cucumber seedling growth were related to their different influences on rhizosphere microbial composition[J]. Biology and Fertility of Soils, 2020, 56(1): 125-136 DOI:10.1007/s00374-019-01408-0 (  0) 0) |
| [4] |
Wu H M, Wu L K, Wang J Y, et al. Mixed phenolic acids mediated proliferation of pathogens Talaromyces helicus and Kosakonia sacchari in continuously monocultured Radix pseudostellariae rhizosphere soil[J]. Frontiers in Microbiology, 2016, 7: 335 (  0) 0) |
| [5] |
Zhou X G, Zhang J H, Pan D D, et al. p-Coumaric can alter the composition of cucumber rhizosphere microbial communities and induce negative plant-microbial interactions[J]. Biology and Fertility of Soils, 2018, 54(3): 363-372 DOI:10.1007/s00374-018-1265-x (  0) 0) |
| [6] |
蔡祖聪, 张金波, 黄新琦, 等. 强还原土壤灭菌防控作物土传病的应用研究[J]. 土壤学报, 2015, 52(3): 469-476 (  0) 0) |
| [7] |
Huang X Q, Zhao J, Zhou X, et al. How green alternatives to chemical pesticides are environmentally friendly and more efficient[J]. European Journal of Soil Science, 2019, 70(3): 518-529 DOI:10.1111/ejss.12755 (  0) 0) |
| [8] |
王宝英, 李金泽, 黄新琦, 等. 土壤强还原处理对连作芥蓝产量、微生物数量及活性的影响[J]. 土壤, 2019, 51(2): 316-323 (  0) 0) |
| [9] |
胡晓军, 郑皓皓, 贾敬业, 等. 麦秸还田耕层酚酸的时间变化及其对夏玉米幼苗生长和产量的影响[J]. 生态学杂志, 2001, 20(3): 9–11, 8 (  0) 0) |
| [10] |
于建光, 顾元, 常志州, 等. 小麦秸秆浸提液和腐解液对水稻的化感效应[J]. 土壤学报, 2013, 50(2): 349-356 (  0) 0) |
| [11] |
于建光, 常志州, 王宁, 等. 高效液相色谱法测定秸秆浸提液或腐解液中12种酚酸[J]. 农业环境科学学报, 2016, 35(11): 2231-2236 DOI:10.11654/jaes.2016-0591 (  0) 0) |
| [12] |
董淑琦, 曹鹏, 胡春艳, 等. 谷子秸秆不同部位水浸液对3种杂草的化感作用[J]. 应用生态学报, 2020, 31(7): 2243-2250 (  0) 0) |
| [13] |
谢星光, 戴传超, 苏春沦, 等. 内生真菌对花生残茬腐解及土壤酚酸含量的影响[J]. 生态学报, 2015, 35(11): 3836-3845 (  0) 0) |
| [14] |
钟宇, 曹敬东, 郑元仙, 等. 微生物菌剂对植烟土壤酚酸含量和微生物数量的调节作用[J]. 西南农业学报, 2020, 33(9): 2037-2041 (  0) 0) |
| [15] |
陈冉, 姜伟涛, 赵蕾, 等. 贝莱斯芽孢杆菌XC1对苹果连作土壤酚酸含量及平邑甜茶幼苗生长的影响[J]. 植物生理学报, 2021, 57(10): 1974-1982 (  0) 0) |
| [16] |
夏青, 罗晨, 曾粮斌, 等. 强还原土壤处理对再植龙牙百合生长不利因子的消减作用[J]. 土壤学报, 2022, 59(1): 183-193 (  0) 0) |
| [17] |
Wang Y, Zhang W, Zhang Z, et al. Isolation, identification and characterization of phenolic acid-degrading bacteria from soil[J]. Journal of Applied Microbiology, 2021, 131(1): 208-220 (  0) 0) |
| [18] |
Mori K, Iriye R, Hirata M, et al. Quantification ofBacillus species in a wastewater treatment system by the molecular analyses[J]. Biotechnology and Bioprocess Engineering, 2004, 9(6): 482-489 (  0) 0) |
| [19] |
Zhao J, Ni T, Li J, et al. Effects of organic-inorganic compound fertilizer with reduced chemical fertilizer application on crop yields, soil biological activity and bacterial community structure in a rice-wheat cropping system[J]. Applied Soil Ecology, 2016, 99: 1-12 (  0) 0) |
| [20] |
Ren L X, Huo H W, Zhang F, et al. The components of rice and watermelon root exudates and their effects on pathogenic fungus and watermelon defense[J]. Plant Signaling & Behavior, 2016, 11(6): e1187357 (  0) 0) |
| [21] |
Wilhelm R C, DeRito C M, Shapleigh J P, et al. Phenolic acid-degrading Paraburkholderia prime decomposition in forest soil[J]. ISME Communications, 2021, 1(1): 4 (  0) 0) |
| [22] |
Chen S L, Zhou B L, Lin S S, et al. Accumulation of cinnamic acid and vanillin in eggplant root exudates and the relationship with continuous cropping obstacle[J]. African Journal of Biotechnology, 2011, 10(14): 2659-2665 (  0) 0) |
| [23] |
李培栋, 王兴祥, 李奕林, 等. 连作花生土壤中酚酸类物质的检测及其对花生的化感作用[J]. 生态学报, 2010, 30(8): 2128-2134 (  0) 0) |
| [24] |
赵亚慧, 王宁, 查显宝, 等. 麦秸还田下翻耕和不同水肥管理措施对稻田理化性质及水稻产量的影响[J]. 农业资源与环境学报, 2020, 37(2): 195-201 (  0) 0) |
| [25] |
Ryszkowski L, Szajdak L, Karg J. Effects of continuous cropping of rye on soil biota and biochemistry[J]. Critical Reviews in Plant Sciences, 1998, 17(2): 225-244 (  0) 0) |
| [26] |
Li H H, Inoue M, Nishimura H, et al. Interactions oftrans-cinnamic acid, its related phenolic allelochemicals, and abscisic acid in seedling growth and seed germination of lettuce[J]. Journal of Chemical Ecology, 1993, 19(8): 1775-1787 (  0) 0) |
| [27] |
冉瑞兰, 赛闹汪青, 孙坤, 等. 阿魏酸和凹土对党参种子萌发、生长及幼苗叶绿素荧光参数的影响[J]. 西北植物学报, 2019, 39(12): 2244-2252 (  0) 0) |
| [28] |
Abenavoli M R, Lupini A, Oliva S, et al. Allelochemical effects on net nitrate uptake and plasma membrane H+-ATPase activity in maize seedlings[J]. Biologia Plantarum, 2010, 54(1): 149-153 (  0) 0) |
| [29] |
沈玉聪, 张红瑞, 张子龙, 等. 酚酸类物质对三七幼苗的化感影响[J]. 广西植物, 2016, 36(5): 607–614, 631 (  0) 0) |
| [30] |
李自博, 周如军, 解宇娇, 等. 人参连作根际土壤中酚酸物质对人参锈腐病菌的化感效应[J]. 应用生态学报, 2016, 27(11): 3616-3622 (  0) 0) |
| [31] |
Duan Y N, Zhou Y F, Li Z, et al. Effects of Bacillus amyloliquefaciens QSB-6 on the growth of replanted apple trees and the soil microbial environment[J]. Horticulturae, 2022, 8(1): 83 (  0) 0) |
| [32] |
王洁, 王蓓蓓, 尚方剑, 等. 香草兰酚酸类自毒物质降解菌的筛选和鉴定及其抑菌效果[J]. 热带生物学报, 2022, 13(6): 595-604 (  0) 0) |
| [33] |
Gurujeyalakshmi G, Mahadevan A. Dissimilation of ferulic acid byBacillus subtilis[J]. Current Microbiology, 1987, 16(2): 69-73 (  0) 0) |
2. Institute of Bast Fiber Crops, Chinese Academy of Agricultural Sciences, Changsha 410205, China;
3. Jiangsu Engineering Research Center for Soil Utilization & Sustainable Agriculture, Nanjing 210023, China;
4. Jiangsu Center for Collaborative Innovation in Geographical Information Resource Development and Application, Nanjing 210023, China
 2023, Vol. 55
2023, Vol. 55


