2. 中国科学院土壤环境与污染修复重点实验室(南京土壤研究所), 南京 210008
在过去的几十年中,人们越来越关注环境中的有害污染物,例如BTEX(苯系物:苯、甲苯、二甲苯、乙苯)、染料、氯化碳、重金属等[1-2]。在这些污染物中,BTEX会对人类产生各种毒性作用,如急性致癌、致突变和致畸作用[3],被美国环境保护署列为优先控制环境污染物[4]。与此同时,随着我国城市化进程的快速发展和“退二进三”产业结构的调整[5],大批高污染高能耗的工矿企业相继关闭、搬迁,在城市及周边地区产生了大量的遗留污染场地[6-7],其存在较严重的土壤和地下水污染问题[8-9]。其中,BTEX的长期污染对人体健康和生活环境产生了不可忽视的影响[6]。因其具有对人体以及动植物危害极大的“三致”效应,在环境中的迁移、转化受到了人们广泛的关注[10-11],成为全球范围内关注的环境问题[12]。
长期污染的土壤一般具有自然衰减能力[13],在这一过程中,微生物通过参与土壤生态系统中的物质循环和能量流动,在土壤功能调节和污染物去除中发挥关键作用[2, 14]。这种由微生物产生的自然衰减能力深受土壤微生物群落特征的影响,如组成、多样性、功能、相互作用关系、组装模式等[15]。因此,对BTEX污染场地土壤微生物群落特征的研究可以进一步提高对土壤功能和生物修复过程的认识。污染物的微生物降解已被确立为一种可持续且经济的碳氢化合物污染土壤和地下水修复策略[16]。目前,已报道许多微生物会降解碳氢化合物,确定参与了有氧和厌氧降解的途径[17-18],而芳烃化合物的生物降解在环境净化中起着重要作用并且已被广泛研究[3]。近年来研究污染土壤或地下水的土著微生物生物降解的报道日益增多[19-20]。例如,Geng等[21]研究表明在长期污染的老化石油土壤中,土著微生物具有降解PAHs的能力,主要集中在变形菌门等[21];D'Ugo等[22]表明在污染水体中Alpha变形菌门和Beta变形菌门显著富集。然而,针对BTEX污染场地不同生境(浅层土、地下水和深层土)下土著微生物群落的对比研究较少。由此,本文基于化工厂搬迁后遗留污染场地不同生境下的微生物群落结构及BTEX代谢途径展开研究,以期为长期污染场地的微生物修复和可持续发展提供科学依据。
1 材料与方法 1.1 样品采集采样点位于江苏省苏州市某搬迁化工厂,该场地主要污染物为BTEX(苯、甲苯、乙苯、二甲苯)、氯苯、氯代烃、甲胺磷等。该化工厂于1990年组建,2007年完成搬迁,2021年进行场地修复,污染时间长达30年,本研究样品采集于修复工程开始前。现场勘测数据显示,该污染场地污染深度达地下15 m左右,因此本研究分别从该化工厂的“1号”和“2号”地块采集了浅层土(2 ~ 3 m)、地下水(6 ~ 9 m)和深层土(15 ~ 18 m)样品。其中,浅层土样品(S1、S2)采用五点采样法进行采集,地下水样品(G1、G2)和深层土样品(D1、D2)采用钻机进行破坏性采样,同时采集周边未污染浅层土壤作为对照土壤(CK)。每个样品3个重复,将采集后的样品置于冰盒中转移到实验室−20℃下储存。
1.2 样品有机物含量测定和DNA提取采用HJ 1067—2019《水质苯系物的测定顶空/气相色谱法》[23]进行BTEX的浓度测定,利用日本岛津气相色谱GC-2010(检测器:FID;色谱柱:InterCap-WAX熔融石英柱30 m×0.25 mm;取样器:HS-10顶空取样器)测定BTEX不同组分的浓度。使用FastDNA SPIN Kit for soil试剂盒(MP bio, Inc., CA, USA),根据说明书操作流程进行土壤总DNA提取。地下水样本DNA提取采用PES膜法提取:在超净工作台中将1 L地下水样品过无菌的0.2 μm PES膜截取水体中总微生物细胞;然后通过磁珠破碎(FastPrep匀浆仪,时间:40 s,速度:6.5 m/s)生物膜,将膜破碎后利用MP试剂盒进行总DNA提取。采用Nanodrop(Thermal, USA)测定DNA纯度,使用Qubit®荧光仪进行双链DNA(dsDNA)定量检测分析,然后再用1% 琼脂糖凝胶电泳检测DNA的完整性。
1.3 16S rRNA扩增子测序及生信分析土壤和水体总DNA样品送至广东美格基因科技有限公司进行微生物16S rRNA V4 ~ V5区基因扩增子测序,测序引物为515F(5'-GTGCCAGCMGCCGCGGTAA-3')和907R(5'-CCGTCAATTCMTTTRAGT TT-3')。PCR反应体系为25 μL,反应程序为:95℃预变性3 min,循环数30×(95℃变性30 s,55℃退火30 s,72℃延伸45 s);72℃延伸10 min。通过琼脂糖凝胶回收试剂盒E.N.A. Gel Extraction Kit (Omega,USA)切胶回收目标片段,利用Illumina(novaseq 6000)测序平台进行高通量测序。测序原始序列使用QIIME (V2.7.1)进行处理。使用Python进行数据整合和格式转换,然后用Vsearch软件对这些序列进行质控、去冗余并聚类操作分类单元(Operational Taxonomic Units,OTUs),相似性截断值为97%。将细菌16S rRNA代表序列上传至RDP数据库[24]进行物种注释。
1.4 宏基因组测序及生信分析宏基因组测序采用Illumina novaseq测序平台,每个样品测序深度在40 Gbp左右。下机数据使用Trimmomatic软件(v0.39)进行质控并去除接头序列,使用metaSPAdes软件进行宏基因组组装,最短Contigs设为500bp。为获得更多的完整功能基因,将大于800 bp的Contigs使用Prodigal(v2.6.3)软件进行蛋白预测。下载Kyoto Encyclopedia of Genes and Genomes (KEGG) 数据库(v94.2),使用Diamond (v0.9.11)软件对Prodigal预测的基因进行KEGG注释[25] (参数设定:-e-value 1e-5;-identity 85),然后使用Perl语言进行KEGG Ortholog(KO number)统计。
1.5 数据统计与分析使用R语言(v4.1.2)实现数据统计和可视化。使用“vegan”和“ggplot2”包进行微生物Alpha和Beta多样性分析。利用“pairwise adonis”包进行样品间配对检验,分析计算解释度(r值)和显著性(P值)。基于加权Bray-Curtis距离的NMDS应力函数值< 0.2,表明NMDS分析结果具有一定的解释意义。使用“tidyverse”、“limma”和“edgeR”包计算不同生境样品中OTUs的富集情况。使用“igraph”包构建共现性网络,斯皮尔曼相关系数|r| > 0.7,P < 0.05。使用“pheatmap”和“ggplot2”包可视化污染物降解基因热图。通过在线平台ChiPlot(https://www.chiplot.online/)可视化基因簇。使用MEGA7构建功能基因系统发育树。统计分析采用PERMANOVA分析、多因素方差分析、t检验和Kruskal-Wallis检验。
2 结果与讨论 2.1 污染场地中BTEX浓度气相色谱分析结果表明,“1号”和“2号”地块的主要有机污染物为BTEX(苯、甲苯、二甲苯、乙苯)和氯代芳香烃(氯苯、二氯苯),具体污染物检出情况见表 1。土壤样品中甲苯检出浓度最高,为7 060 mg/kg;地下水中苯的检出浓度最高,可达1 340 mg/L;对照土壤中均未检测到有机污染物残留。
|
|
表 1 主要有机污染物的类型和浓度 Table 1 Types and concentrations of major organic pollutants |
细菌16S rRNA基因高通量测序结果显示,受BTEX长期污染的土壤与对照土壤中的微生物群落组成有显著差异。在门水平上,相对丰度最高的前10个门丰度之和占各样品中细菌总丰度的90% 以上。对照土壤中细菌以变形菌门(Proteobacteria,29.38%)、酸杆菌门(Acidobacteria,19.19%)、放线菌门(Actinobacteria,13.99%)、厚壁菌门(Firmicutes,4.11%)和绿弯菌门(Chloroflexi,11.94%)为主,占细菌总丰度的78.61%。相比之下,BTEX污染的浅层土壤中变形菌门(52.31%)、绿弯菌门(12.60%)和厚壁菌门(9.63%)的丰度增加,而酸杆菌门(5.82%)和放线菌门(8.14%)的丰度明显下降(图 1A)。其次,地下水和深层土的微生物物种组成与浅层土和对照土壤相比均有显著差异。地下水G1样品中弯曲杆菌门(Campilobacterota,47.37%)丰度最高,为优势菌门;而地下水G2样品中以变形菌门(63.05%)为优势菌门。深层土的微生物物种组成较为简单,D1和D2中都以变形菌门为优势菌门,尤其在D2样品中变形菌门的丰度达到了91.06%(图 1A)。为了比较BTEX暴露对不同生境下微生物群落多样性的影响,本文分析了微生物组Alpha和Beta多样性的变化。测序覆盖率(good coverage)分析显示,各样品覆盖率均大于0.90,样品测序结果能够很好地反映物种多样性(图 1B)。浅层土和地下水的群落丰富度显著高于未污染对照土和污染深层土(P < 0.05)。浅层土和地下水中的observed_otus、Chao1指数和Ace指数显著高于对照土和深层土;浅层土和地下水中群落的Shannon指数和Simpson指数显著高于深层土(P < 0.05),而对照土与浅层土之间没有显著性差异(P > 0.05)(图 1B)。

|
(A:细菌在门水平上物种组成;B:Alpha多样性;C:基于多元方差分析和加权Bray-Curtis距离的样品NMDS分析;D:不同生境中显著富集的OTUs;E:物种显著性富集分析,不同颜色表示丰度排名前10位的OTUs,点大小表示OTUs丰度大小) 图 1 土壤和地下水中细菌群落结构差异 Fig. 1 Differences in bacterial community structures of soil and groundwater samples |
基于Braye-Curtis距离矩阵的非度量多维尺度(NMDS)分析表明,来自同一生境的样品倾向于聚集在一起,不同生境间的细菌群落结构存在显著差异(P = 0.001)(图 1C)。通过显著性富集分析获得在不同生境中显著富集的OTUs,结果显示,在不同生境中OTUs均有显著富集(图 1D);图 1E展示了丰度排名前10位的OTUs在不同生境下的富集情况,可见硫卵菌属(Sulfurovum)丰度最高而且仅在地下水中富集,丙酸弧菌属(Propionivibrio)仅在深层土中富集。然而浅层土中有8种OTUs显著富集,进一步证明浅层土中微生物群落多样性较高。因此,BTEX的长期污染明显改变了不同生境下微生物群落的组成和多样性,其中以变形菌门的改变最为显著。
2.3 污染场地中微生物共现性网络本文通过构建属水平的微生物共现性网络,评估BTEX长期污染对土壤和地下水细菌群落相互作用关系的影响(图 2)。浅层土、深层土和地下水中拓扑结构参数有较大差异(表 2)。与浅层土相比,地下水中的网络边数量和顶点数量分别减少了7.99% 和7.40%,深层土中的网络边数量和顶点数量分别减少了31.55% 和36.60%,这表明深层土中微生物之间的相互作用关系显著减弱,微生物群落复杂性显著降低。与浅层土中网络相比,深层土中细菌群落的连接数(connectance)、平均度(average degree)、聚集系数(clustering coefficient)和度中心性(degree centralization)均较高;而地下水中只有连接数较高。其次,深层土中节点间的正负连线比例(pnc)最高(正连线比例高,负连线比例低),表明在深层土中微生物群落结构很不稳定。综上,随着取样深度的增加,BTEX污染场地的微生物网络复杂性和群落稳定性降低。

|
(斯皮尔曼相关系数r > 0.7,P < 0.05;节点数量排名前18位的模块被赋予不同的颜色,其余模块为灰色;来自同一模块节点之间的连线颜色为模块的颜色,不同模块间节点的颜色为灰色) 图 2 细菌共现性网络分析 Fig. 2 Analysis of bacterial co-occurrence networks |
|
|
表 2 细菌群落共现性网络拓扑参数 Table 2 Network topology parameters of bacterial community co-occurrence |
为研究BTEX长期污染对土壤和地下水中微生物降解BTEX功能的影响,进一步针对浅层土和地下水样品进行宏基因组测序(深层土中微生物丰度较低,DNA质量未达到测序建库要求)。利用KEGG数据库对宏基因组组装结果注释表明,污染样品中共有97种与BTEX降解相关的功能基因,即97个KO。97种降解基因在浅层土和地下水中均存在,其中浅层土中功能基因相对丰度为42.34%,地下水中为57.09%,而对照土中仅注释到少数BTEX降解基因,其丰度仅为0.57%(图 3A)。降解基因层次聚类分析发现,浅层土和地下水样品与对照土显著分开,浅层土S1和S2样品具有更高的相似性,地下水G1样品与其他3个污染样品差异相对较大。大量研究表明,通过单加氧酶或双加氧酶对芳香族化合物苯环上取代基进行氧化,是芳香族化合物降解的关键所在[26]。97个KO中15个属于BTEX单加氧酶家族,12个为双加氧酶家族。其中,地下水G1样品中单加氧酶和双加氧酶的基因丰度最高(图 3B)。此外,在浅层土和地下水中还检测到了5种厌氧降解途径相关功能基因。同时,韦恩图分析发现,地下水G1样品中具有更多特有的降解基因(9个特有KO),而地下水G2样品有4个特有KO,浅层土S2样品有6个特有KO。以上结果均表明,地下水G1样品中具有更高的BTEX降解基因丰度和降解途径多样性。

|
(A:BTEX降解功能基因热图,不同色块深度表示基因丰度(基因丰度以lg进行转化);B:单加氧酶基因、双加氧酶基因和厌氧降解基因在不同样品中的丰度;C:BTEX降解基因韦恩图,展示了不同样品中共有和特有的功能基因的个数) 图 3 BTEX降解潜在功能基因分析 Fig. 3 Analysis of potential functional genes for BTEX degradation |
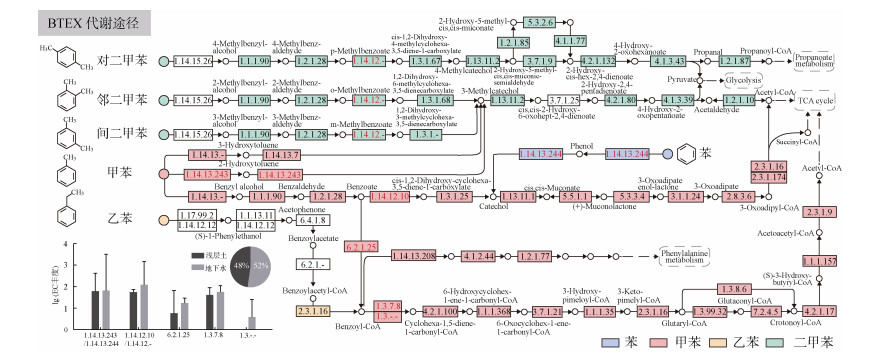
利用KEGG数据库对功能基因进行分析,重构了BTEX的微生物代谢网络(图 4)。BTEX微生物降解过程主要包括好氧和厌氧降解途径,本研究发现长期受BTEX污染的浅层土和地下水样品中微生物呈现出不同的好氧和厌氧降解特征。研究表明,BTEX的降解可以分为外周降解阶段和中心降解阶段[26]。有氧外周降解阶段是指苯系物被转化产生中心中间体邻苯二酚(Catechol)的过程,而中心降解阶段是指外周途径形成的中心中间体裂解开环最终进入细胞的柠檬酸循环(TCA cycle)并最终矿化成CO2和H2O的过程[27]。注释结果显示,在浅层土和地下水中存在完整的苯和甲苯降解途径,而乙苯和二甲苯只注释到部分降解基因。在苯和甲苯的好氧代谢过程中苯/甲苯2-单加氧酶(EC 1.14.13.243/1.14.13.244)是有氧外周降解的关键酶,负责苯/甲苯向邻苯二酚/3-甲基邻苯二酚(3-Methylcatechol)的转化,该酶的丰度在土壤和地下水样品中相当。然而,甲苯通过苯甲酸途径降解时,苯甲酸/甲苯1, 2-双加氧酶(EC 1.14.12.10/ 1.14.12.-)是有氧外周降解的关键酶,此酶在地下水中的丰度更高,该酶在二甲苯的降解过程中也起到关键降解作用。同时本研究发现,在BTEX代谢过程中地下水的关键降解酶丰度(52%)更高(图 4)。
|
(图中不同颜色填充表示不同污染物在KEGG中注释到的酶,无色填充表示未注释到;柱状图表示好氧和厌氧降解途径中关键代谢酶在不同生境中的丰度(对应酶编号为红色);扇形图表示BTEX代谢网络中注释到的所有酶在不同生境中的丰度) 图 4 BTEX降解基因代谢网络 Fig. 4 BTEX degradation gene metabolic network |
在厌氧条件下,长期受污染的土壤和地下水在代谢途径上也有显著差异。微生物通过外周途径将BTEX转化为关键的中心中间体苯甲酰-辅酶A (Benzoyl-CoA),然后苯甲酰-辅酶A转化为次级代谢产物,如乙酰-辅酶A,可用于微生物生长[26]。苯甲酸辅酶A连接酶(EC 6.2.1.25)是在厌氧生长的细胞中发现的,负责将苯甲酸转化为重要的中心中间代谢体苯甲酰-辅酶A,该酶在污染土壤和地下水中同时存在,但在地下水中的丰度更高。在以苯甲酰-辅酶A为中心中间体的苯环还原过程中,本研究注释到了苯环还原第一步的关键酶:依赖于ATP的Ⅰ类苯甲酰辅酶A还原酶(BcrCBAD EC 1.3.7.8)和不依赖ATP的Ⅱ类苯甲酰辅酶A还原酶(BamBC EC: 1.3.-.-)。前者通常存在于兼性厌氧菌中,而后者主要存在于严格的厌氧菌中。如图 4所示,Ⅰ类还原酶的丰度在地下水中略高于污染土壤,而Ⅱ类还原酶仅存在于地下水中。BTEX的微生物降解在地下水中占主导地位,污染土壤中以好氧降解途径为主,而在地下水中同时存在好氧和厌氧降解途径,并且仅在地下水中存在严格厌氧降解途径,这是与浅层土存在的最大差异。
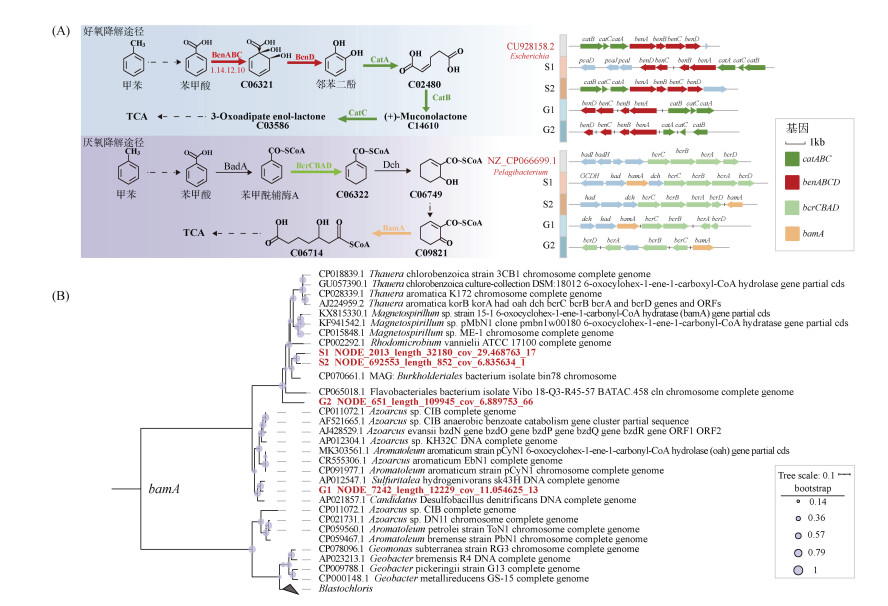
2.6 污染场地中BTEX关键降解基因簇与bamA进化树苯甲酸/甲苯1, 2-双加氧酶(EC 1.14.12.10)是有氧外周降解的关键酶,由benABC三个亚基组成。以甲苯降解为例,苯甲酸/甲苯1, 2-双加氧酶催化苯甲酸生成邻苯二酚的两步反应中的第一步[28],然后在catABC基因簇的作用下开环进入三羧酸循环(TCA)。苯甲酰辅酶A还原酶(EC1.3.7.8)是依赖ATP的厌氧外周降解的关键酶[29],由bcrCBAD四个亚基组成,负责苯环还原的第一步[30],经过几步还原后在bamA基因作用下开环裂解进入TCA循环。因此,为了进一步探究BTEX长期污染土壤和地下水中BTEX代谢多样性和潜能,对BTEX两种降解途径关键基因进行基因簇和遗传进化分析。结果显示,4个长期BTEX污染的样品中均含有benABCD和catABC中全部基因,且大多功能基因至少与另一个功能基因耦联于同一Contig上,尤其在S2样品中获得一条同时包含全部7个降解功能基因的Contig,且与Escherichia基因组中功能基因排列顺序高度一致(图 5A)。在4个宏基因组样品中都拼接得到了厌氧条件下BTEX中间代谢产物苯甲酰辅酶A的降解功能基因bcrCBAD和bamA,且与好氧降解功能基因类似,污染土壤和地下水中这些厌氧条件下降解功能基因也多以基因簇形式排列在一起,S1样品中降解基因来自一条完整的Contig。基因簇中关键开环基因bamA系统发育进化树分析表明,S1、S2和G1样品中bamA基因与已知菌株bamA基因具有较高的同源性并聚类在一起,它们都来自变形菌门。迄今为止,已报道的厌氧降解菌大多来自变形菌门[31],这与图 1A中污染场地中变形菌门丰度更高形成一致结论。而G2样品中bamA基因并未找到与其高度同源并聚类在一起的序列,暗示G2样品中bamA基因可能来源于新的微生物物种(图 5B)。综上所述,长期受BTEX污染的土壤和地下水样品对BTEX具有多种代谢途径和较高的功能微生物物种多样性。
|
(A:好氧降解途径和厌氧降解途径关键基因簇,来自不同Contigs的基因片段用黑色垂直线标记;B:基因簇中所示的厌氧降解途径中关键开环基因bamA的系统发育树) 图 5 BTEX降解基因簇与系统发育树 Fig. 5 BTEX degradation gene cluster and phylogenetic tree |
BTEX的长期污染明显改变了不同生境下的微生物群落组成和多样性,与未污染土壤相比,变形菌门的丰度显著增加。微生物共现性网络分析表明,BTEX长期污染深层土中微生物网络复杂性和群落稳定性降低。进一步对浅层土和地下水的宏基因组测序分析表明,BTEX污染物降解基因在地下水中基因丰度和多样性更高而不是浅层土;其次这些污染物代谢途径在土壤和地下水中好氧降解和厌氧降解途径同时存在,其中编码严格厌氧降解基因的酶(BamBC EC: 1.3.-.-) 仅在地下水中存在。对BTEX的好氧和厌氧降解基因的基因簇分析表明,土壤样品中拥有更完整的基因簇;而对厌氧降解途径中关键开环基因进行系统发育分析表明,G2样品中bamA基因进化距离较远,可能存在新的降解细菌。综上,长期受BTEX污染的化工厂在不同生境下的微生物群落结构有很大的差异,通过这些关键微生物以及新物种参与污染场地生态系统中的物质循环和能量流动,在土壤和地下水中微生物功能调节和污染物去除中发挥关键作用。
| [1] |
Neolaka Y A B, Supriyanto G, Kusuma H S. Adsorption performance of Cr(VI)-imprinted poly(4-VP-co-MMA) supported on activated Indonesia (Ende-Flores) natural zeolite structure for Cr(VI) removal from aqueous solution[J]. Journal of Environmental Chemical Engineering, 2018, 6(2): 3436-3443 DOI:10.1016/j.jece.2018.04.053 (  0) 0) |
| [2] |
Ghosal D, Ghosh S, Dutta T K, et al. Current state of knowledge in microbial degradation of polycyclic aromatic hydrocarbons (PAHs): A review[J]. Frontiers in Microbiology, 2016, 7: 1369 (  0) 0) |
| [3] |
Cao B, Nagarajan K, Loh K C. Biodegradation of aromatic compounds: Current status and opportunities for biomolecular approaches[J]. Applied Microbiology and Biotechnology, 2009, 85(2): 207-228 DOI:10.1007/s00253-009-2192-4 (  0) 0) |
| [4] |
US Environmental Protection Agency. Office of Solid Waste and Emergency Response. Test Methods for Evaluating Solid Waste: Physical/Chemical Methods. 3 ed., 1997.
(  0) 0) |
| [5] |
吴隽雅, 李昌儒. 城市"退二进三"调整规划及其社会生态影响分析[J]. 南京工业大学学报(社会科学版), 2020, 19(1): 69–79, 112 (  0) 0) |
| [6] |
李超, 西伟力, 毕涛, 等. VOCs快速检测在某化工企业搬迁遗留污染场地调查中的应用[J]. 环境监测管理与技术, 2018, 30(3): 53–55, 59 (  0) 0) |
| [7] |
常春英, 肖荣波, 章生健, 等. 城市工业企业搬迁遗留污染场地再开发环境管理问题与思考[J]. 生态经济, 2016, 32(8): 191-195 (  0) 0) |
| [8] |
严康, 楼骏, 汪海珍, 等. 污染场地研究现状与发展趋势: 基于知识图谱的分析[J]. 土壤学报, 2021, 58(5): 1234-1245 (  0) 0) |
| [9] |
李予博. 遗留污染场地土壤环境损害鉴定实物量化与健康风险评估研究[D]. 沈阳: 辽宁大学, 2021.
(  0) 0) |
| [10] |
Fuentes S, Méndez V, Aguila P, et al. Bioremediation of petroleum hydrocarbons: Catabolic genes, microbial communities, and applications[J]. Applied Microbiology and Biotechnology, 2014, 98(11): 4781-4794 DOI:10.1007/s00253-014-5684-9 (  0) 0) |
| [11] |
Vila J, Tauler M, Grifoll M. Bacterial PAH degradation in marine and terrestrial habitats[J]. Current Opinion in Biotechnology, 2015, 33: 95-102 DOI:10.1016/j.copbio.2015.01.006 (  0) 0) |
| [12] |
葛锋, 张转霞, 扶恒, 等. 我国有机污染场地现状分析及展望[J]. 土壤, 2021, 53(6): 1132-1141 (  0) 0) |
| [13] |
Geng S Y, Xu G M, Cao W, et al. Occurrence of polycyclic aromatic compounds and potentially toxic elements contamination and corresponding interdomain microbial community assembly in soil of an abandoned gas station[J]. Environmental Research, 2022, 212(Pt E): 113618.
(  0) 0) |
| [14] |
Liu B, Yao J, Ma B, et al. Microbial community profiles in soils adjacent to mining and smelting areas: Contrasting potentially toxic metals and co-occurrence patterns[J]. Chemosphere, 2021, 282: 130992 DOI:10.1016/j.chemosphere.2021.130992 (  0) 0) |
| [15] |
Jin D C, Zhang F S, Shi Y, et al. Diversity of bacteria and archaea in the groundwater contaminated by chlorinated solvents undergoing natural attenuation[J]. Environmental Research, 2020, 185: 109457 DOI:10.1016/j.envres.2020.109457 (  0) 0) |
| [16] |
Guerra A B, Oliveira J S, Silva-Portela R C B, et al. Metagenome enrichment approach used for selection of oil-degrading bacteria consortia for drill cutting residue bioremediation[J]. Environmental Pollution, 2018, 235: 869-880 DOI:10.1016/j.envpol.2018.01.014 (  0) 0) |
| [17] |
Lee Y, Lee Y, Jeon C O. Biodegradation of naphthalene, BTEX, and aliphatic hydrocarbons by Paraburkholderia aromaticivorans BN5 isolated from petroleum-contaminated soil[J]. Scientific Reports, 2019, 9: 860 DOI:10.1038/s41598-018-36165-x (  0) 0) |
| [18] |
申国兰, 李利, 陈莎. 微生物降解石油源多环芳香烃的研究进展[J]. 土壤, 2018, 50(1): 16-27 (  0) 0) |
| [19] |
祁慧鹓, 朱国繁, 王鑫伟, 等. 农药污染土壤生物刺激修复技术研究进展[J]. 土壤, 2021, 53(2): 221-228 (  0) 0) |
| [20] |
滕应, 王笑咪, 韩玉娟, 等. 土壤中有机复合污染物微生物组转化机制与调控原理: 进展与展望[J]. 土壤学报, 2021, 58(5): 1084-1093 (  0) 0) |
| [21] |
Geng S Y, Cao W, Yuan J, et al. Microbial diversity and co-occurrence patterns in deep soils contaminated by polycyclic aromatic hydrocarbons (PAHs)[J]. Ecotoxicology and Environmental Safety, 2020, 203: 110931 (  0) 0) |
| [22] |
D'Ugo E, Bruno M, Mukherjee A, et al. Characterization of microbial response to petroleum hydrocarbon contamination in a lacustrine ecosystem[J]. Environmental Science and Pollution Research International, 2021, 28(20): 26187-26196 (  0) 0) |
| [23] |
中华人民共和国生态环境部. 水质苯系物的测定顶空/气相色谱法: HJ 1067—2019[S]. 北京: 中国环境科学出版社, 2019.
(  0) 0) |
| [24] |
Wang Q, Garrity G M, Tiedje J M, et al. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267 (  0) 0) |
| [25] |
Wang S Y, Ping Q, Li Y M. Comprehensively understanding metabolic pathways of protein during the anaerobic digestion of waste activated sludge[J]. Chemosphere, 2022, 297: 134117 (  0) 0) |
| [26] |
Fuchs G, Boll M, Heider J. Microbial degradation of aromatic compounds—From one strategy to four[J]. Nature Reviews Microbiology, 2011, 9(11): 803-816 (  0) 0) |
| [27] |
郑瑾, 陈宏坤, 杜显元, 等. 微生物降解苯系污染物的机理及研究进展[J]. 中国资源综合利用, 2020, 38(1): 118-120 (  0) 0) |
| [28] |
Harayama S, Rekik M, Bairoch A, et al. Potential DNA slippage structures acquired during evolutionary divergence of Acinetobacter calcoaceticus chromosomal benABC and Pseudomonas putida TOL pWW0 plasmid xylXYZ, genes encoding benzoate dioxygenases[J]. Journal of Bacteriology, 1991, 173(23): 7540-7548 (  0) 0) |
| [29] |
Boll M, Löffler C, Morris B E L, et al. Anaerobic degradation of homocyclic aromatic compounds via arylcarboxyl-coenzyme A esters: Organisms, strategies and key enzymes[J]. Environmental Microbiology, 2014, 16(3): 612-627 (  0) 0) |
| [30] |
Breese K, Boll M, Alt-Mörbe J, et al. Genes coding for the benzoyl-CoA pathway of anaerobic aromatic metabolism in the bacterium Thauera aromatica[J]. European Journal of Biochemistry, 1998, 256(1): 148-154 (  0) 0) |
| [31] |
Wu Z M, Liu G P, Ji Y H, et al. Electron acceptors determine the BTEX degradation capacity of anaerobic microbiota via regulating the microbial community[J]. Environmental Research, 2022, 215: 114420 (  0) 0) |
2. Key Laboratory of Soil Environment and Pollution Remediation, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China
 2023, Vol. 55
2023, Vol. 55


