2. 中国科学院地理科学与资源研究所生态系统网络观测与模拟重点实验室, 北京 100101;
3. 中国科学院大学资源与环境学院, 北京 100101;
4. 河北省水质工程与水资源综合利用重点实验室, 河北张家口 075000
氨基糖在土壤有机碳和有机氮含量中的占比分别为2% ~ 5%[1]和5% ~ 12%[2-3]。由于植物不含氨基糖,土壤动物只向土壤贡献少量的氨基糖,因此土壤中的大部分氨基糖被认为主要来自微生物[4-5]。氨基糖作为微生物死亡残体的生物标志物被广泛测定。目前可被定量分析测定的土壤氨基糖主要有4种:胞壁酸(MurN)、甘露糖(ManN)、氨基半乳糖(GalN) 和氨基葡萄糖(GluN)[6-8]。其中,胞壁酸和氨基葡萄糖是微生物细胞壁残留物,胞壁酸只存在于细菌细胞壁中,氨基葡萄糖来自于细菌和真菌细胞壁,而甘露糖和氨基半乳糖的来源尚不清楚[6, 9-10]。氨基糖具有异源性,可作为微生物残留物标识物用于评估土壤中不同微生物死亡残体有机碳的含量。Appuhn和Joergensen[5]确定了将真菌氨基葡萄糖转化为真菌残体碳的平均转化系数为9,将细菌胞壁酸转化为细菌残体碳的平均转化系数为45。由于土壤微生物残体碳的周转时间比微生物活体碳更长,对土壤中稳定性碳库的形成具有重要贡献[11-12]。因此,精确地测定土壤氨基糖含量对于评估微生物对土壤有机碳的贡献具有重要意义。
国内外针对土壤氨基糖含量的分析测定方法开展了大量的研究。早期分析氨基糖的方法有电化学法[13]、光度法[14]和电泳法[15]等。这些方法由于受样品杂质影响大,对复杂环境样品分析受限。目前,常用的分析方法有气相色谱法[7]、液相色谱法[8, 16]、红外光谱法[17]和气质联用法[18]。这些方法所采用的前处理方法和检测技术各不相同。气相色谱法前处理过程繁琐,且需要手动进行衍生化处理。红外光谱法虽具有结构定性方面的优势,但灵敏度较低[9, 19]。气质联用法具有定性、可靠性和灵敏度高的特点,但是由于成本太高,因而没有被广泛应用。高效液相色谱法采用自动进样器用户模式进行邻苯二甲醛(OPA) 在线衍生的方法,操作简单方便[16]。Indorf等[8]分析了激发波长、OPA反应时间、四氢呋喃浓度和流动相pH对氨基糖分离的影响,对高效液相色谱法进行优化,使高效液相色谱法具有检出限低、灵敏度和准确度高等特点,从而使该方法得以广泛应用。
关于土壤氨基糖的分析测定多从检出限、定量限、标准曲线的线性、样品的重复性、加标回收率这几个方面考虑方法的质量控制。例如,Zhang和Amelung[7]报道了气相色谱法分析氨基糖的仪器定量限、标准样品线性、样品含量的相对标准偏差和土壤基质加标回收率。Dick等[20]和Zhang等[17]报道了红外光谱法分析氨基糖的标准样品线性。近年来,国内根据Indorf等[8]的方法,建立了高效液相色谱分析土壤氨基糖的方法。一种分析方法的好坏不仅要考虑仪器的灵敏度、精密度和准确度,同时也要考虑包括前处理在内的方法的灵敏度、精密度和准确度[21]。Indorf等[8]通过仪器检出限和定量限检验了高效液相色谱法分析氨基糖样品过程中仪器的灵敏度,通过标准样品线性检验了仪器的准确度,通过空白加标回收率检验了仪器和方法的准确度,但是未见包括前处理在内的整个氨基糖分析流程中仪器和方法精密度的质量控制。
本研究利用OPA柱前在线衍生–高效液相色谱法结合荧光检测器分析红壤剖面中具有不同氨基糖含量的土壤样品[22],利用信噪比、检出限、定量限反映仪器和方法的灵敏度,利用标准样品平行样、土壤样品平行样和土壤样品重复样的重复性反映仪器和方法的精密度,利用标准样品的线性和加标回收率反映仪器和方法的准确度,以为OPA柱前在线衍生–高相液相色谱法测定土壤氨基糖含量的质量控制提供依据。
1 材料与方法 1.1 仪器和色谱条件高效液相色谱仪(Ultimate 3000, Thermo Fisher, USA),包括带脱气单元的低压四元梯度泵(LPG-3400SD Pump)、自动进样器(WPS-3000 Sampler)、柱温箱(TCC-3000 Column Compartment)、荧光检测器(FLD-3100 Detector) 以及变色龙色谱数据处理系统(Chromeleon 7.1.0.898 CDS)。
4种氨基糖的分离在十八烷基硅烷化硅胶柱(Acclaim120 C18; 150 mm × 4.6 mm, 5 μm; Thermo Fisher Scientific, USA) 中进行。柱温箱的温度设置为35 ℃,荧光检测器的灵敏度设为1,激发波长和发射波长分别设置为330 nm和445 nm,流通池温度设置为45 ℃[8]。
由于需要高进样精度和有效的外部针头清洗以消除残留,因此使用专为自动柱前衍生化而设计的自动进样器。衍生过程中,启动自动进样器的用户模式(表 1),自动进样器会自动加入5 μL OPA衍生溶液和3 μL氨基糖样品,衍生化120 s后进样。
|
|
表 1 高效液相色谱仪测定土壤氨基糖含量自动进样器的用户自定义程序 |
流动相由A (甲醇/超纯水,1/1,V/V) 和B (柠檬酸缓冲溶液/甲醇/四氢呋喃,95/2/3,V/V/V) 组成[23]。氨基糖分离过程中流动相A和流动相B的体积比为5/95,流速为1.5 mL/min,流动相的梯度洗脱条件(表 2) 参考Mou等[23]。
|
|
表 2 流动相的梯度洗脱条件 |
供试试剂:甲醇,色谱纯,购自Fisher Scientific公司;硼酸、50% 的氢氧化钠、二水合柠檬酸三钠、无水乙酸钠、盐酸,均为分析纯,购自国药集团化学试剂有限公司;四氢呋喃(色谱纯)、2-巯基乙醇、邻苯二甲醛(OPA) 和4种氨基糖标准样品胞壁酸、甘露糖胺盐酸盐、半乳糖胺盐酸盐和葡萄糖胺盐酸盐,均购买自Sigma公司。
1.3 溶液的配制所用溶液均采用超纯水机(Integral 10, 默克Milli-Q, USA) 制备的超纯水配制。将25 g硼酸溶解于900 mL超纯水中,用50% 的氢氧化钠将溶液pH调节至11,最后用超纯水定容至1 L制备0.4 mol/L硼酸缓冲溶液。将2.5 mL 2-巯基乙醇加到100 mL硼酸缓冲溶液中混匀,制备还原溶液。将5 mg邻苯二甲醛溶解于0.4 mL甲醇、0.4 mL还原溶液和8 mL硼酸缓冲溶液中,制备OPA衍生溶液。将2.941 g二水合柠檬酸三钠和0.328 1 g无水乙酸钠溶解于900 mL超纯水中,用6 mol/L盐酸调节pH至5.3,超纯水定容至1 000 mL制备柠檬酸缓冲溶液。
用十万分之一的天平分别称取2.512 3 mg胞壁酸和21.563 0 mg甘露糖胺盐酸盐、氨基半乳糖胺盐酸盐、氨基葡萄糖胺盐酸盐标准样品,用超纯水配制成胞壁酸浓度为100 μmol/L和甘露糖、氨基半乳糖、氨基葡萄糖浓度为1 000 μmol/L的混合标准样品储备液。用超纯水将混合标准样品储备液逐级稀释配制成7个浓度序列,其中胞壁酸的浓度为0.2、0.5、1.0、2.0、5.0、10.0、20.0 μmol/L,甘露糖、氨基半乳糖和氨基葡萄糖的浓度为2、5、10、20、50、100、200 μmol/L。
1.4 土壤样品采集土壤样品采集于江西省中国科学院千烟洲亚热带森林生态系统观测研究站(115°04′ E, 26°44′ N)。在马尾松(Pinus massoniana) 人工林中设置一个20 m× 20 m的样方,在样方中间位置挖掘一个土壤剖面,采集0 ~ 10、10 ~ 20、20 ~ 40、40 ~ 80 cm深度的土壤样品共4份。将新鲜土壤样品过2 mm筛,4 ℃保存,用于测定土壤氨基糖含量。
1.5 土壤样品前处理土壤氨基糖测定的前处理方法参考Appuhn等[16]。具体为:称取1 g鲜土于水解管中,加入10 mL 6 mol/L盐酸,在烘箱中105 ℃水解6 h;待水解液冷却至室温后,摇匀溶液静置过夜;取1 mL上清液于粗玻璃管中,用氮吹仪(N-Evap-112, Organomation, USA) 在氮气水浴30 ℃吹干,加入1 mL超纯水,于氮气水浴再次吹干;加入2 mL超纯水,混匀后过0.45 μm滤膜,该土壤氨基糖提取液于4 ℃保存待测。
1.6 氨基糖的定性方法本研究利用含有4种氨基糖的混合标准样品进行定量分析。首先对胞壁酸浓度为10 μmol/L和甘露糖、氨基半乳糖、氨基葡萄糖浓度均为100 μmol/L的单标标准样品分别进样,然后根据单标标准样品的保留时间确定混合标准样品以及土壤样品中胞壁酸、甘露糖、氨基半乳糖和氨基葡萄糖的出峰顺序和保留时间。
1.7 仪器和方法的灵敏度、精密度和准确度标准样品和土壤样品出峰后,通过理论塔板数确定色谱柱的柱效。通过相邻两峰的分离度确定4种氨基糖色谱峰的分离情况。为了确定4种氨基糖的仪器检出限和定量限,配制胞壁酸浓度为0.02、0.05、0.1、0.2、0.5、1.0、2.0 μmol/L和甘露糖、氨基半乳糖、氨基葡萄糖浓度为0.2、0.5、1.0、2.0、5.0、10、20 μmol/L的混合标准样品。通过对每个浓度的标准样品连续进样6针,选择浓度最低且信噪比 > 10的标准样品(经测试得,浓度最低且信噪比 > 10的胞壁酸为0.2 μmol/L,甘露糖为10 μmol/L,氨基半乳糖和氨基葡萄糖均为5 μmol/L) 含量计算仪器检出限(式(1)) 和定量限(式(2))。通过对浓度最低且信噪比 > 10的土壤样品(本研究中,信噪比 > 10的最小浓度的胞壁酸、氨基半乳糖和氨基葡萄糖为40 ~ 80 cm土壤样品,甘露糖为0 ~ 10 cm土壤样品) 连续进样6针,利用氨基糖含量的标准差计算方法检出限(式(3)) 和定量限(式(4))。同时,通过标准样品和土壤样品中氨基糖的信噪比,检验仪器和方法的灵敏度[24]。
| $ 仪器检出限 ({\mathtt{μ}}{\rm{mol/L}}) = 3 \times M /信噪比 $ | (1) |
| $ 仪器定量限 ({\mathtt{μ}}{\rm{mol/L}}) = 10 \times M /信噪比 $ | (2) |
| $ 方法检出限 ({\mathtt{μ}}{\rm{mol/L}}) = 3 \times {\rm{SD}} $ | (3) |
| $ 方法定量限 ({\mathtt{μ}}{\rm{mol/L}}) = 10 \times {\rm{SD}} $ | (4) |
式中:M表示浓度最低且信噪比 > 10的标准样品中氨基糖的含量;SD表示浓度最低且信噪比 > 10的土壤样品中氨基糖含量的标准差。
将每个土层的土壤样品分别称取4份,作为土壤样品的重复样提取氨基糖,计算土壤样品重复样中4种氨基糖样品含量的相对标准偏差(式(5))。选取胞壁酸浓度为2 μmol/L和甘露糖、氨基半乳糖、氨基葡萄糖浓度为20 μmol/L的混合标准样品连续进样6针作为标准样品平行样,分别从0 ~ 10 cm和40 ~ 80 cm深度样品中随机选取一个重复样,连续进样6针,分别作为高浓度和低浓度土壤样品平行样,计算土壤样品平行样中4种氨基糖样品含量的相对标准偏差(式(5))。通过标准样品平行样、土壤样品平行样和土壤样品重复样的重复性,检验仪器和方法的精密度[24-25]。
| $ 相对标准偏差 (\%) = 标准差/算数平均值\times 100\% $ | (5) |
利用胞壁酸的浓度为0.2、0.5、1.0、2.0、5.0、10.0、20.0 μmol/L和甘露糖、氨基半乳糖、氨基葡萄糖的浓度为2、5、10、20、50、100、200 μmol/L的混合标准样品,以标准样品的浓度为横坐标,峰面积为纵坐标分别绘制4种氨基糖的标准曲线,每个浓度3个重复,通过计算标准曲线的线性相关系数R2值,检验仪器的准确度。称取8份1 g的石英砂(分析纯,国药集团化学试剂有限公司) 代替土壤,其中4份加入0.5 mL浓度为15 μmol/L的胞壁酸和浓度为150 μmol/L的甘露糖、氨基半乳糖和氨基葡萄糖混合标准样品作为空白加标样品,另外4份不加任何试剂作为空白样品,计算氨基糖的空白加标回收率(式(6))。分别称取8份1 g的0 ~ 10 cm和1 g的40 ~ 80 cm土壤样品,其中4份加入0.5 mL胞壁酸浓度为15 μmol/L和甘露糖、氨基半乳糖和氨基葡萄糖浓度为150 μmol/L的混合标准样品作为土壤基质加标样品,另外4份不加任何试剂作为土壤基质空白样品,计算氨基糖的土壤基质加标回收率(式(6))。通过空白加标回收率和土壤基质加标回收率,检验包括前处理在内的整个分析流程中仪器和方法的准确度[26]。
| $ 加标回收率 (\%) = (加标样中测出的氨基糖含量–空白样中测出的氨基糖含量) /加标量\times100\% $ | (6) |
检测过程中4种氨基糖的出峰先后顺序为胞壁酸、甘露糖、氨基半乳糖和氨基葡萄糖,出峰保留时间分别为8.5、10.8、17.6和18.9 min (图 1),这与Indorf等[8]的研究中4种氨基糖的出峰先后顺序相同。本研究所采用的激发波长、柱温、OPA衍生剂的配制、衍生反应时间和流动相的pH以及空白加标回收率的测定均参考Indorf等[8]的最优方案。为了减小缓冲盐溶液对色谱柱的伤害,延长色谱柱的寿命,本研究中减少了流动相B中柠檬酸缓冲液的比例,即将流动相B由Indorf等[8]的柠檬酸缓冲溶液/甲醇/四氢呋喃体积比为97.8/0.7/1.5改为95/2/3[23]。4种氨基糖完全分离所用的时间大约为20 min,比Indorf等[8]的结果延长约1 min。4种氨基糖的色谱峰峰形较好,胞壁酸、甘露糖、氨基半乳糖和氨基葡萄糖之间色谱峰的分离度分别为4.91、9.54和1.53 (图 1),这符合国家药典委员会[24]关于待测物质色谱峰与相邻色谱峰之间的分离度应 > 1.5的规定,表明相邻两种氨基糖的色谱峰能够完全分离。
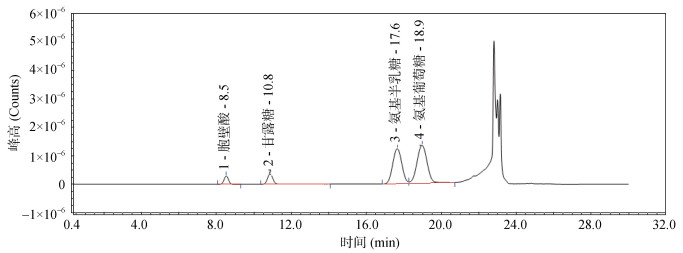
|
图 1 胞壁酸浓度为10 μmol/L和甘露糖、氨基半乳糖、氨基葡萄糖浓度为100 μmol/L的混合标准样品出峰顺序 |
检测过程中,胞壁酸、甘露糖、氨基半乳糖和氨基葡萄糖的理论塔板数分别平均为2 810、2 912、3 959和2 901(表 3),表明本研究中色谱柱的柱效较高,符合国家药典委员会[24]关于理论塔板数需 > 2 000的规定。胞壁酸、甘露糖、氨基半乳糖和氨基葡萄糖的仪器检出限分别为0.030、0.300、0.150和0.150 μmol/L,仪器定量限分别为0.100、1.000、0.500和0.500 μmol/L,方法检出限分别为0.010、1.500、0.100和0.100 μmol/L,方法定量限分别为0.030、5.000、0.300和0.300 μmol/L (表 4)。本研究中,胞壁酸、甘露糖、氨基半乳糖和氨基葡萄糖的仪器定量限分别相当于0.02、0.18、0.09和0.09 μg/mL,低于Zhang和Amelung[7]用气相色谱法测定的氨基糖胞壁酸为10 μg/mL,其他3种氨基糖为20 μg/mL的仪器定量限,也低于Indorf等[8]报道的胞壁酸定量限为0.13 μg/mL,其他3种氨基糖为0.90 μg/mL的结果。
|
|
表 3 四种氨基糖的理论塔板数、信噪比、样品含量和重复土样的相对标准偏差(n=4) |
|
|
表 4 四种氨基糖样品的检出限、定量限、平行样的相对标准偏差以及加标回收率 |
在所有供试土层样品中,胞壁酸、氨基半乳糖和氨基葡萄糖3种氨基糖含量的信噪比均 > 10 (表 3),这符合国家药典委员会[24]和国家质量监督检验检疫总局[25]的规定,表明本研究中分析胞壁酸、氨基半乳糖和氨基葡萄糖时仪器和方法的灵敏度较高。对于甘露糖,除0 ~ 10 cm土层深度的土壤样品外,其他土层中甘露糖含量的信噪比均 < 10,这与下层土壤中甘露糖含量较低有关,而本研究中,甘露糖的方法定量限为5.000 μmol/mL (表 4),因此,分析甘露糖含量低于5.000 μmol/mL的土壤样品时,需要进一步优化仪器和方法。
2.3 仪器和方法的精密度本文以标准样品平行样、土壤样品平行样和土壤样品重复样的相对标准偏差反映方法的精密度[24-25]。4种氨基糖含量的相对标准偏差在0.52% ~ 4.87% (表 3和表 4),表明仪器和方法的精密度良好。在标准样品平行样和土壤样品平行样中4种氨基糖含量的相对标准偏差 < 3%,虽略高于气相色谱法中标准样品平行样的相对标准偏差 < 2% 的结果,但低于土壤样品平行样中样品含量的相对标准偏差6.1% ~ 10.9% 的结果[7],且符合国家质量监督检验检疫总局[25]规定的相同条件下重复试验保留数据的相对标准偏差应≤3% 的标准,这表明仪器具有较高的精密度。而在土壤样品重复样中,4种氨基糖样品含量的相对标准偏差有所增加,这受氨基糖前处理过程的影响。土壤样品重复样中样品含量的相对标准偏差 < 5%,符合国家药典委员会[24]关于重复试验数据的相对标准偏差应 < 5% 的规定,表明本研究中仪器和方法的综合精密度符合标准要求。
2.4 仪器和方法的准确度本研究中,胞壁酸、甘露糖、氨基半乳糖和氨基葡萄糖的标准曲线的线性相关系数R2分别为0.999 7、0.997 0、0.999 5和0.999 8 (图 2),这与Indorf等[8]的结果中标准曲线的线性相关系数r=0.998的结果相当。Dick等[20]利用近红外光谱检测土壤总氨基糖氮含量的标准曲线R2=0.90。Zhang等[17]利用中红外光谱预测土壤中胞壁酸、氨基半乳糖和氨基葡萄糖的浓度,以气相色谱法测量值为自变量,中红外光谱预测值为因变量,进行线性拟合后线性相关系数R2 > 0.90。因此,本研究中高效液相色谱法测定土壤氨基糖的线性拟合结果良好,能够对0.2 ~ 20.0 μmol/L浓度范围内的胞壁酸和2 ~ 200 μmol/L浓度范围内的甘露糖、氨基半乳糖和氨基葡萄糖进行准确测定。

|
图 2 氨基糖的标准曲线 |
本研究中,4种氨基糖的空白样中胞壁酸、甘露糖、氨基半乳糖和氨基葡萄糖均未检出,空白加标回收率分别为91%、81%、93%、94%,土壤基质加标回收率在80% ~ 88% (表 4),这与Zhang和Amelung[7]利用气相色谱法分析氨基糖的土壤基质加标回收率为86% ~ 97%,以及Indorf等[8]利用高效液相色谱法的分析结果中氨基糖的空白加标回收率介于81% ~ 115% 的结果相当,也符合中华人民共和国生态环境部[26]关于有机物的加标回收率范围应在70% ~ 130% 的规定。因此,根据参考Indorf等[8]的最优方案减少流动相中柠檬酸盐的比例后,本研究中分析土壤氨基糖的仪器和方法依旧具有较高的准确度。
3 结论OPA柱前在线衍生–高效液相色谱法检测4种氨基糖的出峰先后顺序为胞壁酸(8.5 min)、甘露糖(10.8 min)、氨基半乳糖(17.6 min) 和氨基葡萄糖(18.9 min),色谱峰峰形较好且分离度 > 1.5,相邻两峰能够完全分离;理论塔板数 > 2 000,色谱柱的柱效较高;胞壁酸、甘露糖、氨基半乳糖和氨基葡萄糖的仪器检出限分别为0.030、0.300、0.150和0.150 μmol/L,仪器定量限分别为0.100、1.000、0.500和0.500 μmol/L,方法检出限分别为0.010、1.500、0.100和0.100 μmol/L,方法定量限分别为0.030、5.000、0.300和0.300 μmol/L;除0 ~ 10 cm深度以下土层中的甘露糖外,其余土壤中氨基糖样品含量的信噪比均 > 10,仪器和方法的灵敏度较高;标准样品平行样、土壤样品平行样以及土壤样品重复样中4种氨基糖样品含量的相对标准偏差 < 5%,仪器和方法都具有较高的精密度。4种氨基糖标准曲线的线性相关系数R2 > 0.997 0,空白加标回收率和土壤基质加标回收率在80% ~ 94%,仪器和方法的准确度较高。可见,OPA柱前在线衍生–高效液相色谱法测定土壤氨基糖含量操作简单,灵敏度、精密度和准确度较高,是分析土壤氨基糖含量的合格方法。
致谢: 感谢中国科学院千烟洲亚热带森林生态系统观测研究站对本研究野外工作的支持与帮助!
| [1] |
Joergensen R G, Meyer B. Chemical change in organic matter decomposing in and on a forest Rendzina under beech (Fagus sylvatica L.)[J]. Journal of Soil Science, 1990, 41(1): 17-21 DOI:10.1111/j.1365-2389.1990.tb00041.x (  0) 0) |
| [2] |
Amelung W, Zhang X, Flach K W, et al. Amino sugars in native grassland soils along a climosequence in North America[J]. Soil Science Society of America Journal, 1999, 63(1): 86-92 DOI:10.2136/sssaj1999.03615995006300010014x (  0) 0) |
| [3] |
He H B, Xie H T, Zhang X D. A novel GC/MS technique to assess 15N and 13C incorporation into soil amino sugars[J]. Soil Biology and Biochemistry, 2006, 38(5): 1083-1091 DOI:10.1016/j.soilbio.2005.09.007 (  0) 0) |
| [4] |
Dai X Y, Ping C L, Hines M E, et al. Amino sugars in Arctic soils[J]. Communications in Soil Science and Plant Analysis, 2002, 33(5/6): 789-805 (  0) 0) |
| [5] |
Appuhn A, Joergensen R G. Microbial colonisation of roots as a function of plant species[J]. Soil Biology and Biochemistry, 2006, 38(5): 1040-1051 DOI:10.1016/j.soilbio.2005.09.002 (  0) 0) |
| [6] |
Amelung W, Brodowski S, Sandhage-Hofmann A, et al. Chapter 6 combining biomarker with stable isotope analyses for assessing the transformation and turnover of soil organic matter[M]//Advances in Agronomy. Amsterdam: Elsevier, 2008: 155–250.
(  0) 0) |
| [7] |
Zhang X D, Amelung W. Gas chromatographic determination of muramic acid, glucosamine, mannosamine, and galactosamine in soils[J]. Soil Biology and Biochemistry, 1996, 28(9): 1201-1206 DOI:10.1016/0038-0717(96)00117-4 (  0) 0) |
| [8] |
Indorf C, Dyckmans J, Khan K S, et al. Optimisation of amino sugar quantification by HPLC in soil and plant hydrolysates[J]. Biology and Fertility of Soils, 2011, 47(4): 387-396 DOI:10.1007/s00374-011-0545-5 (  0) 0) |
| [9] |
Joergensen R G. Amino sugars as specific indices for fungal and bacterial residues in soil[J]. Biology and Fertility of Soils, 2018, 54(5): 559-568 DOI:10.1007/s00374-018-1288-3 (  0) 0) |
| [10] |
Guggenberger G, Frey S D, Six J, et al. Bacterial and fungal cell-wall residues in conventional and no-tillage agroecosystems[J]. Soil Science Society of America Journal, 1999, 63(5): 1188-1198 DOI:10.2136/sssaj1999.6351188x (  0) 0) |
| [11] |
Glaser B, Millar N, Blum H. Sequestration and turnover of bacterial- and fungal-derived carbon in a temperate grassland soil under long-term elevated atmospheric pCO2[J]. Global Change Biology, 2006, 12(8): 1521-1531 DOI:10.1111/j.1365-2486.2006.01186.x (  0) 0) |
| [12] |
Liang C, Schimel J P, Jastrow J D. The importance of anabolism in microbial control over soil carbon storage[J]. Nature Microbiology, 2017, 2: 17105 DOI:10.1038/nmicrobiol.2017.105 (  0) 0) |
| [13] |
Prabhu S V, Baldwin R P. Electrocatalysis and detection of amino sugars, alditols, and acidic sugars at a copper-containing chemically modified electrode[J]. Analytical Chemistry, 1989, 61(20): 2258-2263 DOI:10.1021/ac00195a010 (  0) 0) |
| [14] |
Reissig J L, Storminger J L, Leloir L F. A modified colorimetric method for the estimation of N-acetylamino sugars[J]. The Journal of Biological Chemistry, 1955, 217(2): 959-966 DOI:10.1016/S0021-9258(18)65959-9 (  0) 0) |
| [15] |
Suzuki S, Shimotsu N, Honda S, et al. Rapid analysis of amino sugars by microchip electrophoresis with laser-induced fluorescence detection[J]. Electrophoresis, 2001, 22(18): 4023-4031 DOI:10.1002/1522-2683(200110)22:18<4023::AID-ELPS4023>3.0.CO;2-P (  0) 0) |
| [16] |
Appuhn A, Joergensen R G, Raubuch M, et al. The automated determination of glucosamine, galactosamine, muramic acid, and mannosamine in soil and root hydrolysates by HPLC[J]. Journal of Plant Nutrition and Soil Science, 2004, 167(1): 17-21 DOI:10.1002/jpln.200321302 (  0) 0) |
| [17] |
Zhang B, Yang X M, Drury C F, et al. A mid-infrared spectroscopy method to determine the glucosamine, galactosamine, and muramic acid concentrations in soil hydrolysates[J]. Soil Science Society of America Journal, 2013, 77(3): 842-849 DOI:10.2136/sssaj2012.0359 (  0) 0) |
| [18] |
Funakoshi I, Yamashina I. Quantitative determination of partially methylated alditol acetate of amino sugar by gas chromatography-mass spectrometry[J]. Analytical Biochemistry, 1980, 107(1): 265-270 DOI:10.1016/0003-2697(80)90520-5 (  0) 0) |
| [19] |
魏金娥, 张洪海, 陈岩, 等. 环境样品中氨基糖分析检测方法的研究进展[J]. 地球科学进展, 2019, 34(1): 84-92 (  0) 0) |
| [20] |
Dick W A, Thavamani B, Conley S, et al. Prediction of β-glucosidase and β-glucosaminidase activities, soil organic C, and amino sugar N in a diverse population of soils using near infrared reflectance spectroscopy[J]. Soil Biology and Biochemistry, 2013, 56: 99-104 DOI:10.1016/j.soilbio.2012.04.003 (  0) 0) |
| [21] |
袁国富, 张心昱, 唐新斋, 等. 陆地生态系统水环境观测质量保证与质量控制[M].
中国环境科学出版社, 北京, 2012
(  0) 0) |
| [22] |
于颖超, 张心昱, 戴晓琴, 等. 亚热带红壤区森林土壤剖面微生物残体碳分布及影响因素[J]. 生态学报, 2022, 42(3): 1108-1117 (  0) 0) |
| [23] |
Mou Z J, Kuang L H, Yan B Y, et al. Influences of sample storage and grinding on the extraction of soil amino sugars[J]. Soil Ecology Letters, 2020, 2(2): 157-163 DOI:10.1007/s42832-020-0031-9 (  0) 0) |
| [24] |
国家药典委员会. 中华人民共和国药典-四部: 2020年版[M].
中国医药科技出版社, 北京, 2020
(  0) 0) |
| [25] |
国家质量监督检验检疫总局, 中国国家标准化管理委员会. 高效液相色谱法通则: GB/T 16631—2008[S]. 北京: 中国标准出版社, 2009.
(  0) 0) |
| [26] |
国家环境保护总局. 土壤环境监测技术规范: HJ/T 166—2004[S]. 北京: 中国标准出版社, 2004.
(  0) 0) |
2. Key Laboratory of Ecosystem Network Observation and Modeling, Institute of Geographic Sciences and Natural Resources Research, Chinese Academy of Sciences, Beijing 100101, China;
3. College of Resources and Environment, University of Chinese Academy of Sciences, Beijing 100101, China;
4. Hebei Key Laboratory of Water Quality Engineering and Comprehensive Utilization of Water Resources, Zhangjiakou, Hebei 075000, China
 2023, Vol. 55
2023, Vol. 55


