2. 云南农业大学园林园艺学院, 昆明 650201
土壤作为人类赖以生存与发展的重要生态环境与自然环境组成部分,日益受到人们的关注[1-2]。而土壤矿物作为土壤的主要组成物质,在土壤固相质量中占90% 以上,构成了土壤的“骨骼”,其组成、结构和性质对土壤的物理、化学、生物与生物化学性质均有深刻的影响,因此在土壤学的研究中受到广泛的关注[3]。
锰(Mn)是较强的亲氧元素,由于岩石风化产生的Mn(Ⅱ)迁移性极强,进入地表后易被逐渐氧化,在不同条件下生成种类繁多的氧化锰矿物,并以分散的弱晶质体、结核和胶膜等多种形式广泛分布于土壤、沉积物和岩石表面等地球表生环境中[4]。氧化锰矿物作为土壤矿物和地球沉积物中的重要组成部分,既是动物和植物体内重要的锰元素来源,也是环境中重要的吸附氧化主体、化学反应的催化剂和地球表面固定光能的光电转化器。受源区母岩类型、环境气候及成土时间等因素的影响,锰元素价态多变,在不同的地质条件下可形成超过30种锰氧化物矿物。氧化锰矿物结构和形貌多变、表面活性强、电荷零点(PZC)低、比表面积大,具有在不同位点上吸附大量重金属离子,并携带其在环境中迁移和转化的特性,从而影响重金属污染物在土壤、沉积物和天然水体中的释放、转化、生物有效性及毒性等生物地球化学过程[5],在调控土壤溶液和天然水体重金属浓度中起着重要作用。因此,不同领域研究者对不同结构和形貌的锰氧化物的形成和转化行为进行了广泛研究。
目前对于不同结构的锰氧化物的形成和之间的转化过程已经有了较为深入的研究,但对于地球化学过程中存在的许多与晶体形成相关的现象,无法做到定量或定性地解释或预测,例如,在合成纳米晶体中观察到的不规则和分支晶体形态[6]以及在生物体中发现的生物矿化过程和微观结构。同样,地质记录显示广泛的矿床具有不寻常的矿物学结构特征[7]。在最新的研究中发现,地壳中锰元素的平均氧化态(average oxidation state)在过去10亿年间为了响应大气的氧化存在上升趋势。然而锰的氧化过程相对于大气氧化过程存在迟滞效应。锰是一种氧化还原敏感金属,价态多变,因此可以作为一种有用的地球表生环境氧化还原状态变化的示踪元素[8]。在环境中固态锰多以水羟锰矿(δ-MnO2)结构形式存在,目前针对δ-MnO2的研究多聚焦于其结构转化机制和对金属离子的富集作用并取得突出进展。因此,本文从δ-MnO2结构的转化、晶体的生长机制以及与金属离子之间的相互作用进行系统性综述,以期为δ-MnO2结构-形貌演化过程对金属元素影响的进一步探究提供参考。
1 δ-MnO2的性质、结构转化及影响因素 1.1 δ-MnO2的性质和结构转化δ-MnO2是一种含有少量的K+、Mg2+、Ca2+、Ba2+、Fe2+等离子和15% ~ 25% 水,以及存在大量Mn4+和含有少量Mn2+和Mn3+的弱结晶的结构不确定的层状氧化锰矿物[9]。δ-MnO2结构形貌多变,属六方晶系结构(P63/mmc),以[MnO6]八面体为基本的结构单元,Mn原子位于八面体中心,6个O原子位于八面体顶角,[MnO6]八面体通过共边连接形成层状结构[10],δ-MnO2仅有2 ~ 3层[MnO6]八面体层[11]。环境中常见的水钠锰矿(六方或正交对称)也属于δ-MnO2,由于这些氧化锰矿物在地球表面普遍存在[12],因此其形貌和结构特性受到研究者们的广泛关注。
先前众多研究发现,δ-MnO2形貌多样,如卷曲的叶片状、团聚体形貌、六边形薄片状晶体等形貌均存在[13-15]。而δ-MnO2作为一种广泛存在于表生环境中反应性强的矿物,可以向土壤中数十种不同结构的锰氧化物矿物转化[16]。例如,可向常见层状氧化锰矿物(六方/三斜水钠锰矿、布塞尔矿等)、隧道锰矿物(钙锰矿、锰钾矿(α-MnO2)、软锰矿(β-MnO2))、拉锰矿(R-MnO2)和六方锰矿(γ-MnO2)等)和低价氧化锰矿物(黑锰矿(Mn2+Mn23+O4)、水锰矿(γ-MnOOH)、六方水锰矿(β-MnOOH)、锰榍石(α-MnOOH)等)进行转化[17],其转化关系如图 1所示。在近20年的研究中,Portehault等[18-19]在研究六方水钠锰矿纳米花的合成以及锰钾矿的形成过程中发现,其反应初期中间产物均为弱结晶的δ-MnO2颗粒聚集体;在多种层状结构或隧道结构高价锰氧化物矿物(如软锰矿、斜方锰矿、拉锰矿和钙锰矿)的形成过程中,δ-MnO2作为初始阶段的前驱体存在[14, 16, 20-24]。综上所述,在晶质锰氧化物矿物的形成初期均先形成弱结晶的δ-MnO2,随后在不同的反应条件下,δ-MnO2会向不同结构形貌的晶质氧化锰矿物发生转化。
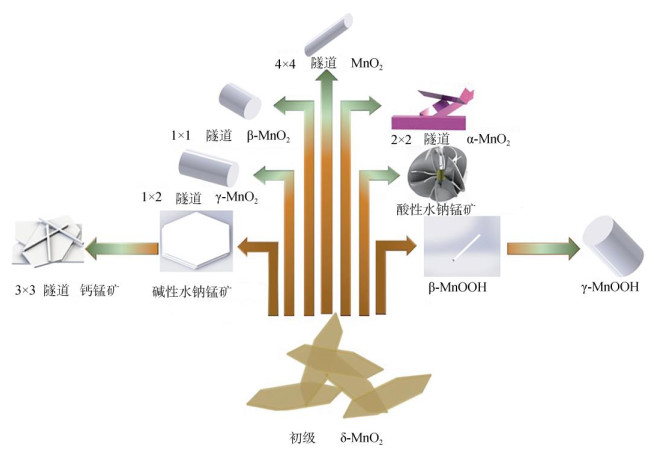
|
图 1 δ-MnO2向不同锰氧化物转化示意图 Fig. 1 Schematic diagram of conversion of δ-MnO2 to different manganese oxides |
影响土壤中δ-MnO2形成与转化的因素主要是pH、Eh、反应时间、温度、氧化还原剂的种类、外来离子种类和含量、水合和脱水等一系列复杂过程[4, 25]。在复杂的土壤环境中,δ-MnO2向不同结构的晶质氧化锰矿物转化过程往往受到多个因素耦合影响。研究表明,Mn2+的存在可以使水钠锰矿的矿相发生转变,其浓度还可影响矿相转化的速率;当初始pH为2.4时可生成六方锰矿和拉锰矿的混合物,pH为4.0时反应56 d水钠锰矿则转变为锰钾矿,而当pH为8.0时仅8 d就生成单相水锰矿[26];Mn2+在40 ℃和pH 4或pH 6的条件下,可自然氧化生成水锰矿,在pH 8和pH 10下则生成黑锰矿[27];通过控制反应过程中的pH、温度和Mn(Ⅶ): Mn(Ⅱ)的比例,可以使反应初期形成的δ-MnO2向锰钾矿、软锰矿和拉锰矿转化[23]。
pH、反应时间和温度是影响δ-MnO2向不同晶质氧化锰矿物转化的主要因素。Elzinga[28]通过将溶液态的Mn2+与人工合成的水钠锰矿在pH为7.5的厌氧条件下反应发现,水钠锰矿会被还原为六方水锰矿(β-MnⅢOOH)和水锰矿(γ-MnⅢOOH),这主要是界面电子从吸附态的Mn(Ⅱ)传递给水钠锰矿结构中的Mn(Ⅳ)原子,并诱发结构中Mn(Ⅳ)原子发生了结构重排。Lefkowitz等[20]研究发现,δ-MnO2与不同浓度的Mn2+在不同pH条件的溶液中反应可以通过电子传递作用形成各种不同价态的低价锰氧化物,如在pH 7.0和7.5时生成六方水锰矿和水锰矿, 在pH 8.0和8.5时生成黑锰矿。Grangeon等[14]在模拟土壤的环境中将δ-MnO2放在酸性避光环境中固相转化8年发现了δ-MnO2向2×2隧道结构的锰钾矿转化的现象。Zhao等[22, 29]研究发现,δ-MnO2在经过Mg2+交换后回流72 h部分转化为3×3隧道结构的钙锰矿,且在pH 9的条件下,通过控制δ-MnO2与Mn2+的比例使其反应20 d后,部分δ-MnO2已转化成为正交对称的水钠锰矿。Chen等[30]研究了煅烧温度对水钠锰矿转变的影响,结果表明,800 ℃下煅烧Na-水钠锰矿和K-水钠锰矿均能得到单一矿相的锰钾矿。Yang和Wang[31]在温度为5 ℃或低于10 ℃的条件下用O2和KMnO4(OPO法)合成水钠锰矿,温度提高,生成黑锰矿与生成水钠锰矿的反应会相互竞争,温度高于20 ℃时,前者的生成占优势。在冯雄汉[4]的研究中有相似的结果,当温度高于20 ℃时,无论反应条件如何变化,都会有黑锰矿生成。Cui等[32]研究发现,在40 ~ 140 ℃的温度范围内,水钠锰矿会向钙锰矿转变,在温度大于100 ℃时,其转变显著增强。与此同时,Bodeï等[33]认为,温度的升高增加了10 Å中间转变的动力学,10 Å叶锰酸盐层的扭结是热诱导形成的,这是形核过程中的关键步骤[21]。
氧化还原作用及氧化还原剂的种类也是影响δ-MnO2向不同晶质化氧化锰矿物转化的一个重要因素。研究发现,微生物和藻类对Mn2+有氧化作用,其生物氧化作用速度较快,多发生在氧化锰矿物形成的初期[34]。Chukhrov等[13]研究发现,环境中的Mn2+可被生物快速氧化得到水羟锰矿。Cai等[35]利用X射线衍射(XRD)技术分析表明,以24 L/min流量的空气氧化Mn(OH)2时,反应至2 h和4 h出现水钠锰矿和六方水锰矿的混合物。Tebo等[36]从海洋中分离得到的锰氧化微生物,海洋芽孢杆菌(Bacillus spores)SG-1,在氧化Mn(Ⅱ)到Mn(Ⅳ)的过程中,在Mn2+浓度较高(大于500 μmol/L)的条件下,产物为六方水锰矿。在赵怀燕[37]的研究中发现,当δ-MnO2在pH 8的条件下,与少量Mn2+(Mn2+/[Mn]≤2%)发生反应,其矿相不变;而Mn2+浓度增加至Mn2+/[Mn] = 5%,δ-MnO2转化为正交层对称型水钠锰矿;继续增加Mn2+浓度(Mn2+/[Mn] ≤10%),则得到六方水锰矿。
外源离子的种类也是影响δ-MnO2向不同结构和形貌的氧化锰矿物转化的因素之一。如在有K+和Al3+的环境中,软锰矿会向锰钾矿、锂硬锰矿转化[38];成矿环境中K+含量较高时,锰钾矿取代软锰矿成为最稳定相[39]。罗瑶[40]在研究黑锰矿和水锰矿的转化和晶体生长机理中发现,当反应体系中阳离子为H+或Na+时,黑锰矿中Mn(Ⅲ)先经歧化反应生成δ-MnO2,通过Mn(Ⅱ)与δ-MnO2间电子传递过程,δ-MnO2进一步转化生成拉锰矿;当反应体系中加入K+时,黑锰矿也是通过以δ-MnO2为中间产物最终转化形成锰钾矿。
2 氧化锰晶体生长机制晶体生长一般有经典和非经典两种机制(图 2),晶体的经典生长过程是基于“基元”为原子或分子的生长过程[41];“非经典晶体生长理论”则是Penn和Banfield[42]研究发现的以单个纳米颗粒为生长“基元”的“定向组装(OA)”现象。
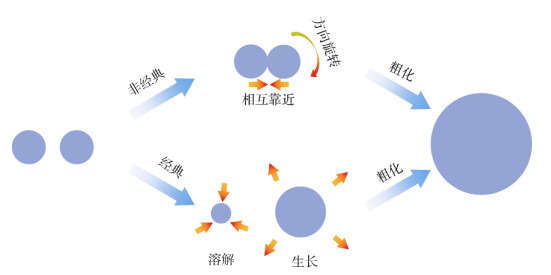
|
图 2 经典和非经典晶体生长机制示意图 Fig. 2 Schematic diagram of classical and non-classical crystal growth mechanisms |
随着研究工作的进行,研究者们发现经典和非经典晶体生长机制在氧化锰的形成和转化过程中均相伴存在。Atkins等[21]在研究水钠锰矿转化形成钙锰矿的过程中以及Grangeon等[14]在研究δ-MnO2转化形成锰钾矿的过程中均发现其矿物生成过程中均存在成核、初始颗粒形成、初始颗粒定向附着、晶体熟化4个阶段。其中,初始颗粒的形成主要是通过溶解-重结晶的方式进行,熟化阶段通过奥斯瓦尔德熟化(Ostwald Ripening)机制使氧化锰晶体消除定向组装带来的内部结构位错和提高结晶度,而形成的初始颗粒在之后阶段沿(010)和(100)晶面头并头和肩并肩定向组装,实现颗粒尺寸的快速增长;在隧道结构锰钾矿纳米线合成过程中,存在由(110)面表面能驱动的定向组装过程,并观测到由于组装晶面原子没有完全匹配,形成了2×3隧道原子结构[43]。研究还发现,在氧阴离子(磷酸根、硅酸根或硫酸根)存在的环境中会合成水钠锰矿,由于含氧阴离子吸附在(110)面,阻碍了水钠锰矿沿边面的组装过程,使其晶体沿边面生长受到抑制,导致在矿物的生成过程中经典晶体生长机制占主导地位,侧面验证水钠锰矿形成的晶体生长过程中存在初始δ-MnO2的定向组装过程[44]。
前人关于氧化锰矿物转化的研究通常把组分、结构和形貌三者分开讨论,而矿物的组分-结构-形貌在不同的尺度上相互影响,并共同耦合决定氧化锰在环境中的转化进程。近年的研究发现,在水钠锰矿晶体生长的过程中,初始六方纳米片在初始阶段迅速团聚形成核,随后通过边对边OA机制在基底上横向聚集并串联形成纳米片,随后水钠锰矿中Mn(Ⅳ)被还原为低价的Mn(Ⅱ/Ⅲ),并逐渐迁移至空穴上下方,空穴上下方的[Mn(Ⅱ/Ⅲ)O6]增多,其连接的‒OH与相邻纳米花瓣之间通过氢键作用相互吸引,并实现沿(001)面的定向组装过程,最终形成六方水纳米花[16];弱结晶态的δ-MnO2向隧道状的锰钾矿转化的过程中也存在多阶段、多方向的OA机制,并且组分-结构-形貌耦合作用于锰钾矿的形成过程。δ-MnO2纳米片首先沿(110)表面通过边到边聚集形成δ-MnO2纳米带,由于结构中Mn(Ⅳ)不断被还原为Mn(Ⅲ)存在,相邻的纳米带会发生面对面的OA机制快速增厚,并在组装过程中层间Mn(Ⅲ)组成锰钾矿2×2的隧道壁,因此锰钾矿的结构和纳米棒形貌同时形成,随后基于头对头和边并边的OA机制,初级纳米棒会相互组装形成更长更宽的纳米棒。而在整个反应过程中,由组装过程形成的缺陷通过溶解-再结晶过程不断得到平滑[24]。综上所述,晶体的非经典生长机制在自然界中是一种普遍存在的生长方式,而环境条件的改变会使氧化锰转化过程受不同的晶体生长机制主导,两种晶体生长机制在氧化锰结构转化过程中普遍存在。
3 δ-MnO2在环境中和金属离子的相互作用氧化锰在环境中对重金属离子具有很强的吸附和富集能力。重金属元素被氧化锰矿物富集后,其在土壤中的浓度和移动性会降低,这些效应对防止重金属污染起积极作用,因此氧化锰矿物也被作为一种环境友好型纳米材料用来修复受污染的土壤。表生环境中存在的Co、Ni、Cu、Pb、Zn、Cd等元素总是与氧化锰和氧化铁相结合或与其含量呈正相关,且土壤中Cd和Pb等大部分重金属元素以铁-锰氧化物结合态存在[45-46]。氧化锰矿物对重金属、过渡元素的富集现象是专性吸附和选择性吸附共同作用的结果,其吸附量与吸附离子的性质和氧化锰表面特性密切相关。而δ-MnO2作为形成晶质氧化锰矿物的前驱体,其对金属离子也有较强的吸附作用。δ-MnO2对不同金属离子的吸附顺序一般为:Pb2+ > Cu2+ > Co2+ > Ni2+ > Zn2+ > Mn2+ > Ca2+ > Mg2+ > Na+[4, 47],且金属的离子吸附与不同δ-MnO2八面体空位数量、分布和锰氧化度以及亚晶胞中层内和层间各种阳离子的分布等有关[48]。
近年来,利用极化扩展X射线吸收精细结构光谱技术(EXAFS)和粉末XRD的矿物结构精修分析表明,Pb2+、Cu2+、Zn2+、Cd2+、Ni2+等重金属阳离子在水钠锰矿层间主要以三齿共角顶(TCS)的内圈配合物形式存在于八面体空位的上方或下方[30,49]。Pb2+主要以内圈络合物形式吸附于酸性水钠锰矿表面的空位位点和层边面位点处(图 3)。低浓度时,Pb2+主要以三齿共角(TCS)络合物形式吸附于空位上下方,高浓度Pb2+可在层内空穴附近形成三齿共边(TES)络合物,Pb2+亦可以双齿共角(DCS)和(或)双齿共边(DES)络合物形式吸附于六方水钠锰矿层边面位点[50];当Pb2+吸附量高时,有部分Pb2+与相邻的锰氧八面体以三齿共边(TES)的方式占据八面体空位周围的三齿孔洞上方或下方或是以两齿配位(DES和DCS)的方式位于八面体层边面[51-52]。Cu2+在pH 4时,主要是以TCS的配位方式吸附在水钠锰矿表面八面体空位的上下方;当pH 8时,Cu2+可以八面体配合物的形式进入空位中[30]。Zn2+在水钠锰矿表面虽是以四配位和六配位2种形式存在,但均与[MnO6]八面体以TCS配位占据在八面体空位的上下方[52]。当Ni2+吸附量大或反应pH高(pH 8)时,Ni2+可进入八面体片层结构中[53]。
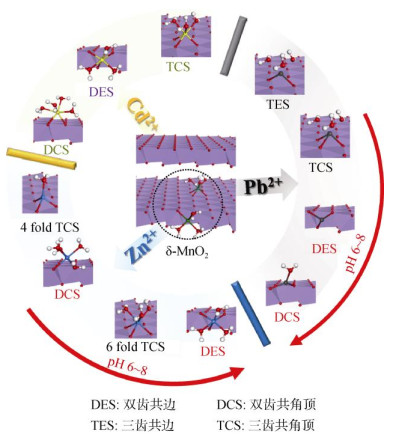
|
图 3 δ-MnO2对Cd2+、Pb2+和Zn2+在不同环境中的吸附机制 Fig. 3 Adsorption mechanisms of Cd2+, Pb2+and Zn2+ by δ-MnO2 in different environments |
δ-MnO2在不同环境中对Cd2+吸附的机理不同。如图 3所示,Cd2+是以三齿共角顶(TCS)的方式吸附在空穴处,随着矿物和Mn(Ⅱ)的反应会导致部分Cd2+由空穴位点释放至边面位点形成双齿共角(DCS)吸附[54]。此外,在有机质存在的环境中,Cd2+还可能以双齿共边(DES)的方式与δ-MnO2相结合。不同环境中Cd2+和δ-MnO2的结合方式多种多样,不同配位和位点吸附的Cd2+受氧化锰不同晶体生长机制的影响也必然不同。经典晶体生长机制与重金属的相互作用更多受颗粒溶解过程控制,Qin等[55]发现,在吸附了Zn的δ-MnO2溶解的过程中,Zn以ⅥZn-TCS结合后的释放速度比ⅣZn-DCS释放速度慢,而Manceau和Steinmann[56]从能量学角度揭示了不同pH下Pb和Zn在不同吸附位点的稳定性有较大的差异。
δ-MnO2的结构转化也会影响矿物对重金属离子的吸附机制。Wu等[57-58]研究含Co3+和Ni2+的水钠锰矿向隧道结构钙锰矿的转化发现,Co3+由于离子半径和Mn4+相近,在转化后进入隧道框架中被氧化锰矿物大量固定,Ni2+更容易以水合离子形式水解形成氢氧化物阻碍隧道矿物的形成。Atkins等[59]报道含同晶替代和吸附态Ni2+的水钠锰矿在转化为钙锰矿时有一半的Ni2+从矿物中流失。因此,氧化锰矿物的转化过程也伴随着重金属离子的固定/释放。结合以往的研究,环境中的重金属离子的吸附和δ-MnO2定向组装过程均受到晶面的影响[60],矿物转化是组分-结构-形貌耦合演化的过程,δ-MnO2在环境条件下组分-结构-形貌耦合演化的过程中如何影响重金属的有效性,以及是否存在已吸附重金属的二次释放污染风险还有待进一步深入研究。
4 总结与展望当前δ-MnO2在土壤中的迁移转化及其与重金属离子相互作用的研究仍有难点,主要表现在以下3方面:①δ-MnO2次生矿化过程中结构-形貌耦合演化过程有待明确。虽然对δ-MnO2结构转化过程已有系统性探究,形貌演化的研究也已经起步,但由于氧化锰矿物的价态多变,电子显微镜束带来的影响,各种原位直接观测形貌演化的手段无法应用。此外,δ-MnO2可向土壤中不同结构的次生氧化锰矿物转化,很难短时间系统性研究其结构-形貌耦合演化的规律。随着研究的不断深入,应聚焦于土壤体系中具有代表性的几种反应活性强和分布广泛的次生氧化锰矿物耦合过程研究,并开发如原子力显微镜等依赖电子束成像观测的体系,原位观测δ-MnO2的形貌演化过程。②土壤体系的复杂性对δ-MnO2的转化规律的影响了解不够全面。已有研究表明,土壤中pH、Eh和Mn2+含量不同,通过电子传递和氧化还原过程会使δ-MnO2向结构截然不同的结晶度更好的次生氧化锰矿转化;土壤中的含氧酸盐、有机质和其他金属离子对δ-MnO2的转化过程也有很大影响。由于土壤本身体系的复杂性、人为活动的干扰和δ-MnO2在土壤中以数年计的转化过程使得在土壤环境中研究δ-MnO2的矿化过程十分困难。基于此,应根据氧化锰矿物已有转化特性的研究,逐步挑选土壤体系中可能影响转化的因素开展单因素、双因素及多因素的协同影响研究,从而完善δ-MnO2在土壤体系中的迁移转化规律。③δ-MnO2转化和重金属的相互作用规律有待开展探索。过去数十年,多聚焦于δ-MnO2对重金属元素的吸附效果和吸附机理的研究,并已取得系统性的进展,但δ-MnO2在土壤体系中结构-形貌的转化,带来吸附位点、吸附力和比表面积等因素的改变,使得其已吸附的重金属具有重新并二次释放的风险。因此,应基于上述①和②的结构-形貌演化规律,进一步针对δ-MnO2转化和重金属相互作用进行研究,以为指导土壤的高效利用,消除重金属二次释放风险,并为探究土壤中其他黏土矿物与重金属的相互影响提供借鉴。
| [1] |
胡文友, 陶婷婷, 田康, 等. 中国农田土壤环境质量管理现状与展望[J]. 土壤学报, 2021, 58(5): 1094-1109 (  0) 0) |
| [2] |
赵其国. 发展与创新现代土壤科学[J]. 土壤学报, 2003, 40(3): 321-327 DOI:10.3321/j.issn:0564-3929.2003.03.001 (  0) 0) |
| [3] |
赵其国. 土壤圈物质循环研究与土壤学的发展[J]. 土壤, 1991, 23(1): 1–3, 15 DOI:10.13758/j.cnki.tr.1991.01.001 (  0) 0) |
| [4] |
冯雄汉. 几种常见氧化锰矿物的合成、转化及表面化学性质[D]. 武汉: 华中农业大学, 2004.
(  0) 0) |
| [5] |
Yang R J, Fan Y Y, Ye R Q, et al. MnO2-based materials for environmental applications[J]. Advanced Materials, 2021, 33(9): 2004862 DOI:10.1002/adma.202004862 (  0) 0) |
| [6] |
Cho K S, Talapin D V, Gaschler W, et al. Designing PbSe nanowires and nanorings through oriented attachment of nanoparticles[J]. Journal of the American Chemical Society, 2005, 127(19): 7140-7147 DOI:10.1021/ja050107s (  0) 0) |
| [7] |
Grotzinger J P, James N P. Precambrian carbonates: Evolution of understanding[M]//Grotzinger J P, James N P. Carbonate sedimentation and diagenesis in the evolving precambrian world. Oklahoma, : SEPM (Society for Sedimentary Geology), 2000: 3–20.
(  0) 0) |
| [8] |
Hummer D R, Golden J J, Hystad G, et al. Evidence for the oxidation of Earth's crust from the evolution of manganese minerals[J]. Nature Communications, 2022, 13: 960 DOI:10.1038/s41467-022-28589-x (  0) 0) |
| [9] |
Ostwald J. Some observations on the chemical composition of todorokite[J]. Mineralogical Magazine, 1986, 50(356): 336-340 DOI:10.1180/minmag.1986.050.356.25 (  0) 0) |
| [10] |
Suib S L. Porous manganese oxide octahedral molecular sieves and octahedral layered materials[J]. Accounts of Chemical Research, 2008, 41(4): 479-487 DOI:10.1021/ar7001667 (  0) 0) |
| [11] |
Villalobos M, Lanson B, Manceau A, et al. Structural model for the biogenic Mn oxide produced by Pseudomonas putida[J]. American Mineralogist, 2006, 91(4): 489-502 DOI:10.2138/am.2006.1925 (  0) 0) |
| [12] |
鲁安怀, 李艳, 丁竑瑞, 等. 地表"矿物膜": 地球"新圈层"[J]. 岩石学报, 2019, 35(1): 119-128 (  0) 0) |
| [13] |
Chukhrov F V, Gorshkov A I, Rudnitskaya E S, et al. Manganese minerals in clays: A review[J]. Clays and Clay Minerals, 1980, 28(5): 346-354 DOI:10.1346/CCMN.1980.0280504 (  0) 0) |
| [14] |
Grangeon S, Fernandez-Martinez A, Warmont F, et al. Cryptomelane formation from nanocrystalline vernadite precursor: A high energy X-ray scattering and transmission electron microscopy perspective on reaction mechanisms[J]. Geochemical Transactions, 2015, 16: 12 DOI:10.1186/s12932-015-0028-y (  0) 0) |
| [15] |
Chen J J, Zhu E B, Liu J, et al. Building two-dimensional materials one row at a time: Avoiding the nucleation barrier[J]. Science, 2018, 362(6419): 1135-1139 DOI:10.1126/science.aau4146 (  0) 0) |
| [16] |
Liang X R, Zhao Z X, Zhu M Q, et al. Self-assembly of birnessite nanoflowers by staged three-dimensional oriented attachment[J]. Environmental Science: Nano, 2017, 4(8): 1656-1669 DOI:10.1039/C6EN00619A (  0) 0) |
| [17] |
Post J E. Manganese oxide minerals: Crystal structures and economic and environmental significance[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(7): 3447-3454 (  0) 0) |
| [18] |
Portehault D, Cassaignon S, Baudrin E, et al. Morphology control of cryptomelane type MnO2 nanowires by soft chemistry. growth mechanisms in aqueous medium[J]. Chemistry of Materials, 2007, 19(22): 5410-5417 DOI:10.1021/cm071654a (  0) 0) |
| [19] |
Portehault D, Cassaignon S, Nassif N, et al. A core-corona hierarchical manganese oxide and its formation by an aqueous soft chemistry mechanism[J]. Angewandte Chemie (International Ed in English), 2008, 47(34): 6441-6444 DOI:10.1002/anie.200800331 (  0) 0) |
| [20] |
Lefkowitz J P, Rouff A A, Elzinga E J. Influence of pH on the reductive transformation of birnessite by aqueous Mn(Ⅱ)[J]. Environmental Science & Technology, 2013, 47(18): 10364-10371 (  0) 0) |
| [21] |
Atkins A L, Shaw S, Peacock C L. Nucleation and growth of todorokite from birnessite: Implications for trace-metal cycling in marine sediments[J]. Geochimica et Cosmochimica Acta, 2014, 144: 109-125 DOI:10.1016/j.gca.2014.08.014 (  0) 0) |
| [22] |
Zhao H Y, Liang X R, Yin H, et al. Formation of todorokite from c-disordered H+-birnessites: The roles of average manganese oxidation state and interlayer cations[J]. Geochemical Transactions, 2015, 16: 8 DOI:10.1186/s12932-015-0023-3 (  0) 0) |
| [23] |
Portehault D, Cassaignon S, Baudrin E, et al. Structural and morphological control of manganese oxide nanoparticles upon soft aqueous precipitation through MnO4−/Mn2+ reaction[J]. Journal of Materials Chemistry, 2009, 19(16): 2407-2416 DOI:10.1039/b816348k (  0) 0) |
| [24] |
Liang X R, Post J E, Lanson B, et al. Coupled morphological and structural evolution of δ-MnO2 to α-MnO2 through multistage oriented assembly processes: The role of Mn(ⅲ)[J]. Environmental Science: Nano, 2020, 7(1): 238-249 DOI:10.1039/C9EN01000A (  0) 0) |
| [25] |
丁维新. 土壤pH对锰赋存形态的影响[J]. 热带亚热带土壤科学, 1994, 3(4): 233-237 (  0) 0) |
| [26] |
Tu S H, Racz G J, Goh T B. Transformations of synthetic birnessite as affected by pH and manganese concentration[J]. Clays and Clay Minerals, 1994, 42(3): 321-330 DOI:10.1346/CCMN.1994.0420310 (  0) 0) |
| [27] |
Gilkes R J, McKenzie R M. Geochemistry and mineralogy of manganese in soils[M]//Graham RD, Hannam RJ, Uren NC. Manganese in Soils and Plants. Dordrecht: Springer, 1988: 23-35.
(  0) 0) |
| [28] |
Elzinga E J. Reductive transformation of birnessite by aqueous Mn(Ⅱ)[J]. Environmental Science & Technology, 2011, 45(15): 6366-6372 (  0) 0) |
| [29] |
Zhao H Y, Zhu M Q, Li W, et al. Redox reactions between Mn(Ⅱ) and hexagonal birnessite change its layer symmetry[J]. Environmental Science & Technology, 2016, 50(4): 1750-1758 (  0) 0) |
| [30] |
Chen C C, Golden D C, Dixon J B. Transformation of synthetic birnessite to cryptomelane: An electron microscopic study[J]. Clays and Clay Minerals, 1986, 34(5): 565-571 DOI:10.1346/CCMN.1986.0340510 (  0) 0) |
| [31] |
Yang D S, Wang M K. Syntheses and characterization of birnessite by oxidizing pyrochroite in alkaline conditions[J]. Clays and Clay Minerals, 2002, 50(1): 63-69 DOI:10.1346/000986002761002685 (  0) 0) |
| [32] |
Cui H J, Feng X H, He J Z, et al. Effects of reaction conditions on the formation of todorokite at atmospheric pressure[J]. Clays and Clay Minerals, 2006, 54(5): 605-615 DOI:10.1346/CCMN.2006.0540507 (  0) 0) |
| [33] |
Bodeï S, Manceau A, Geoffroy N, et al. Formation of todorokite from vernadite in Ni-rich hemipelagic sediments[J]. Geochimica et Cosmochimica Acta, 2007, 71(23): 5698-5716 DOI:10.1016/j.gca.2007.07.020 (  0) 0) |
| [34] |
Wada H, Seirayosakol A, Kimura M, et al. The process of manganese depositton in paddy soils[J]. Soil Science and Plant Nutrition, 1978, 24(3): 319-325 DOI:10.1080/00380768.1978.10433111 (  0) 0) |
| [35] |
Cai J, Liu J A, Suib S L. Preparative parameters and framework dopant effects in the synthesis of layer-structure birnessite by air oxidation[J]. Chemistry of Materials, 2002, 14(5): 2071-2077 DOI:10.1021/cm010771h (  0) 0) |
| [36] |
Tebo B M, Bargar J R, Clement B G, et al. Biogenic manganese oxides: Properties and mechanisms of formation[J]. Annual Review of Earth and Planetary Sciences, 2004, 32: 287-328 DOI:10.1146/annurev.earth.32.101802.120213 (  0) 0) |
| [37] |
赵怀燕. Mn(Ⅱ)对土壤氧化锰矿物转化的影响及其机制[D]. 华中农业大学, 2018.
(  0) 0) |
| [38] |
Parc S, Nahon D, Tardy Y, et al. Estimated solubility products and fields of stability for cryptomelane, nsutite, birnessite, and lithiophorite based on natural lateritic weathering sequences[J]. American Mineralogist, 1989, 74: 466-475 (  0) 0) |
| [39] |
郝瑞霞, 彭省临. 桂西南湖润锰矿床锰矿物的相变特征[J]. 中国锰业, 1999, 17(2): 9-14 (  0) 0) |
| [40] |
罗瑶. 黑锰矿和水锰矿的转化和晶体生长机理[D]. 武汉: 华中农业大学, 2020.
(  0) 0) |
| [41] |
De Yoreo J J, Gilbert P U P A, Sommerdijk N A J M, et al. Crystal growth. Crystallization by particle attachment in synthetic, biogenic, and geologic environments[J]. Science, 2015, 349(6247): aaa6760 DOI:10.1126/science.aaa6760 (  0) 0) |
| [42] |
Penn R L, Banfield J F. Imperfect oriented attachment: Dislocation generation in defect-free nanocrystals[J]. Science, 1998, 281(5379): 969-971 DOI:10.1126/science.281.5379.969 (  0) 0) |
| [43] |
Yuan Y F, Wood S M, He K, et al. Atomistic insights into the oriented attachment of tunnel-based oxide nanostructures[J]. ACS Nano, 2016, 10(1): 539-548 DOI:10.1021/acsnano.5b05535 (  0) 0) |
| [44] |
Wang Q, Liao X Y, Xu W Q, et al. Synthesis of birnessite in the presence of phosphate, silicate, or sulfate[J]. Inorganic Chemistry, 2016, 55(20): 10248-10258 DOI:10.1021/acs.inorgchem.6b01465 (  0) 0) |
| [45] |
Suda A M, Makino T. Functional effects of manganese and iron oxides on the dynamics of trace elements in soils with a special focus on arsenic and cadmium: A review[J]. Geoderma, 2016, 270: 68-75 DOI:10.1016/j.geoderma.2015.12.017 (  0) 0) |
| [46] |
张乃明, 陈建军, 常晓冰. 污灌区土壤重金属累积影响因素研究[J]. 土壤, 2002, 34(2): 90-93 (  0) 0) |
| [47] |
Mellin T A, Lei G B. Stabilization of 10Å-manganates by interlayer cations and hydrothermal treatment: Implications for the mineralogy of marine manganese concretions[J]. Marine Geology, 1993, 115(1/2): 67-83 (  0) 0) |
| [48] |
Zhao W, Wang Q Q, Liu F, et al. Pb2+ adsorption on birnessite affected by Zn2+ and Mn2+ pretreatments[J]. Journal of Soils and Sediments, 2010, 10(5): 870-878 DOI:10.1007/s11368-010-0219-1 (  0) 0) |
| [49] |
Cavani F, Maselli L, Passeri S, et al. Catalytic methylation of phenol on MgO - Surface chemistry and mechanism[J]. Journal of Catalysis, 2010, 269(2): 340-350 DOI:10.1016/j.jcat.2009.11.019 (  0) 0) |
| [50] |
殷辉. 几种过渡金属与六方水钠锰矿的相互作用[D]. 武汉: 华中农业大学, 2013.
(  0) 0) |
| [51] |
Chen J, Lin J C, Purohit V, et al. Photoassisted catalytic oxidation of alcohols and halogenated hydrocarbons with amorphous manganese oxides[J]. Catalysis Today, 1997, 33(1/2/3): 205-214 (  0) 0) |
| [52] |
Chen X, Shen Y F, Suib S L, et al. Catalytic decomposition of 2-propanol over different metal-cation-doped OMS-2 materials[J]. Journal of Catalysis, 2001, 197(2): 292-302 DOI:10.1006/jcat.2000.3063 (  0) 0) |
| [53] |
Chen Y X, Chen Y Y, Lin Q, et al. Factors affecting Cr(Ⅲ) oxidation by manganese oxides[J]. Pedosphere, 1997, 7(2): 185-192 (  0) 0) |
| [54] |
Suzuki K, Kato T, Fuchida S, et al. Removal mechanisms of cadmium by δ-MnO2 in adsorption and coprecipitation processes at pH 6[J]. Chemical Geology, 2020, 550: 119744 DOI:10.1016/j.chemgeo.2020.119744 (  0) 0) |
| [55] |
Qin Z J, Yin H, Wang X M, et al. The preferential retention of ⅥZn over ⅣZn on birnessite during dissolution/ desorption[J]. Applied Clay Science, 2018, 161: 169-175 DOI:10.1016/j.clay.2018.04.017 (  0) 0) |
| [56] |
Manceau A, Steinmann S N. Nature of high-and low-affinity metal surface sites on birnessite nanosheets[J]. ACS Earth and Space Chemistry, 2021, 5(1): 66-76 DOI:10.1021/acsearthspacechem.0c00278 (  0) 0) |
| [57] |
Wu Z K, Peacock C L, Lanson B, et al. Transformation of Co-containing birnessite to todorokite: Effect of Co on the transformation and implications for Co mobility[J]. Geochimica et Cosmochimica Acta, 2019, 246: 21-40 DOI:10.1016/j.gca.2018.11.001 (  0) 0) |
| [58] |
Wu Z K, Lanson B, Feng X H, et al. Transformation of Ni-containing birnessite to tectomanganate: Influence and fate of weakly bound Ni(Ⅱ) species[J]. Geochimica et Cosmochimica Acta, 2020, 271: 96-115 (  0) 0) |
| [59] |
Atkins A L, Shaw S, Peacock C L. Release of Ni from birnessite during transformation of birnessite to todorokite: Implications for Ni cycling in marine sediments[J]. Geochimica et Cosmochimica Acta, 2016, 189: 158-183 (  0) 0) |
| [60] |
Yin H, Feng X H, Tan W F, et al. Structure and properties of vanadium(V)-doped hexagonal turbostratic birnessite and its enhanced scavenging of Pb2+ from solutions[J]. Journal of Hazardous Materials, 2015, 288: 80-88 (  0) 0) |
2. College of Horticulture and Landscape, Yunnan Agricultural University, Kunming 650201, China
 2023, Vol. 55
2023, Vol. 55


