2. 安徽农业大学生物技术中心, 合肥 230036
重金属污染因其存在的普遍性和难治理性而受到广泛关注。铅(Pb)作为五毒金属之一,由于岩石的风化[1],工农业污水的排放[2],矿山的开采、冶炼[3]以及含Pb物质的使用,环境中Pb逐步积聚,浓度越来越高,对人类造成了难以估量的损害。
茶叶作为中国主要的经济作物和出口产品,其产量和品质受到越来越多的关注[4]。据相关报道,茶叶中的Pb含量呈现逐年增加的趋势[5]。茶树作为叶用型经济作物,对氮素的需求非常大,氮不仅参与植物体内蛋白质、核酸、叶绿素、酶、维生素和生物碱的组成,还能促进植物光合作用从而促进植物叶片生长,因此茶叶的产量和品质与氮素供应密切相关[6]。土壤作为一个巨大的氮素存储库,是植物氮素的主要来源。然而土壤中的氮绝大部分以有机态形式存在,无机态只占全氮的1% ~ 5%,绝大多数有机态氮只能转变为无机态氮才能被生物吸收利用[7]。土壤中氮素的转化过程离不开土壤微生物和酶的参与[8]。因此研究Pb污染对茶园土壤中氮转化相关微生物数量和酶活性具有重要意义。
有关茶叶与Pb污染方面的研究已有不少报道,但主要集中在Pb污染对茶叶的生长及生理指标的影响以及茶园土壤中Pb形态的研究[9-10]。对于茶园土壤氮循环相关微生物和酶的研究较少,且没有模拟茶园土壤低浓度Pb累积方面的研究。本文采用盆栽试验,模拟Pb在茶园土壤中的累积过程,探讨Pb不同污染方式(累积和一次性添加)对茶园土壤中氮素转化及其相关微生物数量和酶活性的影响,为研究Pb对茶园土壤中氮转化的作用机理以及提高土壤N素的生物利用率提供理论依据。
1 材料与方法 1.1 试验材料供试茶苗品种为舒茶早茶苗,供试土壤采自安徽省六安市大别山附近种植30 a茶树的茶园,土壤类型为黄棕壤。将采回的土壤混合均匀作为供试土壤,取一部分混合均匀的土,风干,磨碎,过筛后测定土壤基本理化性质[11]。土壤pH为3.93,有机质22.9 g/kg,全氮1.25 g/kg,水解氮120.37 mg/kg,阳离子代换量1.98 cmol/kg,全量Pb背景值为9.84 mg/kg。盆栽试验于2020年9—12月在安徽农业大学大棚中进行。
1.2 试验设计2020年9月,每盆称取供试风干土壤3.5 kg,培养2周后视为新鲜土,移植茶苗4株/盆。向土壤中施入Pb,进行Pb胁迫处理,Pb以PbCl2形式添加。添加方式分为一次性添加(一次污染)和均匀地分10次添加(累积污染)。一次性添加分别称取0.472 1、1.416 4、4.249 3 g PbCl2,将其均匀地混合到茶园土壤中,得到土壤Pb浓度系列分别为100 mg/kg(OL)、300 mg/kg(OM)和900 mg/kg(OH)。累积添加每次分别称取0.047 2、0.141 6、0.425 0 g PbCl2,溶于50 mL蒸馏水中,添加10次,每次间隔10 d,土壤中Pb的叠加累积施入的最终浓度系列分别为100 mg/kg (ML)、300 mg/kg(MM)、和900 mg/kg(MH)。其中不施加外源Pb为对照(CK),共7个处理,每个浓度处理设置3个重复,共计21盆。在茶苗盆栽初始,向每盆土壤施加15N含量为30% 的尿素0.5 g/kg,磷钾肥(磷酸二氢钾)0.44 g/kg。
2021年1月取样,去除土壤中根系和其他非土壤物质,混合均匀,一部分鲜土装入已灭菌的自封袋,4 ℃冰箱中保存,用于测定土壤微生物数量;一部分土壤经风干,磨碎,过2 mm的筛后放入4 ℃冰箱中保存,用于土壤酶活性的测定。
1.3 测定方法 1.3.1 有效Pb含量采用电感耦合等离子发射光谱仪(iCAP 7000 Series,Thermo,德国)进行测定,用EDTA溶液作为提取剂[11]。具体步骤:称取5.000 g土样,加入25 mL 0.05 mol/L的EDTA溶液,振荡2 h后放入离心机,4 000 r/min离心20 min,取上清液用水系滤膜(13 mm × 0.22 μm)过滤,上机测定。
1.3.2 全量Pb含量采用电感耦合等离子发射光谱仪(iCAP 7000 Series,Thermo,德国)进行测定。称取0.1000 g土壤于消解管中,加入5 mL硝酸、3 mL双氧水、2 mL氢氟酸,将消解管放入消解仪中,分别在120、160和190 ℃消解10、10和30 min;消解结束后,揭下盖子,放入赶酸仪中,加入1 mL高氯酸,在160 ℃赶酸至近干,转入25 mL容量瓶中定容。用水系滤膜(13 mm × 0.22 μm)过滤,上机测定。
1.3.3 微生物数量氨化细菌和自生固氮菌数量采用稀释涂布平板法测定[12]; 亚硝酸细菌、硝酸细菌和反硝化细菌数量采用最大或然数(MPN)稀释法测定[12]。
土壤悬液制备:称取10.00 g新鲜土壤,加入90 mL无菌水,置于摇床上振荡(160 r/min,30 min),取出静置5 min,为10–1土壤悬液。取10–1土壤悬液1 mL加9 mL无菌水振荡均匀为10–2土壤悬液,以此类推配制10–3、10–4、10–5…10–8土壤悬液。
涂布平板法:选择细菌合适的土壤悬液,将悬液摇晃均匀,吸取100 uL,加入相应培养基中,用涂布器涂布均匀,倒置于培养箱中,28 ℃培养。每盆土壤做3个重复(氨化细菌和自生固氮菌都选取10-2土壤悬液)。
MPN稀释法:将配好的土壤悬液摇晃均匀,分别选取5个不同浓度的土壤悬液,每个浓度吸取1 mL,加入到装有5 mL无菌水的试管中,置于28 ℃恒温培养箱,培养14 h后,统计结果(硝酸细菌选取10–2 ~ 10–6土壤悬液;硝酸细菌和反硝化细菌选取10–4 ~ 10–8土壤悬液)。
1.3.4 土壤酶活性土壤蛋白酶[13]、脲酶[14]、亚硝酸还原酶[15]和羟胺还原酶[16]活性均参考相关文献,用比色法进行测定。硝酸还原酶[17]活性参考相关文献采用全自动间断化学分析仪(EASYPLUS,Systea,意大利)进行测定。
1.3.5 茶苗和土壤的全氮和15N含量土壤和茶苗的全氮和15N含量采用稳定同位素比质谱仪(Flash EA Isolink CN - Delta V Advantage,Thermo,美国)测定。
1.4 数据处理采用SPSS 20.0软件对数据进行单因素方差和一元线性回归分析,多重比较采用LSD法。采用Origin 2019进行统计分析与作图。
2 结果与分析 2.1 不同污染方式下茶园土壤Pb全量和有效态含量不同方式添加Pb污染对茶园土壤Pb全量和有效态含量的影响如图 1所示,添加Pb对茶园土壤Pb全量和有效态含量影响趋势一致,随着Pb浓度的增加,土壤全量Pb和有效Pb含量增加。Pb浓度为100、300和900 mg/kg时,累积污染处理下的茶园土壤全量Pb和有效Pb含量均高于一次污染,且Pb浓度为300和900 mg/kg时,差异达到显著水平(P < 0.05)。累积污染处理下茶园土壤有效Pb含量占总施入量的79% ~ 84%,一次污染处理下茶园土壤有效Pb含量占总施入量的71% ~ 74%。不同方式添加Pb污染茶园土壤有效Pb含量占全量Pb的74% ~ 84%。
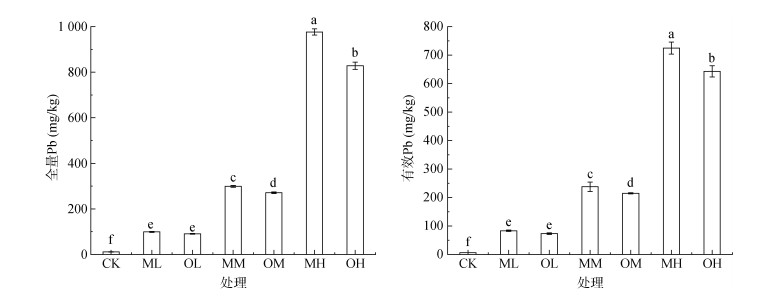
|
(图中小写字母不同表示处理间差异显著(P < 0.05),下同) 图 1 不同处理对茶园土壤Pb全量和有效态含量的影响 Fig. 1 Effects of different treatments on total and available lead contents in tea plantation soil |
Pb污染导致茶园土壤中全氮和15N的含量增加(表 1)。与对照相比,Pb浓度为900 mg/kg和一次性添加Pb浓度为300 mg/kg时显著增加土壤中的全氮含量;Pb浓度为300和900 mg/kg时显著增加了土壤15N的含量。Pb浓度相同时,一次污染土壤中全氮和15N的含量高于累积污染(100 mg/kg的15N的含量除外),但差异均未达到显著水平(P > 0.05)。
|
|
表 1 不同处理对茶园土壤、根系和地上部的全氮和15N含量的影响 Table 1 Effects of different treatments on contents of total nitrogen and 15N in soil, roots and shoots of tea plant |
不同添加方式Pb污染对茶苗根系和地上部全氮和15N含量影响结果如表 1所示。累积污染处理下茶苗根系全氮和15N含量在Pb浓度为100 mg/kg(ML)和300 mg/kg(MM)时减少,在Pb浓度为900 mg/kg(MH)时增加并达到最大,分别为19.2 g/kg和1.58 mg/g;一次污染处理下,Pb污染降低了茶苗根系全氮和15N含量,且随着Pb浓度的增加,茶苗根系全氮和15N含量呈一直减少的趋势,在Pb浓度为900 mg/kg(OH)时最小,分别为12.1 g/kg和0.39 mg/g。Pb污染降低了茶苗地上部全氮和15N含量,当Pb浓度为100 mg/kg和300 mg/kg时,不同方式添加Pb对茶苗根系和地上部全氮和15N含量影响差异不显著;Pb浓度为900 mg/kg时,累积污染处理下的茶苗根系和地上部的全氮和15N含量均显著高于一次污染(P < 0.05)。
2.3 Pb对茶园土壤氮转化微生物的影响不同方式添加Pb污染对茶园土壤中5种可培养氮转化微生物的影响如表 2所示。Pb污染条件下茶园土壤氨化细菌数量与对照相比差异均不显著(P > 0.05)。Pb污染降低了茶园土壤中自生固氮菌、亚硝酸细菌和硝酸细菌的数量,相比于对照,Pb浓度为900 mg/kg时自生固氮菌的数量显著降低;Pb浓度为300 mg/kg和900 mg/kg时,亚硝酸细菌的数量显著降低;一次性添加300 mg/kg或者Pb浓度达到900 mg/kg,硝酸细菌的数量显著降低(P < 0.05)。Pb浓度相同时,不同方式添加Pb污染对茶园土壤中氨化细菌、自生固氮菌、亚硝酸细菌和硝酸细菌数量的影响均不显著。累积污染Pb浓度为900 mg/kg时显著增加了茶园土壤中反硝化细菌的数量,其他浓度Pb处理的反硝化细菌数量与对照相比差异不显著(P > 0.05)。
|
|
表 2 不同处理对茶园土壤氮素转化微生物数量的影响 Table 2 Effects of different treatments on number of nitrogen transforming microorganisms in tea plantation soil |
土壤Pb与氮素转化微生物数量的Pearson相关性分析如表 3所示,茶园土壤中Pb全量与有效态含量间呈现极显著的正相关关系。氨化细菌、自生固氮菌、亚硝酸细菌和硝酸细菌的数量与茶园土壤中Pb全量和有效态含量间呈现极显著的负相关关系,而反硝化细菌的数量与茶园土壤中Pb全量和有效态含量间呈现极显著的正相关关系(P < 0.01)。
|
|
表 3 土壤Pb全量和有效态含量与氮素转化微生物数量的Pearson相关性分析 Table 3 Pearson correlation analysis between total and available Pb contents in soil and the number of nitrogen-transforming microorganisms |
由表 4可知,蛋白酶活性与茶园土壤全量Pb和有效Pb含量间均呈现出极显著的负相关关系(P < 0.01)。Pb浓度为100 mg/kg时,蛋白酶活性增加;Pb浓度为300和900 mg/kg时,其活性显著降低,且随着Pb浓度增大,蛋白酶活性下降幅度越大(表 5)。Pb浓度相同时,污染方式对茶园土壤蛋白酶活性影响差异不显著(P > 0.05)。
|
|
表 4 土壤Pb全量和有效态含量与氮素转化酶活性的关系方程 Table 4 Relation equations between total and available lead contents and activity of nitrogen invertase |
|
|
表 5 不同处理对茶园土壤氮素转化酶活性的影响 Table 5 Effects of different treatments on soil nitrogen invertase activities in tea plantation |
脲酶活性与茶园土壤全量Pb和有效Pb含量间的相关性均不显著(P > 0.05)(表 4)。Pb污染抑制了茶园土壤脲酶活性,且随着Pb浓度的增加抑制作用增强(表 5)。一次性添加300 mg/kg的Pb或者添加Pb浓度达到900 mg/kg时会导致茶园土壤脲酶活性的显著降低。Pb浓度为300 mg/kg和900 mg/kg时,污染方式显著影响脲酶活性,累积污染显著高于一次污染(P < 0.05)。
亚硝酸还原酶活性与茶园土壤全量Pb和有效Pb含量间的相关性均达到极显著水平(P < 0.01)(表 4)。Pb污染显著降低了茶园土壤亚硝酸还原酶活性,且随着Pb浓度的增加抑制作用增强(表 5)。Pb浓度相同时,污染方式对茶园土壤亚硝酸还原酶活性的影响不显著(P > 0.05)。
硝酸还原酶活性与茶园土壤全量Pb和有效Pb含量间均呈极显著相关关系(P < 0.01)(表 4)。Pb污染显著降低了土壤硝酸还原酶的活性,且随着Pb浓度的增加,酶活性下降幅度增大(表 5)。Pb浓度达到900 mg/kg时,硝酸还原酶的活性被抑制程度最大。土壤Pb浓度为100 mg/kg时,污染方式对硝酸还原酶活性具有显著影响,累积污染显著高于一次污染(P < 0.05);Pb浓度为300和900 mg/kg时,累积污染土壤的硝酸还原酶活性高于一次污染,但处理间差异不显著。
羟胺还原酶活性与茶园土壤中全量Pb和有效Pb含量均无显著相关性(P > 0.05)(表 4)。Pb污染浓度为100和300 mg/kg时,对羟胺还原酶活性没有显著影响(表 5);Pb污染浓度为900 mg/kg时,不同污染方式对羟胺还原酶活性影响不同,累积污染显著促进羟胺还原酶活性,一次污染则表现为明显的抑制效果(P < 0.05)(表 5)。
3 讨论Pb浓度增加,土壤全量Pb和有效Pb含量增加,重金属由于其在环境存在时间长不易降解且具有累积性,因此添加Pb总量是影响茶园土壤Pb全量和有效态含量的最主要因素,这与钟晓兰等[18]的研究结果一致。不同方式添加Pb污染对茶园土壤全量Pb和有效Pb含量的影响有差异。研究发现Pb的有效态随着时间的推移而减少[19]。累积污染Pb在土壤的老化时间较短,从而导致累积污染有效Pb含量高于一次污染。
高浓度的Pb胁迫干扰植物氮的代谢过程,推测一方面重金属抑制了茶树吸收土壤中的NO3–或NH4+,另一方面重金属降低了茶树氮代谢同化过程的一些关键酶的活性,从而导致茶树根和茎中全氮和15N含量减少[20]。但植物对重金属也具有一定的耐性,主要通过避免过量重金属进入植物体内,如把重金属固定在细胞壁或者转移到液泡中[21];以及自身耐性机制减轻重金属的毒害作用如一些有机酸和蛋白质与重金属螯合[22]。在一定的重金属胁迫下,植物可以通过自身防御机制减轻重金属对自身的毒害作用。因此相比于累积添加和低浓度的一次性添加,只有在一次性添加高达900 mg/kg的外源Pb才会对植物根和茎中全氮和15N含量产生显著影响。高浓度的重金属影响了生物体对于氮的吸收消耗,导致留在土壤中氮含量的增加。
Pb胁迫减少了可培养氨化细菌、自生固氮菌、亚硝酸细菌和硝酸细菌数量;降低了蛋白酶、脲酶、硝酸还原酶和亚硝酸还原酶的活性。Oliveira和Pampulha[23]研究了长期受污染问题地区的土壤,发现污染土壤样品中不同微生物类群的可培养总数明显减少。当环境中的重金属超过一定浓度时,会通过改变大分子的特异性、诱导活性氧产生、破坏细胞膜、损伤DNA结构以及与酶活性位点结合等途径对微生物和酶产生毒害作用[24],从而导致微生物数量的减少和酶活性的降低。本文研究结果表明:重金属对反硝化作用比硝化作用的影响更小,相比于硝化菌,反硝化菌更能耐受重金属胁迫,可能反硝化菌对重金属污染的适应发生得比硝化菌快得多,适应率可能与微生物多样性和生长速率有关,因为与生长缓慢和多样性较低的自养硝化种群相比,异养反硝化种群具有更大的多样性和生长速率[25]。Pb不同添加方式对茶园土壤与氮循环相关微生物数量的影响不显著,可能是因为两种污染方式下同一污染浓度的有效Pb含量差异相对较小,土壤中与氮循环相关的微生物群落适应了该浓度范围的重金属毒性,因而同一污染浓度不同污染方式下土壤微生物数量差异不大。群落适应可以通过耐受群体的选择性增长和敏感群体的选择性衰退来解释[26];也有研究发现微生物群落可以通过改变其组成和结构来快速适应重金属变化[27]。
重金属对土壤酶活性的影响因酶种类的不同而存在差异。低浓度的外源Pb会增加蛋白酶活性。王涵等[28]研究Cd、Pb严重污染的土壤中蛋白酶活性的变化,也得出了相似的结果。重金属不仅作为某些酶的重要辅因子影响酶活性,还可以通过影响底物间接影响酶活性。印杰等[29]研究崇明东滩湿地发现土壤中Pb2+浓度为100 ~ 500 mg/kg时,硝酸还原酶活性会被抑制。Pb胁迫下硝酸还原酶活性降低,可能是因为重金属破坏了土壤的硝化过程导致土壤中植物可利用的硝酸盐含量少,硝酸还原酶可利用底物减少,使得其活性降低。高浓度的Pb胁迫对于茶园土壤羟胺还原酶有一定的激活作用,其原因可能是高浓度的Pb促进了亚硝酸盐的还原或者氨的氧化过程,产生较多的羟胺,刺激了羟胺还原酶的活性。脲酶对重金属污染敏感,通常用脲酶活性作为判断土壤重金属污染程度的生化指标[30]。本研究结果表明,与其他酶相比,脲酶对茶园土壤Pb污染的敏感度并不高,可能是因为土壤理化性质和种植作物不同。李雨桐等[31]研究发现土壤理化性质和环境是影响土壤微生物的重要因素。Deng等[32]评估了37个环境因素对土壤微生物群落的不同影响,也发现除了重金属,土壤pH、土壤质地和氮被认为在塑造土壤微生物群落方面具有重要作用。本研究的结果表明:Pb的不同添加方式对茶园土壤氮转化酶活性的影响不同,累积污染和一次污染对茶园土壤蛋白酶和亚硝酸还原酶活性影响无显著差异;对于硝酸酶还原酶、脲酶和羟胺还原酶则表现为浓度不同显著性不同。产生这样结果的原因是不同种类的酶对重金属Pb的耐受性不同。
4 结论1) Pb浓度相同时,累积污染处理土壤中Pb全量和有效态含量显著高于一次污染。Pb污染增加了茶园土壤中全氮和15N含量,降低了茶苗植株的全氮和15N含量(MH除外)。污染方式对茶园土壤中全氮和15N含量没有显著影响,高浓度Pb污染(900 mg/kg)条件下,累积污染处理的茶苗植株全氮和15N含量显著高于一次污染。
2) 反硝化细菌能耐受较高浓度的Pb污染。氨化细菌、自生固氮菌、亚硝酸细菌和硝酸细菌的数量与茶园土壤中全量和有效Pb含量间呈现极显著的负相关关系,反硝化细菌的数量则与土壤全量和有效Pb含量间呈现极显著的正相关关系。
3) 蛋白酶、亚硝酸还原酶和硝酸还原酶与茶园土壤中全量和有效Pb含量间均呈极显著的负相关关系。两种污染方式对土壤脲酶、硝酸还原酶和羟胺还原酶活性的影响因Pb污染浓度的不同而存在较大差异。土壤硝酸还原酶更易受到茶园土壤Pb胁迫的影响,其活性作为预测茶园土壤Pb污染程度的主要生化指标具有一定的可行性。
| [1] |
Lee P K, Kang M J, Jeong Y J, et al. Lead isotopes combined with geochemical and mineralogical analyses for source identification of arsenic in agricultural soils surrounding a zinc smelter[J]. Journal of Hazardous Materials, 2020, 382: 121044 DOI:10.1016/j.jhazmat.2019.121044 (  0) 0) |
| [2] |
Karimi A, Naghizadeh A, Biglari H, et al. Assessment of human health risks and pollution index for heavy metals in farmlands irrigated by effluents of stabilization ponds[J]. Environmental Science and Pollution Research, 2020, 27(10): 10317-10327 DOI:10.1007/s11356-020-07642-6 (  0) 0) |
| [3] |
Wen H J, Zhang Y X, Cloquet C, et al. Tracing sources of pollution in soils from the Jinding Pb-Zn mining district in China using cadmium and lead isotopes[J]. Applied Geochemistry, 2015, 52: 147-154 DOI:10.1016/j.apgeochem.2014.11.025 (  0) 0) |
| [4] |
Li W B, Cheng H Y, Mu Y J, et al. Occurrence, accumulation, and risk assessment of trace metals in tea (Camellia sinensis): A national reconnaissance[J]. Science of the Total Environment, 2021, 792: 148354 DOI:10.1016/j.scitotenv.2021.148354 (  0) 0) |
| [5] |
姜红艳, 龚淑英. 茶叶中铅含量现状及研究动态[J]. 茶叶, 2004, 30(4): 210-212 (  0) 0) |
| [6] |
周德超. 氮、磷、钾在植物体中的主要生理作用及植物对养分的吸收[J]. 生物学通报, 1983, 18(5): 7-8 (  0) 0) |
| [7] |
Landesman W J, Dighton J. Response of soil microbial communities and the production of plant-available nitrogen to a two-year rainfall manipulation in the New Jersey Pinelands[J]. Soil Biology and Biochemistry, 2010, 42(10): 1751-1758 DOI:10.1016/j.soilbio.2010.06.012 (  0) 0) |
| [8] |
Gruber N, Galloway J N. An Earth-system perspective of the global nitrogen cycle[J]. Nature, 2008, 451(7176): 293-296 DOI:10.1038/nature06592 (  0) 0) |
| [9] |
夏建国, 兰海霞, 吴德勇. 铅胁迫对茶树生长及叶片生理指标的影响[J]. 农业环境科学学报, 2010, 29(1): 43-48 (  0) 0) |
| [10] |
石元值, 韩文炎, 马立锋, 等. 不同茶园土壤中外源铅的形态转化及其生物有效性[J]. 农业环境科学学报, 2010, 29(6): 1117-1124 (  0) 0) |
| [11] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000
(  0) 0) |
| [12] |
李振高, 骆永明, 滕应. 土壤与环境微生物研究法[M].
科学出版社, 北京, 2008
(  0) 0) |
| [13] |
隋跃宇, 陈一民, 焦晓光, 等. 土壤蛋白酶的测定方法: CN105784695B[P]. 2019-03-26.
(  0) 0) |
| [14] |
关松荫. 土壤酶及其研究法[M].
农业出版社, 北京, 1986
(  0) 0) |
| [15] |
武志杰, 孙志梅, 张丽莉. 一种检测土壤亚硝酸还原酶活性的分析方法: CN1979134A[P]. 2009-06-03.
(  0) 0) |
| [16] |
武志杰, 史云峰, 陈利军, 等. 一种检测土壤中羟胺还原酶活性的分析方法: CN101082567A[P]. 2007-12-05.
(  0) 0) |
| [17] |
刘涛, 褚贵新, 雷雨. 一种土壤硝酸还原酶活性测定的新方法: CN110643676A[P]. 2020-01-03.
(  0) 0) |
| [18] |
钟晓兰, 周生路, 黄明丽, 等. 土壤重金属的形态分布特征及其影响因素[J]. 生态环境学报, 2009, 18(4): 1266-1273 (  0) 0) |
| [19] |
田园, 王晓蓉, 林仁漳, 等. 土壤中镉铅锌单一和复合老化效应的研究[J]. 农业环境科学学报, 2008, 27(1): 156-159 (  0) 0) |
| [20] |
祖艳群, 李元, Bock L, 等. 重金属与植物N素营养之间的交互作用及其生态学效应[J]. 农业环境科学学报, 2008, 27(1): 7-14 (  0) 0) |
| [21] |
Leita L, De Nobili M, Cesco S, et al. Analysis of intercellular cadmium forms in roots and leaves of bush bean[J]. Journal of Plant Nutrition, 1996, 19(3/4): 527-533 (  0) 0) |
| [22] |
孙瑞莲, 周启星. 高等植物重金属耐性与超积累特性及其分子机理研究[J]. 植物生态学报, 2005, 29(3): 397-404 (  0) 0) |
| [23] |
Oliveira A, Pampulha M E. Effects of long-term heavy metal contamination on soil microbial characteristics[J]. Journal of Bioscience and Bioengineering, 2006, 102(3): 157-161 (  0) 0) |
| [24] |
Stohs S J, Bagchi D. Oxidative mechanisms in the toxicity of metal ions[J]. Free Radical Biology and Medicine, 1995, 18(2): 321-336 (  0) 0) |
| [25] |
Feng B, Fang Z, Hou J C, et al. Effects of heavy metal wastewater on the anoxic/aerobic-membrane bioreactor bioprocess and membrane fouling[J]. Bioresource Technology, 2013, 142: 32-38 (  0) 0) |
| [26] |
Diaz-Ravina M, Baath E. Development of metal tolerance in soil bacterial communities exposed to experimentally increased metal levels[J]. Applied and Environmental Microbiology, 1996, 62(8): 2970-2977 (  0) 0) |
| [27] |
Zhao X Y, Tan W B, Peng J J, et al. Biowaste-source- dependent synthetic pathways of redox functional groups within humic acids favoring pentachlorophenol dechlorination in composting process[J]. Environment International, 2020, 135: 105380 (  0) 0) |
| [28] |
王涵, 高树芳, 罗丹, 等. Cd Pb污染土壤中蛋白酶酸性磷酸酶脱氢酶活性的变化[J]. 农业环境科学学报, 2010, 29(3): 500-505 (  0) 0) |
| [29] |
印杰, 范弟武, 徐莎, 等. 崇明东滩湿地土壤中Cr3+、Pb2+和Cd2+对硝酸还原酶的Hormesis效应[J]. 南京林业大学学报(自然科学版), 2016, 40(2): 21-26 (  0) 0) |
| [30] |
洪春来, 贾彦博, 王润屹, 等. 铅污染对土壤微生物及酶活性的影响[J]. 中国农学通报, 2008, 24(12): 304-307 (  0) 0) |
| [31] |
李雨桐, 杨杉, 张艺, 等. 不同地区土壤古菌群落对重金属污染的响应[J]. 环境科学, 2021, 42(9): 4481-4488 (  0) 0) |
| [32] |
Deng S Q, Ke T, Li L T, et al. Impacts of environmental factors on the whole microbial communities in the rhizosphere of a metal-tolerant plant: Elsholtzia haichowensis Sun[J]. Environmental Pollution, 2018, 237: 1088-1097 (  0) 0) |
2. Biotechnology Center of Anhui Agricultural University, Hefei 230036, China
 2023, Vol. 55
2023, Vol. 55


