2. 青海省农林科学院, 西宁 810016;
3. 青海省青稞遗传育种重点实验室/国家麦类改良中心青海青稞分中心, 西宁 810016
混作是可明显改善连作障碍的有效措施[1],不仅可提高土壤微生物群落结构及多样性、提高土壤微生物活性和酶活性、增加有益微生物数量,还能显著改善有害微生物累积所致的微生态失衡、减少自毒物质积累,进而促进土壤微生物区系环境的优化[2],改变土壤物质结构,防止土壤养分失衡[3],最终达到修复连作障碍的目的。
真菌参与土壤有机质的合成与分解,影响着土壤的一系列生化过程[4]。真菌在土壤-作物生态系统中发挥着重要作用[5],一方面可参与动植物残体的分解,在生态系统中起着养分物质再循环的作用,另一方面真菌也受到作物和土壤理化性质的影响[6]。肥料被认为是导致土壤微生物群落改变的主要驱动因子[7-8]。人为的施肥措施可增加土壤养分含量使微生物优势物种多样性发生改变,进而间接影响土壤的理化性质,致使微生物群落组成及生物量发生明显改变[9]。不同的种植模式,如间混作、轮套作等对土壤微生物的数量、活性或者群落结构的影响也是不同的[10]。前人研究表明,马铃薯根际土壤真菌属水平以轮作方式不同其优势属的种类和丰度差异较大[11];玉米/大豆间、套作时,可使间作处理中玉米和大豆根际土壤微生物的数量比单作处理显著增加[12];禾本科牧草燕麦×豆科牧草箭筈豌豆混作时,相比单作燕麦,可显著提高根际土壤细菌数量[13]。
综上所述,施肥可明显改变根际土壤微生物群落结构、多样性及其土壤理化性质,但针对高原地区禾豆混作模式下根际土壤相关理化性质、真菌群落结构及多样性对不同施肥水平的响应机制研究较少。鉴于此,本研究采用Illumina MiSeq高通量测序技术,并结合非度量多维尺度分析(NMDS)、冗余分析(RDA)和曼特尔检验(Mantel test),探讨不同施肥水平下的青稞、豌豆单作和青稞豌豆混作根际土壤真菌群落结构组成及多样性的差异及其与环境因子的相关性,找出影响真菌群落结构差异的主要驱动因子,以期从根际微生物角度得到能明显优化根际微生态的施肥水平和方案,为青稞豌豆混作模式合理的肥料运筹方案制定提供理论依据。
1 材料与方法 1.1 试验区概况田间试验在青海省农林科学院种质资源创新试验基地(36°62′N,101°77′E)进行,属青海省东部湟水河流域灌区,海拔2 309 m。土壤类型为栗钙土,容重1.50 g/cm3,田间持水率15.20%,土壤pH 7.98,全氮含量1.15 g/kg,有效磷含量77.48 mg/kg,耕作层有机质含量22.11 g/kg。为避免春旱导致作物出苗差的,试验地于秋收后耕层土壤封冻前做充分灌溉处理(11月上旬),冬季封冻(11月中下旬至来年3月上旬),来年春季顶凌播种(3月下旬至4月上旬),整个生育期不作灌水处理。
1.2 试验设计田间试验开始于2021年3月,采用随机区组设计,肥料在播前均匀撒施,每小区10行,行距20 cm,行长6 m,小区面积为12 m2。供试青稞品种选用“昆仑15号”;豌豆品种选用“草原23号”,半无叶性品种。试验设置不施肥(0NP)、低氮磷(LNP,37.5 kg/hm2尿素+ 75.0 kg/hm2过磷酸钙)和高氮磷(HNP,75.0 kg/hm2尿素+150.0 kg/hm2过磷酸钙) 3个水平;种植模式设青稞单作(Q)、豌豆单作(W)和青稞豌豆混作(Q×W) 3种模式;共9个处理,每个处理3次重复,共27个小区。青稞单作播量300.0 kg/hm2,豌豆单作播量225 kg/hm2,青稞豌豆混作混合播量为300 kg/hm2,播量比例为青稞: 豌豆=1:9,即青稞30.0 kg/hm2,豌豆270.0 kg/hm2。田间管理采用常规管理方式。
1.3 土壤样品采集试验于青稞拔节期采集根际土壤样品(青稞在生长发育阶段分蘖到拔节期对外源养分的需求最高[14-15])。单作、混作每个小区均采用“Z”字形取土法,取5个点次根际土壤,每个取样位点除去边行随机选择3株作物进行取样,同一取样位点3株植物的根际土混合在一起作为该取样位点的根际土,其中混作按青稞和豌豆根际土壤分开取样后,将根际土壤均匀混合在一起。采用抖土法采集根际土壤样品,以作物为中心,用铁锹按1/2行距(垂直于行向)×株距(平行于行向)×30 cm深的规格破坏性挖出完整根系,轻轻抖落与植物根系吸附的土壤,仍然粘在根系表面(< 1 ~ 4 mm)的土壤为根际土,用毛刷轻轻将其刷下,抖落的土壤即为非根际土。土壤过2 mm孔径筛,装入空心管内,根际土保存于–80 ℃冰箱中,后续用于真菌群落结构及多样性测定;非根际土风干保存,用于后续土壤理化性质的测定。
1.4 土壤基本理化性质测定土壤pH采用pH计测定;土壤有机质含量采用光度比色法测定;土壤速效氮采用碱解扩散法测定;土壤全磷、有效磷含量采用钼锑抗比色法测定;土壤全氮含量采用凯氏定氮法测定。
1.5 根际土壤真菌测序使用Fast DNA SPIN Kit for Soil试剂盒,依照试剂盒说明提取土壤总DNA,提取后的DNA溶液用超微量紫外分光光度计测定其纯度和浓度,浓度大于50 ng/μL的样品在0.8% 的琼脂糖凝胶电泳后检查片段是否完整,检查合格后存放于–80 ℃冰箱保存待测序;ITS1位于真核生物核糖体rDNA序列的18S和5.8S之间。真菌ITS PCR使用NS1-FUNG通用引物NS1和FUNGAL。PCR反应体系和扩增条件以戴瑞清等[16]和马少兰等[17]的方法为依据,由北京诺禾致源科技股份有限公司后续样品建库测序。
1.6 测序数据处理及生物信息学分析测序得到的原始数据,存在一定比例的干扰数据[18]。为了使信息分析的结果更加准确、可靠,首先对原始数据进行拼接、过滤,得到有效数据[19]。序列分析通过Uparse软件进行,将优化的序列聚类为操作分类单位(OTU)。使用RDP贝叶斯算法对97% 相似度的代表性OTU序列进行分类,以获得与每个OTU相对应的物种分类信息[20]。
微生物α多样性包括Shannon指数(表示样品中分类总数及其占比,群落多样性越高,物种分布越均匀,Shannon指数越大)、Simpson指数(代表群落内物种分布的多样性和均匀度,Simpson指数越低,群落多样性越高,物种分布越均匀)、Chao1指数(估计群落样品中包含的物种总数)、ACE指数(估计群落中OTU数目)、覆盖度Coverage(反映测序结果代表样本的真实情况) [21]。使用DPS数据处理系统软件对土壤理化性质及土壤微生物α多样性进行差异显著性统计分析;不同处理的均值在5% 的显著性水平下做LSD多重比较。数据以“平均数±标准差”形式表示。微生物β多样性分析(即真菌群落Beta分析)是对不同样本的微生物群落构成进行分析,首先根据所有样本的物种注释结果和OTUs的丰度信息,将相同分类的OTUs信息合并处理得到物种丰度信息表;然后,通过NMDS统计,根据样本中包含的物种信息,以点的形式反映在二维平面上,而对不同样本间的差异程度,则是通过点与点间的距离体现,距离的远近代表样本差异的大小。
1.7 数据处理与分析利用Canoco 5软件进行RDA分析,研究土壤理化性质与真菌群落之间的关系[22-23],明确驱动土壤原生生物群落组成变化的关键驱动因子。
2 结果与分析 2.1 混作和施肥对土壤理化性质的影响由表 1可见,3种施肥水平下不同种植模式之间速效氮含量均呈现Q×W > W > Q;混作模式速效氮含量在LNP、HNP水平下显著高于0NP水平,且在HNP下含量最高,但与LNP下无显著差异。有效磷含量为46.31 ~ 67.93 mg/kg,青稞单作土壤有效磷含量随着施肥量的增加而升高;豌豆单作、青稞豌豆混作有效磷含量随着施肥量的增加先升高再降低,在LNP水平下大于HNP水平,但无显著差异。有机质含量为15.81 ~ 21.84 g/kg,3种种植模式土壤有机质含量在不同施肥水平下均呈现Q×W > W > Q的趋势;混作模式在HNP下有机质含量最高,显著高于0NP、LNP。所有土壤均为碱性土壤,pH介于8.02 ~ 8.24,青稞、豌豆单作和混作模式均表现为随施肥水平的升高土壤逐渐酸化;混作模式在HNP下pH最低,但与LNP无显著差异。双因素方差分析表明(表 2):种植模式对有机质、速效氮、全氮、有效磷、pH显著影响(P < 0.05);施肥显著改变土壤有机质、全氮、速效氮、有效磷含量(P < 0.05);施肥与种植模式对有机质、全磷、有效磷、速效氮、pH表现出显著的交互作用(P < 0.05)。
|
|
表 1 土壤理化性质 Table 1 Soil physicochemical properties under different treatments |
|
|
表 2 种植模式和施肥水平对土壤理化性质影响的双因素方差分析 Table 2 Two-way ANOVA on effect of cropping pattern and fertilization level on soil physicochemical properties |
通过统计各阶段的序列数、序列长度等参数对数据进行评估。真菌ITS测序共获得2 261 871对原始序列,2 244 757条高质量序列,2 088 520条有效序列,每个样品至少产生78 518条有序序列,平均产生87 353条有序序列,平均长度在229 ~ 358 bp。对所有处理中有效序列进行OTU聚类得到土壤真菌OTU数目进行统计,并绘制花瓣图(图 1),直观展示不同处理共有特征和特有特征的数目,从而通过OTU聚类所注释的物种信息,找出不同环境中特有土壤微生物。
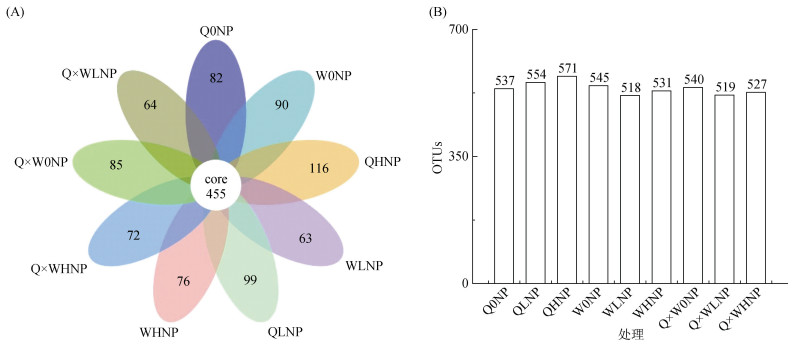
|
图 1 土壤真菌群落OTU花瓣图(A)和OTU数(B) Fig. 1 OTU petals figure (A) and numbers (B) of fungal communities of soils |
由图 1A可知,各处理间真菌特有OTU数目具有显著性差异,9组处理共有OTU数为455个,其中QHNP特有OTU数目最多,为116个,Q×WLNP特有OTU数目最少64个。由图 1B可以看出,青稞单作模式随着施肥水平的增加,土壤中OTU数逐渐增多;豌豆单作模式随着施肥水平的增加,土壤中OTU数先降低后升高;青稞豌豆混作随着施肥水平的增加,土壤中OTU数先降低后升高。
2.3 不同处理下土壤真菌群落Alpha多样性分析真菌土壤多样性指数覆盖率均在99% 以上。由图 2可知,青稞单作ACE指数,随着施肥量的增加逐渐升高,在HNP水平下与其他两水平达显著性差异;豌豆单作ACE指数随着施肥量的增加逐渐降低;混作模式随着施肥量的增加,ACE指数先降低后升高。Chao1指数与ACE指数变化规律相同。在不同施肥水平下Shannon指数均表现为Q > Q×W > W,其中混作模式在LNP水平下最高。Simpson指数与Shannon指数呈现相同规律。以上结果表明青稞单作土壤中真菌群落丰富度和多样性最高,青稞豌豆混作可以降低真菌群落物种丰富度及多样性。
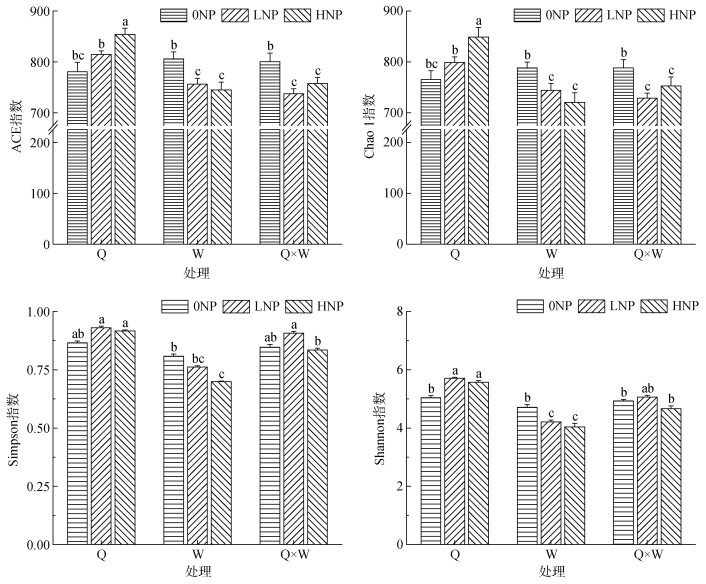
|
(图中小写字母不同表示处理间差异显著(P < 0.05)) 图 2 土壤真菌Alpha多样性指标 Fig. 2 Alpha diversity indexes of soil fungi under different treatments |
在门水平上共得到18个真菌类群,图 3A是真菌在门水平上最大丰度前10位的物种相对丰度柱状图。分别为子囊菌门(Ascomycota,占比63.5% ~ 78.5%)、被孢霉门(Mortierellomycota,3.6% ~ 14%)、担子菌门(Basidiomycota,1.1% ~ 6.9%)、毛霉门(Mucoromycota,0.5% ~ 5.8%)、球囊菌门(Glomeromycota,0.2% ~ 1.8%)、壶菌门(Chytridiomycota,0.3% ~ 0.7%),另外油壶菌门(Olpidiomycota)、捕虫霉门(Zoopagomycota)、芽枝霉门(Blastocladiomycota)、隐孢子菌(Aphelidiomycota) 4种菌门的相对丰度在不同样品中所占比例不到1%。在门水平上,占据主导地位的主要包括子囊菌门、被孢霉门、担子菌门,三者相对丰度之和占各处理总测序丰度的79.7% ~ 87.2%。随着施肥水平的提高,青稞豌豆混作模式中子囊菌门丰度增高,在3种施肥水平下青稞单作中子囊菌门相对丰度均低于混作模式,混作模式会增加子囊菌门物种丰度。图 3C为不同施肥水平下混作门水平的物种丰度图,被孢霉门混作模式在LNP水平下含量最低仅占3.6%,在0NP水平下含量最高;担子菌门恰好相反,在LNP水平下含量最高,0NP水平下含量最低。不同土壤处理门水平上真菌群落结构无明显差异。
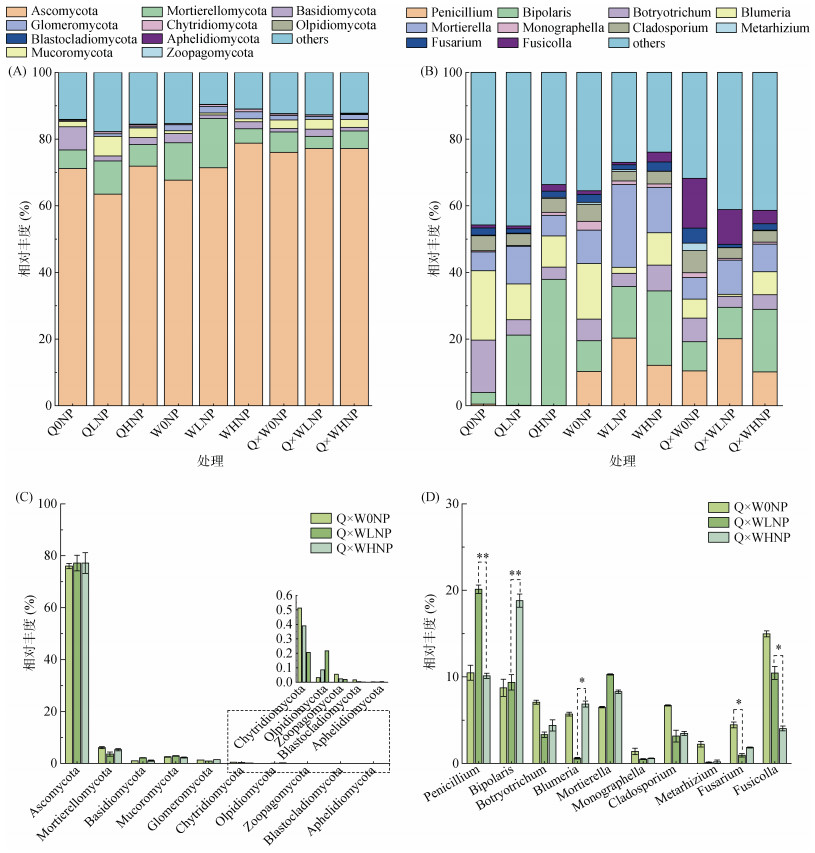
|
(A, C为真菌门水平;B, D为真菌属水平。*、** 分别表示差异达P < 0.05和P < 0.01显著水平) 图 3 混作模式不同施肥水平对土壤真菌相对丰度(A, B)及主要优势菌属丰度(C, D)的影响 Fig. 3 Relative abundances of soil fungi (A, B) and abundances of main dominant genera (C, D) under different fertilization levels of mixed crops |
在属水平上共得到357个真菌类群,图 3B是真菌在属水平上最大丰度前10位的物种相对丰度图。包括青霉菌属(Penicillium)、蠕孢菌属(Bipolaris)、毛葡孢属(Botryotrichum)、布氏白粉菌属(Blumeria)、被孢霉属(Mortierella)、烟草镰刀菌属(Monographella)、枝孢菌属(Cladosporium)、绿僵菌属(Metarhizium)、镰刀菌属(Fusarium)、Fusicolla。属水平上最大丰度前10位的物种,除了Mortierella是被孢霉门被孢菌属外,剩余均为子囊菌门。在属水平上的优势物种为Penicillium、Bipolaris、Botryotrichum。如图 3D为不同施肥水平下混作属水平的物种丰度图,Penicillium在LNP(20.1%)下物种丰度极显著高于HNP(10.2%);Bipolaris随着施肥量的增加,物种丰度也增加,其中HNP比LNP高9.5%,具有极显著差异;Blumeria在LNP (0.6%)下显著低于HNP (6.9%);Fusarium的丰度随着施肥量的增加,先降低后升高;Fusicolla在HNP (4.1%)下丰度显著低于LNP (10.2%)。以上结果表明不同处理土壤真菌群落结构在门水平上无显著差异,但在属水平上有显著性差异,其中不同种植模式会导致土壤真菌群落结构发生变化,不同施肥水平对土壤真菌群落丰度也有显著性影响。
2.5 不同处理下根际土壤真菌群落组成的NMDS分析如图 4,Stress=0.016,说明样品对真菌具有实际解释意义,且具有很好的代表性。相同种植模式的样本会富集到一起,随着施肥水平的变化样本会出现分离的情况,其中混作模式在不同施肥水平下样品分离程度最大,混作模式样品与豌豆单作有部分重叠,说明两样品真菌群落结构有相同之处。同一施肥水平下不同种植模式的样品分化明显,在LNP、HNP水平下Q、W、Q×W没有重叠部分。
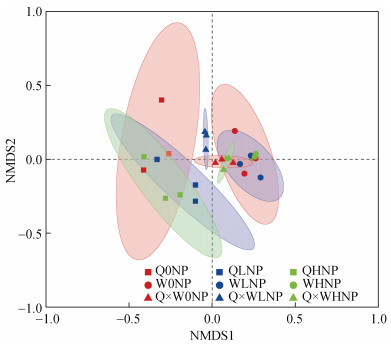
|
图 4 真菌群落结构NMDS分析 Fig. 4 NMDS analysis of soil fungal community structure |
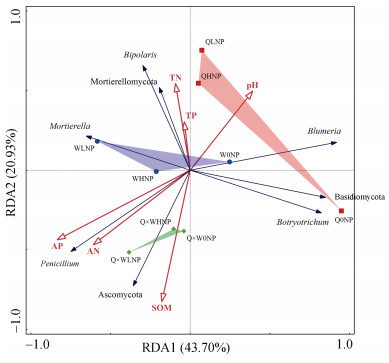
为了更好地了解青稞豌豆混作模式根际土壤真菌与环境因子的关系,对土壤真菌优势物种及土壤理化性质进行DCA去趋势分析,结果显示排序轴最大梯度细菌DCA=2.63 < 3,真菌DCA=2.57 < 3,表明青稞豌豆土壤根际微生物群落分布更接近于线性模型,利用RDA冗余分析能更好地解释根际土壤微生物与土壤理化性质的关系。RDA前两个排序轴的特征值分别解释了43.70% 和20.93% 真菌物种的变化(图 5)。RDA分析表明,6个土壤环境因子共解释了85.12% 的总特征值,对根际土壤真菌群落结构有显著影响。偏冗余分析结果(表 3)表明,6个环境因子中只有速效氮(P=0.046)、有效磷(P=0.002)对真菌群落的构建有显著性影响,分别解释35.9%、17.9% 的真菌群落变化。从图 5中可以看出,影响真菌群落结构的关键土壤因子在不同种植模式下有明显差异,其中混作模式根际真菌群落主要受有效磷、速效氮、有机质影响,而青稞单作和豌豆单作主要受全氮、全磷、pH影响。
|
(SOM:有机质;TN:全氮;TP:全磷;AN:速效氮;AP:有效磷。门水平下优势菌群:Ascomycota,Mortierellomycota,Basidiomycota;属水平下优势菌群:Penicillium,Bipolaris,Botryotrichum,Blumeria,Mortierella) 图 5 土壤真菌门、属水平上优势菌群与环境因子的RDA分析 Fig. 5 RDA analysis of dominant fungal groups and environmental factors at phyla and genera levels in mixed crops |
|
|
表 3 土壤环境因子偏冗余分析(pRDA) Table 3 pRDA of influences of soil environmental factors on fungi community |
门水平上,优势菌群Ascomycota与速效氮、有效磷、有机质呈正相关,与全氮、全磷、pH呈负相关。属水平上,Penicillium、Mortierella与土壤速效氮、有效磷呈正相关;Bipolaris、Blumeria与土壤全氮、全磷、pH呈正相关;Botryotrichum与pH呈正相关,与其他环境因子均呈负相关。Mantel分析结果(表 4)表明:有机质(P=0.044)、有效磷(P=0.002)、速效氮(P=0.016)为显著影响混作土壤真菌群落结构的环境因子。
|
|
表 4 Mantel检验环境因子与混作土壤微生物群落结构的相关性 Table 4 Mantel test correlation between environment parameters and soil microbe community structure |
土壤速效养分是在生态与环境作用下土壤有机态养分转化而来,是评价土壤供肥能力的重要指标[24]。其中速效氮、有效磷含量分别代表土壤中氮、磷供应的强度,其含量的多少决定着作物对氮、磷吸收情况,与作物的长势和品质及产量直接相关[25]。本研究发现青稞豌豆混作处理比青稞单作、豌豆单作处理土壤速效氮、有效磷含量均有显著提高;随着施肥水平的提高,不同种植模式下土壤有机质、全氮、全磷、速效氮含量均随之增加,有效磷含量呈先增加再降低的趋势,这说明种植模式和施肥效应及其交互作用对土壤养分含量有显著性影响,3种种植模式下,施肥量的增加会降低土壤pH。
3.2 施肥与种植模式对土壤真菌多样性及群落结构的影响根际土壤微生物对农作物的生长和对养分的吸收利用有着重要的作用,是土壤环境中重要组成部分[26]。微生物多样性指数用于描述组间和组内生物类型数和均匀度,它可反映生物群落中物种的丰富度及其各类型的分布比,还能比较不同样本间的差异物种[27-28]。本研究发现混作和不同施肥水平对土壤微生物群落组成和相对丰度均存在差异。高通量测序结果表明,不同处理中共鉴定出真菌18门、54纲、131目、290科、357属、591种。
真菌门水平类群中子囊菌门、被孢霉门、担子菌门为优势菌群在土壤中占主导地位,子囊菌门真菌多数为腐生真菌,主要降解土壤中木质素和角质素等难降解的有机质[29]。本研究发现真菌属水平下相对丰度前10位的物种,有9种均来自子囊菌门,仅Mortierella属于被孢霉门,其相对丰度大小排序为豌豆单作 > 青稞豌豆混作 > 青稞单作。Mortierella具有氨化作用和溶磷作用,可以将土壤中的有机氮、磷转化为可被植物直接吸收利用的速效氮、有效磷[30]。Penicillium也具有溶磷作用,不仅可以提高土壤有效磷含量促进作物生长,而且还可以提高其他钙镁磷肥的效力[31],对作物增产、土壤增效有着正向影响,已在国外广泛研究应用。在属水平上还发现了许多潜在致病菌,包括Bipolaris是小麦叶枯病的主要潜在致病菌[32];Blumeria是引起青稞白粉病的潜在致病菌[33];Fusarium会导致作物根腐、茎腐和穗(粒)腐等多种病害,造成作物减产[34];Cladosporium会引起番茄叶子的霉烂[35]。本研究显示豌豆单作、混作青稞土壤中Penicillium、Mortierella相对丰度显著高于青稞单作,混作模式会降低土壤中Bipolaris、Blumeria、Fusarium、Cladosporium的相对丰度(图 3B);其中混作模式在LNP水平下Penicillium丰度最高(图 3D),Bipolaris、Blumeria、Fusarium的相对丰度在LNP水平下最低。研究结果表明混作模式可以提高土壤真菌有益菌群的多样性和相对丰度,减少有害真菌的数量,其真菌群落丰度的变化受施肥量影响显著,有益菌群丰度随施肥量的增加先升高后降低,潜在致病菌丰度随施肥量的增加逐渐升高。
NMDS分析结果表明(图 4),相同种植模式不同施肥水平下和相同水平不同种植模式对土壤真菌群落结构均有显著性影响,一方面是因为不同作物间物种差异,导致其根系周围富集不同种类土壤真菌群落[36];另一方面施肥量在一定程度上可以改善土壤微环境,这可能有益于个别真菌类群的生长,从而引起真菌多样性个体大小或数量的差异,群落结构发生变化且均匀度降低,进而导致多样性指数减小,真菌多样性降低[29]。本研究发现青稞单作随着施肥水平的升高,土壤真菌ACE指数、Chao1指数也随之升高。前人研究指出施肥对土壤微生物多样性有重要影响,施肥会使作物生长期土壤真菌的数量增加[37-38],本研究结果与此一致。也有研究发现土壤真菌的数量随着施肥水平的提高呈先增加后降低的趋势[39]。施用适量肥料能有效调节根际土壤微生物环境,增加土壤微生物数量,当施肥达到临界值时再增施肥料,会对微生物的增殖产生抑制作用[40]。真菌是造成青稞连作障碍的主要原因[1]。随着连作年限增加,土壤有益菌群数量减少,有害真菌菌群成倍增加[41]。本研究表明适当施用肥料能有效抑制青稞豌豆混作中真菌增殖生长,使真菌多样性及丰富度指数降低,当施肥到达临界值时,不再对真菌有抑制作用,所以其多样性及丰富度指数增加。
3.3 土壤微生物多样性及群落结构与土壤养分之间的关系作物和微生物在环境中共同进化并相互作用。高海拔生态系统的一般特点是温度低、降雨量变化大、大气压力低。高海拔地区的寒冷是影响微生物生物多样性和土壤理化性质的一个主要因素[42]。因此,高海拔地区不仅是各种微生物群的热点地区,也是了解某些微生物对在寒冷环境中种植的作物的生长和生产力影响的研究中心[43]。此外,还探索了氮磷添加对青藏高原高寒草甸土壤真菌群落组成的影响[44]。根系相关真菌连接了土壤和根系之间的资源流动,从而影响作物生长和生态系统功能。对高海拔地区作物根际土壤真菌群落结构的研究还不够深入。农型、气候变化和人类活动是控制根际土壤真菌群落结构和功能的主要因素[45]。青稞根际土壤真菌群落必须具有耐旱性和耐寒性,对青藏高原极端气候具有较强的适应性。土壤微生物种类和数量对环境因子的变化和人为扰动的反应十分敏感,能够及时反映土壤的变化[46],土壤微生物群落结构及多样性是多个土壤环境因子共同作用的结果。其中pH、有机质、全氮、速效氮、全磷、有效磷含量等对于研究区土壤微生物多样性起着重要作用[47]。本研究通过RDA分析结果(图 5,表 3)表明有效磷、速效氮是影响土壤真菌群落结构的关键环境因子。不同种植模式下影响土壤真菌群落结构的关键因子也有所不同,其中有机质、速效氮、有效磷为显著影响混作土壤真菌群落结构的环境因子(表 4)。Penicillium、Mortierella与土壤速效氮、有效磷呈正相关,这与许昌超等[48]、宁琪等[31]研究结果一致;Bipolaris、Blumeria与土壤全氮、全磷、pH呈正相关,表明土壤酸化和施肥量的增加可能会导致土壤致病真菌的增殖。
4 结论研究结果表明,土壤中速效氮、有效磷、有机质是混作下真菌群落多样性的主要贡献者,Penicillium、Mortierella在混作土壤中相对丰度最高,是驱动土壤有机氮磷转化为无机氮磷的主要真菌群落。Bipolaris、Blumeria、Fusarium、Cladosporium为土壤真菌群落丰度最高的4种潜在致病菌属,在混作土壤中相对丰度低于单作。混作模式较单作相比可增加土壤有益菌群的相对丰度和多样性,减少潜在致病菌群的含量,其中在低氮磷水平下有益菌群丰度最高,潜在致病菌群相对丰度最低。
本研究的结果仅基于一次性取样,只能表征一个时间断面上的变化。未来应开展青稞豌豆混作模式在不同施肥处理下根际微生态环境的动态监测,进一步研究应从混作模式下作物氮磷吸收利用效率入手,分析混作模式作物养分高效吸收利用的优势。
| [1] |
姚有华, 王玉林, 姚晓华, 等. 不同种植模式对青稞根际土壤微生物群落结构的影响[J]. 西北农业学报, 2021, 30(4): 545-554 (  0) 0) |
| [2] |
Streit J, Meinen C, Nelson W C D, et al. Above- and belowground biomass in a mixed cropping system with eight novel winter faba bean genotypes and winter wheat using FTIR spectroscopy for root species discrimination[J]. Plant and Soil, 2019, 436(1): 141-158 (  0) 0) |
| [3] |
Elahi E, Abid M, Zhang L Q, et al. Agricultural advisory and financial services; farm level access, outreach and impact in a mixed cropping district of Punjab, Pakistan[J]. Land Use Policy, 2018, 71: 249-260 DOI:10.1016/j.landusepol.2017.12.006 (  0) 0) |
| [4] |
Yanarda I H, Zornoza R, Bastida F, et al. Native soil organic matter conditions the response of microbial communities to organic inputs with different stability[J]. Geoderma, 2017, 295: 1-9 DOI:10.1016/j.geoderma.2017.02.008 (  0) 0) |
| [5] |
盛玉钰, 丛静, 卢慧, 等. 神农架国家公园林线过渡带土壤真菌多样性[J]. 生态学报, 2018, 38(15): 5322-5330 (  0) 0) |
| [6] |
魏世清, 李金怀, 蒲小东, 等. 施用沼肥对油茶林根际土壤微生物数量和酶活性影响[J]. 中国沼气, 2018, 36(6): 55-60 (  0) 0) |
| [7] |
Zhao J, Ni T, Li J, et al. Effects of organic-inorganic compound fertilizer with reduced chemical fertilizer application on crop yields, soil biological activity and bacterial community structure in a rice-wheat cropping system[J]. Applied Soil Ecology, 2016, 99: 1-12 DOI:10.1016/j.apsoil.2015.11.006 (  0) 0) |
| [8] |
Li C H, Yan K, Tang L S, et al. Change in deep soil microbial communities due to long-term fertilization[J]. Soil Biology and Biochemistry, 2014, 75: 264-272 DOI:10.1016/j.soilbio.2014.04.023 (  0) 0) |
| [9] |
Cassman N A, Leite M F A, Pan Y, et al. Plant and soil fungal but not soil bacterial communities are linked in long-term fertilized grassland[J]. Scientific Reports, 2016, 6: 23680 DOI:10.1038/srep23680 (  0) 0) |
| [10] |
田琨, 杨彩红. 免耕对不同麦玉轮作方式土壤真菌群落结构的影响[J]. 干旱区资源与环境, 2022, 36(04): 142-148 (  0) 0) |
| [11] |
韩芳, 包媛媛, 刘项宇, 等. 不同轮作方式对马铃薯根际土壤真菌群落结构的影响[J]. 生态环境学报, 2021, 30(7): 1412-1419 (  0) 0) |
| [12] |
瓮巧云, 黄新军, 许翰林, 等. 玉米/大豆间作模式对青贮玉米产量、品质及土壤营养、根际微生物的影响[J]. 核农学报, 2021, 35(2): 462-470 (  0) 0) |
| [13] |
王旭, 曾昭海, 朱波, 等. 燕麦与箭筈豌豆不同混作模式对根际土壤微生物数量的影响[J]. 草业学报, 2009, 18(6): 151-157 (  0) 0) |
| [14] |
马瑞萍, 韦泽秀, 卓玛, 等. 氮磷配施对青稞生长发育及产量的影响[J]. 西南农业学报, 2015, 28(6): 2577-2585 (  0) 0) |
| [15] |
Choi I, Kim H, Hwang J, et al. Yearly variation in growth and yield of winter hulless barley at iksan[J]. The Korean Journal of Crop Science, 2016, 61(3): 171-183 DOI:10.7740/kjcs.2016.61.3.171 (  0) 0) |
| [16] |
戴瑞卿, 林明辉, 赖宝春, 等. 辣椒健康植株与患枯萎病植株根际土壤古菌群落多样性的比较研究[J]. 福建热作科技, 2019, 44(4): 10-14 DOI:10.3969/j.issn.1006-2327.2019.04.004 (  0) 0) |
| [17] |
马少兰, 马彩霞, 徐鹏鑫, 等. 再植枸杞根际真菌群落对长期连作的响应研究[J]. 土壤学报, 2019, 56(06): 1493-1503 (  0) 0) |
| [18] |
Caporaso J G, Lauber C L, Walters W A, et al. Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms[J]. The ISME Journal, 2012, 6(8): 1621-1624 DOI:10.1038/ismej.2012.8 (  0) 0) |
| [19] |
Edgar R C, Haas B J, Clemente J C, et al. UCHIME improves sensitivity and speed of chimera detection[J]. Bioinformatics, 2011, 27(16): 2194-2200 DOI:10.1093/bioinformatics/btr381 (  0) 0) |
| [20] |
Caporaso J G, Kuczynski J, Stombaugh J, et al. QIIME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336 DOI:10.1038/nmeth.f.303 (  0) 0) |
| [21] |
Schloss P D, Westcott S L, Ryabin T, et al. Introducing mothur: Open-source, platform-independent, community-supported software for describing and comparing microbial communities[J]. Applied and Environmental Microbiology, 2009, 75(23): 7537-7541 DOI:10.1128/AEM.01541-09 (  0) 0) |
| [22] |
胡艺, 李秋华, 李钥, 等. 基于NMDS和RDA方法分析贵州百花水库后生浮游动物群落结构动态[J]. 环境科学研究, 2019, 32(9): 1510-1518 (  0) 0) |
| [23] |
孙华方, 李希来, 金立群, 等. 黄河源区斑块化退化高寒草甸土壤细菌群落多样性变化[J]. 环境科学, 2022, 43(9): 4662-4673 (  0) 0) |
| [24] |
郑佳华, 赵萌莉, 王琪, 等. 放牧和刈割对大针茅草原土壤微生物群落结构及多样性的影响[J]. 生态学报, 2022, 42(12): 4998-5008 (  0) 0) |
| [25] |
何海锋, 吴娜, 刘吉利, 等. 不同施肥处理对柳枝稷土壤理化性质及细菌多样性的影响[J]. 中国土壤与肥料, 2022(3): 164-172 (  0) 0) |
| [26] |
林治安, 赵秉强, 袁亮, 等. 长期定位施肥对土壤养分与作物产量的影响[J]. 中国农业科学, 2009, 42(8): 2809-2819 (  0) 0) |
| [27] |
李巧玲, 肖忠, 任明波, 等. 间作不同作物对栀子根际土壤微生态的影响[J]. 微生物学通报, 2021, 48(10): 3588-3602 (  0) 0) |
| [28] |
王亚男, 曾希柏, 王玉忠, 等. 设施蔬菜种植年限对氮素循环微生物群落结构和丰度的影响[J]. 应用生态学报, 2014, 25(4): 1115-1124 (  0) 0) |
| [29] |
Thuy D, Corinne B, Yvan B, et al. Influence of buffalo manure, compost, vermicompost and biochar amendments on bacterial and viral communities in soil and adjacent aquatic systems[J]. Applied Soil Ecology, 2014, 73(2): 78-86 (  0) 0) |
| [30] |
王海英, 郭守玉, 黄满荣, 等. 子囊菌较担子菌具有更快的进化速率和更高的物种多样性[J]. 中国科学: 生命科学, 2010, 40(8): 731–737, 765 (  0) 0) |
| [31] |
宁琪, 陈林, 李芳, 等. 被孢霉对土壤养分有效性和秸秆降解的影响[J]. 土壤学报, 2022, 59(1): 206-217 (  0) 0) |
| [32] |
Efthymiou A, Grønlund M, Müller-Stöver D, et al. Augmentation of the phosphorus fertilizer value of biochar by inoculation of wheat with selected Penicillium strains[J]. Soil Biology and Biochemistry, 2018, 116: 139-147 DOI:10.1016/j.soilbio.2017.10.006 (  0) 0) |
| [33] |
李梦钰, 高闯, 李巧云, 等. 苗期及灌浆期抗Bipolaris sorokiniana叶枯病小麦品种(系)鉴定及相关性分析[J]. 作物杂志, 2021(3): 40-45 (  0) 0) |
| [34] |
魏玲玲, 王玉林, 原红军, 等. 白粉病菌(Blumeria graminis)胁迫下西藏青稞lncRNA全谱解析[J]. 分子植物育种, 2021, 19(17): 5581-5590 (  0) 0) |
| [35] |
张岳平. 镰刀菌真菌毒素产生与调控机制研究进展[J]. 生命科学, 2011, 23(3): 311-316 (  0) 0) |
| [36] |
刘冠, 赵婷婷, 李宁, 等. 番茄与叶霉菌互作机制研究进展[J]. 东北农业大学学报, 2016, 47(9): 91-99 (  0) 0) |
| [37] |
Nguyen T T N, Wallace H M, Xu C Y, et al. The effects of short term, long term and reapplication of biochar on soil bacteria[J]. The Science of the Total Environment, 2018, 636: 142-151 DOI:10.1016/j.scitotenv.2018.04.278 (  0) 0) |
| [38] |
郭天财, 宋晓, 马冬云, 等. 氮素营养水平对小麦根际微生物及土壤酶活性的影响[J]. 水土保持学报, 2006, 20(3): 129–131, 140 DOI:10.3321/j.issn:1009-2242.2006.03.031 (  0) 0) |
| [39] |
Ritz K, Wheatley R E. Effects of water amendment on basal and substrate-induced respiration rates of mineral soils[J]. Biology and Fertility of Soils, 1989, 8(3): 242-246 (  0) 0) |
| [40] |
胡元森, 吴坤, 刘娜, 等. 黄瓜不同生育期根际微生物区系变化研究[J]. 中国农业科学, 2004, 37(10): 1521-1526 (  0) 0) |
| [41] |
Kumar S, Suyal D C, Yadav A, et al. Microbial diversity and soil physiochemical characteristic of higher altitude[J]. PLoS One, 2019, 14(3): e0213844 DOI:10.1371/journal.pone.0213844 (  0) 0) |
| [42] |
Rawat J, Yadav N, Pande V. Role of rhizospheric microbial diversity in plant growth promotion in maintaining the sustainable agrosystem at high altitude regions[M]//Recent Advancements in Microbial Diversity. Amsterdam: Elsevier, 2020: 147–196.
(  0) 0) |
| [43] |
He D, Xiang X J, He J S, et al. Composition of the soil fungal community is more sensitive to phosphorus than nitrogen addition in the alpine meadow on the Qinghai-Tibetan Plateau[J]. Biology and Fertility of Soils, 2016, 52(8): 1059-1072 DOI:10.1007/s00374-016-1142-4 (  0) 0) |
| [44] |
Frąc M, Hannula S E, Bełka M, et al. Fungal biodiversity and their role in soil health[J]. Frontiers in Microbiology, 2018, 9: 707 DOI:10.3389/fmicb.2018.00707 (  0) 0) |
| [45] |
王伏伟, 王晓波, 李金才, 等. 施肥及秸秆还田对砂姜黑土细菌群落的影响[J]. 中国生态农业学报, 2015, 23(10): 1302-1311 (  0) 0) |
| [46] |
Nannipieri P, Ascher J, Ceccherini M T, et al. Microbial diversity and soil functions[J]. European Journal of Soil Science, 2003, 54(4): 655-670 DOI:10.1046/j.1351-0754.2003.0556.x (  0) 0) |
| [47] |
Roesch L F W, Fulthorpe R R, Riva A, et al. Pyrosequencing enumerates and contrasts soil microbial diversity[J]. The ISME Journal, 2007, 1(4): 283-290 DOI:10.1038/ismej.2007.53 (  0) 0) |
| [48] |
许昌超, 张俊涛, 叶少萍, 等. 土壤中一株溶磷青霉菌的分离鉴定及其应用效果研究[J]. 中国土壤与肥料, 2020(6): 272-278 (  0) 0) |
2. Qinghai Academy of Agriculture and Forestry Sciences, Xining 810016, China;
3. Qinghai Key Laboratory of Hulless Barley Genetics and Breeding/Hulless Barley Branch of State Wheat Improvement Centre, Xining 810016, China
 2023, Vol. 55
2023, Vol. 55


