2. 中国科学院大学, 北京 100049
水稻(Oryza sativa L.)作为全世界最重要的粮食作物之一,为超过半数的人口提供了口粮[1]。氮肥的大量施用对水稻生产和产量提升发挥了无可替代的作用[2]。我国水稻主要种植区氮肥施用量普遍较高,氮肥利用效率基本趋于饱和[3-5]。造成肥料利用率低的原因包括高产农田过量施肥,作物产量潜力未得到充分发挥[6],对土壤和环境养分的不充分利用以及养分损失未能得到有效阻控等[7]。水稻品种的改良对水稻产量增加同样作出了显著贡献。有报道指出,我国多数水稻产区的产量增势已经趋于停滞[8-9]。高量的氮肥投入不仅增加了各方面的生产成本,而且造成了严重的资源消耗和环境问题,新育成的高产品种如要获得理想的产量仍旧与施入大量的氮肥密不可分[10]。作为铵偏好型作物,水稻对铵态氮(NH4+-N)的吸收借助于精密的铵吸收系统实现。在化肥减量施用的政策条件下,铵转运基因过表达在实际生产中对水稻生产效益调控和氮素利用率的影响有必要进行探索。目前,在有关铵转运基因的功能方面,其蛋白的研究主要集中在表达模式和转运活性方面[11-12]。水稻中存在12个铵转运蛋白[13-14],研究比较深入的是OsAMT1家族[15-16]。从表达特征看,OsAMT1;1主要在根和茎部表达,表达活性一定程度上受铵态氮的促进;OsAMT1;2的表达具有根系特异性,并对低铵的响应强烈;OsAMT1;3也在根中特异性表达,但受高氮的抑制[16-17]。可见,OsAMT1;1对铵态氮的响应特征比较契合当前水稻生产中较高施氮习惯下氮素利用效率的调控需求。部分研究指出,通过过表达不同OsAMTs基因来调控水稻铵转运效率,在精细的控制条件下对提高水稻氮素利用率有一定效果[17-19]。但OsAMT1;1基因作为水稻获取土壤氮素的关键氮高效基因,在实际生产条件下对水稻氮素利用效率和生产效益的影响却鲜见报道。基于此,本研究通过设置相应的田间试验,对OsAMT1;1基因过表达水稻材料在减氮和高氮投入条件下的植株氮素积累、关键生育期的叶片含氮量与光合特征的变化关系,以及由此导致的氮素利用效率指标变化特征进行了研究,以期通过改变水稻氮素利用关键位点的遗传操作手段,为降低氮肥投入、协同改善水稻氮肥利用效率和优化产量形成提供实际生产条件下的结果支撑。
1 材料与方法 1.1 试验地概况试验于2019年和2020年两个稻作季在中国科学院常熟农田生态系统国家野外科学观测研究站(31°15′15″ N,120°57′43″ E)进行。供试田块土壤类型为浅育型水稻土(乌栅土),基础土壤(0 ~ 20 cm土层)理化性质为:pH 7.36,有机质46.06 g/kg,有效氮(NH4+-N和NO3--N) 30.93 mg/kg,有效磷12.82 mg/kg,速效钾63.8 mg/kg。
1.2 供试材料供试野生型(WT)材料为粳稻日本晴(Nipponbare, NB),OsAMT1;1基因过表达载体由本实验室自行构建保存。将OsAMT1;1基因插入pUN1301载体,并将其导入日本晴进行幼苗再生,筛选抗性再生植株进行种子繁种,获得T2代株系。试验获得了两个独立的纯合系,分别称为OsAMT1;1-OX1和OsAMT1;1-OX2。转基因水稻株系RNA水平的鉴定表明,两个纯合子OsAMT1;1基因的表达丰度均为野生型的20倍左右。过表达株系鉴定所需引物序为:F(5'-3'):TACGGGCTCAAGAAGCTC,R(5'-3'):CACTTGG TTGTTGCTGTTGGA。内参基因OsActin所需的引物序列为:F(5'-3'):TGGTCGTACCACAGGTATTGT GTT,R(5'-3'):AAGGTCGAGACGAAGGATAGCAT。
1.3 试验设计采用田间裂区试验,设置氮缺乏(LN, 不施氮)、中度或减少氮投入(MN,施N 200 kg/hm2)和氮过量施用(HN,施N 350 kg/hm2)3个施氮水平,每个处理重复3次。小区面积12 m × 7 m,小区间做田埂隔离,并用塑料薄膜覆盖埂体,保证各小区单独排灌。水稻植株株距和行距为0.2 m × 0.2 m。选择尿素(含N 460 g/kg N)为氮肥肥源,按照基肥∶分蘖肥∶穗肥= 5∶2∶3的比例施用,其中基肥在移栽前施入,分蘖肥于7月中旬施入,穗肥于8月中旬施入。磷肥肥源为普通过磷酸钙(含P2O5 120 g/kg),钾肥肥源为氯化钾(含K2O 600 g/kg)。磷肥施用量为P2O5 90 kg/hm2,钾肥施用量为K2O 120 kg/hm2。各氮处理条件的磷肥和钾肥施用方式相同,均作为基肥一次性施入。田间灌溉、病虫害防治统一按照台站常规栽培管理要求实施。
1.4 样品采集与项目测定分别于分蘖期、齐穗期、灌浆期和完熟期采集各处理代表性水稻植株样品。植株样品于室内称量鲜重后在105 ℃杀青30 min,在60 ℃烘干至恒重称重,后粉碎待测含氮量。采集灌浆期水稻剑叶,采集时间以齐穗期为基准(离收获4周),采集3份叶片作为生物学重复,做好标记带回室内称取鲜重后,烘干至恒重称重,粉碎待测含氮量。植株样品采用H2SO4-H2O2消煮,含氮量使用化学分析仪(Smartchem 200,Westco Co.,Italy)进行测定。
于灌浆期在田间进行剑叶光合效率的测定:以齐穗期作为基准,每个小区选择长势一致的植株,通过Li-6400 XT便携式光合测定系统对每株主茎剑叶进行测定。测定时间为晴天的上午8:30—11:30,正式测试净光合速率前,机器开机预热20 min,设置光强为1 000 μmol/(m2·s),二氧化碳浓度为400 μmol/mol。
收获时,以1 m2水稻为标准,脱粒自然风干进行产量测定。另外,各处理各株系选取长势均匀的植株,标记后装入尼龙网袋带回室内,用于后期的考种。分样前先统计每份样品的分蘖总数和有效穗数,再将稻穗进行手工脱粒,并收集所有实粒测定籽粒千粒重。
1.5 相关指标计算氮素利用效率的计算和评价指标分别采用:氮素生理效率、氮肥吸收效率和氮肥农学效率[20-21]。
氮素生理效率(PEN, kg/kg)=(施氮区稻谷产量–空白区稻谷产量)/(施氮区植株氮积累量–空白区植株氮积累量)
氮肥吸收效率(REN, %)=(施氮区植株氮积累量–空白区植株氮积累量)/施氮量×100
氮肥农学效率(AEN, kg/kg)=(施氮区稻谷产量–空白区稻谷产量)/施氮量
临界氮含量(Nc)根据Justes等[22]确定的方法进行计算,建立不同株系的氮稀释曲线,并用方程Nc=a DM -b进行拟合,通过方程回归得到参数a和b的值。氮素营养指数(NNI)通过方程式NNI=Na/Nc计算获得,其中Na是实际测得的植株氮含量(%),Nc是根据模型Nc=a×DM-b计算得到的与实际氮含量对应的干物质量(DM)相同时的临界氮含量。当NNI < 1时,实际氮含量低于临界氮含量,表示植株体内氮素处于限制状态;当NNI > 1时,实际氮含量高于临界氮含量,表示植株体内氮素处于非限制状态;NNI=1时,实际氮含量等于临界氮含量,表示植株处于最佳的氮素营养状态;实际氮含量越接近临界氮含量,植株氮含量越有利于植株生长。
1.6 数据处理与统计分析试验数据采用Excel 2019软件进行处理,利用SPSS 13.0软件进行统计和方差分析,并基于邓肯法进行显著性检验,采用Sigmaplot 12.5软件进行制图。图表中数据表示为平均值±标准误,显著性水平为P < 0.05。
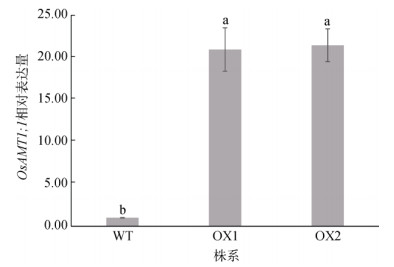
2 结果与分析 2.1 OsAMT1;1过表达株系的基因表达丰度图 1的结果表明,通过对获得的两个纯合株系OsAMT1;1-OX1和OsAMT1;1-OX2进行基因表达丰度的鉴定,发现相较野生型,在两种超表达株系中OsAMT1;1的表达丰度分别提高了20倍左右,表明OsAMT1;1的表达丰度在核酸水平得到了很大程度的提升。
|
(柱图上方不同小写字母表示不同株系间差异显著(P < 0.05)) 图 1 过表达株系的OsAMT1;1表达水平 Fig. 1 OsAMT1;1 expression level of overexpression lines |
由表 1可见,在LN条件下,分蘖期的过表达株系生物量均显著高于野生型(WT);在MN条件下,过表达株系相对WT没有明显优势;在HN条件下,两个过表达株系的差异性不一致。在MN条件下,齐穗期至完熟期(灌浆阶段) WT植株生物量的增量于两个试验季平均增加1.28倍;两种OsAMT1;1过表达株系2019年的增幅均为1.69倍,2020年分别增加1.67倍和1.33倍:平均增加1.59倍,OsAMT1;1过表达株系的生物量在灌浆阶段的积累效应更明显,表明该基因过表达对植株生长速率和生物量的积累有明显的促进作用。齐穗期至完熟期是籽粒灌浆的关键时期,OsAMT1;1过表达株系较高的生物量积累对籽粒产量形成比较有利。在完熟期,OsAMT1;1过表达株系生物量在3个氮处理条件下均表现出促进效应,尤其在MN条件下,OsAMT1;1过表达株系生物量较WT显著增加,与LN处理相比,WT植株生物量在两个试验季的增量达54.49% 和35.23%,平均增加44.86%;而两种OsAMT1;1过表达株系在2019年的生物量分别增加56.8% 和95.25%,2020年分别增加66.32% 和51.18%,平均增加67.39%。可见,过表达株系对氮肥施用的响应和氮肥的干物质生产效益相比WT更明显。在HN条件下,各株系氮素干物质生产效益对施氮水平增加表现不敏感(相比于MN处理),生物量积累效率趋于饱和。
|
|
表 1 OsAMT1;1过表达株系关键生育期植株生物量的变化特征(t/hm2 DW) Table 1 Biomass characteristics of OsAMT1;1 overexpression lines at key stages |
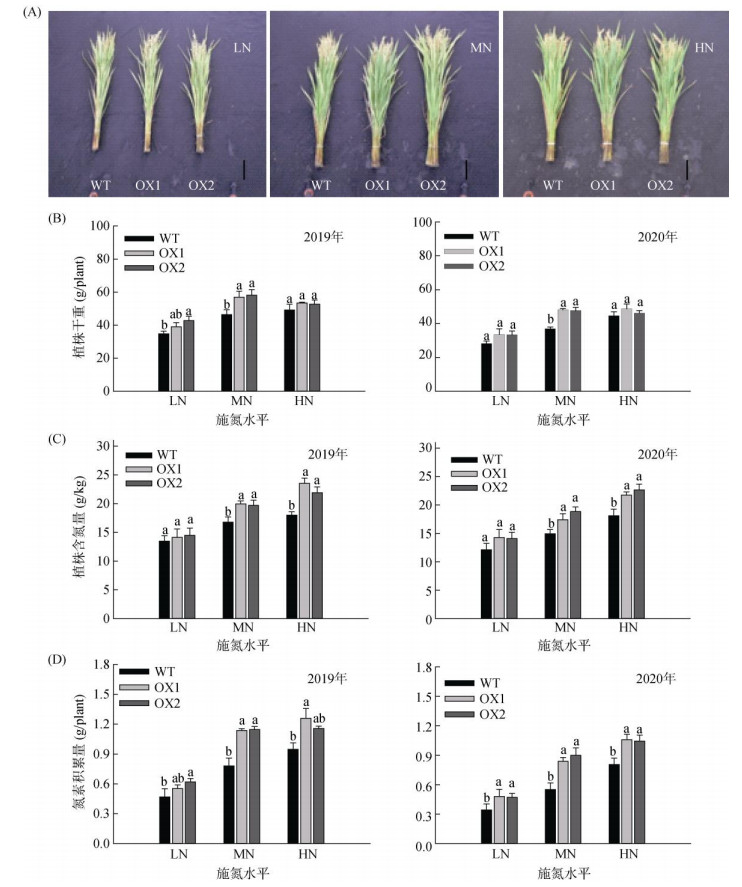
由图 2A可以看出,OsAMT1;1过表达株系在灌浆期有较强的持绿特征,表明其具有比WT更高的含氮量和氮素吸收能力。增加施氮量,WT和OsAMT1;1过表达株系的单株生物量在灌浆期均有所增加,在MN条件下,OsAMT1;1过表达株系单株生物量较WT平均增加26.98%;在HN条件下,OsAMT1;1过表达株系单株生物量较WT平均增加7.18%,增加幅度相比MN条件下明显降低(图 2B)。图 2C表明,在LN和MN条件下,OsAMT1;1过表达对单株含氮量表现出明显的促进作用,在MN条件下明显高于WT,平均高出19.84%;在HN条件下,仍然明显高于WT,平均增加24.38%。图 2D表明,在LN和MN条件下,OsAMT1;1过表达株系对单株氮素积累量表现出明显的促进作用,尤其在MN条件下明显高于WT,两个生长季平均增加52.2 %;在HN条件下,较WT平均增加28.87%,增加幅度相比MN条件下明显降低。可见,通过过表达OsAMT1;1基因强化铵吸收能力,可显著促进植株氮素吸收和向地上部的分配水平,而植株生物量增势在过量氮投入情境下趋于饱和。
|
(图A为野生型植株与OsAMT1;1过表达植株在灌浆期的代表性照片,来自2019年的田间试验,Bar=1 dm;图B~图D中柱图上方不同小写字母表示同一施氮水平下不同植株间差异在P < 0.05水平显著;下同) 图 2 过表达OsAMT1;1对灌浆期植株生长和地上部氮素积累的影响 Fig. 2 Effects of OsAMT1;1 overexpression on plant growth and shoot nitrogen accumulation at grain filling stage |
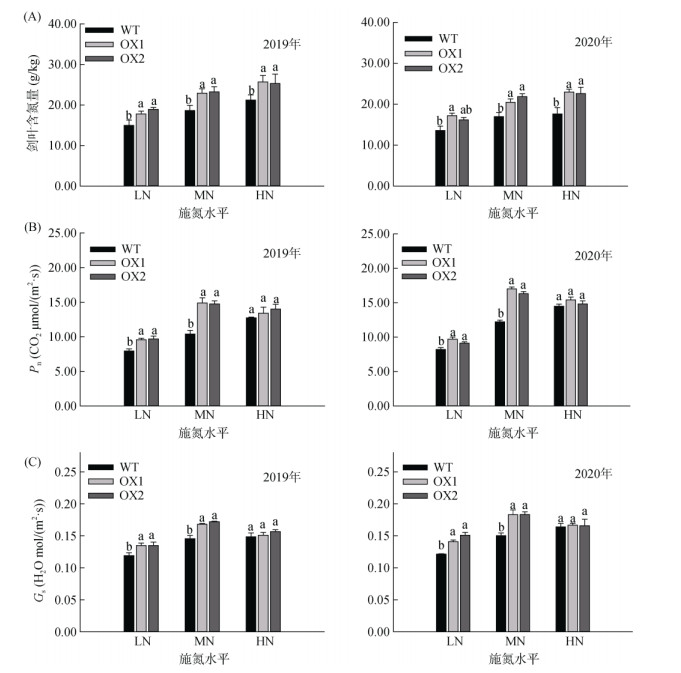
在灌浆期,随着施氮水平的增加,WT和OsAMT1;1过表达株系剑叶含氮量有明显变化(图 3A)。在LN、MN、HN条件下,OsAMT1;1过表达株系剑叶含氮量较WT均有显著的增加,分别平均增加22.98%、24.3%和24.82%。而随着施氮水平的增加,OsAMT1;1过表达株系剑叶净光合速率(Pn,图 3B)和气孔导度(Gs,图 3C)表现出先升高后略微降低的趋势。在MN条件下,OsAMT1;1过表达株系剑叶Pn和Gs较WT分别平均增加40.71% 和19.39%,差异显著;在HN条件下,OsAMT1;1过表达对剑叶Pn和Gs的作用减弱(与MN处理相比)。综合可见,在HN条件下,OsAMT1;1过表达株系Pn和Gs对施氮水平的响应程度比基因本身更敏感。
|
图 3 OsAMT1;1过表达株系在灌浆期剑叶含氮量及光合特性 Fig. 3 OsAMT1;1 overexpression lines flag leaf nitrogen contents and photosynthetic characteristics at grain filling stage |
由表 2可以看出,随着施氮水平的增加,与WT相比,OsAMT1;1过表达株系对水稻产量特征有一定影响。不同施氮水平下,OsAMT1;1过表达均有利于促进单株分蘖数的增加。通过对两个生长季整体的结果分析表明,在LN条件下,OsAMT1;1过表达株系单株分蘖数、单株穗数较WT显著增加,分别较WT平均高出18.2%、22.43%;在MN条件下,二者较WT分别平均增加22.11% 和24.38%。而在HN条件下,OsAMT1;1过表达对分蘖数的促进作用随氮肥施用量的提升趋于饱和,而对穗数的作用相对有所减弱,表明高施氮量和OsAMT1;1过表达相互作用并不利于成穗率的提升。从两年的试验结果可以看出,氮肥用量过高或过低,对OsAMT1;1过表达株系的千粒重并无积极作用。在MN条件下,OsAMT1;1过表达株系相比WT千粒重平均增加10.26%,成穗率也有一定的增加;籽粒产量显著增加,相比WT平均提升17.86%。然而,在HN条件下,产量有所降低,造成这种变化的原因是成穗率和千粒重对施氮水平的负效应所导致。
|
|
表 2 OsAMT1;1过表达对水稻产量特征的影响 Table 2 Effects of OsAMT1;1 overexpression on grain yield components |
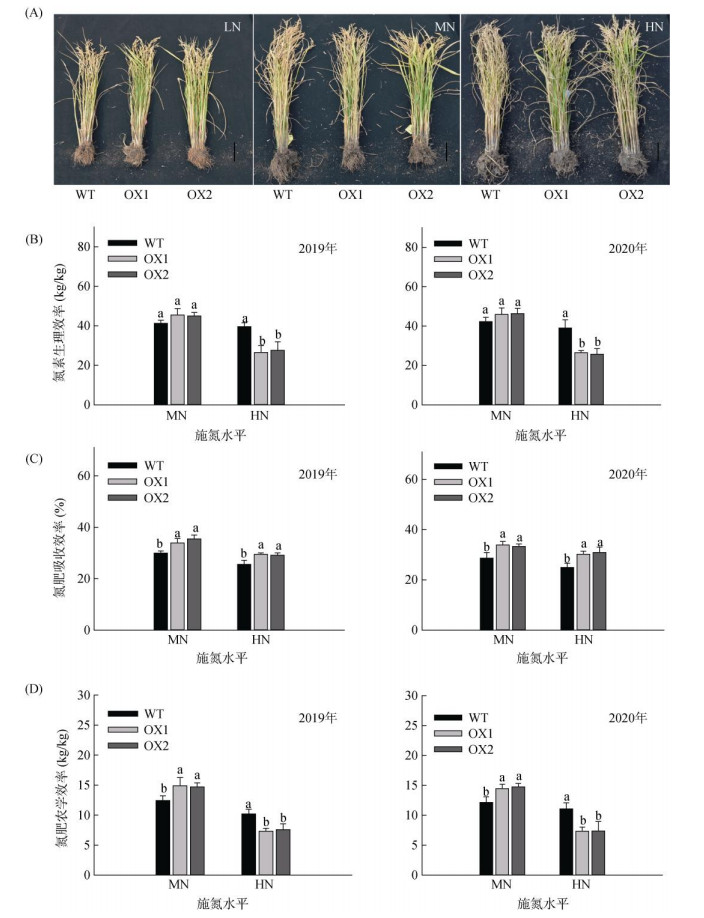
由图 4可以看出,在各个处理条件下,OsAMT1;1过表达株系的持绿特性强于WT(图 4A)。特别在MN条件下,OsAMT1;1过表达株系氮素生理效率(PEN,图 4B)和氮肥农学效率(AEN,图 4D)有所增加,较WT平均增加9.24% 和19.7%,但差异不显著。在HN条件下,OsAMT1;1过表达株系氮素生理效率和氮肥农学效率显著降低。由图 4C可以看出,随着施氮水平的增加,WT和OsAMT1;1过表达株系水稻氮肥吸收效率(REN)有明显的降低趋势,但OsAMT1;1过表达水稻株系的氮素吸收效率仍显著高于WT。在MN条件下,OsAMT1;1过表达株系氮素吸收效率较WT平均增加16.53%,差异显著;在HN条件下,OsAMT1;1过表达株系延续了高强度氮素吸收的趋势,表明高氮条件时的植株内环境有高量的冗余氮素;从光合效率变化的角度看,这也导致了植株高氮缺碳的内环境,是造成植株氮素生理效率和农学效率受到抑制的原因。
|
(图A为2019年试验季收获时OsAMT1;1过表达植株的代表性照片,Bar=1 dm) 图 4 OsAMT1;1过表达对水稻氮素利用效率的影响 Fig. 4 Effects of OsAMT1;1 overexpression on rice nitrogen use efficiency |
本研究分别对2019年和2020年稻季的WT、OX1和OX2株系建立了氮素稀释曲线(图 5A ~ 5B),推导出的a和b参数在不同水稻品系之间以及两个生长季节之间有所不同,但临界氮含量(Nc)与生物量(DM)的关系可以较好地通过Nc = a×DM -b (R2 =0.87 ~ 0.97)方程进行拟合,参数a和b的估计范围分别为3.25 ~ 3.66和0.22 ~ 0.29。OsAMT1;1过表达株系的a值比WT植株大,表明OsAMT1;1过表达植株的氮素含量在生长初期更具优势;b值相近,表明各株系在生育后期氮素含量的变化趋势较为稳定(图 5A ~ 5B)。通过对氮素营养指数(NNI)的分析发现,LN条件下各株系水稻的NNI值均明显小于1,表明植株的生长受到氮素缺乏的限制(图 5C ~ 5D);在MN条件下,OsAMT1;1过表达株系的NNI值大于WT(图 5C ~ 5D),表明OsAMT1;1过表达可能通过促进铵吸收能力提高了水稻植株的氮素获取能力,促进了氮素积累。尤其在灌浆期,WT的NNI理论值明显小于OsAMT1;1过表达株系,在0.96左右变化(图 5C ~ 5D),表明该施氮量适合WT的最佳生长,而过表达株系的NNI值在0.99 ~ 1.14之间变化,比WT的适应范围更高。在生育后期,过量施氮(HN)的情况下,WT植株的NNI值更接近临界值,而OsAMT1;1过表达株系表现出植株氮过量的趋势,NNI值远大于临界值,表明OsAMT1;1过表达在过量施氮时造成了植株体内氮素过剩。基于以上分析发现,OsAMT1;1过表达在适宜施氮植株氮素养分有限时促进氮的获取,有利于改善植株氮营养,提升植株的物质生产能力。
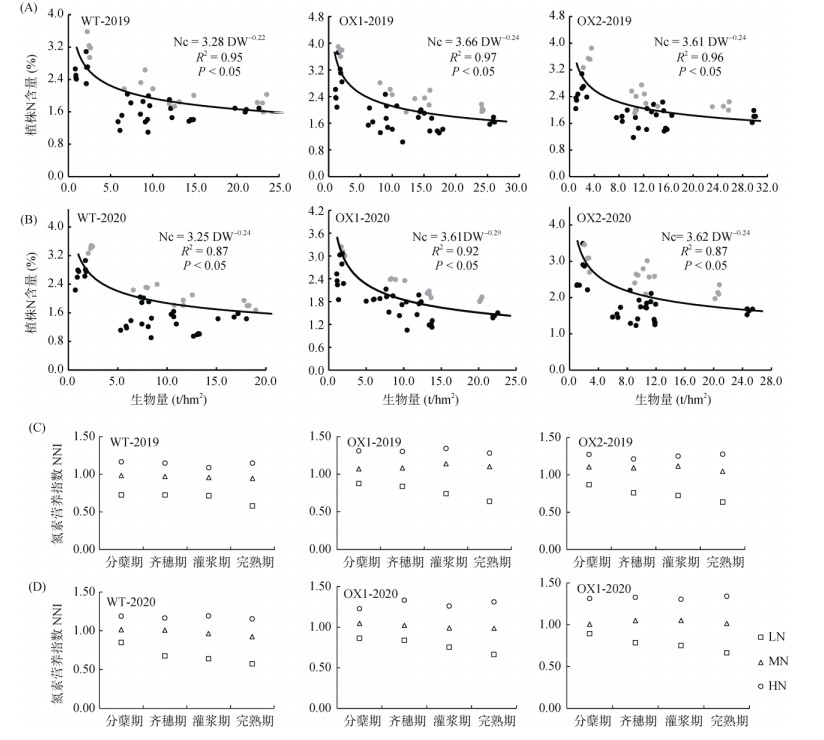
|
图 5 OsAMT1;1过表达株系的氮素稀释曲线和氮素营养指数 Fig. 5 Nitrogen dilution curve and nitrogen nutrient index of OsAMT1:1 overexpression lines |
水稻产量形成的过程是干物质积累与分配的过程,提升灌浆期水稻的干物质积累对籽粒灌浆有积极影响[23-26]。本研究结果表明,在增加施氮量的情况下,OsAMT1;1过表达提高了稻株干物质积累,尤其在灌浆期,OsAMT1;1过表达株系的单株生物量在减氮条件下显著高于WT,表明在该氮肥水平下OsAMT1;1基因的过表达有利于水稻植株的生长发育。在过量施氮条件下,OsAMT1;1过表达株系相比WT没有明显的差异。可见,OsAMT1;1基因过表达对植株生物量积累的影响与施氮量关系密切,在适宜田间供氮或减氮条件下,利用OsAMT1;1过表达使铵吸收系统部分强化,能够为改善植株生长状况和增加籽粒产量提供氮素利用的调控基础。在实际生产过程中,灌浆阶段干物质积累较强的水稻品种的培育也是高产品种的重要考量方向[27-28]。水稻植株整体的氮素含量决定了各个器官的氮素水平,光合速率与体内一定水平的氮素含量呈正相关[29-31];OsAMT1;1蛋白通过对稻株地上部氮素供应发挥作用,影响地上部生长发育[32]。与WT相比,OsAMT1;1的过表达使水稻在苗期和营养生长初期的地上部和根部生物量有所降低,高铵条件下,转基因植株根系对铵态氮的吸收和含量增加[33-34]。本研究结果表明,在减氮条件下,OsAMT1;1基因的过表达促进了单株含氮量的明显增加,并且在植株含氮量较高时,过表达株系剑叶含氮量也有明显增加。可见,田间供氮条件下,增强OsAMT1;1基因的表达能促进根系对氮素的吸收和获取,并在提升向地上部氮素输入量的同时,一定程度上促进氮素向叶片的转移和分配,从而改善植株的氮素干物质生产能力。在高氮条件时,OsAMT1;1过表达株系较强的氮素吸收能力对植株生长的作用趋于饱和甚至产生负效应,与在苗期和营养生长初期的生长表现类似[33-34]。
叶片光合作用强度与植株氮素营养状态呈正相关,净光合速率一般随叶片含氮量增加而提高[35-37]。在本研究中的高量氮素投入下,OsAMT1;1过表达株系剑叶含氮量与WT相比仍处于显著较高水平(相比于MN条件),但光合速率和气孔导度与WT相比无显著差异。OsAMT1;1过表达株系的产量、氮肥农学效率和氮素生理效率并不高,且均弱于WT。这种表现可能是由于OsAMT1;1基因的过量表达在使稻株大量吸收土壤氮素的情况下,使地上部或生产器官有高量的氮素冗余,氮素水平超越了植株正常生长所需的氮素临界值,改变了植株体内氮素(铵态氮)的代谢方式,进而影响了氮素生产效益和利用效率。有关类似的控制试验结果表明,较高的铵含量能够提高氮同化基因的表达水平,对OsAMT1;1过表达株系的叶片碳氮代谢有积极影响,高铵供应时无差异[18]。本研究结果显示,OsAMT1;1过表达在减氮条件下有利于剑叶净光合速率和气孔导度的提升,这也为该施氮条件下获得较高产量和生物量积累提供了碳源条件。而在过量施氮条件下,OsAMT1;1过表达株系剑叶净光合速率和气孔导度相比WT没有明显的变化。由于较强的氮供应使植株氮素水平处于非限制状态,对叶片氮的高分配影响光合生产过程的运行,进而导致叶片净光合速率降低,造成了植株光合生产能力的减弱[36-37]。
田间供氮环境下,增加氮肥施用量能明显促进OsAMT1;1过表达株系单株分蘖数和有效分蘖数的增加;减少氮肥施用量时,OsAMT1;1过表达显著促进了水稻千粒重和产量增加。该条件下OsAMT1;1基因过表达有利于氮素生理效率和氮肥农学效率的提高,主要是因为OsAMT1;1基因过表达使该条件下植株氮素营养状态趋于临界值,关键功能叶氮素水平得到改善,持有较高的光合同化能力。水稻对氮的响应很大程度依赖于对碳的同化和代谢[38],高氮供应主要会逆转水稻体内的碳代谢方向,造成植株体可以同化利用的碳源的不足[39]。在本研究中,过量施氮导致过表达OsAMT1;1对千粒重的影响减弱,甚至出现不利影响,氮素生理效率和氮肥农学效率同时表现出降低的趋势。碳短缺是氮素过度施用条件下水稻植株生长和产量形成的瓶颈[39],这可能也是氮素吸收系统(铵吸收系统)强化后的稻株在高施氮量情况下氮素农学效率降低的原因。
4 结论强化OsAMT1;1的表达能促进水稻的生物量积累和灌浆期植株整体含氮量的增加,并且能够促进单株分蘖的发生。与高氮(HN)投入相比,减少氮肥施用量(MN)能够提升功能叶在灌浆期的净光合速率,对产量特征和氮素利用效率贡献明显。高氮投入导致根系对土壤氮素过量吸收,关键功能叶净光合速率、气孔导度和氮素利用效率随之有所降低,OsAMT1;1过表达株系光合速率与野生型相比无显著变化。可见,OsAMT1;1表达水平的提升在减氮条件下有利于促进水稻光合碳同化,协同植株高氮(相比于过量施氮)的内部环境实现较高的产量和氮素利用率。
| [1] |
Hu Q, Jiang W Q, Qiu S, et al. Effect of wide-narrow row arrangement in mechanical pot-seedling transplanting and plant density on yield formation and grain quality of japonica rice[J]. Journal of Integrative Agriculture, 2020, 19(5): 1197-1214 DOI:10.1016/S2095-3119(19)62800-5 (  0) 0) |
| [2] |
于飞, 施卫明. 近10年中国大陆主要粮食作物氮肥利用率分析[J]. 土壤学报, 2015, 52(6): 1311-1324 (  0) 0) |
| [3] |
陈天祥, 杨顺瑛, 王书伟, 等. 水稻氮素利用效率的基因型差异与调控途径[J]. 土壤, 2022, 54(5): 873-881 (  0) 0) |
| [4] |
郭俊杰, 柴以潇, 李玲, 等. 江苏省水稻减肥增产的潜力与机制分析[J]. 中国农业科学, 2019, 52(5): 849-859 (  0) 0) |
| [5] |
张福锁, 王激清, 张卫峰, 等. 中国主要粮食作物肥料利用率现状与提高途径[J]. 土壤学报, 2008, 45(5): 915-924 (  0) 0) |
| [6] |
Ju X T, Xing G X, Chen X P, et al. Reducing environmental risk by improving N management in intensive Chinese agricultural systems[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(9): 3041-3046 (  0) 0) |
| [7] |
Coskun D, Britto D T, Shi W M, et al. Nitrogen transformations in modern agriculture and the role of biological nitrification inhibition[J]. Nature Plants, 2017, 3: 17074 DOI:10.1038/nplants.2017.74 (  0) 0) |
| [8] |
Peng S B, Tang Q Y, Zou Y B. Current status and challenges of rice production in China[J]. Plant Production Science, 2009, 12(1): 3-8 DOI:10.1626/pps.12.3 (  0) 0) |
| [9] |
Ray D K, Ramankutty N, Mueller N D, et al. Recent patterns of crop yield growth and stagnation[J]. Nature Communications, 2012, 3: 1293 DOI:10.1038/ncomms2296 (  0) 0) |
| [10] |
Tabien R E, Samonte S O P, McClung A M. Forty-eight years of rice improvement in texas since the release of cultivar bluebonnet in 1944[J]. Crop Science, 2008, 48(6): 2097-2106 DOI:10.2135/cropsci2007.12.0680 (  0) 0) |
| [11] |
Yang S Y, Hao D L, Cong Y, et al. The rice OsAMT1;1 is a proton-independent feedback regulated ammonium transporter[J]. Plant Cell Reports, 2015, 34(2): 321-330 DOI:10.1007/s00299-014-1709-1 (  0) 0) |
| [12] |
Hao D L, Yang S Y, Huang Y N, et al. Identification of structural elements involved in fine-tuning of the transport activity of the rice ammonium transporter OsAMT1;3[J]. Plant Physiology and Biochemistry, 2016, 108: 99-108 DOI:10.1016/j.plaphy.2016.07.003 (  0) 0) |
| [13] |
Li S M, Li B Z, Shi W M. Expression patterns of nine ammonium transporters in rice in response to N status[J]. Pedosphere, 2012, 22(6): 860-869 DOI:10.1016/S1002-0160(12)60072-1 (  0) 0) |
| [14] |
Gaur V S, Singh U S, Gupta A K, et al. Influence of different nitrogen inputs on the members of ammonium transporter and glutamine synthetase genes in two rice genotypes having differential responsiveness to nitrogen[J]. Molecular Biology Reports, 2012, 39(8): 8035-8044 DOI:10.1007/s11033-012-1650-8 (  0) 0) |
| [15] |
赵首萍, 施卫明. 水稻NH4+转运蛋白基因OsAMT1.1~1.3, OsAMT3.1和OsAMT4.1表达部位及表达特性初析[J]. 土壤, 2007, 39(3): 460-464 DOI:10.3321/j.issn:0253-9829.2007.03.024 (  0) 0) |
| [16] |
Sonoda Y, Ikeda A, Saiki S, et al. Distinct expression and function of three ammonium transporter genes (OsAMT1;1 - 1;3) in rice[J]. Plant and Cell Physiology, 2003, 44(7): 726-734 DOI:10.1093/pcp/pcg083 (  0) 0) |
| [17] |
Bao A L, Liang Z J, Zhao Z Q, et al. Overexpressing of OsAMT1-3, a high affinity ammonium transporter gene, modifies rice growth and carbon-nitrogen metabolic status[J]. International Journal of Molecular Sciences, 2015, 16(5): 9037-9063 (  0) 0) |
| [18] |
Ranathunge K, El-kereamy A, Gidda S, et al. AMT1;1 transgenic rice plants with enhanced NH4+ permeability show superior growth and higher yield under optimal and suboptimal NH4+ conditions[J]. Journal of Experimental Botany, 2014, 65(4): 965-979 DOI:10.1093/jxb/ert458 (  0) 0) |
| [19] |
Lee S, Marmagne A, Park J, et al. Concurrent activation of OsAMT1;2 and OsGOGAT1 in rice leads to enhanced nitrogen use efficiency under nitrogen limitation[J]. The Plant Journal, 2020, 103(1): 7-20 DOI:10.1111/tpj.14794 (  0) 0) |
| [20] |
Huang L Y, Sun F, Yuan S, et al. Different mechanisms underlying the yield advantage of ordinary hybrid and super hybrid rice over inbred rice under low and moderate N input conditions[J]. Field Crops Research, 2018, 216: 150-157 DOI:10.1016/j.fcr.2017.11.019 (  0) 0) |
| [21] |
Rathke G W, Behrens T, Diepenbrock W. Integrated nitrogen management strategies to improve seed yield, oil content and nitrogen efficiency of winter oilseed rape (Brassica napus L.): A review[J]. Agriculture, Ecosystems & Environment, 2006, 117(2/3): 80-108 (  0) 0) |
| [22] |
Justes E, Mary B, Meynard J M, et al. Determination of a critical nitrogen dilution curve for winter wheat crops[J]. Annals of Botany, 1994, 74(4): 397-407 DOI:10.1006/anbo.1994.1133 (  0) 0) |
| [23] |
Zhang Y B, Tang Q Y, Zou Y B, et al. Yield potential and radiation use efficiency of "super" hybrid rice grown under subtropical conditions[J]. Field Crops Research, 2009, 114(1): 91-98 DOI:10.1016/j.fcr.2009.07.008 (  0) 0) |
| [24] |
Bai P, Bai R Q, Jin Y X. Characteristics and coordination of source-sink relationships in super hybrid rice[J]. Open Life Sciences, 2016, 11(1): 470-475 DOI:10.1515/biol-2016-0061 (  0) 0) |
| [25] |
Wu W G, Zhang H C, Qian Y F, et al. Analysis on dry matter production characteristics of super hybrid rice[J]. Rice Science, 2008, 15(2): 110-118 DOI:10.1016/S1672-6308(08)60028-1 (  0) 0) |
| [26] |
Shao L P, Liu Z J, Li H Z, et al. The impact of global dimming on crop yields is determined by the source-sink imbalance of carbon during grain filling[J]. Global Change Biology, 2021, 27(3): 689-708 DOI:10.1111/gcb.15453 (  0) 0) |
| [27] |
Huang M, Chen J N, Cao F B, et al. Improving physiological N-use efficiency by increasing harvest index in rice: A case in super-hybrid cultivar Guiliangyou 2[J]. Archives of Agronomy and Soil Science, 2016, 62(5): 725-743 DOI:10.1080/03650340.2015.1082031 (  0) 0) |
| [28] |
Wei H H, Meng T Y, Li C, et al. Comparisons of grain yield and nutrient accumulation and translocation in high-yielding japonica/indica hybrids, indica hybrids, and japonica conventional varieties[J]. Field Crops Research, 2017, 204: 101-109 DOI:10.1016/j.fcr.2017.01.001 (  0) 0) |
| [29] |
Makino A. Photosynthesis, grain yield, and nitrogen utilization in rice and wheat[J]. Plant Physiology, 2011, 155(1): 125-129 DOI:10.1104/pp.110.165076 (  0) 0) |
| [30] |
Li Y, Gao Y X, Xu X M, et al. Light-saturated photosynthetic rate in high-nitrogen rice (Oryza sativa L.) leaves is related to chloroplastic CO2 concentration[J]. Journal of Experimental Botany, 2009, 60(8): 2351-2360 DOI:10.1093/jxb/erp127 (  0) 0) |
| [31] |
Liu T, Ren T, White P J, et al. Storage nitrogen co-ordinates leaf expansion and photosynthetic capacity in winter oilseed rape[J]. Journal of Experimental Botany, 2018, 69(12): 2995-3007 DOI:10.1093/jxb/ery134 (  0) 0) |
| [32] |
Zhao S P, Ye X Z, Shi W M. Expression of OsAMT1 (1.1-1.3) in rice varieties differing in nitrogen accumulation[J]. Russian Journal of Plant Physiology, 2014, 61(5): 707-713 DOI:10.1134/S1021443714040220 (  0) 0) |
| [33] |
Hoque M S, Masle J, Udvardi M K, et al. Over-expression of the rice OsAMT1-1 gene increases ammonium uptake and content, but impairs growth and development of plants under high ammonium nutrition[J]. Functional Plant Biology: FPB, 2006, 33(2): 153-163 DOI:10.1071/FP05165 (  0) 0) |
| [34] |
Kumar A, Kaiser B N, Siddiqi M Y, et al. Functional characterisation of OsAMT1.1 overexpression lines of rice, Oryza sativa[J]. Functional Plant Biology: FPB, 2006, 33(4): 339-346 DOI:10.1071/FP05268 (  0) 0) |
| [35] |
Li Y, Yang X X, Ren B B, et al. Why nitrogen use efficiency decreases under high nitrogen supply in rice (Oryza sativa L.) seedlings[J]. Journal of Plant Growth Regulation, 2012, 31(1): 47-52 DOI:10.1007/s00344-011-9218-8 (  0) 0) |
| [36] |
Ju C X, Buresh R J, Wang Z Q, et al. Root and shoot traits for rice varieties with higher grain yield and higher nitrogen use efficiency at lower nitrogen rates application[J]. Field Crops Research, 2015, 175: 47-55 DOI:10.1016/j.fcr.2015.02.007 (  0) 0) |
| [37] |
Hou W F, Tränkner M, Lu J W, et al. Interactive effects of nitrogen and potassium on photosynthesis and photosynthetic nitrogen allocation of rice leaves[J]. BMC Plant Biology, 2019, 19(1): 302 DOI:10.1186/s12870-019-1894-8 (  0) 0) |
| [38] |
Yang S Y, Hao D L, Song Z Z, et al. RNA-Seq analysis of differentially expressed genes in rice under varied nitrogen supplies[J]. Gene, 2015, 555(2): 305-317 DOI:10.1016/j.gene.2014.11.021 (  0) 0) |
| [39] |
Yang S Y, Hao D L, Jin M, et al. Internal ammonium excess induces ROS-mediated reactions and causes carbon scarcity in rice[J]. BMC Plant Biology, 2020, 20(1): 143 DOI:10.1186/s12870-020-02363-x (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China
 2023, Vol. 55
2023, Vol. 55


