2. 浙江省土壤污染生物修复重点实验室, 杭州 311300
塑料制品大量使用引起的废塑料垃圾污染一直是全球备受关注的环境问题之一。微塑料因其粒径小、易被生物吞食,且携带大量污染物等特征近年来被认为是一类新环境污染物。微塑料是指环境中粒径小于5 mm的塑料类颗粒。据已有文献报道,设施农田中微塑料污染丰度可高达7.10×103 ~ 4.69×104个/kg[1],其中聚乙烯微塑料在农田土壤中检出最为普遍,成为主要的微塑料类型[2]。近年来,研究表明微塑料可影响土壤氮素形态转化及其相关微生物群落组成[3],并且也会改变土壤中nifH、amoA、nirK等氮素转化功能基因丰度[4]。农田土壤抗生素污染中磺胺类和四环素类抗生素在土壤检出率相对较高,其含量可高达8.4 mg/kg[5]。抗生素污染会进一步导致环境中微生物耐药性的增强,并通过抗生素抗性基因(ARGs)加速在环境中的传播[6]。微塑料对环境中ARGs丰度和分布的影响也成为近年来研究的热点。如有研究表明,土壤中微塑料的污染也可能会抑制抗生素和ARGs的消散,从而增加其在土壤中的持留能力[7]。因此,从现有报道可以看出,微塑料对土壤中的氮素转化功能基因和抗生素抗性基因均有影响,实际农田土壤中,微塑料与抗生素共存污染的情况也常有存在。因此,考察抗生素污染土壤中,微塑料对土壤氮素转化功能基因和ARGs丰度变化的影响,对认识氮素转化利用和ARGs的污染风险均有重要的意义。
本研究以低密度聚乙烯(LDPE)微塑料、磺胺甲噁唑(SMZ)和四环素(TC)为目标污染物,以红壤性水稻土为供试土壤,并通过人工添加抗生素制备污染土壤。在人工气候箱条件下开展土壤培养试验,研究微塑料对抗生素污染土壤中氮素形态转化、氮素转化功能基因和ARGs变化的影响,为评估土壤微塑料-抗生素复合污染的环境风险提供理论支撑。
1 材料与方法 1.1 供试材料供试土壤采自浙江省杭州市临安区(30°18′ 59.32″ N, 119°44′32.85″E)的未覆膜水田表层土(0 ~ 20 cm),属于红壤母质发育的水稻土。土壤采回后在实验室风干,并去除石块和残根残叶,过2 mm筛后测定相关理化性质。表 1为供试土壤的基本理化性质,土壤经检测均无抗生素和微塑料污染情况。供试微塑料为LDPE微粉,平均粒径678 μm,购自上海阳励机电科技有限公司。供试抗生素磺胺甲噁唑、四环素均为分析纯,购自上海源叶生物科技有限公司。土壤抗生素分析前处理所用的固相萃取小柱为HLB SPE(美国Supelco)小柱,购自上海安谱实验公司。高效液相色谱测定所需的甲醇和甲酸均为HPLC级色谱纯。
|
|
表 1 供试水稻土基本理化性质 Table 1 Physicochemical properties of tested paddy soil |
室内土壤培养试验共设置3个处理:对照处理为添加10 mg/kg磺胺甲噁唑和四环素这两种抗生素的土壤(CK);在相同浓度的抗生素添加处理基础上,设置了添加0.05% 和0.5%(m/m)LDPE微塑料量的两个土壤处理,分别标记为0.05%PE、0.5%PE。每个处理设置3个重复。
称取过2 mm筛的650 g供试土壤放置于1 L玻璃烧杯中,在人工气候培养箱中预培养一周。预培养条件为:温度25 ℃,相对湿度80%,光照与黑暗每12 h交替,土壤水分保持田间持水量的60%。预培养结束后向每个土壤中分别加入50 mL磺胺甲噁唑和四环素混合溶液(两种抗生素浓度均为130 mg/L),充分搅拌均匀后使两种抗生素在土壤中的含量均达到10 mg/kg。针对微塑料处理土壤,分别再加入0.325 g和3.25 g LDPE微粉,充分搅拌均匀,使微塑料含量达到0.05%(m/m)和0.5%(m/m)。共培养29 d,培养条件与预培养时保持一致。培养过程中,分别在第1、8、15、22、29天取土壤样品,测定土壤中磺胺甲噁唑、四环素、硝态氮、铵态氮的含量,第29天的土壤样品同时测定抗性基因和氮素转化功能基因丰度。
1.3 测定方法土壤基本理化性质测定方法参考《土壤农业化学分析方法》[8]。土壤pH采用梅特勒台式pH计测定,土水比为1:2.5(m: V);土壤总有机碳采用标准重铬酸钾容量法测定;全氮采用凯氏定氮法测定;全磷测定采用高氯酸-硫酸法,消煮后经钼锑抗显色法显色后于700 nm波长下测定吸光度。硝态氮采用紫外分光光度法测定,铵态氮采用靛酚蓝比色法测定。有效磷采用硫酸-高氯酸浸提,钼锑抗显色法显色后于波长700 nm处测定吸光度。土壤可溶性有机碳的提取参考文献[9],提取液过0.45 μm PTFE膜后上TOC仪测定。
土壤抗生素测定:称冻干土壤样品2.00 g,加入甲醇/EDTA-Mcllvaine缓冲液混合液(V: V=1:1) 20 mL,振荡30 min,冰浴超声提取10 min,离心、抽滤并收集上清液。残渣再按上述步骤超声提取2次,合并提取液并用水稀释至500 mL。用固相萃取装置对提取液中的抗生素进行萃取富集;用蠕动泵将500 mL提取液以3.0 mL/min的流速泵入活化过的HLB小柱(10 mL甲醇和10 mL水活化),然后氮吹HLB小柱20 min,再用10 mL甲醇(含0.1% 甲酸,V/V)以1.0 mL/min的流速洗脱小柱上的抗生素,收集洗脱液后氮吹至1.5 mL左右,再用甲醇(含0.1% 的甲酸,V/V)定容至2.0 mL。混匀后过0.22 μm滤膜,用高效液相色谱紫外法(U3000, Thermo Fisher)测定磺胺甲噁唑和四环素的浓度。检测时采用的流动相为乙腈: 水(含0.1%甲酸)(10:90, V/V),流速为1 mL/min,设置柱温30 ℃,进样量20 µL,紫外检测波长为278 nm。通过添加回收试验确定本方法测定土壤中磺胺甲噁唑和四环素的回收率分别是94% 和90%。
土壤DNA提取:采用OMEGA Soil DNA Kit试剂盒(M5635-02)(Omega Bio-Tek, Norcross, GA, USA) 提取样品总脱氧核糖核酸(DNA),DNA浓度和纯度分别利用Nanodrop 2000(Thermo Fisher Scientific, Waltham, MA, USA)微量核酸蛋白质分析仪和1.2% 琼脂糖凝胶电泳检测。
PCR检测:定量PCR扩增的引物对详见表 2,反应体系20 μL,包括:2×TB Green Premix Ex Taq II 10 μL,正向引物(10 μmol/L)0.8 μL、反向引物(10 μmol/L)0.8 μL,DNA模板2 μL,补重蒸水(ddH2O) 6.4~20 μL。扩增程序如下:95 ℃预变性30 s,35个循环的95℃变性5 s、60 ℃退火30 s和72 ℃延伸30 s。使用的PCR仪为实时荧光定量仪(TIB8600)。扩增效率为80.8% ~ 83.4%,标准曲线R2值介于0.994 ~ 0.999,同时熔解曲线的单一峰确保了目的基因的特异性扩增。通过2% 琼脂糖凝胶电泳验证PCR扩增产物,同时合成质粒。质粒经测序验证后使用Nanodrop 2000测定浓度,合格的质粒经梯度稀释后制成一系列标准品(101 ~ 108 copies/μL)用于生成标准曲线。
|
|
表 2 试验检测基因及所用引物信息 Table 2 Experimental detected genes and used primers |
试验相关目标基因拷贝数(X0)计算方法:
| $ C_{t }= –K \lg X_{0} +b $ | (1) |
式中:K为标准曲线斜率,b为标准曲线截距,Ct为样品定量PCR扩增的循环次数采用Excel 2019进行数据计算;采用Origin 2021进行作图;采用SPSS 22软件进行单因素方差分析,不同处理之间的多重比较采用Tukey统计检验法, 以0.05水平统计差异的显著性。
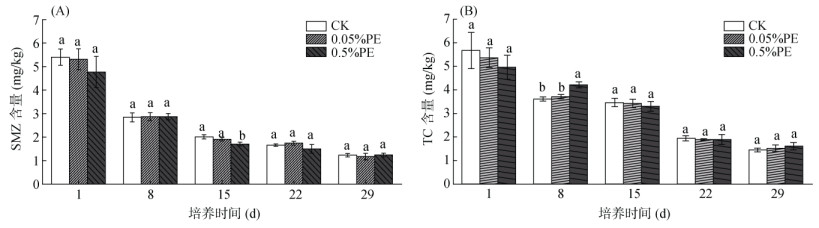
2 结果与讨论 2.1 土壤抗生素的动态变化特征土壤中磺胺甲噁唑和四环素含量的动态变化如图 1所示。可以看出,培养29 d的土壤中磺胺甲噁唑和四环素降解率分别为87.6% ~ 88.3% 和75.1% ~ 77.6%。抗生素在土壤中降解取决于诸多因素,包括环境温度、湿度、光照、酸碱性和微生物活性等[17]。添加0.05% 和0.5% 的PE微塑料均未显著(P > 0.05)影响磺胺甲噁唑和四环素的降解率。这与Wang等[18]研究发现土壤中添加1% 的PE微塑料对环丙沙星产生降解抑制的结果并不一致。一方面,两个研究中使用的抗生素类型、土壤性质和微塑料添加量均有不同,这些差异均有可能导致微塑料对土壤抗生素降解的影响不同。另一方面,也有报道表明,LDPE微塑料在低pH条件下对抗生素的吸附作用较小,以静电排斥为主[19]。杨杰等[20]研究也表明PE微塑料对四环素的吸附量随着pH增加而逐渐增加。
|
(图中小写字母不同表示处理间差异显著(P < 0.05),下同) 图 1 土壤培养过程中抗生素含量的动态变化 Fig. 1 TC and SMZ contents in soil incubation |
表 3为培养29 d后土壤中磺胺类抗性基因(sulI)和四环素抗性基因(tetA)的丰度。0.05%PE、0.5%PE微塑料处理土壤和对照土壤中tetA丰度分别是1.06×107、1.57×107和1.95×107 copies/g。相比于对照土壤,0.05%PE和0.5%PE微塑料处理土壤中tetA抗性基因丰度分别降低了45.6% 和19.5%。同样,微塑料处理土壤中sulI的丰度也分别降低了44.7% 和40.5%。可见,LDPE微塑料添加显著(P < 0.05)降低了土壤中抗生素抗性基因的丰度。从图 1可知,整个培养期内,土壤中微塑料添加并未影响抗生素的降解率,至培养结束,3个处理的抗生素含量仍然保持无显著差异(P > 0.05)。有研究表明,微塑料添加可能会通过增加对土壤抗生素的持留性,从而对ARGs产生诱导压力,导致抗性基因丰度的显著增加[7]。本研究中微塑料的添加未对土壤中抗生素的降解产生显著的影响,因而微塑料处理导致的ARGs丰度降低与抗生素含量变化没有明显相关性。也有研究表明,微塑料对土壤中ARGs丰度的改变受到微塑料粒径、培养时间、表面风化程度等影响,只有微塑料表面风化程度高、土壤培养时间长才会导致土壤中抗性基因的显著增加[21]。此外,微塑料添加导致ARGs丰度有显著差异的原因可能也与土壤微生物群落组成变化有关,从而间接影响ARGs丰度[22]。课题组之前的研究工作表明[23],LDPE微塑料的添加处理显著影响土壤细菌群落组成和结构。另外也有研究表明,微塑料对土壤ARGs丰度的影响也可能通过改变土壤氮素形态产生间接影响[24]。
|
|
表 3 不同处理土壤抗生素抗性基因丰度 Table 3 ARGs abundances under different treatments |
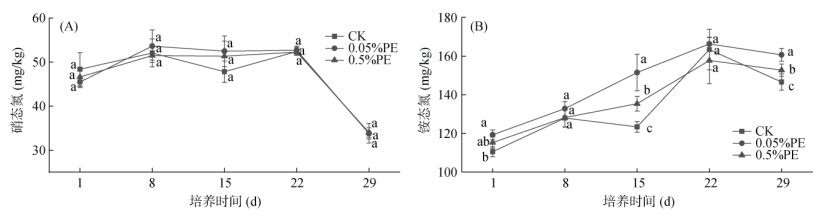
图 2是土壤中硝态氮和铵态氮含量的动态变化趋势。土壤中硝态氮含量总体呈现前期略有上升,培养后期下降的趋势;而铵态氮总体上呈现上升,至22 d后略有下降趋势。因此,在土壤培养过程中,总体上呈现以固氮为主,也有硝化过程;后期硝态氮下降可能是由于培养土壤产生一定程度厌氧导致反硝化的发生[25]。图 2的结果还显示,在抗生素污染情况下,微塑料处理对土壤铵态氮变化的影响相较于硝态氮更为明显。如,0.05%PE微塑料处理下,土壤铵态氮含量显著(P < 0.05)高于CK;0.5%PE微塑料处理在培养第15天和培养第29天两个时间段也显著(P < 0.05)高于CK。同时,在培养第15天,LDPE微塑料添加的土壤硝态氮也要高于对照。土壤铵态氮的增加可能与微塑料添加后提高了脲酶活性,并显著提高固氮微生物的占比有关[26]。有研究表明[27],通过两个月的土壤培养后发现0.5%LDPE薄膜(4.8 ~ 5 mm)的添加显著增加了NH4+含量,土壤脲酶活性也同时增加。课题组前期研究也表明,LDPE微塑料添加土壤培养后,除了增加脲酶活性外,具有固氮功能的伯克氏菌科(Burkholderiaceae)的相对丰度也显著上升[23]。
|
图 2 土壤培养过程中硝态氮和铵态氮的含量变化 Fig. 2 Nitrate and ammonium nitrogen contents in soil incubation |
表 4比较了不同处理土壤中固氮酶还原酶基因(nifH)、氨氧化过程功能基因(amoA和amoB)和亚硝酸盐还原酶基因(nirK和nirS)等功能基因丰度。可以看出LDPE微塑料添加处理总体上降低了上述氮素转化功能基因的丰度,并且以0.05% 添加量的影响最大。与对照相比,绝对丰度达到显著(P < 0.05)下降的氮转化功能基因有nifH、nirK和nirS。Zhao等[28]报道了nifH丰度与土壤速效氮含量呈负相关。本研究中,0.05%PE微塑料添加处理中铵态氮含量显著高于对照处理,而nifH丰度显著下降。LDPE微塑料添加处理中nirK和nirS基因丰度的减少,可能影响土壤的反硝化反应,导致土壤硝态氮的积累。本研究中,在培养15 d土壤中,微塑料添加处理的硝态氮含量要略高于对照土壤,与nirK和nirS基因丰度降低存在关联性。
|
|
表 4 不同处理下土壤氮素转化功能基因丰度 Table 4 Nitrogen functional genes abundances under different soil treatments |
不同处理土壤中,amoA与amoB基因丰度均未呈现显著差异性(P > 0.05)。对照处理中amoB丰度要显著高于amoA,但随着微塑料添加量增加,amoA与amoB基因丰度的差异缩小。谢婉玉等[25]研究认为,在一些农田土壤中,amoB相比于amoA对硝化作用更为重要,起到了主导的作用。因此,LDPE微塑料添加使土壤氨氧化过程功能基因组成发生变化,从而可能影响土壤的硝化作用。此外,也有研究表明,amoB比amoA更易受到外源物质(如微塑料等)的影响而出现丰度降低的情况[29],本研究的结果也与此相似。
3 结论LDPE微塑料添加对土壤铵态氮含量的影响要高于对硝态氮含量的影响,其中,0.05%(m/m)LDPE微塑料添加处理显著增加了土壤中铵态氮的含量,并且在培养15 d后影响最为显著。LDPE微塑料添加未显著改变土壤中四环素和磺胺甲噁唑的降解特征,但显著降低了土壤中抗性基因sulI、tetA,以及氮素转化功能基因nifH、nirK和nirS的丰度。同时,本研究也表明,LDPE微塑料添加改变了氨氧化功能基因amoA和amoB的组成,并且随着微塑料添加量增加,amoA丰度呈现上升而amoB丰度呈现下降趋势。未来可进一步结合土壤培养条件下微塑料表面生物膜中抗生素抗性基因和氮素转化功能基因组成和丰度的变化,探明微塑料对土壤相关功能基因的影响机制。
| [1] |
Zhang G S, Liu Y F. The distribution of microplastics in soil aggregate fractions in southwestern China[J]. Science of the Total Environment, 2018, 642: 12-20 DOI:10.1016/j.scitotenv.2018.06.004 (  0) 0) |
| [2] |
杨杰, 李连祯, 周倩, 等. 土壤环境中微塑料污染: 来源、过程及风险[J]. 土壤学报, 2021, 58(2): 281-298 (  0) 0) |
| [3] |
Wang X, Xing Y, Lv M J, et al. Recent advances on the effects of microplastics on elements cycling in the environment[J]. Science of the Total Environment, 2022, 849: 157884 DOI:10.1016/j.scitotenv.2022.157884 (  0) 0) |
| [4] |
Rong L L, Zhao L F, Zhao L C, et al. LDPE microplastics affect soil microbial communities and nitrogen cycling[J]. Science of the Total Environment, 2021, 773: 145640 DOI:10.1016/j.scitotenv.2021.145640 (  0) 0) |
| [5] |
Zhang H B, Zhou Y, Huang Y J, et al. Residues and risks of veterinary antibiotics in protected vegetable soils following application of different manures[J]. Chemosphere, 2016, 152: 229-237 DOI:10.1016/j.chemosphere.2016.02.111 (  0) 0) |
| [6] |
Macedo G, van Veelen H P J, Hernandez-Leal L, et al. Targeted metagenomics reveals inferior resilience of farm soil resistome compared to soil microbiome after manure application[J]. The Science of the Total Environment, 2021, 770: 145399 DOI:10.1016/j.scitotenv.2021.145399 (  0) 0) |
| [7] |
Sun M M, Ye M, Jiao W T, et al. Changes in tetracycline partitioning and bacteria/phage-comediated ARGs in microplastic-contaminated greenhouse soil facilitated by sophorolipid[J]. Journal of Hazardous Materials, 2018, 345: 131-139 DOI:10.1016/j.jhazmat.2017.11.036 (  0) 0) |
| [8] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000
(  0) 0) |
| [9] |
Fujii S, Yamada A, Fukushima K, et al. Relationships among distribution of fine roots, soil DOC concentration and Collembola[J]. Plant Root, 2013, 7: 21-27 DOI:10.3117/plantroot.7.21 (  0) 0) |
| [10] |
Yuan Q B, Guo M T, Yang J. Monitoring and assessing the impact of wastewater treatment on release of both antibiotic-resistant bacteria and their typical genes in a Chinese municipal wastewater treatment plant[J]. Environmental Science Processes & Impacts, 2014, 16(8): 1930-1937 (  0) 0) |
| [11] |
Szczepanowski R, Linke B, Krahn I, et al. Detection of 140 clinically relevant antibiotic-resistance genes in the plasmid metagenome of wastewater treatment plant bacteria showing reduced susceptibility to selected antibiotics[J]. Microbiology, 2009, 155(Pt 7): 2306-2319 (  0) 0) |
| [12] |
Rösch C, Mergel A, Bothe H. Biodiversity of denitrifying and dinitrogen-fixing bacteria in an acid forest soil[J]. Applied and Environmental Microbiology, 2002, 68(8): 3818-3829 DOI:10.1128/AEM.68.8.3818-3829.2002 (  0) 0) |
| [13] |
Beman J M, Francis C A. Diversity of ammonia-oxidizing Archaea and bacteria in the sediments of a hypernutrified subtropical estuary: Bahía del Tóbari, Mexico[J]. Applied and Environmental Microbiology, 2006, 72(12): 7767-7777 DOI:10.1128/AEM.00946-06 (  0) 0) |
| [14] |
Park S J, Park B J, Rhee S K. Comparative analysis of archaeal 16S rRNA and amoA genes to estimate the abundance and diversity of ammonia-oxidizing Archaea in marine sediments[J]. Extremophiles, 2008, 12(4): 605-615 DOI:10.1007/s00792-008-0165-7 (  0) 0) |
| [15] |
Henry S, Baudoin E, López-Gutiérrez J C, et al. Quantification of denitrifying bacteria in soils by nirK gene targeted real-time PCR[J]. Journal of Microbiological Methods, 2004, 59(3): 327-335 DOI:10.1016/j.mimet.2004.07.002 (  0) 0) |
| [16] |
Throbäck I N, Enwall K, Jarvis Å, et al. Reassessing PCR primers targeting nirS, nirK and nosZ genes for community surveys of denitrifying bacteria with DGGE[J]. FEMS Microbiology Ecology, 2004, 49(3): 401-417 DOI:10.1016/j.femsec.2004.04.011 (  0) 0) |
| [17] |
Koba O, Golovko O, Kodešová R, et al. Antibiotics degradation in soil: A case of clindamycin, trimethoprim, sulfamethoxazole and their transformation products[J]. Environmental Pollution, 2017, 220: 1251-1263 DOI:10.1016/j.envpol.2016.11.007 (  0) 0) |
| [18] |
Wang J, Liu X H, Dai Y X, et al. Effects of co-loading of polyethylene microplastics and ciprofloxacin on the antibiotic degradation efficiency and microbial community structure in soil[J]. Science of the Total Environment, 2020, 741: 140463 DOI:10.1016/j.scitotenv.2020.140463 (  0) 0) |
| [19] |
王佳青, 俞奔, 马绍峰, 等. 土壤—微塑料混合体系中磺胺甲恶唑的解吸行为研究[J]. 土壤学报, 2022, 59(4): 1048-1056 (  0) 0) |
| [20] |
杨杰, 仓龙, 邱炜, 等. 不同土壤环境因素对微塑料吸附四环素的影响[J]. 农业环境科学学报, 2019, 38(11): 2503-2510 (  0) 0) |
| [21] |
Lu X M, Lu P Z, Liu X P. Fate and abundance of antibiotic resistance genes on microplastics in facility vegetable soil[J]. Science of the Total Environment, 2020, 709: 136276 DOI:10.1016/j.scitotenv.2019.136276 (  0) 0) |
| [22] |
Razzaq M, Zeeshan M, Qaisar S, et al. Investigating use of metal-modified HZSM-5 catalyst to upgrade liquid yield in co-pyrolysis of wheat straw and polystyrene[J]. Fuel, 2019, 257: 116119 DOI:10.1016/j.fuel.2019.116119 (  0) 0) |
| [23] |
Fei Y F, Huang S Y, Zhang H B, et al. Response of soil enzyme activities and bacterial communities to the accumulation of microplastics in an acid cropped soil[J]. Science of the Total Environment, 2020, 707: 135634 DOI:10.1016/j.scitotenv.2019.135634 (  0) 0) |
| [24] |
Sun S L, Lu C, Liu J, et al. Antibiotic resistance gene abundance and bacterial community structure in soils altered by Ammonium and Nitrate Concentrations[J]. Soil Biology and Biochemistry, 2020, 149: 107965 DOI:10.1016/j.soilbio.2020.107965 (  0) 0) |
| [25] |
谢婉玉, 王永明, 纪红梅, 等. 秸秆还田种类对稻田N2O排放及硝化反硝化微生物的影响[J]. 土壤, 2022, 54(4): 769-778 (  0) 0) |
| [26] |
Zhu F X, Yan Y Y, Doyle E, et al. Microplastics altered soil microbiome and nitrogen cycling: The role of phthalate plasticizer[J]. Journal of Hazardous Materials, 2022, 427: 127944 DOI:10.1016/j.jhazmat.2021.127944 (  0) 0) |
| [27] |
Shi J, Wang J, Lv J F, et al. Microplastic presence significantly alters soil nitrogen transformation and decreases nitrogen bioavailability under contrasting temperatures[J]. Journal of Environmental Management, 2022, 317: 115473 DOI:10.1016/j.jenvman.2022.115473 (  0) 0) |
| [28] |
Zhao M, Raheem A, Memon Z M, et al. Iso-conversional kinetics of low-lipid micro-algae gasification by air[J]. Journal of Cleaner Production, 2019, 207: 618-629 DOI:10.1016/j.jclepro.2018.10.040 (  0) 0) |
| [29] |
Magda K, Henry Hugh A L, Romain M, et al. Multi-year and short-term responses of soil ammonia-oxidizing prokaryotes to zinc bacitracin, monensin, and ivermectin, singly or in combination[J]. Environmental Toxicology and Chemistry, 2015, 34(3): 618-625 DOI:10.1002/etc.2848 (  0) 0) |
2. Key Laboratory of Soil Contamination Bioremediation of Zhejiang Province, Hangzhou 311300, China
 2023, Vol. 55
2023, Vol. 55


