2. 耕地资源调查监测与保护利用重点实验室, 成都 611130
反硝化作用是指生态系统固定的氮和人为投入生态系统的氮在还原条件下由兼性厌氧的硝酸盐还原菌最终转化为N2的形态返回到大气中的过程[1]。一方面,反硝化过程是农田氮素损失的主要途径。相关研究表明,通过反硝化作用进入再循环的氮素占全球总输入量的52% ~ 100%,反硝化作用造成的氮肥损失占施入氮肥量的12% ~ 30%[2]。另一方面,反硝化是农田温室气体N2O排放的主要过程之一[3]。土壤反硝化过程受多种因素影响,其中最主要的两个因素是土壤理化性质(如土壤pH、有机质含量)和参与反硝化过程的微生物的种类及数量[4]。同一母质发育的土壤,经长期不同利用,如不同的种植制度及管理措施(如耕作、施肥、灌溉等),土壤的理化性质、酶活性、微生物生物量和群落结构等会发生明显改变[5],进而很可能造成土壤反硝化过程的差异。
有机质含量是影响土壤反硝化过程的主要因子之一。有研究表明,土壤反硝化作用与土壤有机质含量呈极显著性正相关(P < 0.01)[6],施用有机物料可以显著增加反硝化作用关键基因nirK、nirS和nosZ的丰度[7]。生物质炭是木屑、作物秸秆、动物粪便、城市固体垃圾等有机物在缺氧、相对低温(≤700℃)的条件下,通过高温分解炭化得到的一种富含碳、性质稳定、芳香化程度高的物质[8-9]。生物质炭具有多微孔结构、大比表面积、高pH等特征,能有效地改善农田土壤pH、容重、孔隙度和持水性等理化性状,吸附固定NH4+和NH3[10-11],从而降低土壤氮素的损失。添加生物质炭被认为是土壤改良、作物增产和固碳减排的重要措施[12]。不少研究发现生物质炭添加会减少农田土壤N2O排放[13-14]。然而,也有研究表明生物质炭矿化可以为土壤反硝化微生物提供充足的碳源和能源,是反硝化过程的主要驱动因素,土壤N2O排放的风险可能会因生物质炭施用有所增加。由此可见,生物质炭添加对于农田N2O排放的影响尚未明确。
综上,同一类型土壤在长期的不同利用方式下其理化及生物学性质会出现差异,而这些差异又与反硝化过程存在密切联系,然而,不同利用方式紫色土反硝化过程的具体差异是什么?这些差异受生物质炭添加有何用影响?尚不清楚。为此,本试验以四川雅安雨城区海拔、母质等成土环境一致的林地、耕地、果园、茶园4种利用方式的紫色土为研究对象,采用厌氧培养–15N标记法,探究并对比不同利用方式紫色土反硝化过程的差异以及外加生物质炭对土壤反硝化过程的影响,以期为合理调节紫色土的利用方式,减少土壤的氮素损失以及N2O等温室气体的排放提供科学依据。
1 材料与方法 1.1 研究区概况试验土壤采集于雅安市雨城区老板山。该山位于濆江之南,地处成都平原和川西高原的交界处,是一片地势较低的山地,属亚热带湿润季风气候,年均气温14.1 ~ 17.9 ℃,年降水量超过1 000 mm。土壤类型为白垩纪灌口组紫色砂页岩发育而成的紫色土。取样时,选取海拔(600 m左右)、母质等成土环境一致土地利用方式不同的茶园(11 a)、果园(8 a)、林地(人工林,3 a)、耕地(> 10 a)4种类型的地块,各随机设置3块2 m × 2 m的样地,用钻头在每一样地取5点土样,混合均匀后,采用四分法留取1 kg左右。所采集的土样带回实验室后立即放在4℃冰箱中进行保存[15]。各土地利用方式土壤采样点描述见表 1。
|
|
表 1 采样地点 Table 1 Locations of sampling sites |
采用厌氧培养–15N标记法进行试验[16]。具体为:每个土壤称取相当于干土重50 g的新鲜土壤至430 mL的塑料瓶中,分别加入占干土质量1% 的生物质炭[17-20],并设置对照;在25 ℃环境中恒温预培养3 d后,均匀加入50 mg/kg的硝酸钾(15N丰度为10 atom%)氮肥溶液,随后加入50 mL蒸馏水,营造淹水厌氧环境;用带三通阀的瓶盖密封塑料瓶,然后用真空泵抽空瓶内气体,形成真空环境,再注入高纯氮气(99.99%),如此反复3次,使瓶中的气体全部变为氮气后送入培养箱,25℃恒温避光培养。在培养2、24、72、144、240 h时,分别抽取2个10 mL的气体,一瓶气样用于测定N2O含量,另一瓶用于测定15N2丰度。气体取样完毕后,使用2.5 mol/L的KCl溶液浸提土壤(水土比=5∶1,V∶m),在25 ℃、250 r/min的条件下振荡1 h,然后过滤,测定滤液中NO3–-N、NH4+-N含量。采用微扩散法[21]富集样品中的15NO3-N,具体方法为:在密闭培养瓶中加入MgO,通过扩散培养将样品中的NH4+-N转化为NH3,并去除瓶内的NH3,然后利用戴氏合金将NO3–-N还原为NH4+-N,再扩散后培养收集15NO3–-N。
1.3 样品分析方法土壤pH用METTLER-S220-KpH计测定,水土比为5∶1(V∶m);土壤有机质(SOM)采用重铬酸钾容量法测定[16];NO3–-N、NH4+-N浓度通过紫外分光光度计进行测定;土壤全氮(TN)采用半微量凯氏法测定[16];N2O浓度由安捷伦气相色谱仪测定;15N丰度使用同位素比质谱分析仪(EA-IRMS,Isoprime 100)进行测定,通过测定荷质比(m/z)29与28及30与28的离子流强度的比值及计算获得[22]。
1.4 数据处理与统计分析土壤N2O产生速率:
| $ F = \rho \times \frac{v}{A} \times \frac{{\Delta C}}{{\Delta t}} \times \frac{{273}}{{273 + T}} $ | (1) |
式中:F为N2O产生速率(N,µg/(kg·h));ρ为标准状态下N2O的密度(1.25 kg/m3);V为塑料瓶内有效空间体积(m3);A为塑料瓶覆盖的土壤面积(m2);Δc为塑料瓶内N2O浓度差(µg/kg);Δt为时间间隔(h);T为培养时瓶内温度(℃)。
培养瓶中N2含量的计算参照Zhang等[20]的计算方法:
| $ C = \left[ {\left( {1.13 \times V} \right) + \left( {1.13 \times {V_1} \times \alpha } \right)} \right] \times {10^6}/m $ | (2) |
式中:C表示培养瓶中N2的含量(N,µg/kg);V表示培养瓶中气体有效空间的体积(m3);V1表示培养瓶中水的体积(m3);α表示Bunsen矫正系数;m表示培养瓶内的干土质量(kg)。
假设土壤中所剩的NO3–-15N丰度与反硝化所产生的N2-15N丰度相等,则:
| $ D = \frac{{\left( {{}_{}^{15}{\text{N}_2} - 0.366\% } \right) \times C}}{{\left( {{}_{}^{15}\text{NO}_3^ - } \right) - \left( {{}_{}^{15}{\text{N}_2}} \right)}} $ | (3) |
式中:D表示反硝化N2产生量(µg/kg);15N2表示N2-15N的丰度;0.366% 为大气中N2-15N的自然丰度; C表示培养瓶中N2的含量(µg/kg);15NO3–表示土壤NO3–-15N的原子百分超。
反硝化潜力:
| $ \text{DP} = {\text{N}_2}\text{O} + {\text{N}_2} $ | (4) |
式中:DP表示土壤的反硝化作用潜力(N,µg/(kg·h));N2O表示每小时N2O的产生量(N,µg/(kg·h));N2表示每小时N2的产生量(N,µg/(kg·h))。
利用SPSS 26.0中的Pearson’s rank方法和逐步回归方法对N2和N2O排放速率及其比值(N2/N2O)、反硝化速率与土壤性质的关系进行研究,并通过单因素方差分析,对比不同利用方式下各指标的差异显著性。图表采用Origin 2023进行绘制。
2 结果与分析 2.1 不同利用方式紫色土基础理化性质4种供试土壤中,茶园、果园、耕地土壤均为酸性,其中,茶园土壤pH最低(4.50),林地土壤呈中偏微碱性;土壤有机质含量为35.83 ~ 47.69 g/kg,以茶园土壤最为丰富,林地土壤含量最低。林地有机质含量低于其他3种土壤,可能是由于林地为人工林,土壤表层枯枝落叶覆盖量不多,而茶园由于特殊的种植方式,茶农会将茶树枝叶覆盖于茶树根表,以防寒和增加土壤有机质含量。4种土壤的全氮含量为2.06 ~ 2.35 g/kg,耕地含量最高,林地含量最低,但各利用方式土壤间不存在显著差异;土壤C/N为10.08 ~ 12.56,果园土壤最高,林地土壤最低。
|
|
表 2 供试土壤理化性质 Table 2 Soil physicochemical properties under different land use types |
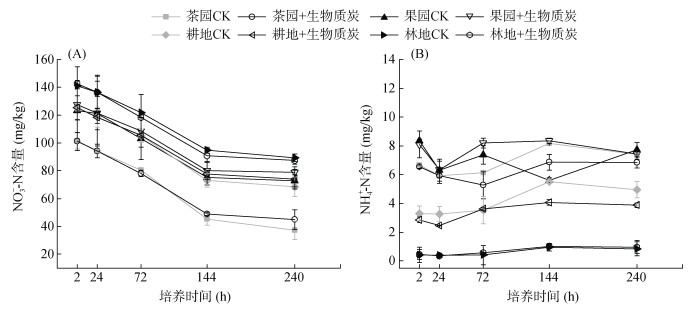
培养期间不同利用方式土壤NO3–-N、NH4+-N含量变化如图 1所示。土壤中NO3–-N含量为林地最高,茶园最低,从开始培养到144 h,4种土壤中NO3–-N含量均呈现急剧下降趋势,144 h后下降速率开始变缓,部分处理甚至保持稳定。而土壤中NH4+-N含量与NO3–-N含量相反,为果园 > 茶园 > 耕地 > 林地,培养期内其含量呈非显著性缓慢上升趋势。添加生物质炭后,与对照相比,土壤中NO3–-N、NH4+-N含量有所降低,但不显著,变化趋势也基本和对照一致。
|
图 1 不同利用方式紫色土NO3–-N、NH4+-N含量变化 Fig. 1 Changes of soil NO3–-N and NH4+-N contents under different land use types |
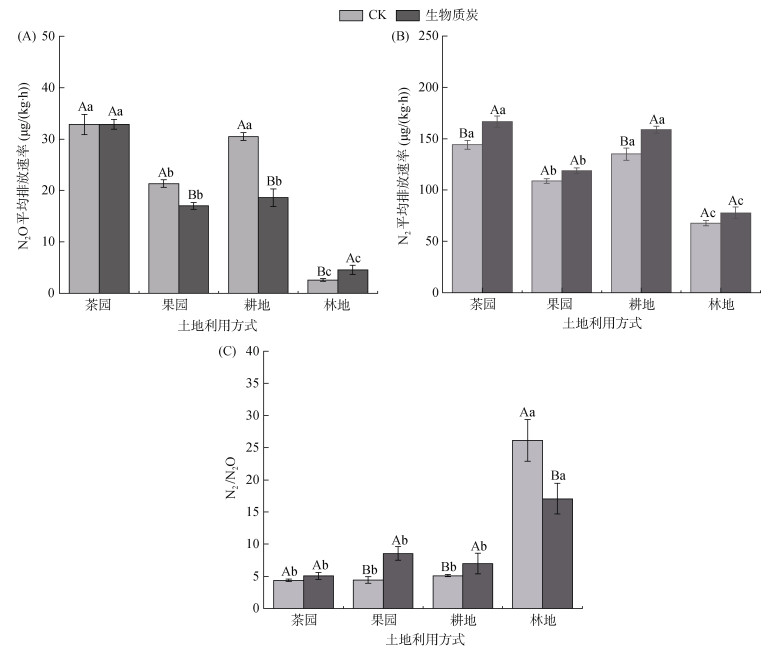
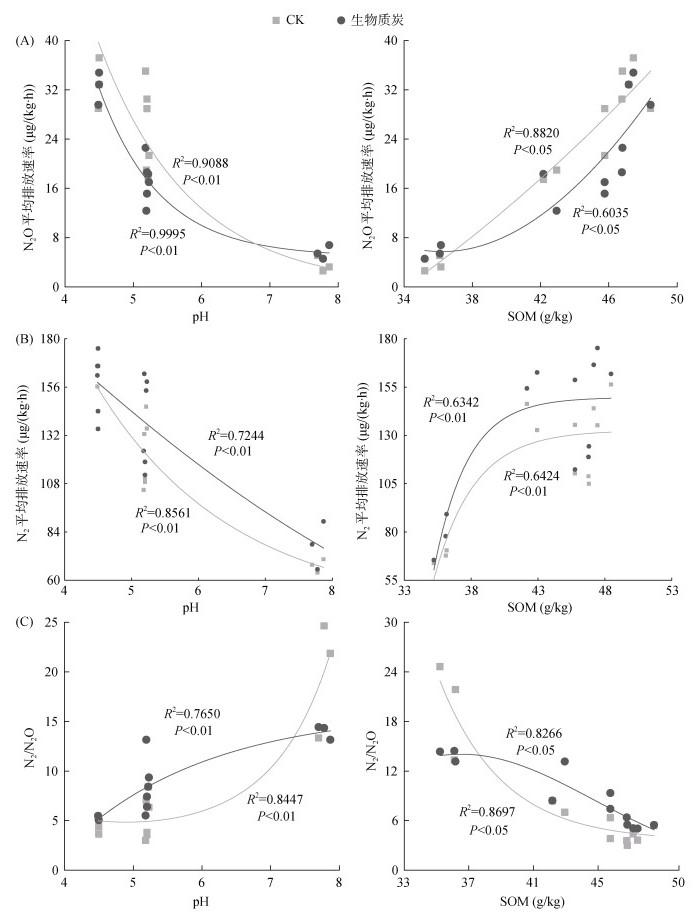
不同利用方式紫色土N2O平均排放速率差异明显(图 2A),表现为茶园 > 果园 > 耕地 > 林地。未添加生物质炭时,茶园、果园、耕地、林地土壤培养期间N2O平均排放速率分别为32.84、30.50、21.34、2.59 μg/(kg·h);添加生物质炭后,分别为32.85、18.59、16.99、4.56 μg/(kg·h)。可见,果园、耕地土壤在添加生物质炭后,N2O平均排放速率显著降低(P < 0.05)。比较4种不同利用方式土壤N2O平均排放速率,在未添加生物质炭时,茶园与耕地土壤之间差异性不显著(P > 0.05),林地土壤明显低于茶园土壤;添加生物质炭后,果园与耕地土壤之间差异性不显著(P > 0.05)。N2O平均排放速率与土壤pH呈明显的指数递减趋势(P < 0.01),而与土壤的有机质含量呈明显的正相关关系(P < 0.05)(图 3A)。
|
(图中不同大写字母表示同一利用方式下生物质炭和对照处理之间差异显著(P < 0.05),不同小写字母表示生物质炭或对照处理下不同利用方式间差异显著(P < 0.05);图 4同) 图 2 不同利用方式土壤N2O(A)和N2(B)平均排放速率及其比值(C) Fig. 2 Soil N2O (A) and N2 (B) average emission rates and N2/N2O (C) under different land use types |
|
图 3 土壤N2O(A)和N2(B)平均排放速率及其比值(C)与pH、有机质含量的关系 Fig. 3 Relationship between soil N2O (A) and N2 (B) average emission rates and N2/N2O (C) with pH and organic matter content |
未添加生物质炭时,茶园、果园、耕地、林地土壤培养期间的N2平均排放速率分别为144.20、135.05、108.83、67.76 μg/(kg·h);添加生物质炭后,分别为166.5、158.7、118.8、77.8 μg/(kg·h)(2B)。可见,添加生物质炭后,4种利用方式土壤的N2平均排放速率均有所提高。总体上,林地土壤的N2平均排放速率明显低于茶园、耕地和果园。N2平均排放速率随土壤pH的升高呈明显的指数递减变化趋势(P < 0.01),与土壤有机质含量呈明显的正相关关系(P < 0.05)(图 3B)。
N2、N2O排放速率比值(N2/N2O)与N2、N2O排放速率呈现相反规律,林地最高,而茶园最低,且茶园、果园、耕地三者不存在显著性差异(图 2C)。与CK相比,添加生物质炭后,土壤的N2/N2O在林地、果园与耕地中存在显著性差异(P < 0.05),而在茶园中不存在显著性差异(P < 0.05)。N2/N2O与土壤pH呈显著性正相关关系(P < 0.01),而与土壤有机质含量呈显著性负相关关系(P < 0.05)(图 3C)。
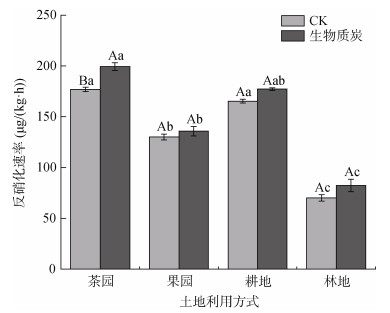
2.4 外加生物质炭后不同利用方式紫色土反硝化速率变化本研究的反硝化速率用气体产物的产生量,即N2O和N2排放速率之和来表征。茶园、耕地、果园、林地4种利用方式土壤的反硝化速率存在较大的差异(图 4)。未添加生物质炭处理,四者的反硝化速率分别为176.84、165.50、130.14、70.29 μg/(kg·h);添加生物质炭后,四者的反硝化速率分别为199.35、177.29、135.79、82.36 μg/(kg·h)。可见,添加生物质炭后,土壤的反硝化速率有所提升,但除茶园土壤外差异均不显著(P > 0.05)。无论是CK还是添加生物质炭处理,茶园土壤的反硝化速率明显高于果园和林地,但与耕地土壤差异性不显著,而耕地土壤和林地土壤反硝化速率也存在显著差异(P < 0.05)。土壤的反硝化速率随土壤pH增加显著性降低(P < 0.01),而土壤的有机质含量与土壤反硝化速率显著正相关(P < 0.05)(图 5)。
|
图 4 不同利用方式土壤反硝化速率 Fig. 4 Soil denitrification rates under different land use types |
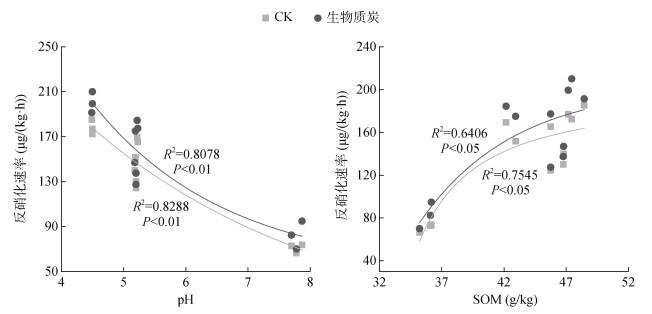
|
图 5 反硝化速率与土壤pH、有机质含量的关系 Fig. 5 Relationship between soil denitrification rate with pH and organic matter content |
从本试验结果可以看出,不同利用方式会导致紫色土的理化性质出现显著性差异,尤其是土壤pH及有机质含量。同时,不同利用方式紫色土N2O、N2排放速率以及反硝化速率也存在显著性差异。将土壤pH、有机质含量分别与试验所得的土壤N2O、N2排放速率以及反硝化速率进行相关性分析,发现其具有较高的相关性。此外,通过对比CK与添加生物质炭土壤的N2O、N2排放速率以及反硝化速率,初步了解了添加生物质炭对土壤反硝化过程的影响。
3.1 土壤pH对紫色土N2O、N2排放速率以及反硝化速率的影响通过本试验结果可知,不同利用方式紫色土的N2O排放速率随土壤pH的升高显著降低(P < 0.01)。供试4种土壤中,茶园土壤pH低至4.50,N2O排放速率为四者中最高,而林地土壤由于缺乏人为干扰,如未对土地大量施肥和耕作,没有农作物对盐基阳离子的吸收而导致的土壤酸化过程等[23-24],使得林地的pH较高,而N2O排放速率最低。目前已有研究显示,土壤pH主要通过改变N2O还原酶的活性对反硝化作用产生影响,通常认为N2O还原酶对酸性条件比较敏感,因此酸性土壤有利于N2O产生[25-28]。不同利用方式紫色土的N2排放速率随土壤pH的升高也显著降低。van Cleemput[29]在监测土壤气体产物中N2的释放时,发现N2排放速率随pH的降低而增大,但N2排放速率降低程度不及N2O排放速率,所以N2/N2O与土壤pH呈显著性正相关(P < 0.01)[30]。在本试验厌氧培养和外加NO3–底物的条件下,4种利用方式紫色土的N2排放速率均高于N2O排放速率,特别是在pH较高、相较于其他3种酸性土壤呈现微碱性的林地土壤中,N2排放速率远高于N2O排放速率。Koskinen和Keeney[31]研究发现,在土壤pH接近于中性条件下(pH 6.9),N2是主要产物,而酸性土壤条件(pH 4.6)则有利于N2O的排放。本试验条件下,林地土壤的pH接近于中性,其N2O产生速率很低,反硝化过程的主要产物是N2,而茶园土壤的pH最低,N2O释放速率在4种土壤中最高。反硝化速率随pH的增加呈现显著性负相关,这与Nanang等[22]的研究结果保持一致。综上可知,土壤pH的提高并不会增加紫色土的反硝化损失风险和N2O排放速率。
3.2 土壤有机质含量对紫色土N2O、N2排放速率以及反硝化速率的影响土壤中的有机物质对土壤的反硝化过程起着重要的促进作用,在本试验中,N2O、N2的释放速率和反硝化速率均与土壤中的有机质含量呈显著的正相关(P < 0.05)。试验所测4种土壤中,林地有机质含量最低,其N2O、N2的排放速率和反硝化速率均为最低,而茶园土壤有机质含量最高,N2O、N2的排放速率和反硝化速率也为最高。不少研究也表明,增加土壤有机质含量,如秸秆还田以及生物质炭与秸秆配施等,会增加土壤反硝化功能基因丰度及促进土壤N2O的排放[15, 32]。土壤有机质矿化能为反硝化作用提供绝大部分电子[33],同时还能为反硝化微生物供给碳源和能量,因此,有机质的矿化是反硝化反应的主要驱动力[27],其中有机质的含量对反硝化反应起着决定性的作用。土壤中有机碳的含量越高,对反硝化反应的影响越大,对脱氮过程中的微生物也越有利,越能促进反硝化过程的进行。
3.3 外加生物质炭对不同利用方式紫色土N2O、N2排放速率以及反硝化速率的影响本试验结果表明,向土壤中添加生物质炭,会提高土壤的N2排放速率和反硝化速率,N2O排放速率因土壤性质不同而有所差异。土壤的N2排放速率和反硝化速率的增加可能是由于生物质炭的加入为反硝化细菌提供了能源与碳源,使反硝化过程进行得更加完全。贺超卉等[34]研究发现添加少量生物质炭可以促进N2O向N2转化。N2O排放速率在不同土壤中呈现出不同的状况,在茶园土壤中,加入生物质炭对N2O排放速率没有明显的影响,但在果园和耕地土壤中,N2O排放速率随着生物质炭的加入而下降,而在林地土壤中则表现为促进N2O的释放。陈诗轩等[35]通过向石灰性农田土壤添加玉米秸秆生物质炭,发现其会显著促进石灰性农田土壤的N2O排放,而吴璜[36]却发现紫色土土壤N2O累积排放量会因秸秆生物质炭的添加而显著降低,这可能是土壤类型不同而导致的差异。添加生物质炭,一方面有利于维持较高的微生物活性,增加土壤微生物生物量碳和氮含量,促进N2O排放[37],另一方面,生物质炭可以通过吸附NO3–离子的方式来影响氮素转化过程,从而减少N2O排放[4]。添加生物质炭后N2O排放速率最终是增加还是降低,可能是多个过程相互抵消后所呈现出的最终结果。
4 结论不同利用方式紫色土N2O、N2排放速率和反硝化速率均为茶园 > 耕地 > 果园 > 林地,其中,茶园和林地存在显著性差异。不同利用方式紫色土的N2O、N2排放速率和反硝化速率随土壤pH升高而显著下降,但与土壤有机质含量呈显著正相关关系。添加生物质炭对4种土壤的N2排放速率和反硝化速率有一定的促进作用,而N2O排放速率对生物质炭添加的响应因土壤性质而异,其中,生物质炭显著降低了果园和耕地土壤N2O排放速率,对林地土壤表现显著促进作用,但对茶园土壤无显著影响。
| [1] |
陈洁, 骆土寿, 周璋, 等. 氮沉降对热带亚热带森林土壤氮循环微生物过程的影响研究进展[J]. 生态学报, 2020, 40(23): 8528-8538 (  0) 0) |
| [2] |
吕海霞, 杨丹丹, 牛犇. 土壤反硝化作用研究进展[J]. 河南农业, 2020(28): 25 (  0) 0) |
| [3] |
陈吉吉, 荆红卫, 曹文超, 等. 亚硝酸盐添加对土壤硝化和反硝化基因转录活性及N2O排放的影响[J]. 土壤学报, 2023, 60(3): 726-737 (  0) 0) |
| [4] |
张星, 刘杏认, 张晴雯, 等. 生物炭和秸秆还田对华北农田玉米生育期土壤微生物量的影响[J]. 农业环境科学学报, 2015, 34(10): 1943-1950 (  0) 0) |
| [5] |
侯亚红, 王磊, 付小花, 等. 土壤碳收支对秸秆与秸秆生物炭还田的响应及其机制[J]. 环境科学, 2015, 36(7): 2655-2661 (  0) 0) |
| [6] |
张成娥, 刘国彬, 陈小利. 坡地不同利用方式下土壤微生物和酶活性以及生物量特征[J]. 土壤通报, 1999, 30(3): 101-103 (  0) 0) |
| [7] |
陈晨, 许欣, 毕智超, 等. 生物炭和有机肥对菜地土壤N2O排放及硝化、反硝化微生物功能基因丰度的影响[J]. 环境科学学报, 2017, 37(5): 1912-1920 (  0) 0) |
| [8] |
Rutigliano F A, Romano M, Marzaioli R, et al. Effect of biochar addition on soil microbial community in a wheat crop[J]. European Journal of Soil Biology, 2014, 60: 9-15 DOI:10.1016/j.ejsobi.2013.10.007 (  0) 0) |
| [9] |
宋延静, 龚骏. 施用生物质炭对土壤生态系统功能的影响[J]. 鲁东大学学报(自然科学版), 2010, 26(4): 361-365 (  0) 0) |
| [10] |
Zhang A F, Liu Y M, Pan G X, et al. Effect of biochar amendment on maize yield and greenhouse gas emissions from a soil organic carbon poor calcareous loamy soil from Central China Plain[J]. Plant and Soil, 2012, 351(1): 263-275 (  0) 0) |
| [11] |
Ribas A, Mattana S, Llurba R, et al. Biochar application and summer temperatures reduce N2O and enhance CH4 emissions in a Mediterranean agroecosystem: Role of biologically-induced anoxic microsites[J]. The Science of the Total Environment, 2019, 685: 1075-1086 DOI:10.1016/j.scitotenv.2019.06.277 (  0) 0) |
| [12] |
张玉铭, 胡春胜, 张佳宝, 等. 农田土壤主要温室气体(CO2、CH4、N2O)的源/汇强度及其温室效应研究进展[J]. 中国生态农业学报, 2011, 19(4): 966-975 (  0) 0) |
| [13] |
Yi Q, Tang S H, Fan X L, et al. Effects of nitrogen application rate, nitrogen synergist and biochar on nitrous oxide emissions from vegetable field in South China[J]. PLoS One, 2017, 12(4): e0175325 DOI:10.1371/journal.pone.0175325 (  0) 0) |
| [14] |
贾俊香, 熊正琴. 秸秆生物炭对菜地N2O、CO2与CH4排放及土壤化学性质的影响[J]. 生态与农村环境学报, 2016, 32(2): 283-288 (  0) 0) |
| [15] |
唐占明, 刘杏认, 张晴雯, 等. 对比研究生物炭和秸秆对麦玉轮作系统N2O排放的影响[J]. 环境科学, 2021, 42(3): 1569-1580 (  0) 0) |
| [16] |
鲍士旦 . 土壤农化分析(3版)[M].
中国农业出版社, 北京, 2000
(  0) 0) |
| [17] |
苏星源, 吴世杰, 高威, 等. 两种水分含量下生物质炭对黑土N2O排放及硝化反硝化基因丰度的影响[J]. 土壤, 2022, 54(5): 928-935 (  0) 0) |
| [18] |
Liu Q, Zhang Y H, Liu B J, et al. How does biochar influence soil N cycle? A meta-analysis[J]. Plant and Soil, 2018, 426(1): 211-225 (  0) 0) |
| [19] |
Chen Y S, Camps-Arbestain M, Shen Q H, et al. The long-term role of organic amendments in building soil nutrient fertility: A meta-analysis and review[J]. Nutrient Cycling in Agroecosystems, 2018, 111(2): 103-125 (  0) 0) |
| [20] |
Siedt M, Schäffer A, Smith K E C, et al. Comparing straw, compost, and biochar regarding their suitability as agricultural soil amendments to affect soil structure, nutrient leaching, microbial communities, and the fate of pesticides[J]. The Science of the Total Environment, 2021, 751: 141607 DOI:10.1016/j.scitotenv.2020.141607 (  0) 0) |
| [21] |
张珮仪, 温腾, 张金波, 等. 扩散法测定土壤无机氮15N丰度方法优化研究[J]. 土壤学报, 2017, 54(4): 948-957 (  0) 0) |
| [22] |
Nanang Z, 程谊, 张金波. 不同利用方式红壤反硝化势和气态产物排放特征[J]. 土壤, 2020, 52(2): 348-355 (  0) 0) |
| [23] |
周建斌, 陶静静, 赵梦真, 等. 农业生产对石灰性土壤无机碳库损失的影响[J]. 土壤学报, 2022, 59(3): 593-602 (  0) 0) |
| [24] |
汪吉东, 许仙菊, 宁运旺, 等. 土壤加速酸化的主要农业驱动因素研究进展[J]. 土壤, 2015, 47(4): 627-633 (  0) 0) |
| [25] |
Heinen M. Simplified denitrification models: Overview and properties[J]. Geoderma, 2006, 133(3/4): 444-463 (  0) 0) |
| [26] |
Stevens R J, Laughlin R J, Malone J P. Soil pH affects the processes reducing nitrate to nitrous oxide and di-nitrogen[J]. Soil Biology and Biochemistry, 1998, 30(8/9): 1119-1126 (  0) 0) |
| [27] |
ŠImek M, Cooper J E. The influence of soil pH on denitrification: Progress towards the understanding of this interaction over the last 50 years[J]. European Journal of Soil Science, 2002, 53(3): 345-354 DOI:10.1046/j.1365-2389.2002.00461.x (  0) 0) |
| [28] |
Liu B B, Mørkved P T, Frostegård Å, et al. Denitrification gene pools, transcription and kinetics of NO, N2O and N2 production as affected by soil pH[J]. FEMS Microbiology Ecology, 2010, 72(3): 407-417 DOI:10.1111/j.1574-6941.2010.00856.x (  0) 0) |
| [29] |
van Cleemput O. Subsoils: Chemo-and biological denitrification, N2O and N2 emissions[J]. Nutrient Cycling in Agroecosystems, 1998, 52(2): 187-194 (  0) 0) |
| [30] |
郑欠. 土壤水分和pH对N2O排放及同位素特征值影响的机理研究[D]. 北京: 中国农业科学院, 2018.
(  0) 0) |
| [31] |
Koskinen W C, Keeney D R. Effect of pH on the rate of gaseous products of denitrification in a silt loam soil 1[J]. Soil Science Society of America Journal, 1982, 46(6): 1165-1167 DOI:10.2136/sssaj1982.03615995004600060009x (  0) 0) |
| [32] |
谢婉玉, 王永明, 纪红梅, 等. 秸秆还田种类对稻田N2O排放及硝化反硝化微生物的影响[J]. 土壤, 2022, 54(4): 769-778 (  0) 0) |
| [33] |
McLain J E T, Martens D A. N2O production by heterotrophic N transformations in a semiarid soil[J]. Applied Soil Ecology, 2006, 32(2): 253-263 DOI:10.1016/j.apsoil.2005.06.005 (  0) 0) |
| [34] |
贺超卉, 董文旭, 胡春胜, 等. 生物质炭对土壤N2O消耗的影响及其微生物影响机理[J]. 中国生态农业学报(中英文), 2019, 27(9): 1301-1308 (  0) 0) |
| [35] |
陈诗轩, 王朝旭. 玉米秸秆生物炭对石灰性农田土壤反硝化过程N2O排放的影响[C]//中国环境科学学会2021年科学技术年会——环境工程技术创新与应用分会场论文集(四). 天津, 2021: 579–585.
(  0) 0) |
| [36] |
吴璜. 施加秸秆生物炭对紫色土反硝化作用及N2O气体排放的影响研究[D]. 重庆: 重庆大学, 2021.
(  0) 0) |
| [37] |
刘杏认, 张星, 张晴雯, 等. 施用生物炭和秸秆还田对华北农田CO2、N2O排放的影响[J]. 生态学报, 2017, 37(20): 6700-6711 (  0) 0) |
2. Key Laboratory of Investigation and Monitoring, Protection and Utilization for Cultivated Land Resources, Chengdu 611130, China
 2023, Vol. 55
2023, Vol. 55


