2. 中国科学院大学, 北京 100049;
3. 冈山大学资源植物科学研究所, 日本冈山 710-0046
锰是植物生长必需的微量元素,在植物的光合作用、呼吸作用、蛋白质合成和激素活化等过程中起着极其重要的作用。锰在光合系统Ⅱ中参与催化水解反应产生氧的过程,并为光合电子传递链提供电子[1]。锰也是一些酶的辅酶因子,参与植物体内多种酶系统的活动,如超氧化物歧化酶(Mn-SOD)[2]。超氧化物歧化酶可以增强植物应答多种胁迫产生的活性氧(ROS)的清除作用,进而减小植物在氧化应激过程中受到的损伤。同时锰是植物体内重要的氧化还原剂,参与植物体内多种氧化还原过程[3]。
植物主要是通过根系从土壤中吸收锰,然后转运到地上部,分配到不同组织,以满足植物生长需求。土壤中锰的生物有效性受到很多因素的影响[4]。锰的有效性随土壤pH的升高而下降[5],含水量低或孔隙度高的土壤锰有效性低[5-6]。我国北方土壤以石灰质土壤为主,pH呈碱性,土壤含水量低,普遍存在锰缺乏问题[7]。而我国南方酸性土壤pH低,土壤湿度高,还原型性强,锰过量可能使植物遭受锰毒害[8]。不合理的栽培措施如单一作物连续种植、石灰施入量过多、土壤耕作造成土壤板结等也会导致土壤有效锰降低[9]。随着全球变暖,水稻的种植区域北移,加剧了水稻缺锰的状况。在缺锰的情况下,植物的干物质生产、净光合作用以及叶绿素含量都将迅速下降[10]。植物的根系会因缺锰而变得稀疏,地上部生长会明显减缓,严重缺锰时,会导致作物减产或者营养价值降低。
植物正常生长的锰需求量为20 ~ 40 mg/kg,当植物锰含量低于这个范围时,锰供给不足,会造成作物生长发育不良,从而减产。而长期施用微肥可能影响微量元素在农田的分布,从而影响作物的产量和土壤的有机碳结构[11]。相反地,当植物锰含量超过500 mg/kg时,会造成锰中毒[12]。由于植物自身很难移动,植物进化出了不同的机制来维持植物锰的稳态,其中转运蛋白起到了非常重要的作用。转运蛋白主要是通过调控植物锰的吸收、转运和分配等来适应环境中锰的变化。水稻中的两个锰转运蛋白OsNRMAP5和OsMTP9介导锰的吸收和转运,两者分别定位在成熟根区的外皮层和内皮层,但表现出不同的极性,OsNRMAP5位于远端,而OsMTP9在同一细胞的近端侧[13-14]。OsNRMAP5主要介导外皮层细胞吸收锰,而OsMTP9负责将锰从外皮层细胞运输到中柱[14]。OsNRAMP3是水稻体内适应环境中锰含量变化的一个重要转运蛋白。锰含量较低时,OsNRAMP3优先将锰转运至幼叶和穗[15]。液泡膜定位的锰转运蛋白OsMTP8.1和OsMTP8.2可以将过量的锰隔离在根系液泡中,以增强水稻对高锰的耐性[16-17]。HvMTP8.1和HvMTP8.2参与大麦中锰在高尔基体的装载,将锰运输到依赖锰的酶中,或者通过分泌囊泡来促进锰的排出,以此来维持锰的稳态[18]。HvNRAMP5主要在大麦的根部表达,低锰条件下,敲除该基因后的大麦苗期生物量显著降低[19]。HvIRT1在锰从根内皮层运输到中柱的过程中起到了重要作用,并且hvirt1-RNAi株系呈现褪绿表型,茎的锰浓度降低,光合作用减弱[20]。AtNRAMP3可以在缺锰条件下将液泡中的锰输出,进而维持光合速率和正常生长[21]。ZmNRAMP2在低锰胁迫下的作用和AtNRAMP3类似,主要是将木质部薄壁细胞液泡中的锰释放出来,从而增加锰向地上部的移动[22]。
水稻和小麦是我国主要的粮食作物,其产量和品质对中国的粮食安全和国民健康具有重要意义。目前,二者对缺锰胁迫的耐性差异并不清楚。因此,本试验选取水稻(品种为日本晴)和小麦(品种为Fielder)为试验材料,研究水稻和小麦对缺锰的耐性差异,并对其耐缺锰的机理进行解析。本研究对水稻和小麦应对土壤缺锰胁迫具有重要意义,也可为培育耐低锰的作物品种提供理论基础,为实现我国粮食增产、营养均衡提供新线索。
1 材料与方法 1.1 水稻和小麦培养方法供试水稻材料品种为日本晴,小麦材料品种为Fielder。本试验采取水培方式培养幼苗。首先,将水稻和小麦种子浸泡于水中,分别置于30、25 ℃暗室中培养2 d。然后,将已发芽的小麦和水稻幼苗转移至浮网上,浮网放置于0.5 mmol/L CaCl2溶液中,覆上锡箔纸进行遮光培养。水稻置于生长室(30 ℃ 16 h光照/25 ℃ 8 h黑暗,湿度70%,光照强度50 000 lux)培养,小麦置于普朗克植物培养箱(22 ℃ 16 h光照/ 18 ℃ 8 h黑暗,湿度65%,光照强度30 000 lux)培养。苗龄为5 d后,掀开锡箔纸,并将水稻和小麦置于营养液中培养。苗龄为14 d时,对以上幼苗采取缺锰(–Mn, 0 μmol/L)和加锰(+Mn, 0.5 μmol/L)处理,处理21 d后收样。
营养液中含大量元素(mmol/L):MgSO4·7H2O (0.5),KNO3 (0.05),CaNO3·4H2O (0.72)和KH2PO4 (0.5),以及微量元素(μmol/L):Fe(Ⅲ)-EDTA (100),MnCl2·4H2O (0.5),CuSO4·5H2O (0.2),ZnSO4·7H2O (0.4),H3BO3 (3)和(NH4)6Mo7O24·4H2O (1)。
1.2 水稻和小麦取样方法和生理指标测定苗龄14 d时,分别选取3颗水稻和小麦幼苗,处理前进行取样。首先,将水稻根部在4 ℃的0.5 mmol/L CaCl2溶液中浸泡15 min,以减少水稻根部的阳离子交换。然后,将幼苗分成根、基部节和不同叶片进行取样。接着,将长势相近的水稻和小麦平均分成两盆,分别进行缺锰和加锰处理。处理21 d后进行取样,按照上述流程,选取3颗幼苗,测量根长、地上部高度和最新伸展出的叶片的SPAD值,然后将幼苗分成根、基部节、不同叶片样品,并拍照记录植株整体长势。
取样后将样品置于70 ℃烘箱烘至恒重,然后用硝酸进行消煮,采用ICP-MS(PerkinElmer NexION 1000)测定各样品的锰、铁、铜、锌含量。
单株锰积累量(mg/plant)=植株总锰含量(mg/kg)×植株干质量(kg/plant)
锰的根向地上部转运率(%)=(地上部锰积累量(mg))/(植株总锰积累量(mg))×100
各部位锰分配(%)=(各部位锰积累量(mg))/(植株总锰积累量(mg))×100
锰的再分配(mg/plant)=缺锰处理后锰积累量(mg/plant)–缺锰处理前锰积累量(mg/plant)
锰的再分配率(%)=(各部位缺锰处理后锰积累量(mg)–各部位缺锰处理前锰积累量(mg))/(缺锰处理前总锰积累量(mg))×100
1.3 RNA提取和第一链cDNA的合成取苗龄14 d的水稻和小麦根部和基部节样品,每个处理3个重复。取样完成后立即将样品放入液氮速冻,然后提取RNA。RNA提取方法采用TRIZOL法[23]。RNA提取结束后,采用HiScript Ⅱ Q RT SuperMix for qPCR (+gDNA wiper)反转录试剂盒(Vazyme,货号R323-01)进行反转录。反转录后的产物即样品的cDNA用于后续的绝对定量试验。
取水稻和小麦基部节的RNA样品作为模板进行第一链cDNA的合成反应,按照PrimeScriptTM 1st Strand cDNA Synthesis第一链合成系统(Takara,货号6110A)操作,得到的cDNA用于克隆目的基因。
1.4 目的基因序列获取及克隆基因全长获取参照前人的方法[24]。具体有如下步骤:首先,使用RAP-DB (https://rapdb.dna.affrc.go.jp/tools/search/)的基因搜索工具查找水稻的OsNRAMP3、OsNRAMP2、OsMTP8.1、OsMTP8.2、OsMTP9的基因序列。以上基因的信息见表 1。获得以上基因的全长序列后将其在小麦数据库(http://wheatomics.sdau.edu.cn/blast/blast.html)进行比对,得到以上基因在小麦中的同源序列,即TaNRAMP3、TaNRAMP2、TaMTP8.1、TaMTP8.2、TaMTP9等小麦基因序列。以合成后的第一链cDNA为模板,进行以上目的片段的克隆。反应体系为:上下引物各1 μL,2 × Phanta® Max Master Mix 10 μL,cDNA 2 μL,ddH2O 6 μL。水稻目的片段克隆引物序列见表 1,小麦目的片段克隆引物序列见表 2。通过琼脂糖凝胶电泳检测片段大小,然后利用FastPure Gel DNA Extraction Mini Kit (Vazyme,货号DC301-1)进行凝胶产物回收。将回收产物连接进入pYES2载体中,然后转入大肠杆菌中进行扩繁。将菌液交由生工生物工程股份有限公司进行测序。测序结果与所需目的片段吻合后,采用质粒小提试剂盒FastPure® Plasmid Mini Kit (Vazyme,货号DC201-1)提取质粒。
|
|
表 1 水稻目的片段扩增用引物 Table 1 Primers for target fragment amplification in rice |
|
|
表 2 小麦目的片段扩增用引物 Table 2 Primers for target fragment amplification in wheat |
将上述质粒以10倍的浓度梯度进行稀释,依次稀释至10–7,得到浓度分别为原始模板浓度、原始浓度的1/10、1/102、1/103、1/104、1/105和1/106的稀释标准样品,将这些样品作为模板,进行下述实时荧光定量PCR反应。实时荧光定量PCR结果采用2–ΔΔCt法。以质粒拷贝数的对数值为横坐标,以测得的Ct值为横坐标绘制标准曲线。
1.6 实时荧光定量PCR扩增实时荧光定量PCR采用Applied Biosystems™ QuantStudio™ 3 (Thermo Fisher,货号A665)实时荧光定量PCR仪进行,5 μL体系中包含以下成分:ChamQ Universal SYBR qPCR Master Mix(Vazyme,货号Q711-02)2.5 μL,正反引物各0.1 μL,模板2 μL,ddH2O 0.3 μL。荧光定量PCR引物见表 3。荧光定量PCR的反应条件:95 ℃预变性30 s;95 ℃ 10 s,60 ℃ 30 s,40个循环;95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。分别以水稻和小
麦cDNA样品为模板,进行实时荧光定量PCR反应。根据标准曲线可以计算水稻和小麦样品中目的基因的拷贝数。
| $ \begin{array}{l}{\rm{拷贝数}}\left({\rm{copies}}/{\rm{ngRNA}}\right)=\\ \frac{6.02\times {10}^{23}({\rm{copies}}/{\rm{mol}})\times {\rm{样品浓度}}({\rm{g}}/{\rm{mL}})}{{\rm{碱基数}}\times 660({\rm{g}}/{\rm{mol}})\times {\rm{RNA}}\left({\rm{ng}}/{\rm{mL}}\right)}\end{array} $ |
|
|
表 3 实时荧光定量PCR引物 Table 3 Primers for real-time quantitative PCR |
数据采用SPSS 16.0软件进行统计分析,采用独立样本t-检验分析各指标的差异显著性。使用Excel软件绘图。
2 结果与分析 2.1 水稻和小麦对缺锰胁迫的耐性差异为明确水稻和小麦对缺锰胁迫的耐性差异,本研究比较了缺锰(–Mn)和加锰(+Mn)处理下水稻和小麦的生长情况。结果发现,与加锰处理相比,缺锰处理的水稻幼苗根长无显著变化(图 1A和图 1B),地上部高度下降了9.2%(图 1C)。比较第七片叶(最新完全展开叶片)的SPAD值发现,缺锰处理比加锰处理显著降低了19.9%(图 1D)。进一步将水稻分成不同部位观察发现,缺锰处理水稻长出的最新叶片(第八片叶)比加锰处理的要小(图 1A)。小麦在缺锰培养21 d后,植株的表型与加锰处理没有显著差异(图 1E)。与表型相一致的是,小麦的根长、地上部高度和最新完全展开叶片(第六片叶)的SPAD值在缺锰和加锰处理间没有显著差异(图 1B、图 1C和图 1D)。以上结果表明水稻受缺锰胁迫的影响较大,而小麦受缺锰的影响相对较小。
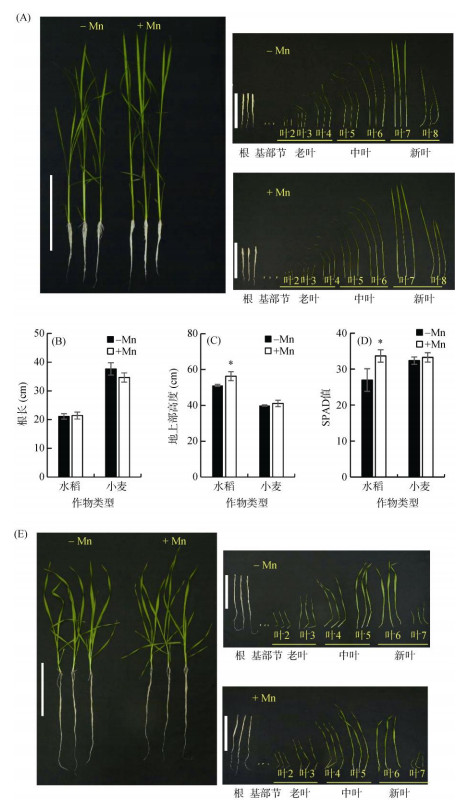
|
(A:水稻在加锰(+Mn)和缺锰(–Mn)条件下的生长情况;B:水稻和小麦根长;C:水稻和小麦地上部高度;D:水稻和小麦最新展开叶片的SPAD值;E:小麦在加锰和缺锰条件下的生长情况。图柱上方*号表示不同锰处理下植株间差异达P < 0.05显著水平,下同) 图 1 水稻和小麦对缺锰胁迫的耐性差异 Fig. 1 Differences of response to Mn deficiency stress between rice and wheat |
为便于对水稻和小麦各部位的生物量和元素含量进行分析,根据缺锰处理前后水稻和小麦的叶片总数,将叶片分为老叶(水稻为第二片叶至第四片叶,小麦为第二片叶和第三片叶)、中叶(水稻为第五片叶和第六片叶,小麦为第四片叶和第五片叶)和新叶(水稻为第七片叶和第八片叶,小麦为第六片叶和第七片叶)。结果发现,缺锰培养的水稻根部、中叶和新叶的生物量显著低于加锰培养的水稻,其中新叶的生物量降低了44%(图 2A)。对于整个植株,缺锰培养的水稻根和地上部的生物量均显著低于加锰培养的水稻,分别降低了16.7% 和20.7%(图 2A)。小麦各部位的生物量没有受到缺锰的影响(图 2B)。另外,缺锰条件下,水稻根冠比显著低于加锰处理,而小麦根冠比与加锰处理间没有差异(图 2C)。这些结果表明缺锰影响了水稻的生物量,对小麦生物量影响不大,小麦对缺锰胁迫的耐性比水稻更强。
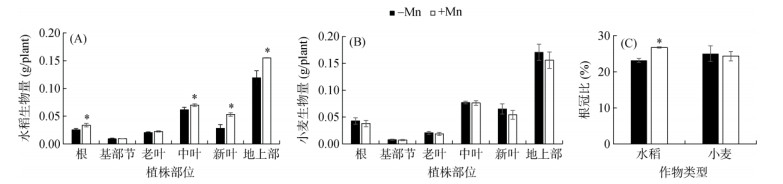
|
图 2 缺锰对水稻和小麦生物量和根冠比的影响 Fig. 2 Effects of Mn deficiency on biomass and root-to-shoot ratios of rice and wheat |
与加锰处理相比,总体上缺锰处理的水稻和小麦各部位锰含量均显著下降(图 3A和图 3B)。缺锰处理下,水稻根、基部节、新叶、中叶和老叶中锰含量分别比加锰处理降低了48.5%、89.5%、78.8%、94.3% 和84.6%(图 3A)。小麦根、基部节、新叶、中叶和老叶中锰含量在缺锰条件下比加锰分别降低了94.9%、84.4%、79.1%、92.1% 和75%(图 3B)。其中,缺锰条件下,水稻和小麦新叶中锰含量分别为5.6 mg/kg(图 3A)和8.2 mg/kg(图 3B)。而缺锰时仅水稻新叶的SPAD值降低(图 1D),表明小麦耐缺锰的能力比水稻更强。
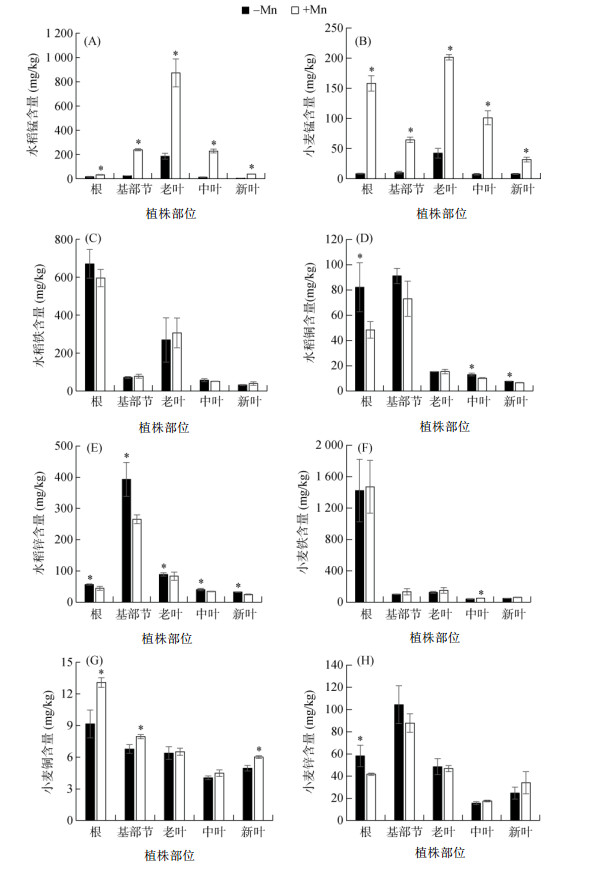
|
图 3 缺锰对水稻和小麦不同部位锰、铁、铜和锌含量的影响 Fig. 3 Effects of Mn deficiency on concentrations of Mn, Fe, Cu and Zn in different parts of rice and wheat |
对水稻和小麦在加锰和缺锰条件下各部位铁、铜和锌含量进行分析,结果发现,与加锰处理相比,水稻在缺锰条件下的各部位铁含量无显著差异(图 3C),而铜在根、中叶和新叶中的含量显著升高(图 3D),锌含量在水稻的各部位均有所增加,其中在基部节中增加量最为显著(增加了48.3%)(图 3E)。而在小麦中,与加锰处理相比,缺锰处理的各部位铁含量均无显著差异(除中叶铁含量略有下降外)(图 3F),根、基部节和新叶中的铜含量显著降低(图 3G),根中的锌含量显著升高,而其他部位的锌含量无显著差异(图 3H)。
2.3 缺锰对水稻和小麦锰转运、分配和再分配的影响根据根和地上部的锰含量和生物量计算单株锰积累量,结果发现,与加锰处理相比,缺锰处理水稻和小麦的锰积累量分别降低了86.6% 和84.3%(图 4A)。不管是在加锰还是在缺锰条件下,小麦的锰积累量均比水稻的要低(图 4A)。但与加锰处理相比,缺锰处理小麦和水稻中锰从根向地上部的转运率分别增加和降低了16.4% 和7.5%(图 4B)。表明缺锰时,与水稻相比,小麦可将更多的锰从根中转运到地上部。同时分析不同部位锰的分配发现,缺锰时增加了锰向水稻根和老叶的分配,减少了基部节、中叶和新叶中锰的积累(图 4C);而缺锰降低了锰向小麦根和中叶的分配,增加了锰在老叶和新叶的积累(图 4D)。表明缺锰时,小麦从根中运输到地上部的锰,主要是运往老叶和新叶中。
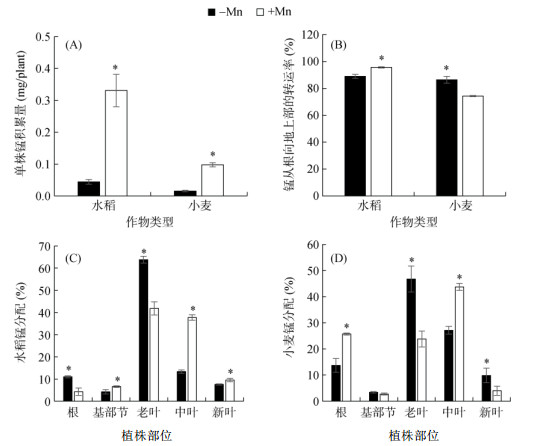
|
图 4 缺锰对水稻和小麦锰吸收、转运和分配的影响 Fig. 4 Effects of Mn deficiency on Mn uptake, transport and distribution in rice and wheat |
另外,为进一步研究水稻和小麦中锰的再分配情况,本研究比较了缺锰处理前后锰的积累和再分配率,结果发现,缺锰处理后水稻和小麦单株锰积累量约为缺锰处理前的2倍(图 5A),表明水稻和小麦缺锰过程中锰积累量差异不大。缺锰21 d后,水稻基部节和老叶中8.1% 的锰再分配到了根、中叶和新叶中(图 5B)。而在小麦中,根和基部节中36.2% 的锰得到了再利用,再分配到了老叶、中叶和新叶中,锰含量分别下降了35.6% 和0.6%(图 5C)。表明在缺锰条件下,水稻中主要是基部节和老叶中的锰得到了再利用,迁移到了根、中叶和老叶中;而小麦的老叶、中叶和新叶中的锰主要来自根部。
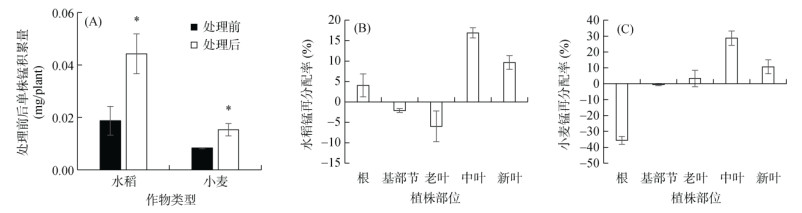
|
图 5 水稻和小麦中锰的再分配 Fig. 5 Redistribution ratios of Mn in rice and wheat |
绝对实时荧光定量PCR结果发现,转运基因NRAMP3、MTP8.2和MTP9在水稻根中的拷贝数是小麦的9.1倍、103.1倍和3.9倍(图 6A、图 6B和图 6C)。MTP8.1在水稻和小麦中的拷贝数则无显著差异(图 6D)。小麦根中TaNRAMP2的拷贝数是水稻OsNRAMP2的3.8倍~ 5.1倍(图 6E),表明NRAMP3、MTP8.2和MTP9在水稻根中的表达量比小麦高,而小麦中TaNRAMP2的表达量比水稻OsNRAMP2更高。
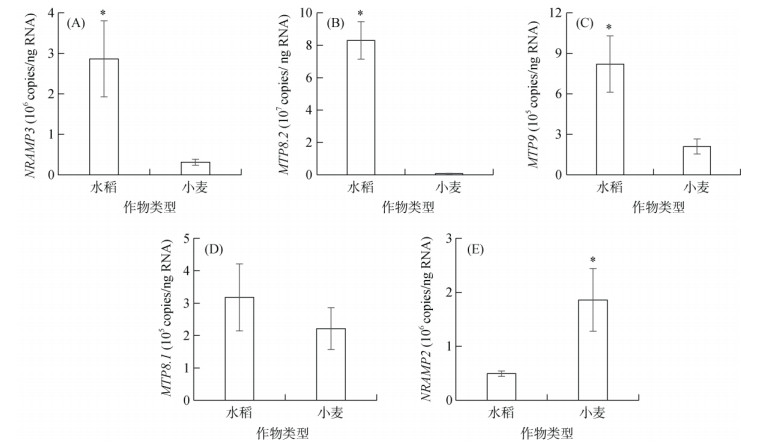
|
图 6 水稻和小麦根中不同锰转运基因的表达量 Fig. 6 Expression levels of Mn transporters in rice and wheat roots |
锰在植物体内发挥着不可替代的作用。缺锰会影响作物生长,严重时可导致植物产量下降。不同作物以及相同作物不同品种对缺锰胁迫的耐性有差异[9],但其中的机理并不十分清楚。研究耐缺锰的机制将有助于提高作物对锰有效性低的土壤的适应能力。本研究通过比较苗期水稻和小麦对缺锰胁迫的耐性,发现小麦比水稻更耐缺锰,这主要是由于缺锰时,小麦根中TaNRAMP2的表达量比水稻OsNRAMP2更高,可以将根中的锰更多地运输到地上部,特别是新叶。
小麦比水稻更耐缺锰胁迫主要有以下几个证据支撑:①小麦地上部株高在缺锰和加锰处理间没有差异,而水稻缺锰时的地上部株高比加锰时要小(图 1);②小麦根和地上部的生物量在缺锰和加锰处理间没有差异,而水稻缺锰时的生物量比加锰时要小(图 2);③小麦最新展开叶片的SPAD值在缺锰和加锰处理间没有差异,而水稻缺锰时最新展开叶片的SPAD值比加锰时要小(图 1D)。小麦的锰累积量比水稻低(图 4A),这可能是因为负责锰吸收的转运蛋白NRAMP5在小麦中的表达比水稻中低[25]。但与加锰相比,缺锰增加小麦中锰从根向地上部的转运(图 4B),同时增加了锰向新叶的分配(图 4D)。再分配试验结果发现,缺锰时小麦主要是根中的锰得到再利用,向地上部转运(图 5C);而缺锰减少了水稻锰从根向地上部的转运(图 4B),也降低了锰向新叶的分配(图 4C),缺锰时水稻主要是基部节和老叶中的锰得到了再利用(图 5B)。表明小麦比水稻更耐缺锰的原因主要是小麦根中的锰可以得到再利用,可以向地上部转运。
为探究缺锰时小麦根中的锰更易得到再利用的原因,本研究比较了水稻和小麦根中相关锰转运基因的绝对表达量,包括锰吸收转运基因MTP9,锰分配转运基因NRAMP3[13, 21],锰液泡储存转运基因MTP8.1/8.2[16-17]和锰液泡外排转运基因NRAMP2[22, 26]。本研究发现,锰吸收转运基因MTP9和锰分配转运基因NRAMP3在水稻中的表达量比小麦高,而小麦中锰的转运率却比水稻高,这可能是因为MTP9和NRAMP3的锰转运活性在小麦中比在水稻中高。水稻中锰液泡储存转运基因MTP8.2的表达量比小麦高(图 6B),增加了锰在水稻根中储存,从而降低锰从水稻根中向地上部转运。另一方面,小麦中TaNRAMP2的拷贝数显著高于水稻OsNRAMP2(图 6E)。有研究发现,NRAMP2在水稻和玉米中均定位于液泡膜[22, 26]。且在缺锰条件下,敲除玉米ZmNRAMP2降低了锰从根向地上部的转运,造成地上部锰含量显著降低[22],这主要是因为ZmNRAMP2负责将液泡中的锰运到细胞质,使得缺锰条件下液泡中储存的锰得到再利用,表明NRAMP2对玉米应对缺锰胁迫发挥了重要作用。因此,小麦根中TaNRAMP2的高表达,有助于缺锰状态下小麦根部液泡中锰的输出并转运至地上部,从而维持小麦在缺锰条件下的正常生长。
本研究主要比较了苗期水稻和小麦对缺锰耐性的差异,而不同生育期作物对缺锰耐性的能力是否存在差异,以及不同作物及相同作物不同品种间对缺锰的耐性差异也不清楚。因此,对不同作物以及相同作物不同品种间在不同生育期对缺锰耐性的机制研究将有利于提高作物应对缺锰胁迫的能力。
4 结论小麦幼苗对缺锰胁迫的耐性比水稻高,主要是通过调控锰转基因NRAMP2在根中的表达,增加缺锰条件下小麦根中锰的再利用,进而保证幼苗的正常生长。本研究揭示了水稻和小麦耐缺锰性差异的机理,可为筛选耐低锰的作物品种提供新的理论依据。
| [1] |
Schmidt S B, Jensen P E, Husted S. Manganese deficiency in plants: The impact on photosystem Ⅱ[J]. Trends in Plant Science, 2016, 21(7): 622-632 DOI:10.1016/j.tplants.2016.03.001 (  0) 0) |
| [2] |
Bowler C, Slooten L, Vandenbranden S, et al. Manganese superoxide dismutase can reduce cellular damage mediated by oxygen radicals in transgenic plants[J]. The EMBO Journal, 1991, 10(7): 1723-1732 DOI:10.1002/j.1460-2075.1991.tb07696.x (  0) 0) |
| [3] |
许文博, 邵新庆, 王宇通, 等. 锰对植物的生理作用及锰中毒的研究进展[J]. 草原与草坪, 2011, 31(3): 5-14 (  0) 0) |
| [4] |
江胜国, 詹华明, 刘广明, 等. 天津小站稻种植区土壤主要微量营养元素的有效量及其影响因素[J]. 土壤, 2021, 53(6): 1215-1220 (  0) 0) |
| [5] |
胡厚军, 万松华, 何晓燕, 等. 浅析影响土壤铜铁锰锌钼有效性的因素[J]. 农业与技术, 2014, 34(2): 23-24 (  0) 0) |
| [6] |
刘鑫, 雷宏军, 朱端卫. 变动氧化还原状况下酸性土壤中活性锰的变化[J]. 土壤学报, 2008, 45(4): 734-739 (  0) 0) |
| [7] |
丁燕芳, 赵凤霞, 米琳, 等. 豫中植烟土壤有效态微量元素与pH和有机质的关系[J]. 土壤, 2022, 54(1): 88-94 (  0) 0) |
| [8] |
吴名宇, 李顺义, 张杨珠. 土壤锰研究进展与展望[J]. 作物研究, 2005, 19(2): 137-142 (  0) 0) |
| [9] |
Barman A, Pandey R N, Singh B, et al. Manganese deficiency in wheat genotypes: Physiological responses and manganese deficiency tolerance index[J]. Journal of Plant Nutrition, 2017, 40(19): 2691-2708 DOI:10.1080/01904167.2017.1381717 (  0) 0) |
| [10] |
Shenker M, Plessner O E, Tel-Or E. Manganese nutrition effects on tomato growth, chlorophyll concentration, and superoxide dismutase activity[J]. Journal of Plant Physiology, 2004, 161(2): 197-202 DOI:10.1078/0176-1617-00931 (  0) 0) |
| [11] |
张艳, 胡亚鲜, 郭胜利. 长期施用微肥条件下微量元素和有机官能团在团聚体中的积累特征[J]. 土壤学报, 2022, 59(5): 1420-1431 (  0) 0) |
| [12] |
Shao J F, Yamaji N, Shen R F, et al. The key to Mn homeostasis in plants: Regulation of Mn transporters[J]. Trends in Plant Science, 2017, 22(3): 215-224 DOI:10.1016/j.tplants.2016.12.005 (  0) 0) |
| [13] |
Sasaki A, Yamaji N, Yokosho K, et al. Nramp5 is a major transporter responsible for manganese and cadmium uptake in rice[J]. The Plant Cell, 2012, 24(5): 2155-2167 DOI:10.1105/tpc.112.096925 (  0) 0) |
| [14] |
Ueno D, Sasaki A, Yamaji N, et al. A polarly localized transporter for efficient manganese uptake in rice[J]. Nature Plants, 2015, 1: 15170 DOI:10.1038/nplants.2015.170 (  0) 0) |
| [15] |
Yang M, Zhang W, Dong H X, et al. OsNRAMP3 is a vascular bundles-specific manganese transporter that is responsible for manganese distribution in rice[J]. PLoS One, 2013, 8(12): e83990 DOI:10.1371/journal.pone.0083990 (  0) 0) |
| [16] |
Chen Z H, Fujii Y, Yamaji N, et al. Mn tolerance in rice is mediated by MTP8.1, a member of the cation diffusion facilitator family[J]. Journal of Experimental Botany, 2013, 64(14): 4375-4387 DOI:10.1093/jxb/ert243 (  0) 0) |
| [17] |
Takemoto Y, Tsunemitsu Y, Fujii-Kashino M, et al. The tonoplast-localized transporter MTP8.2 contributes to manganese detoxification in the shoots and roots of Oryza sativa L[J]. Plant and Cell Physiology, 2017, 58(9): 1573-1582 DOI:10.1093/pcp/pcx082 (  0) 0) |
| [18] |
Pedas P, Schiller Stokholm M, Hegelund J N, et al. Golgi localized barley MTP8 proteins facilitate Mn transport[J]. PLoS One, 2014, 9(12): e113759 DOI:10.1371/journal.pone.0113759 (  0) 0) |
| [19] |
Wu D Z, Yamaji N, Yamane M, et al. The HvNramp5 transporter mediates uptake of cadmium and manganese, but not iron[J]. Plant Physiology, 2016, 172(3): 1899-1910 DOI:10.1104/pp.16.01189 (  0) 0) |
| [20] |
Long L Z, Persson D P, Duan F Y, et al. The iron-regulated transporter 1 plays an essential role in uptake, translocation and grain-loading of manganese, but not iron, in barley[J]. The New Phytologist, 2018, 217(4): 1640-1653 DOI:10.1111/nph.14930 (  0) 0) |
| [21] |
Lanquar V, Ramos M S, Lelièvre F, et al. Export of vacuolar manganese by AtNRAMP3 and AtNRAMP4 is required for optimal photosynthesis and growth under manganese deficiency[J]. Plant Physiology, 2010, 152(4): 1986-1999 DOI:10.1104/pp.109.150946 (  0) 0) |
| [22] |
Guo J X, Long L Z, Chen A L, et al. Tonoplast-localized transporter ZmNRAMP2 confers root-to-shoot translocation of manganese in maize[J]. Plant Physiology, 2022, 190(4): 2601-2616 DOI:10.1093/plphys/kiac434 (  0) 0) |
| [23] |
陈星, 汪琦, 黄迎春, 等. 水稻颖果总RNA提取方法的研究[J]. 北京师范大学学报(自然科学版), 2005, 41(1): 79-81 (  0) 0) |
| [24] |
Zhang H, Ma J, Liu J J, et al. Molecular characterization of the TaWTG1 in bread wheat (Triticum aestivum L.)[J]. Gene, 2018, 678: 23-32 DOI:10.1016/j.gene.2018.08.010 (  0) 0) |
| [25] |
Sui F Q, Chang J D, Tang Z, et al. Nramp5 expression and functionality likely explain higher cadmium uptake in rice than in wheat and maize[J]. Plant and Soil, 2018, 433(1): 377-389 (  0) 0) |
| [26] |
Li Y, Li J J, Yu Y H, et al. The tonoplast-localized transporter OsNRAMP2 is involved in iron homeostasis and affects seed germination in rice[J]. Journal of Experimental Botany, 2021, 72(13): 4839-4852 DOI:10.1093/jxb/erab159 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Institute of Plant Science and Resources, Okayama University, Kurashiki 710-0046, Japan
 2023, Vol. 55
2023, Vol. 55


