2. 中国科学院大学, 北京 100049;
3. 南京林业大学林学院, 南京 210037;
4. 南京师范大学地理科学学院, 南京 210023
小麦是世界上食用最广泛的粮食,养活了全球超过1/3的人口[1]。随着全世界人口增长,粮食需求与日俱增。同时,气候变化和土地退化等问题也正在威胁粮食安全[2]。
生物质炭(生物质废弃物在无氧或限氧条件下热解炭化生产的材料)添加被认为是具有增加土壤碳库和缓解气候变化潜力的措施[3]。此外,生物质炭在改良土壤和提高作物生产力等附加价值方面的报导也越来越多[4-6]。但是生物质炭对作物生产的影响是剂量依赖的,不合理施用甚至会降低作物产量[7]。例如,Mia等人[8]通过盆栽试验发现当一次性施用120 t/hm2草木生物质炭时,显著降低了苜蓿产量。Baronti等人[4]在盆栽试验中发现了一次性施用60 t/hm2木材生物质炭时显著提高了Lolium perenne地上部生物量,当施用量超过100 t/hm2时无增产效果,甚至在施用120 t/hm2时造成减产。然而,在以每季2.25和22.5 t/hm2生物质炭连续施用的盆栽试验中观察到小麦产量持续提高,但增产效果有下降趋势[5]。因此,通过长期田间试验来研究生物质炭连续施用对作物生产的影响具有重要意义。
土壤微生物是土壤养分循环重要推动者,对维持土壤肥力有重要意义[7]。秸秆还田和添加生物质炭等农田管理措施会改变土壤生境,影响土壤微生物群落组成、结构和多样性,进而改变土壤微生物群落的功能[9]。由于土壤pH、总有机碳(SOC)和碳氮比(C/N)等因素的变化,在弱酸性水稻土中施用生物质炭显著增加了细菌alpha多样性和改变了群落组成,最终降低微生物代谢熵[10]。在玉米–小麦系统中一次性施用生物质炭4 a后显著降低了细菌群落丰度9% ~ 36%。细菌群落中,碳矿化率较低的Chloroflexi类群相对丰度增加被认为更有利于土壤碳的维持和提高[11]。然而,这些短期的、一次性的施加生物质炭并不能预示土壤微生物群落结构和功能对多次连续施用的响应,需要长期田间试验来研究生物质炭施用对土壤微生物群落的影响。
本研究基于玉米秸秆及其生物质炭连续施用的长期定位试验,结合16S核糖体RNA基因(16S rRNA)和内转录间隔区1(ITS1)高通量测序技术,重点比较了秸秆和生物质炭还田对土壤性质改良、小麦产量提升以及微生物群落结构和功能的影响。
1 材料与方法 1.1 试验区概况试验地位于江苏省扬州市江都区小纪镇良种繁育基地(119°42′E,32°35′N),试验区属于亚热带季风气候,年平均气温14.7 ℃,年平均降水量1 140 mm。
田间试验始于2010年,各小区面积为10 m2 (4 m × 2.5 m)。试验地土壤类型为下位砂姜土(中国土壤发生分类)或始成土(美国土壤系统分类)。土壤砂粒、粉粒和黏粒分别为20%、58% 和22%。试验开始前0 ~ 15 cm土壤基本理化性质、供试玉米秸秆和生物质炭的性质见表 1。
|
|
表 1 供试土壤、玉米秸秆和玉米秸秆生物质炭的基本性质 Table 1 Basic properties of tested soil, maize straw, and biochar derived maize straw |
试验共设置5个处理:不添加玉米秸秆及其生物质炭(CK),6 t/(hm2·a) 玉米秸秆还田(Straw),低剂量(2.4 t/(hm2·a))、中剂量(6 t/(hm2·a))和高剂量(12 t/(hm2·a))玉米秸秆生物质炭还田(分别记为BC1、BC3和BC5)。每个处理3个重复,共计15个小区,采用随机完全区组设计。生物质炭采用炭化炉(专利号ZL200920232191.9)[12]在400 ℃热解温度下生产。BC1处理用炭量相当于将6 t玉米秸秆全部炭化(400 ℃条件下产炭率约为40%)。秸秆和生物质炭在每年小麦播种前均匀翻入0 ~ 15 cm土层中,截至2021年小麦收获,秸秆还田或施炭共11次。小麦条播,播种量为200粒/行,行距25 cm。各处理均按当地习惯施肥,氮肥(以N计)180 kg/hm2,按3 : 4 : 3的比例分别在播种、分蘖期和拔节期施用;磷肥(以P2O5计)、钾肥(以K2O计)均为50 kg/hm2通过复合肥以基肥的方式施入。其他除草和病虫害防治等措施均与当地相同。
1.3 样品采集与土壤理化性质测定2021年6月小麦成熟后,在每个小区中间人工收割3行,脱粒、晒干后称重计产。
小麦收获后,在每个小区内按“S”形路线用直径5 cm土钻采集0 ~ 15 cm土壤样品5个,捏碎混合成一个土壤样品。新鲜土壤样品过2 mm筛,一部分保存于–40℃冰箱用于土壤DNA提取,其余部分自然风干用于土壤基本理化性质测定。
土壤容重(BD)用环刀法测定,田间持水量(WHC)用威尔科克斯法测定,pH以1 : 2.5土液比(m : V)用pH计(Mettler-Toledo Inc,Columbus,OH,USA) 测定。土壤全碳(TC)和全氮(TN)含量通过元素分析仪(Perkin Elmer 2400,Series II CHNS/O analyzer,Perkin Elmer Inc.,Waltham,MA,USA) 测定。全磷(TP)通过H2SO4-HClO4消煮–钼锑抗比色法测定,全钾(TK)用H2SO4-HF消煮–火焰光度法测定,碱解氮(AN)用碱解扩散法测定,有效磷(AP)用0.5 mol/L pH 8.5 NaHCO3浸提–钼锑抗比色法测定,速效钾(AK)用醋酸铵–火焰光度计法测定[13]。
1.4 土壤DNA提取与高通量测序称取0.5 g鲜土样,使用FastDNA Spin kit for soil(MP Biomedicals,Cleveland,OH,USA)提取土壤样品总DNA。通过ND-1000 UV-Vis微量紫外/可见分光光度计(NanoDrop ND-1000,NanoDrop Technologies,Wilmington,USA)测定DNA纯度和浓度,然后将合格的DNA保存于–20 ℃备用。
采用细菌通用引物515F (5′GTGCCAGCMGCCGCGGTAA-3′)/907R (5′-CCGTCAATTCCTTTGAGTTT-3′) 对细菌16S rRNA基因(V4 ~ V5)区,和真菌通用引物ITS1F (5′-CTTGGTCATTTAGAGGAAGTAA-3′)/ITS2 (5′-GCTGCGTTCTTCATCGATGC-3′)对真菌ITS1基因进行扩增。添加barcode、核酸纯化磁珠纯化后等摩尔浓度混合后,通过Illumina Miseq PE250测序平台(Illumina,San Diego,CA,USA),2×250 bp的双端测序策略对文库进行测序。
原始序列按barcode拆分,经质控和拼接后获得高质量序列(平均质量分数 > 25且序列长度 > 200 bp)。将高质量序列导入QIIME2(https://qiime2.org/)中,经过“q2-vsearch”插件去重复、97% 相似性de-novo聚类、去除嵌合体后获得OUT表和代表性序列,通过“q2-feature-classifier”插件训练分类器并对代表性序列进行物种注释,至少在20% 以下的样本数中出现且序列数之和≥5的OTUs用于下游分析。最终,一共获得6 128个细菌OTUs和1 221个真菌OTUs。
1.5 原核微生物群落功能预测使用PICRUSt2 (Phylogenetic Investigation of Communities by Reconstruction of Unobserved States)软件包以KEGG数据库对原核微生物群落功能进行预测,鉴别出组间具有显著差异(P < 0.05)的功能基因用于后续分析。
1.6 数据处理所有数据分析在R 4.0.4中进行。使用‘microeco’软件包进行微生物群落组成,α和β多样性分析;使用‘agricolae’软件包进行单因素方差分析或Kruskal-Wallis检验;基于‘ggplot2’软件包进行数据可视化。
2 结果 2.1 小麦产量与土壤理化性质不同处理小麦产量如表 2所示。高剂量生物质炭处理(BC5)显著提高了小麦产量。总体上,生物质炭添加平均提高小麦产量15%。
|
|
表 2 不同处理小麦产量和土壤理化性质 Table 2 Wheat yields and soil physiochemical properties under different treatments |
秸秆还田和生物质炭添加显著提高了土壤肥力(表 2)。与CK处理相比,中等剂量(BC3)和高剂量(BC5)生物质炭还田显著降低了土壤容重和提高了土壤田间持水量。秸秆和生物质炭还田并未显著提高土壤pH。土壤TC、TN和TP均随着生物质炭的添加量增加而增加。土壤TK在各处理间差异不显著,但与CK和Straw处理相比,生物质炭添加显著提高了AK含量。与CK处理相比,Straw处理未显著提高土壤AP含量,但添加生物质炭处理土壤AP含量显著提高。
2.2 微生物群落组成秸秆和生物质炭还田对土壤细菌群落组成有显著影响。在门分类水平上,变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)和厚壁菌门(Firmicutes)占绝对优势,累计相对丰度超过80%(图 1A)。其中,Proteobacteria相对丰度随生物质炭添加量增加而增加,而Firmicutes和Actinobacteria相对丰度随生物质炭添加而降低(图 1A)。真菌群落在门水平上相对丰度大于1% 的有4个类群,分别是子囊菌门(Ascomycota)、接合菌门(Zygomycota)、担子菌门(Basidiomycota)和球囊菌门(Glomeromycota),相对丰度总和超过60%(图 1B),但在组内变异较大,在组间未观测到显著差异。
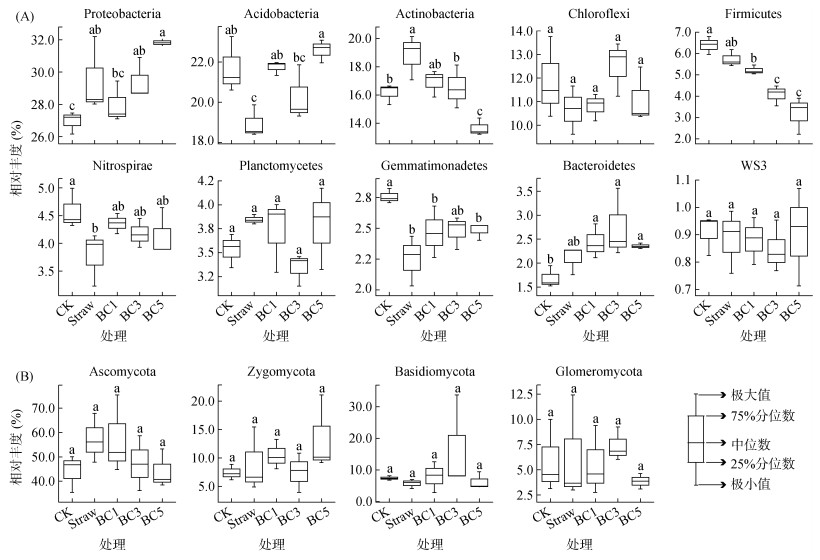
|
(不同小写字母表示处理间差异显著(P < 0.05)) 图 1 不同处理下细菌(A)和真菌(B)主要物种在门水平上的相对丰度 Fig. 1 Relative abundances of main taxes within bacterial (A) and fungal (B) communities at phylum levels under different treatments |
在本研究中,秸秆和生物质炭长期连续还田对土壤细菌群落α多样性影响有限,而BC5处理显著增加了真菌群落Chao1和ACE指数(表 3)。
|
|
表 3 不同处理下土壤细菌和真菌的α多样性指数 Table 3 Alpha diversities of soil bacteria and fungi under different treatments |
非度量多维尺度分析(Non-metric Multidimensional Scaling,NMDS)表明,土壤细菌群落和真菌群落结构在不同处理间差异显著(Stress < 0.2)(图 2),对于土壤细菌群落CK和Straw处理聚集并与生物质炭添加处理明显区分开,且BC1、BC3和BC5处理沿NMDS1轴水平分布(图 2A)。对于土壤真菌群落,CK和Straw处理在NMDS1轴上显著分离,添加生物质炭处理(BC1、BC3、BC5)和不添加生物质炭处理(CK、Straw)在NMDS2轴被区分开(图 2B)。
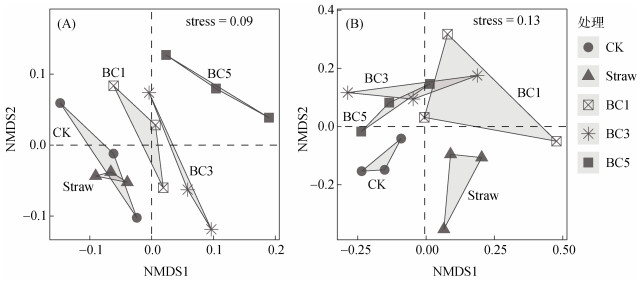
|
图 2 土壤细菌(A)和真菌(B)群落非度量多维尺度分析 Fig. 2 NMDS analyses of soil bacterial (A) and fungal (B) communities |
PICRUSt2对16S标记基因进行功能预测结果见图 3。生物质炭添加可以增加多数碳固定相关的功能基因丰度,同时降低碳降解相关的功能基因丰度。氮固定和反硝化相关的功能基因丰度基本呈现随着生物质炭添加量增加而逐渐降低。相对于CK和Straw处理,ppa (磷溶解基因)在BC5处理中显著增加。
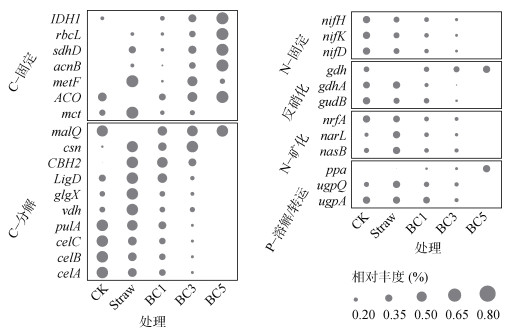
|
图 3 不同处理下PICRUSt2预测的细菌群落功能基因的相对丰度(Min-max标准化) Fig. 3 Relative abundances (Min-max standard) of functional genes of soil bacterial communities predicted by PICRUSt2 under different treatments |
秸秆还田和生物质炭还田均被认为是提高土壤有机碳库[14]、改良土壤[15]和提高作物产量[8]的有效措施。生物质炭具有高保水性和高孔隙度[16],可以有效提高土壤田间持水量和降低土壤容重(表 2)。随着生物质炭连续施用的累加,秸秆炭化后还田(BC1)和秸秆直接还田(Straw)相较于空白处理(CK)分别提高土壤全碳含量77%和23% (表 2),表明生物质炭的固碳潜力是其秸秆原料的3倍以上,这主要是由于生物质炭具有难降解属性[17]。在改善土壤养分状况方面,BC1处理土壤速效钾和有效磷含量约为CK的2倍和1倍,而Straw处理与CK之间却无显著差异,这可能与生物质炭的难降解性和强吸附能力有关[5],使得生物质炭发挥着类似缓释肥料的效果。维持和提升作物生产力是施肥和各种改良措施的初衷,但有研究发现,当生物质炭一次性施用量超过80 t/hm2时,可能会降低作物产量[6]。本研究中高剂量(12 t/(hm2·a))生物质炭添加处理,其累计施用量超过130 t/hm2,仍然在可持续地增加小麦产量,这说明这种“少量多次”连续施用的方式,能够避免一次性大量施用带来的减产风险。
生物质炭不但可以改善土壤水分和养分条件[18],其自身还可以为微生物提供栖息地,避免被其他生物捕食,从而提高土壤微生物多样性[19]。研究表明,土壤细菌群落结构更多地受土壤pH影响[20],而真菌群落结构则更多地受土壤有机质含量影响[21-22]。施用生物质炭可以显著提高酸性土壤pH,但是中性或碱性土壤的pH对生物质炭施用响应不明显[6]。本研究供试土壤呈中性,在每年最高12 t/hm2剂量施用下,土壤pH未显著改变,可能是导致细菌群落α多样性未发生显著变化的主要原因。微生物群落中各物种相对丰度的变化导致β多样性显著改变,例如,变形菌门(Proteobacteria)相对丰度在生物质炭处理中显著增加(图 1),这与该类群喜欢生存于富营养环境中有关[23]。本研究中,12 t/(hm2·a) 生物质炭处理(BC5)显著提高了真菌群落Chao1和ACE多样性指数(表 3),这主要归因于生物质炭添加带入大量有机碳,丰富了土壤碳源[15, 24]。
生物质炭一方面由于其自身难降解性直接提高土壤碳库,另一方面,可通过抑制无机氮对土壤本底有机碳降解的刺激作用,引起负激发效应,间接利于土壤固碳[25]。本研究通过PICRUSt2功能预测分析发现,生物质炭处理增加了细菌群落对碳固定相关功能基因丰度,但降低了碳降解相关功能基因丰度(图 3),这表明施用生物质炭可能使土壤微生的群落向更有利于碳固定的方面转变[26]。氮固定相关功能基因丰度随生物质炭添加量增加而降低(图 3),表明生物固氮可能随着土壤总氮和有效氮含量增加而被抑制[27]。但这与生物质炭促进生物固氮的研究结果相反[28-29],需要通过15N同位素标记试验进一步验证,以克服PICRUSt2基于参考基因组预测的局限性。
4 结论1) 生物质炭添加显著提高了小麦产量,这主要与土壤肥力提升有关。对于土壤有效磷和速效钾含量,秸秆炭化还田比秸秆直接还田提升潜力更大。
2) 生物质炭连续添加对于维持土壤细菌多样性和提高真菌多样性有积极作用。PICRUSt2功能预测显示,细菌群落碳固定相关功能基因丰度显著增加,碳降解和氮固定相关功能基因丰度显著下降,表明连续施炭能促进微生物群落向利于土壤碳固定方向转变,但可能抑制生物固氮作用。未来需要结合宏基因组学等技术,研究不同土壤类型、作物系统和气候带中施用生物质炭对土壤微生物群落结构和功能的影响。
| [1] |
Singh R P, Singh P K, Rutkoski J, et al. Disease impact on wheat yield potential and prospects of genetic control[J]. Annual Review of Phytopathology, 2016, 54: 303-322 DOI:10.1146/annurev-phyto-080615-095835 (  0) 0) |
| [2] |
陈睿山, 郭晓娜, 熊波, 等. 气候变化、土地退化和粮食安全问题: 关联机制与解决途径[J]. 生态学报, 2021, 41(7): 2918-2929 (  0) 0) |
| [3] |
谢祖彬, 刘琦, 许燕萍, 等. 生物炭研究进展及其研究方向[J]. 土壤, 2011, 43(6): 857-861 (  0) 0) |
| [4] |
Baronti S, Alberti G, Delle Vedove G, et al. The biochar option to improve plant yields: First results from some field and pot experiments in Italy[J]. Italian Journal of Agronomy, 2010, 5(1): 3 DOI:10.4081/ija.2010.3 (  0) 0) |
| [5] |
He L L, Zhao J, Yang S M, et al. Successive biochar amendment improves soil productivity and aggregate microstructure of a red soil in a five-year wheat-millet rotation pot trial[J]. Geoderma, 2020, 376: 114570 DOI:10.1016/j.geoderma.2020.114570 (  0) 0) |
| [6] |
Liu Q, Liu B J, Zhang Y H, et al. Biochar application as a tool to decrease soil nitrogen losses (NH3 volatilization, N2O emissions, and N leaching) from croplands: Options and mitigation strength in a global perspective[J]. Global Change Biology, 2019, 25(6): 2077-2093 DOI:10.1111/gcb.14613 (  0) 0) |
| [7] |
Biederman L A, Harpole W S. Biochar and its effects on plant productivity and nutrient cycling: A meta-analysis[J]. GCB Bioenergy, 2013, 5(2): 202-214 DOI:10.1111/gcbb.12037 (  0) 0) |
| [8] |
Mia S, van Groenigen J W, van de Voorde T F J, et al. Biochar application rate affects biological nitrogen fixation in red clover conditional on potassium availability[J]. Agriculture, Ecosystems & Environment, 2014, 191: 83-91 (  0) 0) |
| [9] |
Pathy A, Ray J, Paramasivan B. Biochar amendments and its impact on soil biota for sustainable agriculture[J]. Biochar, 2020, 2(3): 287-305 DOI:10.1007/s42773-020-00063-1 (  0) 0) |
| [10] |
Zheng J F, Chen J H, Pan G X, et al. Biochar decreased microbial metabolic quotient and shifted community composition four years after a single incorporation in a slightly acid rice paddy from southwest China[J]. Science of the Total Environment, 2016, 571: 206-217 DOI:10.1016/j.scitotenv.2016.07.135 (  0) 0) |
| [11] |
Zheng H J, Liu D Y, Liao X, et al. Field-aged biochar enhances soil organic carbon by increasing recalcitrant organic carbon fractions and making microbial communities more conducive to carbon sequestration[J]. Agriculture, Ecosystems & Environment, 2022, 340: 108177 (  0) 0) |
| [12] |
谢祖彬, 卑其成, 刘刚, 等. 一种秸秆制炭装置: 200920232191.9[P]. 2010–06–16.
(  0) 0) |
| [13] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000
(  0) 0) |
| [14] |
宋依依, 曹阳, 段鑫盈, 等. 秸秆还田深度对土壤团聚体组成及有机碳含量的影响[J]. 土壤, 2022, 54(2): 344-350 (  0) 0) |
| [15] |
Dai Z M, Xiong X Q, Zhu H, et al. Association of biochar properties with changes in soil bacterial, fungal and fauna communities and nutrient cycling processes[J]. Biochar, 2021, 3(3): 239-254 DOI:10.1007/s42773-021-00099-x (  0) 0) |
| [16] |
Bakshi S, Aller D M, Laird D A, et al. Comparison of the physical and chemical properties of laboratory and field-aged biochars[J]. Journal of Environmental Quality, 2016, 45(5): 1627-1634 DOI:10.2134/jeq2016.02.0062 (  0) 0) |
| [17] |
刘本娟, 谢祖彬, 刘琦, 等. 生物质炭引起的土壤碳激发效应与土壤理化特性的相关性[J]. 土壤, 2021, 53(2): 343-353 (  0) 0) |
| [18] |
孙宁婷, 王小燕, 周豪, 等. 生物质炭种类与混施深度对紫色土水分运移和氮磷流失的影响[J]. 土壤学报, 2022, 59(3): 722-732 (  0) 0) |
| [19] |
Quilliam R S, Glanville H C, Wade S C, et al. Life in the 'charosphere' - Does biochar in agricultural soil provide a significant habitat for microorganisms?[J]. Soil Biology and Biochemistry, 2013, 65: 287-293 DOI:10.1016/j.soilbio.2013.06.004 (  0) 0) |
| [20] |
Rousk J, Bååth E, Brookes P C, et al. Soil bacterial and fungal communities across a pH gradient in an arable soil[J]. The ISME Journal, 2010, 4(10): 1340-1351 DOI:10.1038/ismej.2010.58 (  0) 0) |
| [21] |
Yang N, Li X X, Liu D, et al. Diversity patterns and drivers of soil bacterial and fungal communities along elevational gradients in the Southern Himalayas, China[J]. Applied Soil Ecology, 2022, 178: 104563 DOI:10.1016/j.apsoil.2022.104563 (  0) 0) |
| [22] |
李慧敏, 田胜营, 李丹丹, 等. 有机物料施用对潮土活性有机碳及微生物群落组成的影响[J]. 土壤学报, 2021, 58(3): 777-787 (  0) 0) |
| [23] |
Dai Z M, Su W Q, Chen H H, et al. Long-term nitrogen fertilization decreases bacterial diversity and favors the growth of Actinobacteria and Proteobacteria in agro-ecosystems across the globe[J]. Global Change Biology, 2018, 24(8): 3452-3461 DOI:10.1111/gcb.14163 (  0) 0) |
| [24] |
Guo X F. Effects of biochar on the diversity and community structure of soil fungi in intercropping system[J]. Applied Ecology and Environmental Research, 2019, 17(4): 8817-8834 (  0) 0) |
| [25] |
Lu W W, Ding W X, Zhang J H, et al. Biochar suppressed the decomposition of organic carbon in a cultivated sandy loam soil: A negative priming effect[J]. Soil Biology and Biochemistry, 2014, 76: 12-21 DOI:10.1016/j.soilbio.2014.04.029 (  0) 0) |
| [26] |
Zhang X, Zhang Q Q, Zhan L P, et al. Biochar addition stabilized soil carbon sequestration by reducing temperature sensitivity of mineralization and altering the microbial community in a greenhouse vegetable field[J]. Journal of Environmental Management, 2022, 313: 114972 DOI:10.1016/j.jenvman.2022.114972 (  0) 0) |
| [27] |
张燕辉, 胡天龙, 王慧, 等. 利用15N2直接标记法研究水稻种植对稻田固氮量和固氮活性的影响[J]. 土壤, 2021, 53(4): 739-745 (  0) 0) |
| [28] |
Güereña D T, Lehmann J, Thies J E, et al. Partitioning the contributions of biochar properties to enhanced biological nitrogen fixation in common bean (Phaseolus vulgaris)[J]. Biology and Fertility of Soils, 2015, 51(4): 479-491 DOI:10.1007/s00374-014-0990-z (  0) 0) |
| [29] |
Xiu L Q, Zhang W M, Wu D, et al. Biochar can improve biological nitrogen fixation by altering the root growth strategy of soybean in Albic soil[J]. Science of the Total Environment, 2021, 773: 144564 DOI:10.1016/j.scitotenv.2020.144564 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. College of Forestry, Nanjing Forestry University, Nanjing 210037, China;
4. School of Geography Sciences, Nanjing Normal University, Nanjing 210023, China
 2023, Vol. 55
2023, Vol. 55


