2. 中国科学院大学, 北京 100049;
3. 江苏省农业科学院经济作物研究所, 南京 210014;
4. 江西农业大学国土资源与环境学院, 南昌 330045
间作在我国有悠久的历史基础,已然从过去的低投入低产出演变为高投入高产出的现代农业模式[1-2]。禾本科作物玉米与豆科作物花生间作目前已得到广泛推广[3-4],但由于玉米和花生个体生物量存在较大差异,导致密植体系中高矮杆作物光照分配存在差异,共生期的花生因个体矮小被遮荫,导致减产[5]。因此,合理布局玉米花生间作,提高光资源利用效率,是提高单位面积花生生产力的关键。针对集约化带状间作体系,因地制宜规划行朝向[6]或行数比[7]可以改善花生冠层光照条件,提高花生单位产量。间作体系中地下微生物对作物生产力的促进作用已得到普遍认可,其中光合碳是维护作物与根际微生物组良性互作的重要桥梁。由于植物通过光合作用同化的碳中约有30% 沿叶–茎–根分配至根际[8],且光合作用中碳水化合物的合成取决于叶绿体吸收的光合有效辐射[9]。因此,改变花生冠层光照条件,可改善由光合碳主导的植物–微生物互作关系,保障作物生长。但目前关于花生光合碳地下分配如何响应地上光照条件变化仍有待明确。
光照对根际微生物群落的调控主要通过光合碳进行。植物根系通过分泌光合作用生产的各类有机物作为资源或信号物质调控根际微生物群落,招募根际促生菌,其具有帮助宿主植物生长、吸收营养和抵御病原体的作用,深刻影响着植物生产力及健康[10-12]。其作用原理主要为调节土壤养分利用率,如固氮、溶磷和结钾;分泌植物激素,如生长素、赤霉素和脱落酸;产生铁载体,促进植物吸收利用铁元素[13]。宿主植物与根际微生物基于根系分泌物形成特定共生结构,当根系分泌物含量或组成发生变化时根际微生物群落可产生快速响应,并反馈到植物[14-15]。因此,植物与根际微生物群落的相互作用与光照条件紧密相关。综上可知,地上部光照条件的变化可通过改变根系碳分泌调控植物与根际微生物的相互作用关系,即地上部光照条件的变化可重塑宿主与根际微生物群落的相互作用关系。例如,在次优光照条件下,拟南芥诱导根际微生物组以弱化病原体抗性为代价来维持宿主生长[16];豆科植物地下根瘤发育与地上光信号紧密相关[17]。充分了解光照如何调控根际微生物以促进作物增产十分重要,但目前对间作体系中矮杆作物与根际微生物群落相互作用关系如何响应高杆作物引起的光照变化仍不清楚。
在玉米花生间作体系中,充分利用光资源对花生根际微生物群落的调控作用,挖掘根际微生物对花生增产的促进作用具有重要意义。以往对间作体系中光资源的研究集中在光如何影响作物本身,缺乏对光诱导下作物–根际微生物良性互作的研究。基于此,本研究在长期玉米花生间作试验地中设置两种行朝向(东西朝向和南北朝向)来改变花生冠层光照条件,以探明:①不同光照条件对花生根际光合碳分配的影响;②不同光照条件引起的花生根际细菌群落变化;③光照调控的根际细菌群落变化对花生产量的影响。本研究有助于农业工作者全面考虑可持续生态间作体系的布局设计,充分利用地上地下协同作用来提高作物生产力。
1 材料与方法 1.1 试验地概况田间长期试验地位于江苏省南京市江苏省农业科学院六合基地(32°48′N,118°63′E),基地属北亚热带季风气候,年平均气温16.5 ℃,年均降水量589.5 mm,全年平均日照时长为1 781.9 h。试验地土种为黄棕壤土,适合作物生长。试验样地于2012年建立了玉米花生长期间作体系,播种前土壤进行施肥和翻耕处理。耕层土壤基本化学性质为:pH 7.96,有机质(SOM) 8.31 g/kg,全氮(TN) 0.46 g/kg,全磷(TP) 0.45 g/kg,全钾(TK) 17.89 g/kg,阳离子交换量(CEC) 15.49 coml/kg。
1.2 试验处理供试花生品种为中花16,玉米品种为苏玉24。2021年,间作区通过改变带状间作朝向设置了低光照处理(LL,东西行朝向)和高光照处理(HL,带状南北行朝向)。种植布局为5 m玉米条带(两行玉米,行间距为0.5 m)和5 m花生条带(四行花生,行间距为0.5 m)。每行株间距离花生为0.4 m,玉米为0.4 m。每个处理为5 m×5 m (长×宽),用宽0.4 m、高0.3 m的垄沟隔开相邻小区。5月10日播种,花生于10月7—10日收获,玉米于9月17—20日收获。试验样地在作物生长期进行了良好的田间管理。
1.3 同位素标记试验为探究花生向根际分配光合碳的量,本研究同时在温室使用13CO2进行了同位素标记试验。选用花生品种为中花16,盆栽用土取自田间试验地。将出苗30 d的花生放入标记箱中,连续30 d(5月)向标记箱中通入13CO2,使其浓度维持在420 ~ 450 μL/L。标记结束后取出花生,小心收集根际土壤进行下一步测定。标记期间使用黑色聚酯布遮挡阳光模拟田间遮阴情况,标记箱温度维持在36 ℃内。
1.4 样品采集及分析方法2021年于天气晴朗的花生盛花期(8月)按照“S”型采样法选取10株花生进行光合有效辐射测定和光截获(LI)计算,并在成熟后收获测定单株产量。根际土壤样品采集于上述盛花期花生的邻近植株,轻轻拔起花生植株后抖落附着在根部的大块土壤,收集紧贴根表的土壤作为根际土壤。非根际土壤采自每两列花生间耕层(5 ~ 20 cm)。将所有土壤样品混匀后分为3份用于理化性质测定,分6份用于高通量测序。
光截获测定方法参考王才斌等[18]。土壤化学性质测定参考《土壤农业化学分析方法》[19]。土壤pH测定采用电位计法,SOM测定采用重铬酸钾氧化–容量法,TN测定采用凯氏定氮法,TP测定采用碳酸钠熔融法,TK测定采用氢氧化钠熔融法,CEC测定采用乙酸铵交换法。土壤13C原子丰度测定方法参考Li等[20]。
1.5 土壤DNA提取及16S rRNA高通量测序准确称取0.5 g土壤样品,使用试剂盒FastDNATM SPIN Kit for Soil (MP Biomedicals,美国)提取土壤总DNA。DNA浓度及纯度使用Nanodrop (NanoReady Touch,遂真,中国)测定,使用琼脂糖凝胶电泳检测DNA完整性。
使用细菌常用引物799F(5′-AACMGGATTAGATACCCKG-3′)和1193R(5′-ACGTCATCCCCACCTTCC-3′)[21]扩增细菌16S rRNA基因的V5 ~ V7区。通过Illumina平台进行DNA文库制备和高通量测序。原始数据为FASTQ格式,使用Trimmomatic软件对原始序列进行去杂。去杂后的序列拼接使用FLASH进行。测序数据经过预处理之后,使用Vsearch软件,根据97% 的序列相似性进行聚类并去除嵌合体,将聚类后的序列归为不同OTU (Operational Taxonomic Unit)。使用QIIME软件包挑选出各个OTU的代表序列,并将所有代表序列与Silva(version138)数据库进行比对注释。所有样品序列被抽平至30 409条,以便比较不同样品的多样性。
1.6 数据分析不同指标显著性差异使用t检验(t-test)和单因素方差分析(one-way ANOVA)计算。使用R语言的“vegan”包进行如下分析:基于Bray-Curtis距离的非度量多维尺度分析(NMDS)以表征处理间群落结构差异,置换多元方差分析(PERMANOVA)用以检验处理间群落结构差异的显著性,冗余分析(Redundancy Analysis,RDA)用以探索群落物种组成受环境变量约束的关系,并进行Mantel检验。随机森林(Random Forest,RF)模型的构建及参数计算分别使用R语言的“randomForest”、“rfUtilities”和“rfPermute”包。使用STAMP软件进行组间优势菌种差异分析。结构方程模型(Structural Equation Modeling,SEM)使用AMOS 26软件构建。
2 结果与分析 2.1 光照条件对花生光截获、产量及根际土壤化学性质的影响根据田间测定结果,由于不同行朝向下玉米对花生的遮阴效果不同,低光照(LL)和高光照(HL)处理的LI分别为989.20和1 298.73 mmol/(m2·s),伴随着更高的LI,HL处理的单株花生产量(单株花生成熟荚果鲜重)比LL处理显著提高了21.66%(P < 0.05)。花生根际土壤的TN含量与CEC在LL和HL处理间没有显著性差异。HL处理显著提高了花生根际土壤的光合碳(13C原子丰度)、SOM、TP和TK(P < 0.05)含量,分别是LL处理的2.93倍、1.13倍、1.42倍和1.12倍。相较于LL处理,HL处理下土壤pH降低了0.77个单位。
2.2 光照条件对花生根际细菌多样性的影响通过计算花生根际细菌群落的Observed species (图 1A)、Simpson指数(图 1B)和ACE指数(图 1C)发现,光照条件的变化并不能显著改变花生根际细菌群落的α-多样性,且花生根际土壤(LL、HL)与非根际土壤(BS)相比α-多样性也无显著性差异。但基于Bray-Curtis距离矩阵的NMDS分析(图 1D)结果表明,不同处理间花生根际细菌的群落结构(β-多样性) 存在显著分异(P < 0.05)。HL处理与BS和LL处理的群落结构沿NMDS1轴分异且分异较大。BS与LL处理沿NMDS2轴分异,且BS与LL处理相较于BS与HL处理群落结构分异较小。

|
(柱状图上方小写字母“ns”代表不同处理间无显著性差异(P > 0.05)) 图 1 不同光照条件下花生根际细菌多样性 Fig. 1 Diversity of peanut rhizosphere bacteria under different light conditions |
|
|
表 1 光照条件对花生产量及根际土壤化学性质的影响 Table 1 Peanut yields and chemical properties of rhizosphere soil under different light conditions |
随机森林模型结果表明,影响花生产量的因子依次是光合碳(9.15%) > LI(8.40%) > pH(7.94%) > CEC (7.77%) > TP(6.88%) (图 2A,P < 0.05)。影响群落结构(NMDS1)的因子依次是光合碳(9.19%) > TP (8.91%) > TK (8.84%) > LI (8.39%) > SOM (8.32%) > pH (8.27%) (图 2B,P < 0.05)。RDA分析展示了环境因子对根际细菌群落结构的影响(图 2C),结果表明,主坐标1(RDA1)和主坐标2(RDA2)分别解释了总变异的26.30% 和16.14%。LL和HL处理的细菌群落沿RDA1显著分异(P < 0.05)。环境因子TP(R2=0.83)、pH (R2=0.81)、光合碳(R2=0.80)、SOM(R2=0.63)、TK(R2= 0.59)和LI(R2=0.58)均显著驱动了根际细菌群落结构变异(P < 0.05),其中,TP、pH和光合碳对不同光照条件下花生根际细菌群落结构影响最大(图 2D)。总之,光合碳对花生产量和根际细菌群落结构均具有较大影响,且与HL处理花生根际细菌群落结构变化呈正相关。

|
(*表示在P < 0.05水平影响显著,**表示在P < 0.01水平影响显著) 图 2 随机森林模型分析环境因子对花生产量和根际细菌群落结构的影响 Fig. 2 Effects of environmental factors on peanut yield and rhizosphere bacterial community structure analyzed by random forest model |
为探究不同光照条件下群落结构变异过程中的差异富集菌种,选取相对丰度最高的50个属使用STAMP进行分析(图 3)。结果表明,LL和HL处理中各有9个属显著富集。相较于HL处理,LL处理中苔藓杆菌属(Bryobacter)、假单胞菌属(Pseudomonas)、溶杆菌属(Lysobacter)、类固醇杆菌属(Steroidobacter)、马赛菌属(Massilia)等显著富集(P < 0.01);而在LL处理中,显著富集的菌属有拟无枝酸菌属(Amycolatopsis)、伯克霍尔德氏菌属(Burkholderia)、根瘤菌属(Rhizobium)、慢生根瘤菌属(Bradyrhizobium)、分枝杆菌属(Mycobacterium)等(P < 0.05)。

|
图 3 不同光照条件下显著富集的优势菌种 Fig. 3 Dominant strains significantly enriched under different light conditions |
本研究通过SEM构建探究了产量与光照条件及根际细菌群落的关系(图 4)。本研究中,模型与数据适配度良好(χ2=11.288,P=0.127,df=7),最终模型解释了花生产量98.8% 的变异。结果显示,光照条件对产量有直接正效应(r=0.440,P < 0.001),对光合碳也具有正效应(r=0.928,P < 0.001);光合碳分别促进细菌群落结构(β-多样性)变异及富集菌种相对丰度增加(r=0.949,P < 0.001和r=0.941,P < 0.001),这两者对于产量提升具有显著正效应(r=0.304,P < 0.001和r=0.290,P < 0.001)。由此可见,高光条件既可直接促进产量提高,也可通过增加根际光合碳含量影响根际细菌群落从而促进产量提升。
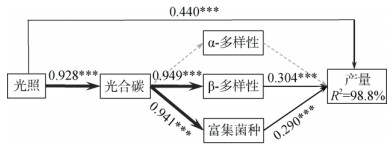
|
(箭头上的数字是标准化路径系数(r),箭头粗细表示系数大小,实线箭头表示显著性正相关(***,P < 0.001),虚线表示无显著相关性;光照用LI代表,α-多样性由ACE指数代表,β-多样性由NMDS1代表,富集菌种为在HL处理显著富集的细菌;R2表示产量变异的解释率) 图 4 基于结构方程模型分析的产量与光照条件、光合碳和根际细菌的关系 Fig. 4 Relationships between yield and light condition, photosynthesized carbon and rhizobacteria based on structural equation modeling analysis |
植物的冠层光截获对其光合作用及光合产物存在影响,由于一部分盈余的光合产物会通过根系分泌至根际,因而光截获影响着根系分泌物的释放[22]。本研究通过同位素标记验证了这一点,高光照条件的根际土壤含有更多的光合碳。这些分泌物包括低分子化合物(有机酸、糖、氨基酸)和部分无机离子[23]。其中,H+和低分子有机酸可酸化土壤环境降低土壤pH,或通过还原和交换作用活化土壤中难溶性养分,增加根际土壤养分有效性[13]。此外,光合碳可塑造根际微生物群落,微生物能通过自身代谢分解和矿化土壤养分,增加土壤养分含量[24]。本研究结果与前人结论相符,由于高光照条件的根系分泌物更多,其含有的H+和低分子有机酸导致土壤pH显著下降,并且有更高的TP、TK等养分资源。由于花生生长喜好偏酸性的土壤,高光照条件降低pH,有利于花生生长。根据随机森林模型的分析结果发现,土壤养分变化也是促进产量提升的关键因素。因此,地上光照条件对植物根际土壤环境具有重要影响,土壤环境的变化对植物生长与生产力提升存在深刻影响。
3.2 光照条件调控并优化花生根际细菌群落光照对根际细菌群落通过叶–茎–根轴向调控,地上合成的光合碳通过根系分泌至根际成为塑造根际细菌群落的最主要驱动力。本研究通过基于Bray-Curtis距离矩阵的NMDS分析发现了细菌群落结构的变化,且通过随机森林和RDA分析得出了光合碳对细菌群落结构影响的结果。但研究结果表明,光合碳输入的变化并不能引起细菌群落α-多样性的变化,这种地上植物与地下细菌α-多样性不吻合的结果在先前的研究中也有所发现[25]。基于Bray-Curtis距离矩阵的NMDS分析得出,高光照条件下根际与非根际的差异大于低光照条件下根际与非根际的差异。这是因为高光照条件引起植物根际光合碳的增加,增强了植物对微生物群落的生化调节,使其与非根际土壤差异增大。本研究还发现,一些特定细菌在不同光照条件下的富集差异,例如根瘤菌属、慢生根瘤菌属[26]、伯克霍尔德氏菌属[28]等植物根际促生菌在高光照条件下显著富集。这意味着当植物合成更多光合产物时可以更有效塑造有利于自身的根际细菌群落,而当植物缺乏更多光合碳分泌时会减弱自身对根际细菌群落正向的调控能力。
3.3 光照条件调控根际细菌促进花生增产充足的光照和功能适宜的根际细菌群落是保障作物生产的重要因子,结构方程模型验证了其中的关系。较高的光截获对花生产量有正向促进作用,同时对应了根际更高的光合碳分配,这有利于植物选择性招募对提高产量有益的细菌群落和优势菌种。当光照充足时,光合作用合成的碳水化合物远多于其自己生长发育所需的量,剩余部分作为植物与微生物交换的资本,用以换取微生物对植物的促生等有益作用。在此过程中,关键富集菌种通过植物供给的碳源作为能源来活化根际土壤中的养分或促进植物激素产生,以此展现对植物生长的促进能力。例如,豆科植物根瘤的固氮活性与其光合产物的供应水平密切相关,光合碳是为根瘤菌提供能量维持共生关系的重要因子[27];伯克霍尔德氏菌摄取光合碳帮助植物溶磷和生产激素[28]。因此,充足的光照保障花生根系分泌足量光合碳供给根际促生菌,维持植物–根际细菌良好互作以保障作物生产力。从细菌群落角度来看,由于细菌群落的α-多样性在不同光照条件下无显著性差异,因此其不能有效解释花生产量变异。光照影响的细菌β-多样性改变可能有助于细菌群落功能的转变,例如调节土壤养分转化、生产植物激素、拮抗病原菌等[29]。本研究结果表明,在高光照条件下花生根际构建了富含根瘤菌、伯克霍尔德氏菌和拟无枝酸菌等有益菌,并伴随机会性致病菌假单胞菌[30]减少的细菌群落。该群落可能具有促进花生对氮磷等营养元素的获取以及产生植物激素的功能,并且对花生的致病风险有所降低,这有利于保障花生生长及产量提升。综上所述,结构方程模型分析对光照、细菌群落与花生产量的关系提供了进一步的支持。
4 结论间作体系中增加矮杆作物花生31.2% 冠层光截获使产量增加21.7%。地上部的高光截获对应了地下更多的光合碳分配,根际更丰富的光合碳资源展现了花生对根际细菌更强的塑造作用。由更多光合碳塑造的根际细菌有益于花生增产。可见,更高的花生冠层光截获可调控根际细菌群落,促进花生增产。
| [1] |
李隆. 间套作强化农田生态系统服务功能的研究进展与应用展望[J]. 中国生态农业学报, 2016, 24(4): 403-415 (  0) 0) |
| [2] |
苏本营, 陈圣宾, 李永庚, 等. 间套作种植提升农田生态系统服务功能[J]. 生态学报, 2013, 33(14): 4505-4514 (  0) 0) |
| [3] |
谢凯, 翁伯琦. 玉米与旱地作物间作套种研究进展[J]. 中国农学通报, 2014, 30(6): 26-32 (  0) 0) |
| [4] |
张晓娜, 陈平, 杜青, 等. 玉米/大豆、玉米/花生间作对作物氮素吸收及结瘤固氮的影响[J]. 中国生态农业学报(中英文), 2019, 27(8): 1183-1194 (  0) 0) |
| [5] |
李奇松, 李家俊, 叶江华, 等. 玉米/豆科作物间作系统中不同互作因子对群体产量的影响[J]. 福建农业学报, 2020, 35(6): 582-590 (  0) 0) |
| [6] |
Midmore D J. Agronomic modification of resource use and intercrop productivity[J]. Field Crops Research, 1993, 34(3/4): 357-380 (  0) 0) |
| [7] |
张昆, 万勇善, 刘风珍, 等. 不同玉米花生间作模式对饱果期花生冠层微环境及光合特性的影响[J]. 山东农业科学, 2021, 53(8): 28-32 (  0) 0) |
| [8] |
陆雅海, 张福锁. 根际微生物研究进展[J]. 土壤, 2006, 38(2): 113-121 (  0) 0) |
| [9] |
祁红彦, 周广胜, 许振柱. 北方玉米冠层光合有效辐射垂直分布及影响因子分析[J]. 气象与环境学报, 2008, 24(1): 22-26 (  0) 0) |
| [10] |
白洋, 钱景美, 周俭民, 等. 农作物微生物组: 跨越转化临界点的现代生物技术[J]. 中国科学院院刊, 2017, 32(3): 260-265 (  0) 0) |
| [11] |
申建波, 白洋, 韦中, 等. 根际生命共同体: 协调资源、环境和粮食安全的学术思路与交叉创新[J]. 土壤学报, 2021, 58(4): 805-813 (  0) 0) |
| [12] |
马莹, 曹梦圆, 石孝均, 等. 植物促生菌的功能及在可持续农业中的应用[J/OL]. 土壤学报, 2022: 1–15. (2022-11-14). https://kns.cnki.net/kcms/detail/32.1119.P.20221111.1234.004.html.
(  0) 0) |
| [13] |
周益帆, 白寅霜, 岳童, 等. 植物根际促生菌促生特性研究进展[J]. 微生物学通报, 2023, 50(2): 644-666 (  0) 0) |
| [14] |
陈龙池, 廖利平, 汪思龙, 等. 根系分泌物生态学研究[J]. 生态学杂志, 2002, 21(6): 57–62, 28 DOI:10.3321/j.issn:1000-4890.2002.06.013 (  0) 0) |
| [15] |
熊明彪, 何建平, 宋光煜. 根分泌物对根际微生物生态分布的影响[J]. 土壤通报, 2002, 33(2): 145-148 (  0) 0) |
| [16] |
Hou S J, Thiergart T, Vannier N, et al. A microbiota-root-shoot circuit favours Arabidopsis growth over defence under suboptimal light[J]. Nature Plants, 2021, 7(8): 1078-1092 DOI:10.1038/s41477-021-00956-4 (  0) 0) |
| [17] |
Wang T, Guo J, Peng Y Q, et al. Light-induced mobile factors from shoots regulate rhizobium-triggered soybean root nodulation[J]. Science, 2021, 374(6563): 65-71 DOI:10.1126/science.abh2890 (  0) 0) |
| [18] |
王才斌, 郑亚萍, 成波, 等. 高产花生冠层光截获和光合、呼吸特性研究[J]. 作物学报, 2004, 30(3): 274-278 DOI:10.3321/j.issn:0496-3490.2004.03.016 (  0) 0) |
| [19] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000
(  0) 0) |
| [20] |
Li P F, Liu J, Saleem M, et al. Reduced chemodiversity suppresses rhizosphere microbiome functioning in the mono-cropped agroecosystems[J]. Microbiome, 2022, 10(1): 108 DOI:10.1186/s40168-022-01287-y (  0) 0) |
| [21] |
Thijs S, De Beeck M O, Beckers B, et al. Comparative evaluation of four bacteria-specific primer pairs for 16S rRNA gene surveys[J]. Frontiers in Microbiology, 2017, 8: 494 (  0) 0) |
| [22] |
平晓燕, 周广胜, 孙敬松. 植物光合产物分配及其影响因子研究进展[J]. 植物生态学报, 2010, 34(1): 100-111 (  0) 0) |
| [23] |
任改弟, 王光飞, 马艳. 根系分泌物与土传病害的关系研究进展[J]. 土壤, 2021, 53(2): 229-235 (  0) 0) |
| [24] |
李春俭, 马玮, 张福锁. 根际对话及其对植物生长的影响[J]. 植物营养与肥料学报, 2008, 14(1): 178-183 (  0) 0) |
| [25] |
Prober S M, Leff J W, Bates S T, et al. Plant diversity predicts beta but not alpha diversity of soil microbes across grasslands worldwide[J]. Ecology Letters, 2015, 18(1): 85-95 DOI:10.1111/ele.12381 (  0) 0) |
| [26] |
赵叶舟, 王浩铭, 汪自强. 豆科植物和根瘤菌在生态环境中的地位和作用[J]. 农业环境与发展, 2013, 30(4): 7-12 (  0) 0) |
| [27] |
吴狄, 杨腾, 林臣峰, 等. 天目山银杏根区土壤固氮微生物群落沿海拔梯度的分布特征[J]. 土壤, 2022, 54(5): 958-967 (  0) 0) |
| [28] |
黄瑞林, 张娜, 孙波, 等. 典型农田根际土壤伯克霍尔德氏菌群落结构及其多样性[J]. 土壤学报, 2020, 57(4): 975-985 (  0) 0) |
| [29] |
Zhao Y, Sun Y, Pei M, et al. Enhanced rice yields are related to pronounced shifts in soil resident bacterial community structures in response to Rhodopseudomonas palustris and Bacillus subtilis inoculation[J]. Journal of Soils and Sediments, 2021, 21(6): 2369-2380 DOI:10.1007/s11368-021-02929-8 (  0) 0) |
| [30] |
Li X G, Ding C F, Hua K, et al. Soil sickness of peanuts is attributable to modifications in soil microbes induced by peanut root exudates rather than to direct allelopathy[J]. Soil Biology and Biochemistry, 2014, 78: 149-159 DOI:10.1016/j.soilbio.2014.07.019 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Institute of Industrial Crops, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;
4. College of Land Resources and Environment, Jiangxi Agricultural University, Nanchang 330045, China
 2023, Vol. 55
2023, Vol. 55


