2. 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所), 南京 210008
砷(As)和镉(Cr)是我国土壤中最主要的两种重(类)金属污染元素,根据2014年《全国土壤污染调查公报》[1]显示,我国污染土壤中As和Cr的点位超标率分别为2.7% 和1.1%,分别位居第三和第六位。土壤中重金属的赋存形态和含量决定了其有效性(毒性)和环境生态风险,而重金属的形态和含量又与重金属的吸附–解吸、溶解–沉淀以及氧化–还原等土壤界面过程密切相关。研究重金属在土壤固相表面的吸附规律与机制,是理解重金属污染过程、评估环境风险、制订精准修复措施等方面的基础。
已有研究表明,土壤固相对重金属的吸附能力与其自身的电荷性质、比表面积、吸附位点总浓度等表面性质密切相关。如带负电荷的硅酸盐矿物通常对重金属阳离子吸附能力较强,而对阴离子吸附能力较弱[2-3];反之,带正电荷的铁铝氧化物对土壤中以阴离子形态存在的金属离子的吸附亲和力较高[4-5]。通常矿物表面的吸附位点浓度越高,其吸附重金属的能力越强[6]。此外,矿物的粒径越小,比表面积越大,其吸附重金属的容量也就越大[7-8]。静电作用和配位作用等是土壤矿物吸附重金属的主要机制[9-11]。矿物对金属离子的吸附行为除了受自身表面性质控制,还受pH、离子强度和温度等环境因素的影响[12-13]。通常环境的pH越高,土壤矿物对阴离子型重金属的吸附能力越弱,而对阳离子型重金属的吸附能力越强[14-16]。当吸附主要由静电力控制时,吸附受离子强度影响较大;若由化学作用主宰,则受离子强度影响较小[17-18]。
目前对土壤单一矿物吸附重金属的规律和机制已经有较为深入的认识,相关的研究报道很多。但是实际土壤固相组成复杂,往往是多种矿物共存,黏土矿物与铁铝氧化物相互胶结以复合体的形式存在[19-20]。当黏土矿物表面被铁、铝等氧化物包被后,其表面物理化学性质发生改变,从而影响其对重金属的吸附[21]。例如,高岭石与铁铝氧化物胶结会使其表面的净负电荷密度降低,从而降低复合体系的zeta电位值[22]。蒙脱石与氧化铁复合后,矿物的比表面积和吸附位点增加,对Cd和As的吸附亲和力明显增强[23-24]。许海娟等[25]发现,蒙脱石–针铁矿复合体和蒙脱石–非/弱晶质氧化铁复合体的等电点和表面羟基含量均明显高于单一蒙脱石体系,对磷的吸附能力也更强。这些研究证明矿物之间互作对土壤中离子吸附有重要影响,离子在单一矿物体系中的吸附特征不能简单外推到多种矿物共存的实际土壤体系。
目前关于矿物互作对离子吸附的影响大多集中于对阳离子型金属的探讨,对于矿物互作如何影响阴离子吸附特性及其机制还不清楚。因此,本研究以典型土壤矿物高岭石、蒙脱石、针铁矿和三水铝石为材料,通过比较单一矿物与复合矿物的离子吸附特征和表面性质,研究层状硅酸盐矿物与铁铝氧化物互作对As(Ⅴ)和Cr(Ⅵ) 吸附的影响,并初步探讨其机制,以助于加深对实际土壤中重金属化学行为的理解,为重金属污染风险评价和修复策略制订提供基础信息和重要参考。
1 材料与方法 1.1 试验试剂选择土壤典型矿物高岭石(1∶1型层状硅酸盐矿物)、蒙脱土(2∶1型层状硅酸盐矿物)、针铁矿和三水铝石为供试材料。高岭石购于北海高岭科技有限公司,蒙脱石和三水铝石购于Aladdin公司。针铁矿采用Atkinson等[26]的方法制备。所有矿物均经X-射线衍射(XRD)和傅里叶变换红外光谱法(FTIR)鉴定。
供试As(Ⅴ) 和Cr(Ⅵ) 分别为分析纯Na2CrO4和KH2AsO4,试验用水为超纯水。
1.2 矿物复合体制备在供试4种单一矿物中,两种氧化物对As(Ⅴ) 和Cr(Ⅵ) 吸附能力较强,而层状硅酸盐矿物对二者的吸附量几乎为零,因此本研究以针铁矿和三水铝石为参照矿物;两种硅酸盐矿物中,蒙脱石拥有较高的比表面积和表面位点浓度,其与氧化物的互作比高岭石强,因此本研究选择针铁矿–蒙脱石和三水铝石–蒙脱石复合体作为土壤氧化物–层状硅酸盐复合体的代表。
制备矿物复合体一般有机械混合和化学混合两种方式[27]。但目前在实验室条件下通过化学混合比较容易制备的主要是铁氧化物–层状硅酸盐的复合体,通过该法合成三水铝石与层状硅酸盐复合体还比较困难,尚无现成的方法可依。因此,本研究采用机械混合的方式制备两种复合体。具体为:分别将质量比为1∶1的针铁矿、蒙脱石粉末和三水铝石、蒙脱石粉末分散于100 mL超纯水中,制备成浓度为10 g/L的矿物悬液,用超声波分散仪(KQ-400DB,昆山舒美超声仪器有限公司)充分分散30 min后,用磁力搅拌器搅拌24 h,室温条件下静置2 d;离心分离矿物复合体悬液,将离心沉淀物用超纯水清洗多次至上清液电导率小于6 μS/cm。制备样品经50 ℃烘干,研磨过100目筛,储存在干燥器中备用。
1.3 单一和复合矿物的性质表征 1.3.1 比表面积测定采用氮气吸附–BET法测定4种单一矿物以及两种复合矿物的比表面积。使用全自动比表面积及孔隙度分析仪(ASAP 2420,美国默瑞提克仪器有限公司)进行分析,测定参数:脱气温度120 ℃,脱气时间6 h,进样量约0.2 g。
1.3.2 红外光谱(FTIR)分析将蒙脱石、针铁矿、三水铝石以及两种复合矿物采用溴化钾压片法,在傅里叶变换红外光谱仪(Nicolet 8700,Nicolet Analytical Instruments,USA)上进行分析,测定波数范围为400 ~ 4 000 cm-1,分辨率是4 cm-1,扫描64次。
1.3.3 zeta电位测定将4种单一矿物以及两种复合矿物分别配制成0.2 g/L的矿物悬液,使用NaCl溶液将悬液的离子强度调节至1 mmol/L,用NaOH或HCl将悬液pH调节至6.50(与矿物–重金属等温吸附试验条件保持一致)。悬液经超声波充分分散后静置15 h,取上层稳定矿物悬液,采用zeta电位分析仪(ZetaPlus,Brookhaven Instruments,New York,USA)分析测定其zeta电位,每个样品重复测定2次。
1.3.4 表面位点浓度分析采用电位滴定法测定4种单一矿物以及两种复合矿物表面的总吸附位点浓度。为避免CO2的干扰,用预煮沸的去离子水分别制备浓度为10 g/L的矿物悬液,用NaCl溶液将离子强度调节至1 mmol/L。在25 ℃、持续通入氮气、持续搅拌(80 r/min)的情况下,使用自动电位滴定仪(T50, Mettler Toledo Inc.,Columbus,OH,USA)对矿物悬浮液进行酸碱滴定,滴定过程中使用复合玻璃pH电极(DGi 115-SC,Mettler Toledo Inc.,Columbus,OH,USA)测定pH。具体为:首先,用HCl溶液(0.098 mol/L)将悬液滴定至pH 3.00,然后用NaOH溶液(0.098 mol/L)滴定至pH 10.00。HCl和NaOH溶液以动态平衡模式添加:每次滴定至少稳定20 s,直到体系pH变化 < 0.4/(mV·min) 时认为体系酸碱反应达到平衡,然后记录pH并添加下一滴滴定剂。在相同的条件下,进行不添加矿物的空白滴定试验。每个试验重复2次。矿物表面位点总浓度为从pH 3.00滴定到pH 10.00过程中矿物消耗的OH-量与空白试验消耗量之差(μmol/g)[28]。
1.3.5 矿物微观形貌扫描电镜(SEM)观察将4种单一矿物以及两种复合矿物样品研磨至200目,真空镀铂后在拉曼场发射扫描电子显微镜(FESEM;MAIA 3 GMU,Tescan,Seoul,Korea)上进行微观形貌观察。工作电压为20 kV,输入速率约为30 kcps。
1.4 矿物–重金属等温吸附试验和元素分布EDS分析采用化学平衡试验法研究针铁矿、三水铝石、高岭石、蒙脱石、针铁矿–蒙脱石复合物和三水铝石–蒙脱石复合物对Cr(Ⅵ) 和As(Ⅴ) 的吸附。具体为:将5 g/L的矿物悬液与不同浓度的Cr(Ⅵ) 溶液(单一矿物:0 ~ 1 000 μmol/L;复合矿物:0 ~ 800 μmol/L)或As(Ⅴ) 溶液(单一矿物:0 ~ 1 000 μmol/L;复合矿物:0 ~ 600 μmol/L)混合,用HCl和NaOH调节体系pH为6.50,用NaCl溶液调节体系离子强度至1 mmol/L;将混合体系在25 ℃下,以200 r/min的速度在摇床中振荡4 h;反应平衡后,将混合物使用高速离心机(日立高速冷冻离心机CR22N/CR21N,上海合商科学仪器有限公司)离心分离(10 000 g × 5 min),上清液使用0.45 μm的微孔滤膜(25 mm×0.45 μm,南京荣华科学器材有限公司)过滤。采用二苯碳酰胺分光光度(DPC)法[29]测定滤液中的Cr(Ⅵ) 浓度,采用电感耦合等离子质谱法(ICP-MS)测定As(Ⅴ) 浓度。
用差减法计算Cr(Ⅵ) 和As(Ⅴ) 吸附量Qe(μmol/g):
| $ {Q_\text{e}} = \frac{{\left( {{C_0} - {C_\text{e}}} \right) \times V}}{m} $ | (1) |
式中:C0和Ce分别为初始浓度和吸附平衡浓度(μmol/L);V为溶液体积(L);m为矿物用量(g)。
使用Langmuir方程对等温吸附数据进行拟合,方程表达式为:
| $ {Q_\text{e}} = \frac{{{A_\text{max}} \times k \times {C_\text{e}}}}{{1 + k \times {C_\text{e}}}} $ | (2) |
式中:Qe表示单位质量矿物对离子的吸附量(μmol/g);Ce为吸附平衡时溶液中离子浓度(μmol/L);Amax表示矿物对阴离子的最大吸附容量(μmol/g);k为吸附亲和力常数(μL/μmol)。
采用X射线能量色散谱(EDS)法分析针铁矿、蒙脱石和针铁矿–蒙脱石复合物吸附Cr(Ⅵ) 和As(Ⅴ)后的元素分布。具体为:分别将5 g/L的针铁矿、蒙脱石和针铁矿–蒙脱石复合物矿物悬液与1 000 μmol/L的Cr(Ⅵ) 或As(Ⅴ) 溶液混合,调节pH至6.50,离子强度至1 mmol/L。其余吸附步骤参照上述化学平衡试验方法。离心分离后,将离心管管底的沉淀物用去离子水洗涤3次,冷冻干燥,研磨过200目筛备用。将样品真空镀铂,使用能量色散X射线能谱仪(EDS;Ultim Max 170,Oxford Instruments,Abingdon,UK)扫描输出矿物表面元素的点扫和面扫分布图。
2 结果与分析 2.1 矿物复合体的表面性质供试矿物比表面积如表 1所示。4种单一矿物的比表面积大小顺序为:蒙脱石 > 针铁矿 > 高岭石 > 三水铝石,供试三水铝石的比表面积较小,仅4.16 m2/g。针铁矿–蒙脱石复合物(质量比1∶1)和三水铝石–蒙脱石复合物(质量比1∶1)的比表面积分别介于两两复合的矿物单体之间。假设复合体中矿物无相互作用,那么复合体的比表面积理论上等于各单一矿物的比表面积与其在复合体中百分含量乘积之和,本研究中为两种单一矿物比表面的平均值(因为质量比为1∶1)。针铁矿–蒙脱石复合体的比表面积(52.7 m2/g)与两种纯矿物比表面积的平均值(52.45 m2/g)接近,但三水铝石–蒙脱石复合体比表面积(27.37 m2/g)则低于两种矿物单体的平均比表面积(31.37 m2/g)。因此,蒙脱石与三水铝石的复合降低了矿物的比表面积,而其与针铁矿的互作对比表面积影响不大。
|
|
表 1 供试矿物的比表面积、zeta电位、表面位点总浓度 Table 1 Specific surface areas, zeta potentials, and total surface site concentrations of tested minerals |
在pH 6.50、离子强度为1 mmol/L (NaCl)条件下供试矿物的zeta电位结果(表 1)显示,针铁矿和三水铝石的zeta电位为正值,说明这两种氧化物均带正电荷;两种层状硅酸盐矿物的zeta电位为负值,说明其表面带负电荷。针铁矿与蒙脱石复合后,复合体的zeta电位(–19.75 mV)介于两种矿物单一体系zeta电位之间:针铁矿表面的正电荷被蒙脱石表面的负电荷完全中和,而蒙脱石表面的负电荷也有所减少,与前人的结果一致[22]。因此,矿物之间的相互作用使蒙脱石表面负电荷和针铁矿表面正电荷均减少。三水铝石–蒙脱石复合体的zeta电位(–28.02 mV)远低于三水铝石单一体系的zeta电位(19.19 mV),而与单一蒙脱石体系的zeta电位(–26.44 mV)相近。说明二者的相互作用完全中和了三水铝石的表面正电荷,但对蒙脱石表面负电荷的影响很小。这说明与蒙脱石相比,供试三水铝石的比表面积和表面位点浓度均较低(表 1),复合后其对复合体的表面电荷贡献占比几乎可以忽略。
基于酸碱电位滴定测定的供试矿物表面位点浓度结果(表 1)表明,蒙脱石的表面位点总浓度最大,其次是高岭石,三水铝石最少。假设复合体中矿物之间没有相互作用,那么复合体的表面位点总浓度理论上应等于各单一矿物的表面位点总浓度与其在复合体中的百分含量乘积之和,本研究中为两种单一矿物表面位点总浓度的平均值(因为质量比为1∶1)。针铁矿–蒙脱石复合体的表面位点总浓度介于两单一矿物之间,但明显低于理论值;三水铝石–蒙脱石复合体的表面位点总浓度与两种单一矿物的平均值相比没有明显变化。可见,蒙脱石与针铁矿之间的相互作用会使矿物表面位点总浓度减少,但其与三水铝石的交互作用对矿物表面位点总浓度影响不大。
2.2 矿物复合体的红外光谱蒙脱石、针铁矿、三水铝石、三水铝石–蒙脱石复合体和针铁矿–蒙脱石复合体的红外光谱如图 1所示。蒙脱石红外光谱的主要吸收峰归属如下:3 400 ~ 3 600和1 300 ~ 1 650、1 031和464、915和842以及798和518 cm-1分别为蒙脱石表面H–OH的伸缩振动和内外表面弯曲振动、Si–O的伸缩振动和弯曲振动、Al–Al–OH和Al–Mg–OH的弯曲振动以及Al–O–Si的面外和面内弯曲振动。单一针铁矿红外光谱中3 412、3 142、888、795和644 cm-1处吸收峰分别为表面H–OH的伸缩振动、Fe–OH的伸缩振动、Fe–OH的面内弯曲振动、Fe–OH的面外弯曲振动和Fe–O的伸缩振动频率。三水铝石单体的红外光谱中,3 620、3 526和3 451 cm-1附近的吸收带均可归属于其表面H–OH的伸缩振动,1 635和1 382 cm-1处为H–OH的内外表面弯曲振动,968 cm-1处出现Al–OH的弯曲振动。
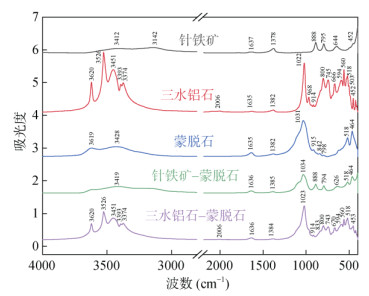
|
图 1 三水铝石、蒙脱石、针铁矿、针铁矿–蒙脱石复合体和三水铝石–蒙脱石复合体的红外光谱图 Fig. 1 Infrared transmittance spectra of gibbsite, montmorillonite, goethite, goethite-montmorillonite and gibbsite-montmorillonite |
与单一蒙脱石相比,针铁矿–蒙脱石复合体红外光谱在915 cm-1(Al–Al–OH的弯曲振动)吸收峰强度明显减弱,三水铝石–蒙脱石复合体的红外光谱没有发生明显改变。与单一针铁矿相比,针铁矿–蒙脱石复合体中3 142 cm-1(Fe–OH的伸缩振动)的吸收峰强度明显减弱,Fe–O的伸缩振动向低频位移至626 cm-1处;三水铝石的吸收带在三水铝石–蒙脱石复合体中均没有发生明显位移。
以上结果表明,针铁矿与蒙脱石复合过程中存在化学键作用,而三水铝石与蒙脱石之间可能没有化学作用,以物理作用为主。
2.3 矿物复合体的微观形貌4种单一矿物以及两种复合矿物的微观形貌如图 2所示。高岭石和蒙脱石均呈细小麟片状,三水铝石为颗粒尺寸 < 2 μm的六边形片状体,针铁矿呈针状。4种单体的微观形貌均和其常见形貌吻合,说明供试矿物纯度较高,具有良好的代表性。三水铝石–蒙脱石复合体中,可以发现两种片状矿物单体的复合体,视野中已无大量的三水铝石规则六边形出现。针铁矿–蒙脱石复合体中,矿物发生了明显的团聚现象,针铁矿紧紧包被在蒙脱石表面,只有少部分蒙脱石裸露在外。这些微观形貌直观地说明氧化物与层状硅酸盐矿物的确发生了结合。

|
图 2 高岭石、蒙脱石、三水铝石、针铁矿、针铁矿–蒙脱石复合体和三水铝石–蒙脱石复合体的SEM图 Fig. 2 SEM micrographs of kaolinite, montmorillonite, gibbsite, goethite, goethite-montmorillonite and gibbsite-montmorillonite complexes |
在pH 6.50、背景电解质NaCl浓度为1 mmol/L时,单一矿物高岭石、蒙脱石、针铁矿、三水铝石及针铁矿–蒙脱石和三水铝石–蒙脱石两种复合矿物对Cr(Ⅵ) 和As(Ⅴ) 的吸附等温线如图 3所示。
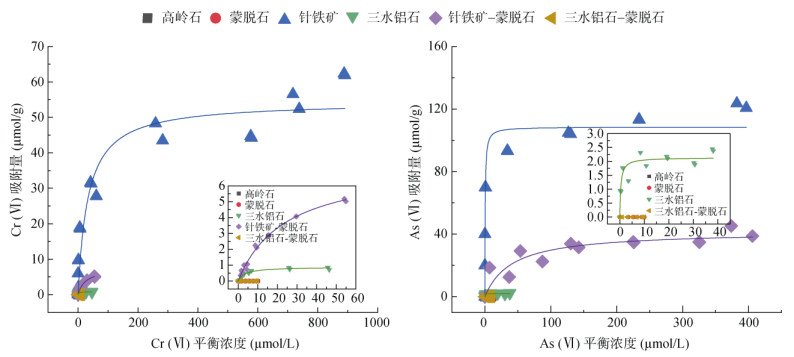
|
(在pH 6.50、背景电解质NaCl浓度为1 mmol/L时,高岭石、蒙脱石和三水铝石–蒙脱石复合体的等温吸附曲线为y=0) 图 3 高岭石、蒙脱石、三水铝石、针铁矿、针铁矿–蒙脱石复合体和三水铝石–蒙脱石复合体对Cr(Ⅵ)和As(Ⅴ) 的等温吸附曲线 Fig. 3 Adsorption isotherms of Cr (Ⅵ) and As (Ⅴ) by kaolinite, montmorillonite, gibbsite, goethite, goethite-montmorillonite and gibbsite-montmorillonite |
对于单一矿物体系,随初始浓度增加,针铁矿和三水铝石对Cr(Ⅵ) 和As(Ⅴ) 的吸附量逐渐增大,但增加的幅度越来越小,直至基本达到平衡。针铁矿对Cr(Ⅵ) 和As(Ⅴ) 吸附能力大于三水铝石,且针铁矿的吸附量也远大于三水铝石;而高岭石和蒙脱石的吸附量则低于检测限。针铁矿与蒙脱石复合后,对两种金属离子的吸附等温线的趋势与针铁矿单体保持一致,但吸附能力较针铁矿明显减弱;三水铝石–蒙脱石复合体的吸附量低于检出限。
表 2显示了针铁矿、三水铝石和针铁矿–蒙脱石复合物等温吸附数据的Langmuir方程拟合结果。结果表明,Langmuir方程可以较好地描述3种矿物样品对Cr(Ⅵ) 和As(Ⅴ) 的吸附(R2 > 0.8,P < 0.01)。针铁矿对Cr(Ⅵ) 和As(Ⅴ) 的最大吸附量分别达到了48.31 μmol/g和108.52 μmol/g,三水铝石对Cr(Ⅵ) 和As(Ⅴ) 的最大吸附量较小。对比针铁矿–蒙脱石复合体对As(Ⅴ)和Cr(Ⅵ)的吸附容量和单一针铁矿与蒙脱石的最大吸附量,发现两种矿物复合后的最大吸附量实测值介于两单一矿物的最大吸附量之间,但明显小于两单一矿物的平均值,同样地,三水铝石和蒙脱石复合体最大吸附量的实测值也远低于平均值。这说明与蒙脱石发生交互作用后,针铁矿和三水铝石对Cr(Ⅵ) 和As(Ⅴ) 的吸附能力受到抑制。
|
|
表 2 高岭石、蒙脱石、三水铝石和针铁矿及复合矿物对Cr(Ⅵ) 和As(Ⅴ) 的吸附等温线的Langmuir方程拟合参数 Table 2 Fitted Langmuir isotherm parameters of Cr(Ⅵ) and As(Ⅴ) adsorbed by kaolinite, montmorillonite, gibbsite, goethite and complex minerals |
吸附Cr(Ⅵ) 和As(Ⅴ) 后的蒙脱石、针铁矿和针铁矿–蒙脱石复合体表面元素点扫分布和针铁矿–蒙脱石复合体面扫分布如图 4和图 5所示。在元素点扫图中,蒙脱石表面的Cr(Ⅵ) 和As(Ⅴ) 含量低于EDS的检测限,说明蒙脱石对Cr(Ⅵ) 和As(Ⅴ) 这两种阴离子的吸附量很低;在针铁矿表面Cr(Ⅵ) 和As(Ⅴ) 的含量分别为0.2% 和0.7%;在针铁矿–蒙脱石复合矿物中Cr(Ⅵ)和As(Ⅴ)的含量分别为0.1% 和0.3%。这一结果佐证了等温吸附试验的结果,即矿物对Cr(Ⅵ) 和As(Ⅴ) 的吸附量遵循以下排序:针铁矿 > 蒙脱石–针铁矿复合体 > 蒙脱石,进一步说明,与蒙脱石的互作会降低针铁矿对Cr(Ⅵ) 和As(Ⅴ) 的吸附能力。

|
图 4 吸附Cr(Ⅵ)后的蒙脱石、针铁矿和针铁矿–蒙脱石复合体表面元素点扫分布图(A)和针铁矿–蒙脱石复合体面扫分布图(B) Fig. 4 Point sweep distribution diagrams of elements on surfaces of montmorillonite, goethite and goethite-montmorillonite after Cr(Ⅵ) adsorption (A) and decent sweep distribution diagram of goethite-montmorillonite (B) |

|
图 5 吸附As(Ⅴ) 后的蒙脱石、针铁矿和针铁矿–蒙脱石复合体表面元素点扫分布图(A)和针铁矿–蒙脱石复合体面扫分布图(B) Fig. 5 Point sweep distribution diagrams of elements on surface of montmorillonite, goethite and goethite-montmorillonite after As(Ⅴ) adsorption (A) and decent sweep distribution diagram of goethite-montmorillonite (B) |
在针铁矿–蒙脱石–Cr(Ⅵ) 的EDS面扫图中,Cr(Ⅵ) 的分布图与铁(Fe)的分布图相似,说明Cr(Ⅵ) 主要吸附于复合体的针铁矿表面,这一结果与吸附试验中针铁矿吸附Cr(Ⅵ) 的能力较强相符。同时,Cr(Ⅵ) 与铝(Al)、硅(Si)(来自蒙脱石)分布也比较一致,但等温吸附试验的结果表明蒙脱石对Cr(Ⅵ) 几乎没有吸附能力(图 3与表 2),其原因可能是复合体中针铁矿在蒙脱石表面分布比较均匀,从而使与Fe结合的Cr(Ⅵ) 在空间分布上与Al和Si相似。与Cr(Ⅵ) 类似,As(Ⅴ) 的面扫分布图与Fe的分布图也呈现出高度的一致性,证实在针铁矿–蒙脱石复合体中,As(Ⅴ) 也主要吸附于针铁矿表面。
上述EDS分析结果与等温吸附试验结果都证明,针铁矿对Cr(Ⅵ) 和As(Ⅴ) 的吸附能力较强,但与蒙脱石复合后,其吸附会受到较强的抑制。
3 讨论等温吸附试验结果(图 3、表 2)和EDS元素分布结果(图 4、图 5)表明,针铁矿和三水铝石与蒙脱石复合后,其对As(Ⅴ) 和Cr(Ⅵ) 吸附会受到抑制,这主要是因为铁铝氧化物与层状硅酸盐矿物之间的交互作用影响了矿物的表面性质。首先,矿物之间的交互作用改变了其表面电荷性质。与蒙脱石复合后,针铁矿和三水铝石表面的净正电荷均大幅减少,电荷的符号发生反转(表 1)。前人的试验结果表明,氧化铁的存在,降低了高岭石表面的有效负电荷密度,导致体系的zeta电位–pH曲线向正值方向位移[30]。Sumner和Reeve[31]在研究中也发现,铁氧化物与高岭石发生胶结作用后,其表面大量的正电荷被高岭石所带的负电荷中和。矿物表面的电荷性质是影响其对离子吸附能力的主要因素。研究表明,针铁矿与带负电荷的细菌相互作用后其表面正电荷也会大量减少,从而使其对HPO4-的吸附能力显著减弱[32]。因此,本研究中,矿物交互作用对Cr(Ⅵ) 和As(Ⅴ) 吸附的抑制可能也与针铁矿和三水铝石的表面正电荷被蒙脱石反转有关。
其次,矿物之间的相互作用改变了其表面位点浓度和官能团性质。蒙脱石与针铁矿之间的相互作用使其总表面位点浓度减少(表 1),即部分As(Ⅴ)、Cr(Ⅵ) 吸附位点被矿物间的互作所掩蔽。复合体的SEM结果表明,针铁矿紧密包裹在蒙脱石表面(图 2),这显然会使矿物暴露的外表面积减少。此外,蒙脱石属于2∶1型层状硅酸盐矿物,有很强的膨胀性[33],纳米级针铁矿可能进入蒙脱石的层间,导致针铁矿的表面位点浓度进一步减少[21]。Li等[34]在用氧化铁改性蒙脱石时发现,Fe会进入蒙脱石的层间进而影响矿物层间距等晶层结构,并导致矿物羟基数量减少。沸石与有机质复合后,其表面的活性位点会被占据,沸石对Cd2+的吸附量从3.13 mg/g降为2.27 mg/g [35]。针铁矿–蒙脱石互作对As(Ⅴ)、Cr(Ⅵ) 吸附的抑制效应可能还与矿物表面官能团性质变化有关。针铁矿表面存在羟基,但与蒙脱石复合后表面羟基红外吸收峰强度明显减弱(图 1)。一方面,蒙脱石可以通过物理掩盖作用减少针铁矿表面羟基的数量;另一方面,蒙脱石边面的Si–OH和Al–OH可能与针铁矿表面的Fe–OH发生反应生成Si–O–Fe键或Al–O–Fe键(图 1),进而导致针铁矿对As(Ⅴ)、Cr(Ⅵ) 的专性吸附位点减少,吸附量降低。
最后,矿物之间的交互作用降低了矿物的比表面积。三水铝石和蒙脱石复合后,复合体的比表面积明显减小,但针铁矿–蒙脱石的比表面积与理论值接近(表 1)。本研究中SEM结果(图 2)表明,针铁矿和三水铝石与蒙脱石复合后矿物之间出现了团聚现象,从而导致复合矿物表面吸附位点减少。因此,氧化物与层状硅酸盐矿物复合后比表面积减少,也可能是其对As(Ⅴ) 和Cr(Ⅵ) 吸附能力下降的原因之一。
4 结论1) 铁铝氧化物与层状硅酸盐矿物之间存在相互作用,这种相互作用抑制了氧化物对As(Ⅴ) 和Cr(Ⅵ)的吸附。供试矿物中,针铁矿对As(Ⅴ) 和Cr(Ⅵ) 的吸附能力大于三水铝石,而高岭石和蒙脱石对二者几乎没有吸附。两种铁铝氧化物–层状硅酸盐矿物复合体(针铁矿–蒙脱石及三水铝石–蒙脱石复合体,质量比为1∶1)对As(Ⅴ) 和Cr(Ⅵ) 的吸附容量显著低于两单一矿物吸附量的平均值。
2) 铁铝氧化物和层状硅酸盐矿物发生交互作用后,矿物表面性质发生了改变,这可能是As(Ⅴ) 和Cr(Ⅵ)吸附受到抑制的主要原因。与针铁矿单一体系相比,针铁矿–蒙脱石复合体所带正电荷量减少,表面位点总浓度降低,表面羟基数量减少;与三水铝石和蒙脱石单体相比,三水铝石–蒙脱石复合体的比表面积明显减少。这些表面性质是影响矿物吸附As(Ⅴ) 和Cr(Ⅵ) 这两种阴离子的主要因素。
| [1] |
环境保护部, 国土资源部. 全国土壤污染状况调查公报[EB/OL]. (2014-04-17). https://www.meegov.cn/gkml/sthjbgw/qt/201404/W020140417558995804588.pdf.
(  0) 0) |
| [2] |
Sari A, Tuzen M. Cd(Ⅱ) adsorption from aqueous solution by raw and modified kaolinite[J]. Applied Clay Science, 2014, 88/89: 63-72 DOI:10.1016/j.clay.2013.12.021 (  0) 0) |
| [3] |
张志军, 李亚南, 佟震阳, 等. 高岭石对金属阳离子的吸附特性研究[J]. 矿业科学学报, 2017, 2(3): 294-300 (  0) 0) |
| [4] |
Ertani A, Mietto A, Borin M, et al. Chromium in agricultural soils and crops: A review[J]. Water, Air, & Soil Pollution, 2017, 228(5): 190 (  0) 0) |
| [5] |
吴萍萍. 不同类型矿物和土壤对砷的吸附—解吸研究[D]. 北京: 中国农业科学院, 2011.
(  0) 0) |
| [6] |
Meenakshi S, Sundaram C S, Sukumar R. Enhanced fluoride sorption by mechanochemically activated kaolinites[J]. Journal of Hazardous Materials, 2008, 153(1/2): 164-172 (  0) 0) |
| [7] |
Mohapatra D, Mishra D, Chaudhury G R, et al. Arsenic adsorption mechanism on clay minerals and its dependence on temperature[J]. Korean Journal of Chemical Engineering, 2007, 24(3): 426-430 DOI:10.1007/s11814-007-0073-z (  0) 0) |
| [8] |
Shi M Q, Min X B, Ke Y, et al. Recent progress in understanding the mechanism of heavy metals retention by iron (oxyhydr)oxides[J]. Science of the Total Environment, 2021, 752: 141930 DOI:10.1016/j.scitotenv.2020.141930 (  0) 0) |
| [9] |
Adebayo G B, Adegoke H I, Fauzeeyat S. Adsorption of Cr(Ⅵ) ions onto goethite, activated carbon and their composite: Kinetic and thermodynamic studies[J]. Applied Water Science, 2020, 10(9): 1-18 (  0) 0) |
| [10] |
Mamindy-Pajany Y, Hurel C, Marmier N, et al. Arsenic (Ⅴ) adsorption from aqueous solution onto goethite, hematite, magnetite and zero-valent iron: Effects of pH, concentration and reversibility[J]. Desalination, 2011, 281: 93-99 DOI:10.1016/j.desal.2011.07.046 (  0) 0) |
| [11] |
Ren X H, Zhang Z L, Luo H J, et al. Adsorption of arsenic on modified montmorillonite[J]. Applied Clay Science, 2014, 97/98: 17-23 DOI:10.1016/j.clay.2014.05.028 (  0) 0) |
| [12] |
Jiang S Q, Yan X R, Peacock C L, et al. Adsorption of Cr(Ⅵ) on Al-substituted hematites and its reduction and retention in the presence of Fe2+ under conditions similar to subsurface soil environments[J]. Journal of Hazardous Materials, 2020, 390: 122014 DOI:10.1016/j.jhazmat.2019.122014 (  0) 0) |
| [13] |
Sujana M G, Pradhan H K, Anand S. Studies on sorption of some geomaterials for fluoride removal from aqueous solutions[J]. Journal of Hazardous Materials, 2009, 161(1): 120-125 DOI:10.1016/j.jhazmat.2008.03.062 (  0) 0) |
| [14] |
Arai Y, Sparks D L. Residence time effects on arsenate surface speciation at the aluminum oxide-water interface[J]. Soil Science, 2002, 167(5): 303-314 DOI:10.1097/00010694-200205000-00001 (  0) 0) |
| [15] |
陈英旭, 朱荫湄, 袁可能, 等. 土壤中铬的化学行为研究——Ⅰ. 几种矿物对六价铬的吸附作用[J]. 浙江农业大学学报, 1990, 16(2): 119-124 (  0) 0) |
| [16] |
吴萍萍, 曾希柏. 人工合成铁、铝矿对As(Ⅴ)吸附的研究[J]. 中国环境科学, 2011, 31(4): 603-610 (  0) 0) |
| [17] |
Xu R K, Wang Y, Tiwari D, et al. Effect of ionic strength on adsorption of As(Ⅲ) and As(Ⅴ) on variable charge soils[J]. Journal of Environmental Sciences, 2009, 21(7): 927-932 DOI:10.1016/S1001-0742(08)62363-3 (  0) 0) |
| [18] |
严玉鹏, 王小明, 胡震, 等. 磷酸根在矿物表面的吸附-解吸特性研究进展[J]. 土壤, 2021, 53(3): 439-448 (  0) 0) |
| [19] |
Çengeloğlu Y, Kır E, Ersöz M. Removal of fluoride from aqueous solution by using red mud[J]. Separation and Purification Technology, 2002, 28(1): 81-86 DOI:10.1016/S1383-5866(02)00016-3 (  0) 0) |
| [20] |
Wang Y X, Reardon E J. Activation and regeneration of a soil sorbent for defluoridation of drinking water[J]. Applied Geochemistry, 2001, 16(5): 531-539 DOI:10.1016/S0883-2927(00)00050-0 (  0) 0) |
| [21] |
谭文峰, 周素珍, 刘凡, 等. 土壤中铁铝氧化物与黏土矿物交互作用的研究进展[J]. 土壤, 2007, 39(5): 726-730 (  0) 0) |
| [22] |
Hou T, Xu R K, Zhao A Z. Interaction between electric double layers of kaolinite and Fe/Al oxides in suspensions[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2007, 297(1/2/3): 91-94 (  0) 0) |
| [23] |
刘婷, 郝秀珍, 刘存, 等. 羟基铁柱撑蒙脱石同时吸附水溶液中Cd(Ⅱ)和As(Ⅴ)的研究[J]. 环境科学学报, 2020, 40(7): 2468-2476 (  0) 0) |
| [24] |
邓天天, 马培, 李晗晟. 蒙脱石、铁氧化物及其复合体对水中As(Ⅲ)的吸附效果[J]. 生态与农村环境学报, 2017, 33(3): 252-259 (  0) 0) |
| [25] |
许海娟, 王锐, 魏世勇, 等. 蒙脱石-氧化铁复合体的表征及其对不同形态磷的吸附特性[J]. 土壤学报, 2019, 56(6): 1381-1389 (  0) 0) |
| [26] |
Atkinson R J, Posner A M, Quirk J P. Adsorption of potential-determining ions at the ferric oxide-aqueous electrolyte interface[J]. The Journal of Physical Chemistry, 1967, 71(3): 550-558 DOI:10.1021/j100862a014 (  0) 0) |
| [27] |
魏世勇, 杨小洪. 针铁矿-高岭石复合体的表面性质和吸附氟的特性[J]. 环境科学, 2010, 31(9): 2134-2142 (  0) 0) |
| [28] |
Jodin M C, Gaboriaud F, Humbert B. Limitations of potentiometric studies to determine the surface charge of gibbsite γ-Al(OH)3 particles[J]. Journal of Colloid and Interface Science, 2005, 287(2): 581-591 DOI:10.1016/j.jcis.2005.02.032 (  0) 0) |
| [29] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000
(  0) 0) |
| [30] |
徐仁扣, 肖双成. 氧化铁的存在方式对土壤和黏土矿物胶体动电电位的影响[J]. 土壤学报, 2009, 46(5): 945-947 (  0) 0) |
| [31] |
Sumner M E, Reeve N G. The effect of iron oxide impurities on the positive and negative adsorption of chloride by kaolinites[J]. Journal of Soil Science, 1966, 17(2): 274-279 DOI:10.1111/j.1365-2389.1966.tb01473.x (  0) 0) |
| [32] |
Hong Z N, Li J Y, Jiang J, et al. Presence of bacteria reduced phosphate adsorption on goethite[J]. European Journal of Soil Science, 2015, 66(3): 406-416 DOI:10.1111/ejss.12247 (  0) 0) |
| [33] |
Yu T R, Ji G L. Chemistry of variable charge soils[M].
Oxford University Press, New York, 1997
(  0) 0) |
| [34] |
Li K W, Lu H L, Nkoh J N, et al. The important role of surface hydroxyl groups in aluminum activation during phyllosilicate mineral acidification[J]. Chemosphere, 2023, 313: 137570 DOI:10.1016/j.chemosphere.2022.137570 (  0) 0) |
| [35] |
Zhou W J, Ren L W, Zhu L Z. Reducement of cadmium adsorption on clay minerals by the presence of dissolved organic matter from animal manure[J]. Environmental Pollution, 2017, 223: 247-254 DOI:10.1016/j.envpol.2017.01.019 (  0) 0) |
2. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China
 2023, Vol. 55
2023, Vol. 55


