2. 生态环境部南京环境科学研究所, 南京 210042
莠去津,又名阿特拉津,属于三嗪类除草剂,是世界上使用最广泛的除草剂之一。截至2020年10月,我国所登记的莠去津单剂共246种,混剂共486种,莠去津使用量逐年递增[1]。莠去津对一年生禾本科杂草、阔叶杂草和某些多年生杂草都有一定的抑制作用[2],被广泛用于林业幼林抚育期间化学除草以及农业尤其是谷类作物除草。作为一种常见的土壤污染物,莠去津进入土壤会危及土地环境安全,影响其生态服务功能[3]。
在使用中,大部分莠去津除了直接进入土壤,附着在作物上、扩散于大气中的莠去津也会因风吹雨淋进入土壤。由于其性质的特殊性,莠去津在土壤中的残留时间长,半衰期最长可达399 d[4]。研究表明,许多农田土壤存在莠去津的残留,不仅影响了土壤理化性质,降低了土壤肥力,还因其难降解、残效期长,对后继作物产生了一定毒害作用[5]。我国温室和开放农田土壤中莠去津峰值分别为137 mg/kg和134 mg/kg,且大部分温室土壤中莠去津浓度显著高于周边农田土壤[6]。三江平原农田土壤中莠去津平均浓度为79.32 mg/kg,存在潜在生态风险[7]。
许多研究证实,莠去津会对土壤生态系统造成不同程度的伤害[8]。例如,当土壤中莠去津含量超过0.5 mg/kg时将影响水稻等敏感作物的生长[9];植株受药后会发生叶片变黄、生物量减少[10]、株高根重降低[11]甚至死亡的现象[12]。另外,莠去津会对土壤生物如蚯蚓、线虫的生长发育和运动行为产生严重损伤,影响其正常的生命活动[13-14],且一般通过氧化胁迫效应、DNA损伤以及影响生理相关基因表达等方式造成土壤生物群体破坏甚至死亡[15-16]。
国内学者关于莠去津对土壤动物影响的研究主要集中在毒性机制方面,蚯蚓的毒性试验主要在滤纸或人工土壤中进行。有研究表明,林木根际土壤中的莠去津降解速度快于非根际土[17]。而目前尚未有关于莠去津对森林土壤中蚯蚓毒性效应的研究。因此,本研究拟通过室内模拟的方法探索3种不同森林土壤中莠去津对蚯蚓的毒性效应,以期为评估莠去津使用对森林土壤生物的环境风险提供依据。
1 材料与方法 1.1 试验材料 1.1.1 受试生物试验蚯蚓为赤子爱胜蚓(Eisenia foetida),购自南京市江宁区蚯蚓养殖场。挑选2 ~ 3月龄、生殖环明显、个体重量为450 ~ 500 mg、大小约一致的健康成年蚯蚓作为试验生物。
1.1.2 供试土壤供试土壤分别取自南京市玄武区紫金山(土壤类型为黄棕壤,植被为竹林),六合区方山(土壤类型为黄棕壤性土,植被为落叶阔叶林和针阔叶混交林)以及江宁区青龙山(土壤类型为石灰土,植被为落叶阔叶林)。经与当地管理部门确认,采样点土壤两年内未施用任何农药,也未涉及相关的农事操作。采用五点采样法采集0 ~ 20 cm土层新鲜土壤,采样时去除土壤中的石块,并充分混匀后置于自封袋带回实验室。部分样品立即过40目筛去除小石子和植物根系等残渣,置于4 ℃冰箱种保存备用,用于莠去津对蚯蚓的毒性试验研究;部分样品风干后保存,用于测定土壤的基本理化性质。试验土壤的主要理化性质见表 1。
|
|
表 1 试验土壤的主要理化性质 Table 1 Main physiochemical properties of tested soil |
莠去津,纯度为95%,购于捷马化工股份有限公司;丙酮,分析纯。
1.2 试验方法 1.2.1 试验前蚯蚓预养试验前将蚯蚓置于与试验过程相同的环境条件(温度20 ℃ ± 2 ℃,湿度80% ± 2%,光照500 ~ 700 Lux,光暗时间比14 h∶10 h,添加牛粪作为营养物质)下预养7 d。
1.2.2 莠去津准备称取2.105 3 g的莠去津(纯度为95%),加丙酮溶解定容至100 mL,配制成浓度为20 g/L的母液。取部分母液分别加入适量丙酮配制成100、10、1、0.1 mg/mL的工作液。
1.2.3 莠去津暴露试验共设计6种莠去津暴露浓度处理,分别为0、40、80、160、320、480 mg/kg土。按照设定的浓度处理,分别称取500 g新鲜土壤加入1 L标本瓶中,从中取10 g土壤加入不同浓度药液,混匀,平铺放入通风橱中风干6 h,待丙酮完全挥发后,将处理过的土壤混入标本瓶中,得到不同莠去津含量的受试土壤,同时设置空白对照(CK1:不加药,只加水)和溶剂对照(CK2:不加药,只加丙酮和水)。每个标本瓶中放入10条已在无药土壤样品中预培养的蚯蚓作为1个处理,并用纱布封口。每个处理均设3个重复。从保存的新鲜土壤中取样置于105 ℃条件下烘干称重,测定其含水量。各处理加入适量的去离子水以调节土壤水分含量达到干重的30% ~ 35%,充分搅拌,混匀。将各处理标本瓶放入培养箱(温度20℃ ± 2 ℃,湿度80% ± 2%,光照500 ~ 700 Lux,光暗时间比14 h∶10 h)内培养。试验培养周期为5周,培养过程中每天不定时用水分速测仪PR1测量土壤水分,保持土壤水分在30% ~ 35%。
1.2.4 毒性效应测定在试验培养7、14、21、28和35 d时,分别观察记录蚯蚓的死亡数和鲜重,计数时以尾部对机械刺激无反应视为死亡,蚯蚓死亡后应及时被清除。在培养0和35 d时测量蚯蚓体宽。测定蚯蚓鲜重前,先用滤纸吸收蚯蚓皮肤表面的水分。测定蚯蚓体宽时,先用滤纸吸收蚯蚓皮肤表面的水分,并待蚯蚓不再蠕动时,使用游标卡尺进行测定。
1.2.5 数据分析使用SPSS 25.0软件以莠去津有效浓度为自变量(x),蚯蚓死亡率、鲜重和体宽的变化量为因变量(y),分别建立药剂与蚯蚓各指标的回归方程,统计分析半数致死浓度(LC50)、蚯蚓鲜重和体宽的半效应浓度(EC50)及95% 置信限,对LC50和EC50与土壤各理化性质做相关性分析,计算相关系数。
2 结果与分析 2.1 莠去津对蚯蚓死亡率的影响由图 1可知,3种土壤中各莠去津暴露浓度组蚯蚓的死亡率随着时间的延长而上升,且暴露浓度越高,蚯蚓的死亡率越高。暴露7 d时,黄棕壤和黄棕壤性土中,160、320、480 mg/kg三个浓度组蚯蚓的死亡率与对照组相比,具有显著差异,而前三者间也存在显著差异,说明在这两种土壤中短期高浓度(160、320、480 mg/kg)莠去津暴露对蚯蚓的致死效应较强。暴露14 d时,黄棕壤性土中80 mg/kg浓度组蚯蚓的死亡率与对照组相比,出现显著差异(P < 0.05);石灰土中各浓度组中均逐渐出现蚯蚓死亡的现象。暴露21 d时,黄棕壤中80 mg/kg浓度组蚯蚓死亡率与对照组相比,也出现显著差异(P < 0.05)。暴露28和35 d时,黄棕壤和黄棕壤性土中各浓度组蚯蚓死亡率与对照组相比,均存在显著差异(P < 0.05);石灰土中,除40 mg/kg浓度组外,各浓度组与对照组相比,也均存在显著差异(P < 0.05)。
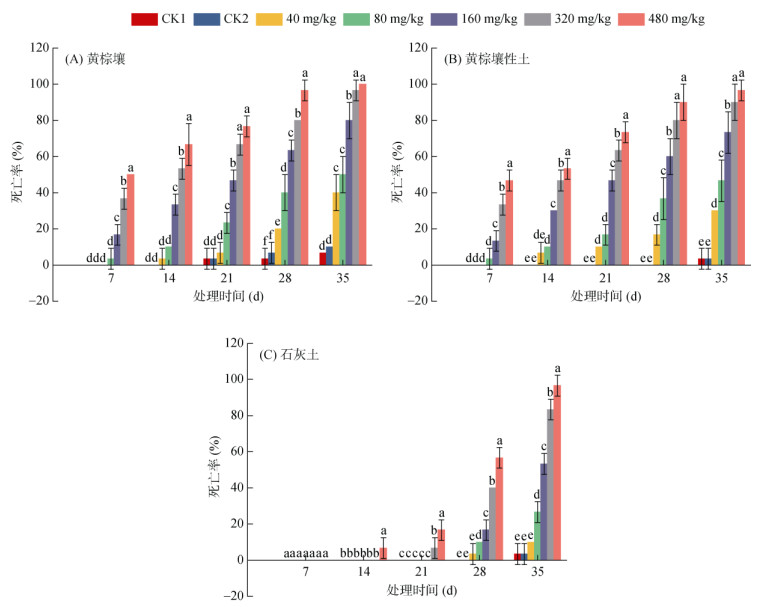
|
(图中不同小写字母表示同一时间不同处理间差异在P < 0.05水平显著,下同) 图 1 三种土壤中不同莠去津浓度暴露后蚯蚓死亡率随时间的响应 Fig. 1 Responses of earthworm mortality to time after exposure to different atrazine concentrations in three soils |
由表 2可以看出,试验期间,3种土壤中蚯蚓死亡率的LC50随着时间的延长而逐渐减小,说明3种土壤中莠去津对蚯蚓的致死效应均随着时间的延长而逐渐增强。不同土壤中莠去津对蚯蚓的致死效应存在差异。莠去津暴露7 d时,LC50表现为黄棕壤 < 黄棕壤性土,而石灰土中未观察到蚯蚓死亡;暴露14、21、28和35 d时,蚯蚓的LC50均表现为黄棕壤 < 黄棕壤性土 < 石灰土。可见,莠去津暴露浓度相同时,黄棕壤中的蚯蚓受到的致死效应最强,石灰土中的蚯蚓受到的致死效应最弱。
|
|
表 2 不同土壤中莠去津对蚯蚓的致死效应 Table 2 Lethal effects of atrazine on earthworms in different soils |
由图 2可知,3种土壤中除40 mg/kg浓度组外,其他各浓度组蚯蚓鲜重随着时间的延长均出现了显著的下降,且浓度越高,鲜重降低越多。
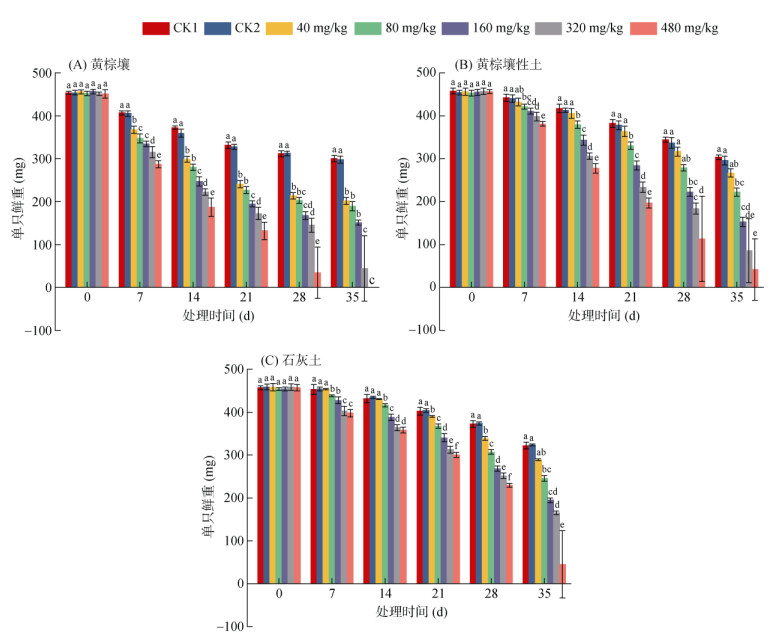
|
图 2 三种不同土壤中不同莠去津浓度暴露后蚯蚓鲜重随时间的响应 Fig. 2 Responses of earthworm fresh weight to time after exposure to different atrazine concentrations in three different soils |
试验期间,黄棕壤中各浓度组蚯蚓鲜重与对照组相比,均存在显著差异(P < 0.05),说明黄棕壤中40 mg/kg的莠去津暴露即可对蚯蚓鲜重产生明显的抑制作用。黄棕壤性土和石灰土中,除40 mg/kg浓度组外,其余浓度组蚯蚓鲜重与对照组相比,均存在显著差异(P < 0.05),说明上述两种土壤中80 mg/kg及以上浓度的莠去津暴露均对蚯蚓鲜重存在明显的抑制作用(P < 0.05),且暴露35 d时最大可观察无效应浓度(NOEC)值均为40 mg/kg。
由表 3可以看出,3种土壤中蚯蚓鲜重的EC50随着时间的延长而逐渐减小,说明3种土壤中莠去津对蚯蚓体重的抑制作用均随着时间的延长而逐渐增强。不同土壤中莠去津对蚯蚓体重的抑制作用存在差异。暴露7 d时,蚯蚓鲜重的EC50表现为黄棕壤性土 > 石灰土 > 黄棕壤,其中黄棕壤性土和石灰土中蚯蚓鲜重的EC50值极为接近,均远高于黄棕壤;暴露14、21、28和35 d时,蚯蚓鲜重的EC50均表现为黄棕壤 < 黄棕壤性土 < 石灰土。说明莠去津暴露浓度相同时,黄棕壤中蚯蚓体重受到的抑制作用最强,暴露后7 d内黄棕壤性土和石灰土中蚯蚓体重受到的抑制作用相近,而暴露7d后,石灰土中的蚯蚓体重受到的抑制作用最弱。
|
|
表 3 不同土壤中莠去津对蚯蚓鲜重的影响 Table 3 Effects of atrazine on earthworm fresh weight in different soils |
由图 3可知,3种土壤中莠去津对蚯蚓体宽的抑制作用均随浓度的增加而增加。暴露35 d时,黄棕壤和黄棕壤性土中,高浓度组(320、480 mg/kg)蚯蚓体宽与对照组相比,存在显著差异(P < 0.05);石灰土中,仅480 mg/kg浓度组蚯蚓体宽与对照组存在显著差异(P < 0.05)。该结果表明高浓度的莠去津暴露对蚯蚓体宽存在明显的抑制作用。
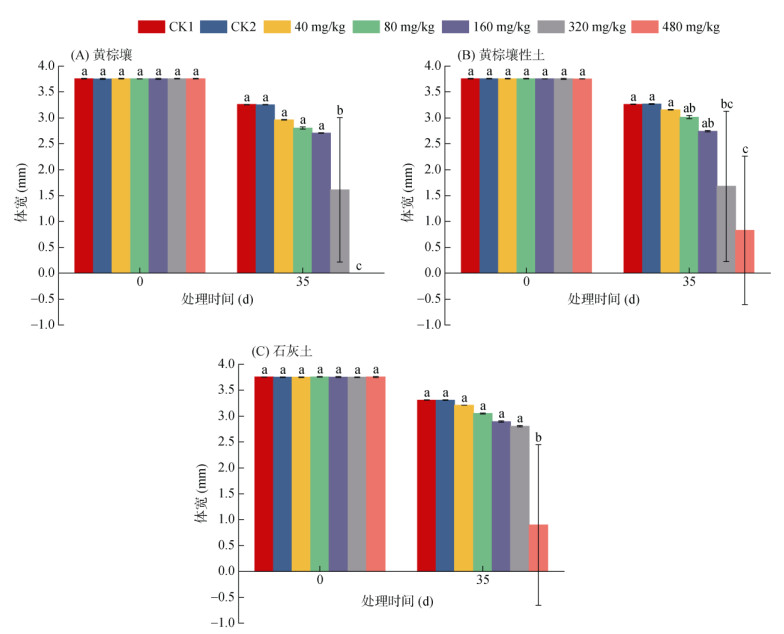
|
图 3 三种不同土壤中不同莠去津浓度暴露后蚯蚓体宽随时间的响应 Fig. 3 Responses of earthworm width to time after exposure to different atrazine concentrations in three different soils |
由表 4可以看出,不同土壤中莠去津对蚯蚓体宽的抑制作用存在差异。暴露35 d时,蚯蚓体宽的EC50值表现为黄棕壤 < 黄棕壤性土 < 石灰土,说明莠去津暴露浓度相同时,黄棕壤中的蚯蚓体宽受到的抑制作用最强,石灰土中的蚯蚓体宽受到的抑制作用最弱。
|
|
表 4 不同土壤中莠去津对蚯蚓体宽的影响 Table 4 Effects of atrazine on earthworm body width in different soils |
从表 5可以看出,试验期间,蚯蚓的毒性效应终点(LC50、鲜重EC50、体宽EC50)与土壤pH、有机质和全氮含量呈正相关关系,与土壤全磷、有效磷、水解性氮、速效钾、全钾含量呈负相关关系,相关性大小表现为有效磷 > 全磷 > 有机质 > pH > 水解性氮 > 速效钾 > 全氮 > 全钾。相对于其他土壤性质指标,莠去津对蚯蚓的毒性作用与土壤有机质、有效磷和全磷具有较好的相关性。
|
|
表 5 蚯蚓属性与土壤理化性质的相关系数 Table 5 Correlation coefficients of earthworm properties with soil physiochemical properties |
土壤中蚯蚓的数量是评价土壤肥力和反映土壤健康状况的生物学指标[18],蚯蚓数量越多,说明土壤越肥沃[19]。蚯蚓处于土壤食物链的底层,日常活动在土壤浅层,极易接触到农药,是土壤农药污染的直接受害者,所以蚯蚓也被用作土壤农药残留的预警生物[20]。
本试验结果表明,3种土壤中蚯蚓鲜重和体宽受抑制作用随着污染暴露时间延长而增强,死亡率随污染暴露时间增长而升高,且莠去津浓度越高,抑制作用越强,呈现明显的时间–效应关系和剂量–效应关系。刘嫦娥[21]采用野外土壤进行14 d的蚯蚓毒性试验,测定不同浓度莠去津下不同时间蚯蚓鲜重的变化,研究发现,第1周各浓度组蚯蚓鲜重降幅均大于第2周,处理组蚯蚓鲜重随着时间的延长持续降低,且暴露浓度越高,蚯蚓鲜重降低越大;徐建等[16]采用滤纸法研究莠去津对蚯蚓的毒性,发现40 mg/L莠去津暴露24 h内,蚯蚓死亡率仅为10%,而50 mg/L莠去津暴露48 h内,死亡率达到90%;胡玲等[22]研究不同浓度下莠去津对蚯蚓的致死效应,结果表明,在40 mg/kg浓度下48 h时蚯蚓出现死亡;王彦华等[23]采用人工土壤法研究发现,莠去津对蚯蚓暴露7 d和14 d的半致死浓度LC50分别为204.8和180.4 mg/kg。本试验结果与上述研究结果基本一致。除浓度和时间外,莠去津所处的土壤环境也会影响其对土壤生物的毒性作用。本试验结果表明,不同土壤中蚯蚓致死效应存在差异,黄棕壤中蚯蚓的致死效应最强,石灰土中蚯蚓的致死效应最弱,这反映了土壤理化性质会影响莠去津对蚯蚓的毒性效应。通过蚯蚓死亡率LC50与不同土壤理化性质的相关性分析发现,有机质含量与莠去津毒性有较强的负相关性,这与吴丹[10]研究莠去津在不同土壤中对大豆的胁迫效应结果相符。这可能是因为土壤中有机质能够吸附莠去津分子,并显著降低其生物有效性。有研究表明,有机质能够通过π–π键、氢键、静电作用等多种机理与莠去津发生化学和物理吸附[24-26],增加莠去津吸附残留,有效减少污染物的浓度,从而降低其生态和人体健康风险[27]。此外,本研究还发现,土壤有效磷、全磷含量与莠去津毒性有强的正相关性。相关试验也证实外源磷会加重高浓度莠去津胁迫下生物受到的伤害[28]。但也有研究发现,土壤中有效磷和全磷与莠去津的降解半衰期无显著相关性[29],或者添加外源磷可以促进土壤中莠去津的消解[30]。这些研究结果的差异,可能是因为仅通过全磷、有效磷含量并不能准确地评估土壤磷的养分供应能力导致的[31]。
5 结论1) 莠去津浓度越高,污染时间越长,对蚯蚓的毒性效应越强,高浓度和长时间的莠去津暴露,对土壤环境安全具有潜在的生态风险。
2) 莠去津在不同理化性质的土壤中对蚯蚓影响程度不同,毒性效应与土壤中有机质的含量呈负相关,与全磷和有效磷的含量呈正相关,可见土壤肥力显著影响莠去津对蚯蚓的毒性作用。
3) 在有机质含量较低的地区使用莠去津产生的环境风险相对较高,今后农林业在施用除草剂时可将土壤性质列为参考因素。
| [1] |
司友斌, 孟雪梅. 除草剂阿特拉津的环境行为及其生态修复研究进展[J]. 安徽农业大学学报, 2007, 34(3): 451-455 (  0) 0) |
| [2] |
张静, 李墨, 袁新, 等. 三种检测方法对比水中莠去津残留研究[J]. 安徽化工, 2021, 47(4): 132-134 (  0) 0) |
| [3] |
司绍诚, 吴宇澄, 李远, 等. 耕地和草地土壤健康研究进展与展望[J]. 土壤学报, 2022, 59(3): 625-642 (  0) 0) |
| [4] |
李博. 土壤中阿特拉津环境行为及降解转化研究[J]. 环境科学与管理, 2017, 42(5): 141-145 (  0) 0) |
| [5] |
郝文波, 李丽春, 韩云, 等. 6种长效除草剂土壤残留致烟草药害症状及其致害临界值[J]. 广东农业科学, 2013, 40(9): 80–82, 89 (  0) 0) |
| [6] |
Dou R N, Sun J T, Deng F C, et al. Contamination of pyrethroids and atrazine in greenhouse and open-field agricultural soils in China[J]. The Science of the Total Environment, 2020, 701: 134916 DOI:10.1016/j.scitotenv.2019.134916 (  0) 0) |
| [7] |
王春勇, 夏龙, 王鹏飞, 等. 农田、退耕还湿地、天然草本沼泽土壤重金属和农药的分布及潜在生态风险评价——以抚远市乌苏镇东兴村为例[J]. 湿地科学, 2019, 17(2): 222-227 (  0) 0) |
| [8] |
董静, 夏龙超, 平永青, 等. 水环境中阿特拉津污染及修复研究现状[J]. 应用化工, 2022, 51(1): 144-149 (  0) 0) |
| [9] |
王英姿, 纪明山, 黄国宏, 等. 土壤中莠去津对几种农作物安全临界浓度的确定[J]. 沈阳农业大学学报, 2002, 33(1): 33-34 (  0) 0) |
| [10] |
吴丹. 阿特拉津在不同类型土壤中的环境行为及其对大豆胁迫作用的差异[D]. 哈尔滨: 东北农业大学, 2020.
(  0) 0) |
| [11] |
王淑楠. 莠去津与镉复合胁迫对玉米幼苗生态毒性的影响[D]. 太原: 山西大学, 2021.
(  0) 0) |
| [12] |
陈良燕, 林玉锁. 莠去津乙草胺和甲磺隆3种除草剂对青菜危害的生物测试[J]. 农业环境保护, 2001, 20(2): 111-114 (  0) 0) |
| [13] |
高敏苓, 戴树桂, 张平. 绿麦隆、阿特拉津单一与复合污染对蚯蚓的毒性效应研究[J]. 生态环境, 2006, 15(3): 525-528 (  0) 0) |
| [14] |
Yin J C, Hong X, Ma L Y, et al. Non-targeted metabolomic profiling of atrazine in Caenorhabditis elegans using UHPLC-QE orbitrap/MS[J]. Ecotoxicology and Environmental Safety, 2020, 206: 111170 DOI:10.1016/j.ecoenv.2020.111170 (  0) 0) |
| [15] |
孟琰, 王金花, 朱鲁生, 等. 莠去津对赤子爱胜蚓(Eisenia foetida)体腔细胞DNA损伤的研究[J]. 安全与环境学报, 2009, 9(5): 24-29 (  0) 0) |
| [16] |
徐建, 张平, 穆洪, 等. 两种除草剂复合污染对蚯蚓的毒性效应[J]. 农业环境科学学报, 2006, 25(5): 1188-1192 (  0) 0) |
| [17] |
Yao B, Gu X J, Shu Y G, et al. Degradation of atrazine and changes in soil biological indices throughout dendroremediation using poplars[J]. Journal of Forestry Research, 2019, 30(6): 2331-2339 DOI:10.1007/s11676-018-0759-6 (  0) 0) |
| [18] |
张江周, 李奕赞, 李颖, 等. 土壤健康指标体系与评价方法研究进展[J]. 土壤学报, 2022, 59(3): 603-616 (  0) 0) |
| [19] |
陈旭飞, 张池, 戴军, 等. 赤子爱胜蚓和毛利远盲蚓对添加造纸污泥土壤的化学和生物学特征的影响[J]. 生态学报, 2014, 34(5): 1114-1125 (  0) 0) |
| [20] |
陈林华, 江吉红, 杨正见, 等. 蚯蚓生物标志在农药污染评价中的应用[J]. 浙江农业学报, 2010, 22(1): 130-134 (  0) 0) |
| [21] |
刘嫦娥. 四种除草剂对蚯蚓生理生态的影响及其降解特征[D]. 昆明: 云南大学, 2012.
(  0) 0) |
| [22] |
胡玲, 林玉锁, 常卫民, 等. 呋喃丹和阿特拉津单一和复合作用对蚯蚓致死效应的研究[J]. 科技信息, 2008(31): 713-714 (  0) 0) |
| [23] |
王彦华, 赵学平, 苍涛, 等. 莠去津和毒死蜱对蚯蚓的单一与联合毒性效应: 环境安全与生态学基准/标准国际研讨会、中国毒理学会环境与生态毒理学专业委员会第三届学术研讨会、中国环境科学学会环境标准与基准专业委员会2013年学术研讨会[C]. 南京, 2013.
(  0) 0) |
| [24] |
Cao Y, Wang L P, Kang X D, et al. Insight into atrazine removal by fallen leaf biochar prepared at different pyrolysis temperatures: Batch experiments, column adsorption and DFT calculations[J]. Environmental Pollution, 2023, 317: 120832 DOI:10.1016/j.envpol.2022.120832 (  0) 0) |
| [25] |
梁茂儒, 陆玉芳, 马明坤, 等. 木屑生物质炭对水中阿特拉津、多菌灵和啶虫脒复合农药的吸附性能研究[J]. 土壤, 2022, 54(4): 793-801 (  0) 0) |
| [26] |
Cheng C H, Shi X J, Yin G W, et al. Atrazine adsorption by graphene-based materials: Interaction mechanism and application in real samples[J]. Environmental Technology & Innovation, 2022, 28: 102823 (  0) 0) |
| [27] |
董攀月, 陈禹竹, 曾军, 等. 不同施肥处理下旱地红壤中阿特拉津的环境归趋及其调控研究[J]. 土壤, 2022, 54(6): 1201-1209 (  0) 0) |
| [28] |
武淑文, 侯磊, 洪子萌, 等. 阿特拉津胁迫下外源磷对香蒲磷吸收和抗氧化酶系统的影响[J]. 农业环境科学学报, 2021, 40(4): 844-851 (  0) 0) |
| [29] |
陈世宇. 不同土壤中阿特拉津降解特征、降解基因分布及细菌群落演替规律[D]. 杭州: 浙江大学, 2021.
(  0) 0) |
| [30] |
张超兰, 徐建明. 氮磷无机营养物质对莠去津在土壤中消解的影响研究[J]. 农业环境科学学报, 2007, 26(5): 1694-1697 (  0) 0) |
| [31] |
刘瑾, 杨建军. 近三十年农田土壤磷分子形态的研究进展[J]. 土壤学报, 2021, 58(3): 558-567 (  0) 0) |
2. Nanjing Institute of Environmental Sciences, Ministry of Ecology and Environment, Nanjing 210042, China
 2023, Vol. 55
2023, Vol. 55


