2. 中国科学院大学, 北京 100049
土壤被称作“最后的科学前沿”,强调了土壤生物的物种多样性和群落复杂性。化肥在满足粮食生产的同时,也造成了微生物多样性失衡、土壤退化、作物产量降低等许多环境问题[1-2]。有机肥料被认为可以部分替代化肥实现土壤质量的改善和作物产量的提高[3-4]。秸秆含有多种支持作物生长的养分元素,秸秆还田能提升土壤肥力、保水能力,同时促进土壤团聚体的形成,增强土壤固碳能力[5]。畜禽粪便是农村主要污染源之一,而粪肥富含氮、磷等元素,秸秆猪粪配施可能实现畜禽养殖废弃物的资源化利用。有研究指出施用有机肥可以显著促进细菌多样性和特定类群的生长[6-7],短期施肥可能引起微生物生物量和活性的迅速反馈,但长期施肥可能涉及微生物群落功能和生产力变化[8]。厘清土壤微生物多样性和群落结构的动态变化对选择合适的施肥措施、提升土壤生态系统功能具有重要意义[9]。然而,长期有机培肥下土壤细菌多样性和群落结构随施肥年限如何变化仍有待探究。
土壤微生物多样性和群落结构是衡量土壤质量最敏感的生物指标之一,为快速评估土壤质量变化提供了可能性[10-11]。提高土壤生物多样性、增加更多有益微生物对于农业可持续发展至关重要。土壤微生物群落参与物质合成、矿化和分解,影响土壤养分循环,菌群活动还能影响土壤结构和水分状况[12]。微生物多样性可以确保所有有机物质被回收利用,提高养分循环效率。化肥施用下微生物群落受到较强的环境过滤作用,长期不合理施用化肥可能破坏微生物群落结构,降低微生物多样性[13-14]。秸秆还田对土壤肥力的提升潜力有限,可能造成植物与微生物之间的养分竞争,从而影响微生物群落结构。但猪粪秸秆配施可以加速秸秆分解,有利于提高土壤微生物多样性[15-16]。当前关于长期不同施肥措施下细菌多样性及群落结构如何响应仍缺乏全面了解。虽然微生物多样性与土壤功能之间存在着复杂的联系,但通常认为提高细菌多样性可以增强其对环境压力的抵御能力,进而提升生态系统的稳定性和生产力[17]。
红壤广泛分布于我国东南丘陵区,水热潜力高,但养分瘠薄、微生物多样性低,制约了土壤生物功能和农业生产力的协同提升[18]。秸秆猪粪配施是提升红壤有机碳容量、缓解土壤加速退化的常用措施,影响了土壤细菌多样性和群落结构的演替过程和速率。在养分贫瘠的土壤中施用秸秆对作物增产尤为有效,而养分丰富的土壤存在较高的微生物功能冗余作用,添加外源碳源对微生物多样性及作物产量的影响相对有限[19]。因此,研究不同施肥年限及施肥处理对土壤细菌多样性和群落结构演替的影响,将有助于进一步认识土壤微生物在耕地地力和粮食产能提升中发挥的重要生态功能。本研究依托旱地红壤秸秆还田培肥试验,运用高通量测序技术,旨在探究:①不同施肥年限及施肥处理下土壤细菌多样性和群落结构的演变规律;②土壤细菌多样性和群落结构变化的关键驱动因子;以期为因地制宜确立红壤施肥方式、改善旱地红壤质量与健康提供科学依据。
1 材料与方法 1.1 研究区概况田间试验位于江西省鹰潭农田生态系统国家野外研究站(116°55′E,28°13′N),属中亚热带季风气候。年均温17.8℃,年均降水量1795,无霜期262d。供试土壤属于第四纪红黏土母质发育的黏化湿润富铁土,土壤pH较低,养分贫瘠,有机质及氮磷元素含量低。本试验开始前表层土壤(0 ~ 20 cm)基本化学性质如表 1所示。
|
|
表 1 试验开始前表层土壤主要化学性质 Table 1 Initial chemical properties of tested topsoil |
长期试验始于2011年,种植系统为单作玉米。试验设置3个处理:①对照(CK),不施肥;②化肥(N),单施氮磷钾肥;③化肥+秸秆猪粪配施(NSM),氮磷钾肥+秸秆猪粪配施(输入量为每年1 000 kg/hm2 C,玉米秸秆与猪粪按9:1的C输入比)。每处理3个重复,每个试验区块设置为100 m2 (5 m × 20 m),采用随机区组排列,每个区块用水泥板完全分隔。玉米种植前(4月)一次性施入尿素(N 150 kg/hm2)、钙镁磷肥(P2O5 75 kg/hm2)、钾肥(K2O 60 kg/hm2),玉米秸秆、猪粪与化肥同期施入并翻耕混匀,有机物料每年带入土壤的N、P和K含量分别为40.19、4.58和35.43 kg/hm2;此外不再进行其他施肥处理。
1.3 样品采集与分析试验选择玉米种植后第1年(Y2011)、第3年(Y2013)及第7年(Y2017)收获期采集土壤耕层样品。按S形采样法在每个小区各采10个样点,将土样充分混匀后在低温条件下带回室内。所有土样分为2份,1份自然风干后用于测定土壤基本化学性质,1份鲜样冻存于−80 ℃冰箱并尽快提取土壤基因组总DNA。
土壤pH采用电位法测定(水︰土= 2.5︰1,V︰m),土壤有机碳(SOC)、全氮(TN)、全磷(TP)、全钾(TK)和有效磷(AP)分别采用重铬酸钾氧化–容量法、凯氏定氮法、碳酸钠熔融法、氢氧化钠熔融法和碳酸氢钠浸提–钼锑抗比色法测定[20]。
1.4 16S rRNA基因高通量测序完全依照DNA提取试剂盒(MoBio Laboratories, Inc., CA, USA)说明书提取土壤样品总DNA。PCR扩增使用的引物为细菌通用515F和907R,扩增区域为细菌16S rRNA的V4 ~ V5可变区[21]。PCR反应体系为:5 × FastPfu缓冲液4 μL,10 μmol/L正、反向引物各0.25 μL,2.5 mmol/L dNTP 2 μL,模板DNA 10 ng和FastPfu聚合酶0.4 μL,添加无菌水补足至20 μL。PCR扩增流程如下:95 ℃预变性5 min,(94 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s)×30个循环,72 ℃延伸10 min。采用PCR产物纯化试剂盒(AXYGEN公司)纯化PCR产物,采用Illumina MiSeq PE300平台进行高通量测序。
对原始序列进行质量筛选,使用QIIME软件(v1.9.1)进行流程分析。按照质量分数Q20筛选序列,将序列匹配到不同样品中。使用Usearch算法按照97% 的相似性聚类序列,以此划分成不同的操作分类单元(OTU),并在此过程中剔除嵌合体序列,对最终所得序列在SILVA119数据库中比对并注释。为保持测序量一致以便比较细菌多样性,对所有样品序列进行抽平处理。
1.5 数据分析数据差异性分析在SPSS24.0软件中进行,采用单因素方差分析(one-way ANOVA),多重比较选择Duncan分析。利用QIIME软件计算细菌α多样性指数(Richness、Pielou、Shannon、Simpson),使用Richness指数评估细菌物种丰富度,Pielou、Shannon和Simpson评估细菌物种均匀度[18-22]。主坐标分析(PCoA)和聚类分析(hclust)用以表征群落结构差异。Spearman相关性分析用于展示细菌群落多样性、群落组成与土壤化学因子的相关性。随机森林分析用于检验每个环境因子对细菌多样性和群落组成的重要性得分,双因素方差分析用于比较施肥年限、施肥处理以及二者相互作用对细菌多样性的影响。以上分析均在R软件(version 3.6.2)的相关程序包(vegan、randomForest和psych)中完成。
2 结果与分析 2.1 土壤化学性质的变化与NSM处理相比,在玉米种植后的第7年(Y2017),N处理下土壤pH显著下降,而CK与NSM处理之间没有显著差异(图 1)。施肥处理显著提高了SOC含量,N和NSM处理在Y2017的SOC含量分别是CK处理的1.56倍和2.05倍。与CK和N处理相比,NSM处理在Y2017的TN分别增加了54.47% 和40.74%。Y2013和Y2017下,不同处理间TK没有显著差异。NSM处理的TP、AP在Y2013和Y2017下显著高于CK处理,而N处理只在Y2017下有显著增加。N和NSM处理在Y2017下的TP分别比CK处理增加了25.00% 和52.38%,AP分别为CK处理的1.74倍和5.00倍。
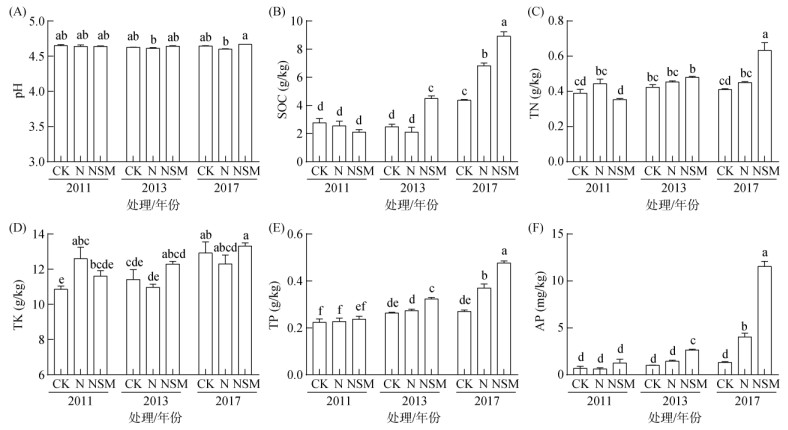
|
(图中小写字母不同表示处理间差异显著(P < 0.05),下图同) 图 1 施肥处理和施肥年限对土壤化学性质的影响 Fig. 1 Soil chemical properties under different fertilization treatments and fertilization years |
与Y2011相比,Y2013和Y2017下所有处理的细菌α多样性均显著升高(图 2)。N和NSM处理的Richness、Pielou和Shannon指数表现为Y2017显著高于Y2013,而NSM处理的Simpson指数在Y2013和Y2017之间没有显著变化;CK处理的α多样性指数在Y2013和Y2017之间均没有显著变化。Y2017下,N和NSM处理的Richness、Pielou和Shannon指数均高于CK处理,其中Richness指数分别比CK处理增长61.48% 和65.00%。Y2013下N处理的4个多样性指数均显著低于NSM处理,而Y2017下N与NSM处理之间没有显著差异。

|
图 2 施肥处理和施肥年限对细菌α多样性指数的影响 Fig. 2 Alpha diversity indexes under different fertilization treatments and fertilization years |
门水平上土壤细菌群落主要以放线菌门(Actinobacteria,24.82%)、绿弯菌门(Chloroflexi,24.30%)、厚壁菌门(Firmicutes,15.48%)、酸杆菌门(Acidobacteria,7.46%)和α-变形菌门(α-Proteobacteria,5.63%)为主(图 3A)。与Y2011相比,Y2013和Y2017的α-变形菌门及Firmicutes的相对丰度显著下降,而Chloroflexi和Acidobacteria相对丰度显著增高。Y2013和Y2017下N和NSM处理Actinobacteria相对丰度显著高于CK处理。属水平上细菌群落以纤线杆菌属(Ktedonobacter,18.22%)、费氏丙酸杆菌属(Cutibacterium,5.69%)、Thermomarinilinea(2.41%)和Biomaibacter(2.34%)为优势菌属(图 3B)。Y2013和Y2017中Cutibacterium、类芽胞杆菌(Paenibacillus)、Staphylococcus属相对丰度显著低于Y2011,而Ktedonobacter、Biomaibacter和康奈斯氏杆菌属(Conexibacter)的相对丰度显著高于Y2011。聚类分析和主坐标分析(PCoA)结果显示,同一施肥年限细菌群落相似性高,PCoA前两轴累积解释了土壤细菌群落变化的55.92%(图 4)。

|
图 3 施肥处理和施肥年限对细菌门水平(A)和属水平(B)群落组成的影响 Fig. 3 Bacterial community compositions at phylum (A) and genus (B) levels under different fertilization treatments and fertilization years |
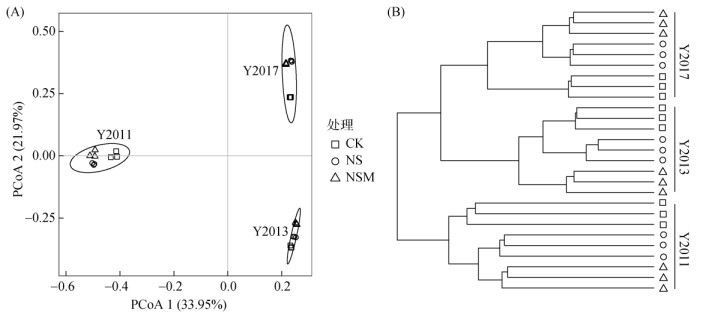
|
图 4 基于Bray-Curtis距离的PCoA和聚类分析 Fig. 4 Principal coordinates analysis (PCoA) and cluster analysis based on Bray-Curtis distance |
相关性热图分析结果表明,细菌群落(PCoA1)与SOC、C/N和TP呈显著正相关,细菌多样性指数与SOC、C/N、TP和AP呈显著正相关,pH、TK与细菌群落结构和多样性均无显著相关(图 5)。随机森林分析预测了每个化学因子对细菌群落和多样性的相对重要性(图 6)。结果显示,TP最重要,表现为对每个响应变量的方差解释度达到11.66% ~ 21.13%;其次是AP(7.26% ~ 13.16%)和SOC(6.23% ~ 11.91%)。
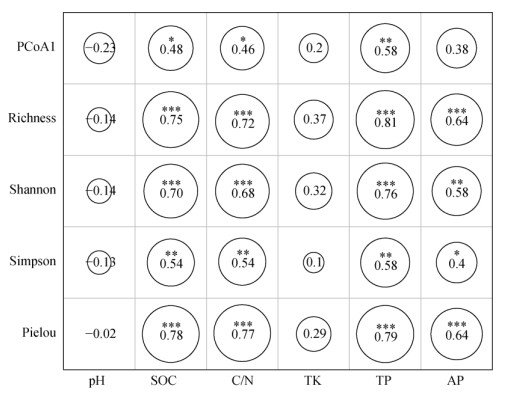
|
(图中数字为相关系数,C/N为SOC与TN之比;*、**、*** 分别表示相关性达P < 0.05、P < 0.01、P < 0.001显著水平) 图 5 土壤化学性质与细菌群落结构和多样性的Spearman相关性 Fig. 5 Spearman correlation between soil chemical properties with bacterial diversity and community structure |
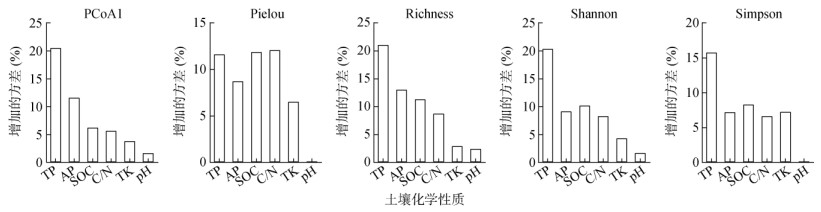
|
图 6 随机森林模型分析土壤化学性质对细菌群落结构和多样性的影响 Fig. 6 Effects of soil chemical properties on bacterial diversities and community structures based on random forest model analysis |
双因素方差分析结果表明,施肥年限除对土壤pH无显著影响外,对其他理化因子、细菌多样性和群落组成都有显著影响(表 2)。施肥处理对pH、SOC、TP和AP有显著影响,但对细菌α多样性和群落组成的影响并不显著。除pH外,施肥年限(R2 = 0.33 ~ 0.60)对土壤理化因子差异的解释量要高于施肥处理(R2 = 0.08 ~ 0.20),且施肥年限对细菌α多样性变异的解释度达到60.71% ~ 68.74%。施肥年限与施肥处理对pH、SOC、TP、AP和Pielou指数存在显著的交互作用。
|
|
表 2 施肥年限与施肥处理对土壤理化因子和细菌多样性的双因素分析 Table 2 Two factors analysis of effects of fertilization treatment and year on soil chemical properties and bacterial diversities |
生物多样性丧失会降低大多数生态系统的功能并随时间推移损害其稳定性,土壤微生物多样性受到农田管理措施和植被的调节[23-24]。本研究结果显示,N和NSM处理均显著提高了土壤细菌多样性。随机森林分析表明,TP对多样性的贡献度最高。南方旱地红壤的“缺磷”问题限制了区域水热资源潜力的发挥,提高磷有效性既能提高微生物多样性又能刺激微生物活性[18]。猪粪本身含有丰富的磷[25],与N处理相比,NSM处理显著提升了土壤TP和AP的含量。无论是单独施用还是与化肥配施,猪粪都能提高细菌多样性[26]。秸秆分解会增加土壤磷含量,当秸秆连续还田时,磷容易富集在土壤表层导致养分表聚现象[27]。猪粪、秸秆作为有机物料输入土壤,为微生物提供了SOC、TN等能源,秸秆还田处理可能有利于促进土壤大团聚体的形成,通过增加土壤碳固存促进了细菌生物量和多样性[28-29]。值得注意的是,随着施肥年限的延长,Y2017下NSM处理的SOC、TN、TP和AP含量显著高于Y2013,但细菌多样性并不成比例地增加。尽管N处理的养分含量低于NSM处理,但表现出较高的细菌多样性变化。Yang等[26]研究指出,当AP含量过高时,反而会降低细菌多样性。因此,在南方典型的旱地红壤区,施肥必须同时考虑碳氮磷养分的库容增加和比例平衡两个维度[26]。
与Y2011相比,CK处理在Y2013和Y2017下的细菌多样性显著升高,这可能与土壤有机碳变化及土地利用的转变有关[30]。土壤有机质含量通常被认为在局部尺度上主导土壤细菌多样性,而红壤有机质贫瘠可能限制微生物生长[31-33]。本研究表明,SOC是导致细菌多样性变异的重要贡献因子。Y2017下CK处理SOC含量显著高于Y2011,这可能主要来源于玉米根系残茬和根系分泌物,这些不同的新碳维持了不同细菌分类群的生长[30-34],促进了细菌多样性的提高。Liu等[35]研究表明,小麦、玉米和大豆等作物长期连作可能导致SOC降低、微生物多样性下降,但玉米相对较耐连作障碍,本研究结果未出现类似下降情况。另一方面,由根系输入的有机物质可能塑造了一个高度异质的土壤环境,这种空间异质性也会影响细菌多样性的维持[36]。Tardy等[37]的研究表明,微生物多样性可能不遵循与土地管理强度的线性负相关关系,而是呈现驼峰型关系,即在低强度和高强度下具有较低的微生物多样性,在中等强度下具有较高的微生物多样性。在群落演替过程中,微生物丰富度和均匀度会随着演替时间延长而升高,符合中等干扰假说[38]。
CK、N和NSM 3个处理的细菌群落主要是根据不同的施肥年限聚类成簇,双因素分析也表明施肥处理对细菌群落组成的作用并不显著,提示施肥年限而非施肥处理对土壤细菌群落起重要驱动作用。植物不仅可以释放多种根系分泌物作为基质和信号物质,刺激不同土壤微生物的生长[39],而且通过驱动土壤湿度的变化来影响土壤细菌生存的地下环境条件,从而改变微生物群落结构[40]。施肥通过影响土壤中不同元素的可用性来影响微生物群落结构[41]。大量研究结果表明,秸秆猪粪配施可以显著改善南方红壤区养分失衡问题,调节微生物群落结构,从而促进不同元素转化过程[42-43]。TP和AP是随机森林分析中影响土壤细菌群落结构两个最重要的因子。磷输入影响解磷细菌的数量和种类,且对于非共生固氮菌而言磷常被视为关键营养元素[44],这都将直接贡献于细菌群落结构的变化[45]。N和NSM处理丰富了土壤磷养分资源,能够促进变形菌门(Proteobacteria)的生长[46-47],并抑制绿弯菌门(Chloroflexi)等寡营养型细菌的生长。本研究发现,Proteobacteria的相对丰度在Y2013和Y2017显著下降,而Chloroflexi的相对丰度在Y2011极低,但在Y2013和Y2017明显提高。一项全球研究[48]表明,Chloroflexi在农业生态系统中更为丰富,而Proteobacteria在自然生态系统中则较为常见,Y2011正是本研究的样地由自然土转变为耕作土的起始年。NSM处理下升高的放线菌门(Actinobacteria)在提升农业土壤质量方面可能起着重要作用,在田间实践中它已被证明能够降解畜禽粪便中的有机质[49]。CK、N和NSM处理下,Chloroflexi相对丰度的增加可能与SOC升高有关,因为它专门降解植物来源的有机物[50]。Y2013和Y2017中Chloroflexi的纤线杆菌属(Ktedonobacter)和Thermomarinilinea的相对丰度最高。Ktedonobacter属于纤线杆菌科(Ktedonobacteraceae),可以降解植物木聚糖和纤维素[51],有利于秸秆的分解利用。土壤细菌群落结构的转变可能有利于提高红壤肥力和碳氮磷养分含量。Thermomarinilinea属于厌氧绳菌科(Anaerolineacea),可能是其他需氧微生物的生长消耗了过多氧气并产生了厌氧土壤条件,导致了该科细菌的比例升高[52]。
4 结论本研究选择南方瘠薄旱地红壤,针对不同施肥处理下土壤细菌多样性及群落结构的演替特征进行分析显示,不同施肥年限和施肥处理的土壤化学性质、细菌多样性和群落结构均存在显著差异。在施肥第7年及秸秆猪粪配施处理下,土壤肥力改善效益最好。单施化肥处理和秸秆猪粪配施处理细菌多样性均显著提升。秸秆和畜禽粪肥的合理配施是增强红壤供肥能力、保障粮食丰产增效的重要举措,系统探究不同年限下施肥处理对土壤细菌群落的变化,为提升土壤健康和维持农田生态多功能性提供了科学依据。
| [1] |
Beltran-Garcia M J, Martínez-Rodríguez A, Olmos-Arriaga I, et al. Nitrogen fertilization and stress factors drive shifts in microbial diversity in soils and plants[J]. Symbiosis, 2021, 84(3): 379-390 DOI:10.1007/s13199-021-00787-z (  0) 0) |
| [2] |
Bishnoi U. Agriculture and the dark side of chemical fertilizers[J]. Environmental Analysis & Ecology Studies, 2018, 3(1): 552 (  0) 0) |
| [3] |
Wang Y, Zhu Y C, Zhang S X, et al. What could promote farmers to replace chemical fertilizers with organic fertilizers?[J]. Journal of Cleaner Production, 2018, 199: 882-890 DOI:10.1016/j.jclepro.2018.07.222 (  0) 0) |
| [4] |
Yang Q Y, Zhang M K. Effect of bio-organic fertilizers partially substituting chemical fertilizers on labile organic carbon and bacterial community of citrus orchard soils[J]. Plant and Soil, 2023, 483(1): 255-272 (  0) 0) |
| [5] |
张玉娇, 邱慧珍, 郭亚军, 等. 不同施氮量下玉米秸秆还田对土壤有机碳及其组分的影响[J]. 国土与自然资源研究, 2022(2): 87-90 (  0) 0) |
| [6] |
Zhao J, Ni T, Li Y, et al. Responses of bacterial communities in arable soils in a rice-wheat cropping system to different fertilizer regimes and sampling times[J]. PLoS One, 2014, 9(1): e85301 DOI:10.1371/journal.pone.0085301 (  0) 0) |
| [7] |
Li F, Chen L, Zhang J B, et al. Bacterial community structure after long-term organic and inorganic fertilization reveals important associations between soil nutrients and specific taxa involved in nutrient transformations[J]. Frontiers in Microbiology, 2017, 8: 187 (  0) 0) |
| [8] |
Lazcano C, Gómez-Brandón M, Revilla P, et al. Short-term effects of organic and inorganic fertilizers on soil microbial community structure and function: A field study with sweet corn[J]. Biology and Fertility of Soils, 2013, 49(6): 723-733 DOI:10.1007/s00374-012-0761-7 (  0) 0) |
| [9] |
Chen C, Zhang J N, Lu M, et al. Microbial communities of an arable soil treated for 8 years with organic and inorganic fertilizers[J]. Biology and Fertility of Soils, 2016, 52(4): 455-467 DOI:10.1007/s00374-016-1089-5 (  0) 0) |
| [10] |
Visser S, Parkinson D. Soil biological criteria as indicators of soil quality: Soil microorganisms[J]. American Journal of Alternative Agriculture, 1992, 7(1/2): 33-37 (  0) 0) |
| [11] |
He J Z, Zheng Y, Chen C R, et al. Microbial composition and diversity of an upland red soil under long-term fertilization treatments as revealed by culture-dependent and culture-independent approaches[J]. Journal of Soils and Sediments, 2008, 8(5): 349-358 DOI:10.1007/s11368-008-0025-1 (  0) 0) |
| [12] |
Singh J S, Pandey V C, Singh D P. Efficient soil microorganisms: A new dimension for sustainable agriculture and environmental development[J]. Agriculture, Ecosystems & Environment, 2011, 140(3/4): 339-353 (  0) 0) |
| [13] |
Sun L, Yu Y J, Petropoulos E, et al. Long-term manure amendment sustains black soil biodiversity by mitigating acidification induced by chemical N fertilization[J]. Microorganisms, 2022, 11(1): 64 DOI:10.3390/microorganisms11010064 (  0) 0) |
| [14] |
桑文, 赵亚光, 张霁峰, 等. 化肥减量配施有机液体肥对加工番茄生长及土壤酶活性的影响[J]. 中国土壤与肥料, 2021(2): 53-60 (  0) 0) |
| [15] |
胡凯婕, 栾璐, 郑洁, 等. 秸秆还田方式对丛枝菌根真菌群落和玉米磷素利用的影响[J]. 土壤学报, 2023, 60(1): 269-279 (  0) 0) |
| [16] |
孔培君, 郑洁, 栾璐, 等. 不同秸秆还田方式对旱地红壤细菌群落、有机碳矿化及玉米产量的影响[J]. 环境科学, 2021, 42(12): 6047-6057 (  0) 0) |
| [17] |
Torsvik V, Øvreås L. Microbial diversity and function in soil: From genes to ecosystems[J]. Current Opinion in Microbiology, 2002, 5(3): 240-245 DOI:10.1016/S1369-5274(02)00324-7 (  0) 0) |
| [18] |
栾璐, 郑洁, 程梦华, 等. 不同秸秆还田方式对旱地红壤细菌多样性及群落结构的影响[J]. 土壤, 2021, 53(5): 991-997 (  0) 0) |
| [19] |
Wang S, Huang X L, Zhang Y, et al. The effect of corn straw return on corn production in Northeast China: An integrated regional evaluation with meta-analysis and system dynamics[J]. Resources, Conservation and Recycling, 2021, 167: 105402 DOI:10.1016/j.resconrec.2021.105402 (  0) 0) |
| [20] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000
(  0) 0) |
| [21] |
Xue L, Ren H D, Li S, et al. Soil bacterial community structure and co-occurrence pattern during vegetation restoration in Karst rocky desertification area[J]. Frontiers in Microbiology, 2017, 8: 2377 DOI:10.3389/fmicb.2017.02377 (  0) 0) |
| [22] |
孙军, 刘东艳. 多样性指数在海洋浮游植物研究中的应用[J]. 海洋学报, 2004, 26(1): 62-75 (  0) 0) |
| [23] |
Altieri M A. The ecological role of biodiversity in agroecosystems[J]. Agriculture, Ecosystems & Environment, 1999, 74(1/2/3): 19-31 (  0) 0) |
| [24] |
Bardgett R D, van der Putten W H. Belowground biodiversity and ecosystem functioning[J]. Nature, 2014, 515(7528): 505-511 DOI:10.1038/nature13855 (  0) 0) |
| [25] |
Edmeades D C. The long-term effects of manures and fertilisers on soil productivity and quality: A review[J]. Nutrient Cycling in Agroecosystems, 2003, 66(2): 165-180 DOI:10.1023/A:1023999816690 (  0) 0) |
| [26] |
Yang Y R, Li X G, Liu J G, et al. Bacterial diversity as affected by application of manure in red soils of subtropical China[J]. Biology and Fertility of Soils, 2017, 53(6): 639-649 DOI:10.1007/s00374-017-1209-x (  0) 0) |
| [27] |
区晓琳, 陈志彪, 陈志强, 等. 亚热带侵蚀红壤区植被恢复过程中土壤团聚体化学计量特征[J]. 土壤学报, 2018, 55(5): 1156-1167 (  0) 0) |
| [28] |
Bu R Y, Ren T, Lei M J, et al. Tillage and straw-returning practices effect on soil dissolved organic matter, aggregate fraction and bacteria community under rice-rice-rapeseed rotation system[J]. Agriculture, Ecosystems & Environment, 2020, 287: 106681 (  0) 0) |
| [29] |
宋依依, 曹阳, 段鑫盈, 等. 秸秆还田深度对土壤团聚体组成及有机碳含量的影响[J]. 土壤, 2022, 54(2): 344-350 (  0) 0) |
| [30] |
Szoboszlay M, Dohrmann A B, Poeplau C, et al. Impact of land-use change and soil organic carbon quality on microbial diversity in soils across Europe[J]. FEMS Microbiology Ecology, 2017, 93(12): fix146 (  0) 0) |
| [31] |
Ma W M, Li Z W, Ding K Y, et al. Effect of soil erosion on dissolved organic carbon redistribution in subtropical red soil under rainfall simulation[J]. Geomorphology, 2014, 226: 217-225 DOI:10.1016/j.geomorph.2014.08.017 (  0) 0) |
| [32] |
Zhong W H, Cai Z C. Long-term effects of inorganic fertilizers on microbial biomass and community functional diversity in a paddy soil derived from quaternary red clay[J]. Applied Soil Ecology, 2007, 36(2/3): 84-91 (  0) 0) |
| [33] |
Tian J, He N P, Hale L, et al. Soil organic matter availability and climate drive latitudinal patterns in bacterial diversity from tropical to cold temperate forests[J]. Functional Ecology, 2018, 32(1): 61-70 DOI:10.1111/1365-2435.12952 (  0) 0) |
| [34] |
Dijkstra F A, Zhu B, Cheng W X. Root effects on soil organic carbon: A double-edged sword[J]. New Phytologist, 2021, 230(1): 60-65 DOI:10.1111/nph.17082 (  0) 0) |
| [35] |
Liu X B, Liu J D, Xing B S, et al. Effects of long-term continuous cropping, tillage, and fertilization on soil organic carbon and nitrogen of black soils in China[J]. Communications in Soil Science and Plant Analysis, 2005, 36(9/10): 1229-1239 (  0) 0) |
| [36] |
Portell X, Pot V, Garnier P, et al. Microscale heterogeneity of the spatial distribution of organic matter can promote bacterial biodiversity in soils: Insights from computer simulations[J]. Frontiers in Microbiology, 2018, 9: 1583 DOI:10.3389/fmicb.2018.01583 (  0) 0) |
| [37] |
Tardy V, Spor A, Mathieu O, et al. Shifts in microbial diversity through land use intensity as drivers of carbon mineralization in soil[J]. Soil Biology and Biochemistry, 2015, 90: 204-213 DOI:10.1016/j.soilbio.2015.08.010 (  0) 0) |
| [38] |
Álvarez-Molina L L, Martínez M L, Pérez-Maqueo O, et al. Richness, diversity, and rate of primary succession over 20 year in tropical coastal dunes[J]. Plant Ecology, 2012, 213(10): 1597-1608 DOI:10.1007/s11258-012-0114-5 (  0) 0) |
| [39] |
Bais H P, Weir T L, Perry L G, et al. The role of root exudates in rhizosphere interactions with plants and other organisms[J]. Annual Review of Plant Biology, 2006, 57: 233-266 DOI:10.1146/annurev.arplant.57.032905.105159 (  0) 0) |
| [40] |
Tajik S, Ayoubi S, Lorenz N. Soil microbial communities affected by vegetation, topography and soil properties in a forest ecosystem[J]. Applied Soil Ecology, 2020, 149: 103514 DOI:10.1016/j.apsoil.2020.103514 (  0) 0) |
| [41] |
Preem J K, Truu J, Truu M, et al. Bacterial community structure and its relationship to soil physico-chemical characteristics in alder stands with different management histories[J]. Ecological Engineering, 2012, 49: 10-17 DOI:10.1016/j.ecoleng.2012.08.034 (  0) 0) |
| [42] |
郑洁, 程梦华, 栾璐, 等. 秸秆还田对玉米根际氨氧化微生物群落及红壤硝化潜势的影响[J]. 生态学报, 2022, 42(12): 5022-5033 (  0) 0) |
| [43] |
Qaswar M, Huang J, Ahmed W, et al. Linkages between ecoenzymatic stoichiometry and microbial community structure under long-term fertilization in paddy soil: A case study in China[J]. Applied Soil Ecology, 2021, 161: 103860 DOI:10.1016/j.apsoil.2020.103860 (  0) 0) |
| [44] |
Xun W B, Li W, Huang T, et al. Long-term agronomic practices alter the composition of asymbiotic diazotrophic bacterial community and their nitrogen fixation genes in an acidic red soil[J]. Biology and Fertility of Soils, 2018, 54(3): 329-339 DOI:10.1007/s00374-018-1264-y (  0) 0) |
| [45] |
郭龙, 冯童禹, 薛壮壮, 等. 氮形态和磷肥对红壤玉米根际解磷微生物群落和磷酸酶活性的影响[J/OL]. 土壤学报, 2023, 60(5). DOI: 10.11766/trxb202108250454.
(  0) 0) |
| [46] |
Fierer N, Bradford M A, Jackson R B. Toward an ecological classification of soil bacteria[J]. Ecology, 2007, 88(6): 1354-1364 DOI:10.1890/05-1839 (  0) 0) |
| [47] |
Kirchman D L. The ecology of Cytophaga-Flavobacteria in aquatic environments[J]. FEMS Microbiology Ecology, 2002, 39(2): 91-100 (  0) 0) |
| [48] |
Trivedi P, Delgado-Baquerizo M, Anderson I C, et al. Response of soil properties and microbial communities to agriculture: Implications for primary productivity and soil health indicators[J]. Frontiers in Plant Science, 2016, 7: 990 (  0) 0) |
| [49] |
Singh U, Choudhary A K, Sharma S. A 3-year field study reveals that agri-management practices drive the dynamics of dominant bacterial taxa in the rhizosphere of Cajanus cajan[J]. Symbiosis, 2022, 86(2): 215-227 DOI:10.1007/s13199-022-00834-3 (  0) 0) |
| [50] |
Naumoff D G, Dedysh S N. Lateral gene transfer between the Bacteroidetes and Acidobacteria: The case of α-L[J]. FEBS Letters, 2012, 586(21): 3843-3851 DOI:10.1016/j.febslet.2012.09.005 (  0) 0) |
| [51] |
Qian Z Z, Zhu K X, Zhuang S Y, et al. Soil nutrient cycling and bacterial community structure in response to various green manures in a successive Eucalyptus (Eucalyptus urophylla × Eucalyptus grandis) plantation[J]. Land Degradation & Development, 2022, 33(15): 2809-2821 (  0) 0) |
| [52] |
Song Z X, Massart S, Yan D D, et al. Composted chicken manure for anaerobic soil disinfestation increased the strawberry yield and shifted the soil microbial communities[J]. Sustainability, 2020, 12(16): 6313 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China
 2024, Vol. 56
2024, Vol. 56


