2. 土壤与农业可持续发展重点实验室(中国科学院), 南京 210008;
3. 贵州省烟草科学研究院烟草行业山地烤烟品质与生态重点实验室, 贵阳 550081;
4. 贵州省烟草公司黔西南州公司, 贵州兴义 562400
铵态氮和硝态氮是烟草植株能够吸收利用的速效氮源[1]。根系是植物吸收转化营养的关键部位,可以直接吸收和利用土壤中的铵态氮和硝态氮[2-4]。烟草苗期氮素即开始在根系和叶片中积累,且苗期根系活力、表面积、体积、平均直径等值越高,对烟草后期的生长发育越有利[5-6]。尽管烟草是喜硝作物,但烟草的农艺性状和产量受铵态氮和硝态氮比例(铵硝比)的影响,且铵态氮可以直接被烟草同化[6],在苗期提高铵态氮的含量不仅可以促进根系萌发和伸长还可以提高烟草干物质的积累[7]。王蒙等[8]研究发现铵硝比4∶6为豫中烟区浓香型烤烟生长最适宜的氮形态配比。王利超等[1]发现铵硝比1∶1配合施用,不仅可以协调烟叶主要化学成分,还可以使致香物质的组成较为协调。介晓磊等[9]研究表明两种形态氮素的存在有助于叶片钾和氯的积累,铵态氮还有利于总糖的提高。张新要等[10]研究表明铵态氮、硝态氮合理配施,能提高烟叶的产质量,协调内在化学成分,对烟叶品质的提高有利。而氮肥在施入土壤后经过硝化作用会快速地由铵态氮转化为硝态氮。可见,合理配比的铵态氮和硝态氮施用能兼顾烟草氮素高效利用、烟叶品质和环境保护的要求。
目前生产上关于提升烤烟生长与氮肥利用的技术有氮肥深施、改施炭基肥、有机物料替代部分化肥、绿肥还田与高效移栽等[11-15],但还需要寻求更加绿色环保的新措施。生物硝化抑制剂是由植物根系产生、能够抑制土壤硝化作用的一类物质,具有来源广、环境友好等优点。生物硝化抑制剂能有效抑制土壤硝化作用,减缓铵态氮转化为硝态氮的进程,是维持根际土壤合理铵硝比的一项有效策略[16-18]。目前已经有一些生物硝化抑制剂在热带牧草、水稻、玉米和高粱根系分泌物中被发现[19-23]。酚酸类化合物丁香酸(Syringic Acid,SA)是继1, 9-癸二醇后从水稻根系分泌物中鉴定出的第二个水稻源生物硝化抑制剂,它能与1, 9-癸二醇产生协同抑制土壤硝化作用的效果[24]。华瑶等[25]通过土壤微域培养试验,发现丁香酸能显著抑制在黔西南植烟土壤硝化速率5% ~ 51%,且抑制效率优于另一生物硝化抑制剂对羟基苯丙酸甲酯(MHPP);同时,丁香酸能抑制氨氧化古菌(AOA)和氨氧化细菌(AOB) 的amoA基因丰度,并降低21% 的N2O排放。此外,最新研究表明,丁香酸还能在弱酸性水稻土和酸性红壤上抑制硝化作用及N2O排放[26]。
目前生物硝化抑制剂丁香酸的研究主要关注对土壤氮转化的影响,对植物生长的影响鲜有报道。不同生物硝化抑制剂对植物根系生长的研究主要集中在MHPP和水稻源1, 9-癸二醇上,但是两者的调控效果不一。Liu等[27]研究发现MHPP能抑制拟南芥主根的伸长和促进侧根的发育。在药用植物紫苏中,MHPP对主根伸长抑制作用随浓度增加而增加[28]。而水稻源生物硝化抑制剂1, 9-癸二醇则对拟南芥根系有一定的促进效果,特别是在低浓度条件下,1, 9-癸二醇能促进拟南芥主根的伸长[29]。丁香酸在抑制植烟土壤硝化作用的同时,对烟草根系生长的影响如何?是否与其他生物硝化抑制剂有相似或不同的调控作用还有待探索。由此,本研究以能抑制植烟土壤硝化作用的生物硝化抑制剂——丁香酸为对象,通过室内琼脂基质试验,探讨其对贵州黔西南地区两个主栽烟草品种K326和云烟85苗期根系生长的影响及作用范围,以期能为丁香酸在烟苗培养和植烟土壤上的田间应用提供理论依据。
1 材料与方法 1.1 试验材料与试验设计供试烟草品种为K326、云烟85,生物硝化抑制剂为丁香酸(Sigma-Aldrich,美国)。
为了更好更方便地观察烟草苗期根系的变化,采用琼脂基质进行培养试验。琼脂基质还能部分反映常规烟草幼苗育苗基质的特性。试验时,首先将烟草种子装入灭菌后的1.5 mL离心管中,加入1 mL 10% H2O2、10 μL十二烷基硫酸钠(SDS),涡旋仪蜗旋均匀,保证种子灭菌完全,保持15 min后,在离心管表面喷洒75% 酒精灭菌后转移入超净工作台。随后,用移液枪吸取灭菌水对种子进行冲洗5 ~ 7次,直至洗净为止,再加入适量0.1% 琼脂糖溶液,使种子短暂悬浮在琼脂糖溶液中以备后续播种。使用特制播种枪头将种子播种到常规萌发培养基质(13 cm×13 cm)上,基质成分为:2 mmol/L KH2PO4、2 mmol/L MgSO4·7H2O、5 mmol/L NaNO3、1 mmol/L CaCl2·2H2O、50 μmol/L H3BO3、12 μmol/L MnSO4·2H2O、1 μmol/L ZnCl2、1 μmol/L CuSO4·5H2O、0.2 μmol/L Na2 MoO4·2H2O、100 μmol/L EDTA(乙二胺四乙酸二钠盐,二水)、100 μmol/L FeSO4·7H2O、0.5 g/L 2-(N-吗啉)乙磺酸(MES)、1% (m/V)蔗糖、0.6% (m/V)琼脂粉(用3 mol/L NaOH调至pH 5.8)。其中,添加的MES可以起到pH缓冲作用,防止基质pH在植物生长过程中发生大幅度变化。基质板用Parafilm膜封口后垂直置于光照培养室中,使根沿基质表面垂直向下生长。培养室光周期为16 h/8 h,温度(23 ± 1) ℃,光照强度为8 000 lux。
丁香酸设置6个不同浓度:0、10、25、50、100、200 μmol/L,溶解于乙醇,现配现用。烟草种子在常规培养基质上发芽7 d后(根长达0.6 ~ 0.7 cm),取长势均匀的烟草幼苗转移至丁香酸处理的基质上继续生长,在培养3 d和5 d测定烟草主根长和侧根数量。每个处理设置15个重复。
1.2 测定指标主根伸长量:烟草移苗后在基质底部标记初始根长度[29],在移苗后的3 d用直尺测量净增长量,测量后再次在基质底部做标记,5 d后测量较3 d时的增长量。
一级侧根数量:用肉眼数出一级侧根数量[30],并用直尺量出一级侧根长度(侧根长度大于0.5 mm记为一条侧根,不到0.5 mm记为无侧根)[31]。
1.3 数据处理应用Excel 2019进行数据处理,数据的统计分析采用SPSS 23.0,图表使用Origin 2021和Excel 2019制作。
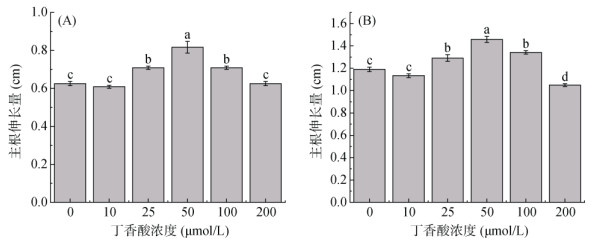
2 结果与分析 2.1 丁香酸对烟草K326主根增长的影响如图 1所示,不同浓度丁香酸对烟草K326根系主根净增长的影响表现为低浓度促进,高浓度抑制。丁香酸处理3 d时,在低浓度10 ~ 50 μmol/L范围内对K326主根伸长量的促进作用随浓度增加而增加,在50 μmol/L时丁香酸的促进作用最强达30.67%(表 1);在50 ~ 200 μmol/L浓度范围内,丁香酸对K326主根生长的促进效应随浓度增加而下降,在100 μmol/L时促进率为13.33%,但在200 μmol/L时无显著影响(图 1A)。丁香酸处理5 d时,对K326主根伸长的影响与3 d时的效果类似。在50 μmol/L时,丁香酸对K326主根伸长量的促进率最强为22.55%;在200 μmol/L时反而有一定的抑制效应(图 1B)。可见,在25 ~ 100 μmol/L内,丁香酸对培养3 d和5 d的K326主根伸长量均表现为显著的促进作用,且在50 μmol/L时有最强的促进效果,丁香酸的促进率在3 d时比5 d时更高(表 1)。
|
(图中误差线表示SE,柱图上方不同小写字母表示处理间差异显著(LSD,P<0.05),下同) 图 1 不同浓度丁香酸对处理3 d(A)和5 d时(B)K326主根伸长量的影响 Fig. 1 Effects of different syringic acid concentrations on elongation of K326 primary roots at 3 d (A) and 5 d (B) |
|
|
表 1 不同浓度丁香酸处理3 d和5 d时K326主根伸长促进率 Table 1 Promoting rates of different syringic acid concentrations on K326 taproot elongation at 3 d and 5 d |
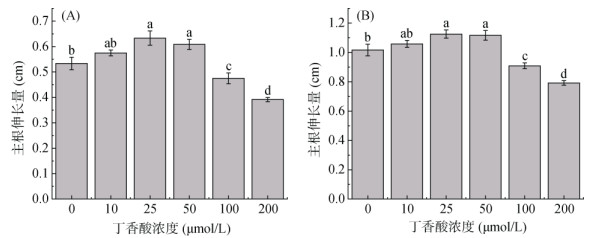
如图 2所示,不同浓度丁香酸对烟草云烟85根系主根净增长也有低促高抑的效果。丁香酸处理3 d时,在低浓度10 ~ 50 μmol/L范围内对云烟85主根净增长的影响表现为促进,最适浓度为25 μmol/L,促进效果最佳达18.75%(表 2);在25 ~ 200 μmol/L浓度范围内,丁香酸对云烟85主根净增长的促进效应随浓度增高而下降,在50 μmol/L时的促进作用虽有下降但依然显著,但从100 μmol/L开始,丁香酸对云烟85主根净增长表现为显著抑制(图 2A)。丁香酸处理5 d时,对云烟85主根伸长的影响与3 d时类似。在25 μmol/L时,丁香酸对云烟85主根伸长促进效率最强,为10.66%;在100 ~ 200 μmol/L浓度范围内,丁香酸对云烟85主根伸长有一定的抑制作用(图 2B)。可见,丁香酸在低浓度25 ~ 50 μmol/L时能显著促进云烟85主根伸长,且丁香酸的促进效率3 d时优于5 d时(表 2)。
|
图 2 不同浓度丁香酸对处理3 d(A)和5 d(B)时云烟85主根伸长量的影响 Fig. 2 Effects of different syringic acid concentrations on elongation of Yunyan85 primary roots at 3 d (A) and 5 d (B) |
|
|
表 2 不同浓度丁香酸处理3 d和5 d时云烟85主根伸长促进率 Table 2 Promoting rates of different syringic acid concentrations on Yunyan85 taproot elongation at 3 d and 5 d |
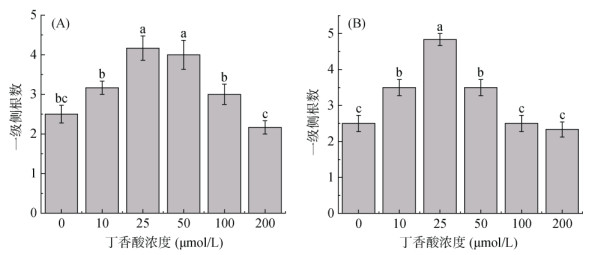
如图 3所示,处理5 d时,不同浓度丁香酸对K326和云烟85一级侧根数量的影响表现为低促高抑的作用。25 ~ 50 μmol/L丁香酸显著促进K326侧根发生;10 μmol/L和100 μmol/L丁香酸促进K326烟草侧根发生,但效果不显著;200 μmol/L丁香酸对K326侧根发生有一定抑制作用但不显著;其中25 μmol/L丁香酸是促进烟草K326侧根发育的最适浓度(图 3A)。由图 3B可知,10 ~ 50 μmol/L丁香酸均能显著促进云烟85侧根发育,100 ~ 200 μmol/L丁香酸对云烟85侧根发育无显著影响,其中25 μmol/L丁香酸是促进烟草云烟85侧根发育的最适浓度。
|
图 3 不同浓度丁香酸对K326(A)和云烟85(B)侧根数量的影响 Fig. 3 Effects of different syringic acid concentrations on numbers of lateral roots of K326 and Yunyan 85 |
|
|
表 3 不同浓度丁香酸处理对烟草K326和云烟85侧根数的促进率 Table 3 Promotion rates of different syringic acid concentrations on numbers of lateral roots of tobacco K326 and Yunyan 85 |
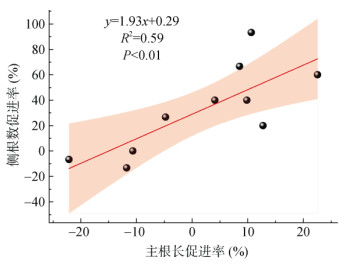
如图 4所示,将丁香酸处理下烟草K326和云烟85主根长和侧根数的促进率进行相关性分析,发现两个品种的主根长变化率和侧根数变化率呈显著正相关(R2=0.59,P<0.01),即丁香酸对烟草苗期主根和侧根生长的调控是一致的,能同时促进主根伸长和侧根发育。在25和50 μmol/L添加浓度时,丁香酸能同时促进两个烟草品种的主根长和侧根数;在200 μmol/L时,丁香酸对主根长和侧根数反而有一定的抑制效应。值得注意的是,处理5 d时,25和50 μmol/L丁香酸对云烟85主根增长的促进率低于K326,但对云烟85侧根数的促进反而强于K326。
|
图 4 丁香酸处理下K326和云烟85主根伸长和侧根发育促进率的相关性 Fig. 4 Correlation between stimulations of primary root elongation and lateral root development of K326 and Yunyan 85 by syringic acid |
酚酸类物质广泛存在于植物根系分泌物中,是根系代谢物中重要的组成成分。本课题前期研究发现,酚酸类生物硝化抑制剂丁香酸能抑制贵州黔西南植烟土壤的硝化作用和N2O排放[25]。本研究在此基础上,进一步发现丁香酸对两个典型烟草品种的苗期根系生长均具有低促高抑的调控作用。这与一些酚酸类物质在其他植物品种上的效果类似。葛杰克等[32]研究发现,外源添加低浓度(50 mg/kg)酚酸类物质对羟基苯甲酸能促进栝楼根系伸长,且随着浓度升高,其促进效应转变为抑制作用。王戈[33]发现烟草根系分泌物中酚酸类混合物对烟草幼苗地下部生物量有低促高抑的作用。在生物硝化抑制剂对根系调控方面,最新研究发现,1, 9-癸二醇在100 ~ 400 μmol/L范围内能促进拟南芥苗期主根伸长和侧根发育,但在高浓度800 μmol/L时反而有抑制作用[29],这与本研究丁香酸对烟草根系生长低促高抑的效应一致。然而,另外一种生物硝化抑制剂MHPP在0 ~ 80 μmol/L浓度范围内却显著抑制了拟南芥主根伸长[27]。这些生物硝化抑制剂对根系调控效果的差异可能是由于其化学结构不同,导致调控模式不同。丁香酸能促进两个烟草主栽品种K326与云烟85的主根伸长,在处理3 d和5 d时都能促进主根增长,效果稳定,表明合适浓度的丁香酸能维持较稳定的正向调控作用,在种植烤烟时可以考虑在基肥或烟苗培养基质中适当增加丁香酸,以助于促进烟株幼苗的生长以及根系的发育。
本研究中,丁香酸对主栽品种K326和云烟85侧根发育的影响与主根类似,表现为低促高抑的趋势。低浓度10 ~ 50 μmol/L范围内丁香酸能促进K326和云烟85侧根的发育,这与MHPP在40 ~ 80 μmol/L时促进拟南芥侧根发育和在20 ~ 40 μmol/L时促进药用紫苏侧根发育的结果相似[27-28],说明生物硝化抑制剂可能是一种潜在的侧根促生剂。本研究进一步发现丁香酸对两个典型烟草品种苗期主根和侧根生长有一致的调控效应,这表明适合浓度丁香酸添加对烟苗生长有正面的调控效应。但25 ~ 50 μmol/L丁香酸对处理5 d时云烟85主根增长的促进率低于K326,对云烟85侧根数的促进率反而强于K326。随着培养时间的增长,丁香酸对两个品种5 d时的主根促进率均低于3 d时。这些结果表明,丁香酸对烟草主根增长促进率的降低可能与其后期促进侧根发育有关[34-35]。
Mandal等[36]研究发现,酚酸类物质会对生长素吲哚乙酸(IAA)的合成产生影响,通过抑制或激活IAA降解酶刺激或抑制IAA的产生,还可通过保持IAA氧化酶和过氧化酶的辅助因子处于活跃状态来刺激IAA的活性,从而促进根系的生长。因此,生长素可能介导了低浓度丁香酸对烟草苗期根系的促生作用,但具体的调控机制还有待进一步探究。
丁香酸作为生物硝化抑制剂不仅能抑制烟株根际土壤的硝化作用,还能调控烟草根系的生长,可作为一种环境友好的新型氮肥增效剂和根系促生剂。本研究发现丁香酸对K326主根促进效果优于云烟85,但对云烟85的侧根发育促进优于K326,未来有待在更多的烟草品种中和田间试验中测试丁香酸的效果。植株对土壤营养的吸收受其根系生长状况的影响[37]。本研究中,外源添加一定浓度的丁香酸能促进烟草K326和云烟85根系发育,这为丁香酸今后在不同烟草品种上的推广应用提供了可能性。因为苗期根系越发达,其生理活性越强,烟株自抗能力越高,同时有益微生物与烟草根系形成互惠互利的共生关系,能明显改善烟株的农艺性状,提高烟叶外观质量,协调化学成分,最后提高其经济效益,减少环境风险[38-39]。
4 结论外源添加适宜浓度的生物硝化抑制剂丁香酸均能促进烟草品种K326和云烟85的主根增长。低浓度丁香酸对不同烟草品种侧根发育也有促进效应,25 μmol/L丁香酸能够显著提高K326和云烟85的一级侧根数量。随着培养时间增加,丁香酸对烟草主根增长促进效应减弱,可能更有利于后期侧根发育。丁香酸能够促进贵州当地主栽品种烟草的根系发育,为今后研发新型的烟草优质专用肥提供了理论指导。
| [1] |
王利超, 王涵, 朴世领, 等. 铵硝氮配比对烤烟生长生理及产量和品质的影响[J]. 西北农林科技大学学报(自然科学版), 2012, 40(12): 136-144 (  0) 0) |
| [2] |
高维常, 蔡凯, 曾陨涛, 等. 农用地膜残留对土壤氮素运移及烤烟根系生长的影响[J]. 土壤学报, 2020, 57(6): 1556-1563 (  0) 0) |
| [3] |
陈沂岭, 赵学强, 张玲玉, 等. 铵硝营养对水稻氮效率和矿质养分吸收的影响[J]. 土壤, 2019, 51(2): 243-250 DOI:10.13758/j.cnki.tr.2019.02.005 (  0) 0) |
| [4] |
黄玲, 翁贤权, 侯利涵, 等. 不同形态氮及钾营养对栲树苗生长和氮吸收的影响[J]. 中南林业科技大学学报, 2019, 39(9): 39-47 (  0) 0) |
| [5] |
徐威, 王晓巍, 王文丽, 等. 烟草漂浮育苗基质配方的筛选[J]. 甘肃农业大学学报, 2022, 57(6): 131-139 (  0) 0) |
| [6] |
李玉静, 冯雨晴, 赵园园, 等. 硝态铵态氮比例对不同氮效率烟草苗期氮素吸收及利用的影响[J]. 中国烟草学报, 2023, 29(1): 23-35 (  0) 0) |
| [7] |
宋文静, 宋科, 董建新, 等. 铵硝混合营养对烟草苗期氮代谢酶及内源生长素的影响[J]. 江苏农业科学, 2019, 47(8): 100-104 (  0) 0) |
| [8] |
王蒙, 王喜枝, 刘世亮, 等. 铵态氮/硝态氮配比对豫中烟区烤烟生长及品质调控研究[J]. 河南农业科学, 2016, 45(4): 37-42 (  0) 0) |
| [9] |
介晓磊, 黄向东, 刘世亮, 等. 不同氮素供应对烟草品质指标的影响[J]. 土壤通报, 2007, 38(6): 1150-1153 (  0) 0) |
| [10] |
张新要, 姜占省, 李天福, 等. 不同饼肥用量和氮素形态配比对烤烟产质量的影响[J]. 土壤通报, 2005, 36(6): 867-870 (  0) 0) |
| [11] |
祖韦军, 潘文杰, 张金召, 等. 耕作深度与翻压绿肥对植烟土壤微生物功能多样性及酶活性的影响[J]. 南方农业学报, 2020, 51(10): 2383-2393 (  0) 0) |
| [12] |
陈懿, 林英超, 杨志晓, 等. 炭基肥对黄壤烤烟生理和氮素吸收与平衡的影响[J]. 土壤学报, 2022, 59(3): 864-872 (  0) 0) |
| [13] |
李青山, 王德权, 高政绪, 等. 氮肥配施纳米碳对植烟土壤氮素转化及N2O排放的影响[J]. 土壤, 2021, 53(2): 258-264 DOI:10.13758/j.cnki.tr.2021.02.006 (  0) 0) |
| [14] |
李孝刚, 彭曙光, 靳志丽, 等. 有机物料对植烟土壤氮素矿化及微生物性质的影响[J]. 土壤学报, 2021, 58(1): 225-234 (  0) 0) |
| [15] |
林叶春, 陈伟, 陈懿, 等. 井窖式移栽对烟苗生长和光合特性的影响[J]. 中国农业大学学报, 2015, 20(4): 120-126 (  0) 0) |
| [16] |
陆玉芳, 施卫明. 生物硝化抑制剂的研究进展及其农业应用前景[J]. 土壤学报, 2021, 58(3): 545-557 (  0) 0) |
| [17] |
Subbarao G V, Searchinger T D. Opinion: A more ammonium solution to mitigate nitrogen pollution and boost crop yields[J]. Proceedings of the National Academy of Sciences of the United States of America, 2021, 118(22): e2107576118 (  0) 0) |
| [18] |
曾后清, 朱毅勇, 王火焰, 等. 生物硝化抑制剂——一种控制农田氮素流失的新策略[J]. 土壤学报, 2012, 49(2): 382-388 (  0) 0) |
| [19] |
Zakir H A K M, Subbarao G V, Pearse S J, et al. Detection, isolation and characterization of a root-exuded compound, methyl 3-(4-hydroxyphenyl) propionate, responsible for biological nitrification inhibition by Sorghum (Sorghum bicolor)[J]. The New Phytologist, 2008, 180(2): 442-451 DOI:10.1111/j.1469-8137.2008.02576.x (  0) 0) |
| [20] |
Subbarao G V, Nakahara K, Ishikawa T, et al. Biological nitrification inhibition (BNI) activity in sorghum and its characterization[J]. Plant and Soil, 2013, 366(1): 243-259 (  0) 0) |
| [21] |
Subbarao G V, Nakahara K, Hurtado M P, et al. Evidence for biological nitrification inhibition in Brachiaria pastures[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(41): 17302-17307 (  0) 0) |
| [22] |
Sun L, Lu Y F, Yu F W, et al. Biological nitrification inhibition by rice root exudates and its relationship with nitrogen-use efficiency[J]. The New Phytologist, 2016, 212(3): 646-656 DOI:10.1111/nph.14057 (  0) 0) |
| [23] |
Otaka J, Subbarao G V, Ono H, et al. Biological nitrification inhibition in maize—Isolation and identification of hydrophobic inhibitors from root exudates[J]. Biology and Fertility of Soils, 2022, 58(3): 251-264 DOI:10.1007/s00374-021-01577-x (  0) 0) |
| [24] |
Lu Y F, Zhang X N, Ma M K, et al. Syringic acid from rice as a biological nitrification and urease inhibitor and its synergism with 1, 9-decanediol[J]. Biology and Fertility of Soils, 2022, 58(3): 277-289 DOI:10.1007/s00374-021-01584-y (  0) 0) |
| [25] |
华瑶, 陆玉芳, 高维常, 等. 生物硝化抑制剂对黔西南黄壤硝化作用及N2O排放的影响[J]. 土壤, 2023, 55(3): 512-519 DOI:10.13758/j.cnki.tr.2023.03.007 (  0) 0) |
| [26] |
Lu Y F, Hua Y, Lv N, et al. Syringic acid from rice roots inhibits soil nitrification and N2O emission under red and paddy soils but not a calcareous soil[J]. Frontiers in Plant Science, 2022, 13: 1099689 DOI:10.3389/fpls.2022.1099689 (  0) 0) |
| [27] |
Liu Y Y, Wang R L, Zhang P, et al. The nitrification inhibitor methyl 3-(4-hydroxyphenyl)propionate modulates root development by interfering with auxin signaling via the NO/ROS pathway[J]. Plant Physiology, 2016, 171(3): 1686-1703 DOI:10.1104/pp.16.00670 (  0) 0) |
| [28] |
Ma J H, Cao Y H, Sun L L, et al. Methyl 3-(4-hydroxyphenyl) propionate modulates plant growth and secondary metabolite accumulation by inducing metabolic changes in Perilla frutescens[J]. Plant and Soil, 2020, 453(1): 577-593 (  0) 0) |
| [29] |
Ma M K, Lu Y F, Di D W, et al. The nitrification inhibitor 1, 9-decanediol from rice roots promotes root growth in Arabidopsis through involvement of ABA and PIN2-mediated auxin signaling[J]. Journal of Plant Physiology, 2023, 280: 153891 DOI:10.1016/j.jplph.2022.153891 (  0) 0) |
| [30] |
梁栋. IAA和BR参与干旱胁迫影响烟草侧根发育的研究[D]. 北京: 中国农业科学院, 2021.
(  0) 0) |
| [31] |
冯晓宇, 李光杰, 董刚强, 等. 不同浓度NH4+和K+处理对拟南芥突变体amos2侧根发育的影响[J]. 植物生理学报, 2013, 49(5): 463-468 (  0) 0) |
| [32] |
葛杰克, 叶雨蒙, 楼雪怡, 等. 酚酸化感作用对栝楼生理特性及根际微生态的影响[J]. 水土保持学报, 2023, 37(3): 258–266, 272 (  0) 0) |
| [33] |
王戈. 烤烟不同品种根系分泌物与黑胫病抗性关系研究[D]. 昆明: 云南农业大学, 2012.
(  0) 0) |
| [34] |
马新明, 刘国顺, 王小纯, 等. 烟草根系生长发育与地上部相关性的研究[J]. 中国烟草学报, 2002, 8(3): 26-29 (  0) 0) |
| [35] |
黄泽春, 彭海峰, 屠乃美, 等. 不同农艺措施对烟草根系生长影响的研究进展[J]. 作物研究, 2008, 22(S1): 466-469 (  0) 0) |
| [36] |
Mandal S, Mandal M, Das A, et al. Stimulation of indoleacetic acid production in a Rhizobium isolate of Vigna mungo by root nodule phenolic acids[J]. Archives of Microbiology, 2009, 191(4): 389-393 DOI:10.1007/s00203-008-0455-6 (  0) 0) |
| [37] |
张福锁, 曹一平. 根际动态过程与植物营养[J]. 土壤学报, 1992, 29(3): 239-250 DOI:10.3321/j.issn:0564-3929.1992.03.012 (  0) 0) |
| [38] |
马存金, 任士伟, 郑磊, 等. 硅钙钾镁肥用量对烟草根系发育及烟叶质量的影响[J]. 中国农学通报, 2020, 36(31): 7-12 (  0) 0) |
| [39] |
农传江, 汤利, 徐智, 等. 有机肥部分替代化肥对土壤有机碳库和烤烟经济性状的影响[J]. 中国土壤与肥料, 2016(4): 70-75 (  0) 0) |
2. Key Laboratory of Soil and Sustainable Agriculture, Chinese Academy of Sciences, Nanjing 210008, China;
3. Upland Flue-Cured Tobacco Quality & Ecology Key Laboratory of China Tobacco, Guiyang 550081, China;
4. Qianxi'nan Prefecture Company of Guizhou Tobacco Company, Xingyi, Guizhou 562400, China
 2024, Vol. 56
2024, Vol. 56


