2. 土壤与农业可持续重点实验室(中国科学院), 南京 210008
三氯生(Triclosan,TCS)是常见的广谱抗菌剂,因其脂溶性强,易穿透细胞膜,对真菌、酵母菌和病毒等具有高效的抑杀作用,因此十几年来经常被添加进各种药品和个人护理产品中,如牙膏、抗菌皂、洁面乳和洗衣液[1-2]。这些污染物会随着人类活动进入到固废或水体中,最终进入到污水处理厂,但由于目前污水处理工艺无法完全去除TCS,而残留的TCS会在土壤中不断累积,对生态系统造成潜在威胁[3]。2017年美国食品及药物管理局开始限制TCS的广泛使用[4]。尽管如此,TCS在多种介质如土壤[5]、沉积物[6]、地下水[7]甚至生物体[8]中仍有大量检出,其带来的环境问题不容忽视。已有研究表明,TCS在农田土壤中的暴露会对微生物群落和植物产生毒害作用[9],并且通过食物链累积和接触暴露对人体的内分泌系统和细胞DNA造成损伤[10-11],对土壤生态系统和人类健康造成极大威胁。因此,研究农田土壤中TCS转化及其污染土壤的修复至关重要。
铁锰氧化物广泛存在于土壤环境中,对环境中污染物的迁移和转化具有重要的作用和意义[12]。其中锰氧化物作为重要的活性物质,具有表面积大(50 ~ 300 m2/g)、氧化还原电位高(1.23 V)、表面活性高等特性,是土壤氧化物的重要组成部分,特别是在我国南方红壤地区,其含量在土壤组成中占比极大[13]。以往的研究表明,锰氧化物对环境中的多种有机污染物,如氯酚[14]、苯胺[15],以及含酚羟基的抗生素和激素等药物[16-17]具有氧化去除作用。目前,新污染物对土壤健康的影响受到了极大关注,然而土壤介质中有机污染的转化研究相对较少。因此,开展土壤中锰氧化物与有机污染物之间的界面反应机理的研究,利用土壤中广泛存在的天然锰氧化物修复污染土壤提高土壤自身治污能力[18]具有重要的现实意义,应用前景也将远远超过传统的污染土壤治理措施。基于此,本文研究了不同土壤类型条件下pH、锰氧化物浓度和小分子有机酸对农田土壤中TCS降解的影响,提出了TCS在锰氧化物作用下的降解机制以及转化路径,以期为TCS污染土壤的修复提供理论依据和技术支持。
1 材料与方法 1.1 试剂与仪器实验材料:三氯生(TCS,97%)为分析纯,购自上海阿拉丁;甲醇和丙酮均为液相色谱纯;亚硝酸钠、高锰酸钾、硝酸锰、草酸、酒石酸、柠檬酸、甲酸等均为分析纯;实验用水均为Milli-Q超纯水。
实验仪器:高效液相色谱仪(HPLC-2030,Shimadzu);双层往复恒温振荡仪(HZ-2610K,上海佐研仪器科技有限公司);原子吸收光谱仪(Z-2000,Hitachi);高效液相色谱-飞行时间质谱联用仪(HPLC-QTOF-MS,SCIEX)。
1.2 供试土壤供试土壤分别采自于江西鹰潭市、云南金墩乡和河南封丘市的稻田,3种土壤的pH、有机质含量和铁锰金属浓度等信息详见表 1。土壤风干、磨碎处理后,用丙酮配置2 g/L的TCS储备液,取一定量的储备液在有机溶剂的辅助下与土壤混匀,配置成50 mg/kg的TCS模拟污染土样,自然风干、老化2周后过60目筛备用。
|
|
表 1 供试土壤的理化性质 Table 1 Physiochemical properties of tested soils |
选取土壤中常见的δ型锰氧化物(δ-MnO2)进行研究,其制备流程如下[19]:250 mL的0.15 mmol/L Mn (NO3)2·4H2O溶液在蠕动泵作用下以20 mL/min的速度泵入250 mL的0.1 mmol/L KMnO4和0.2 mmol/L NaOH的混合溶液中,在添加过程中和之后的24 h内持续以600 r/min速度搅拌;然后将混合溶液离心,离心所得沉淀物用蒸馏水和乙醇洗涤数次,直至滤出液pH为中性;将洗涤后的样品晾干水分,放入真空冷冻干燥机中干燥48 h后用研钵研磨,过60目细筛后密封保存待用。
通过环境扫描电镜(SU8220,Hitachi)和X射线衍射仪(Ultima Ⅳ,Rigaku)对合成的锰氧化物进行表征分析。
1.4 试验设计 1.4.1 TCS的降解动力学称取质量为0.05 g左右的锰氧化物加入到含有0.5 g污染土壤样品和2 mL去离子水(土水比为1∶4)的棕色玻璃瓶中(土壤悬液中锰氧化物和TCS的浓度分别为25 g/L和12.5 mg/L),盖上带有聚四氟乙烯内衬的瓶盖。预先将玻璃瓶充分混匀,以80 Hz频率下超声3 min,使锰氧化物均匀分散在土壤悬液中。随后将反应瓶放置于恒温摇床,保持25 ℃、150 r/min,避光振荡8 h。每个样品设置2个平行,分别在0.5、1、2、4、8 h对土壤中TCS进行全提,即向土壤悬液中加入5 mL甲醇振荡,然后在80 Hz的频率下超声辅助提取5 min,取出1 mL样品以15 000 r/min离心2 min,过0.22 μm的滤膜后进行TCS浓度分析,上述方法测得的TCS回收率为93%±1%。
参照上述试验方法,将不同反应时间段的样品以3 500 r/min离心5 min,过0.22 μm的滤膜后收集到5 mL离心管中,加入一滴硝酸酸化后,采用火焰原子法测定不同样品中Mn2+的浓度。
1.4.2 环境因素影响1) 不同土壤类型对TCS降解的影响。称取质量为0.5 g不同供试土壤置于8 mL棕色玻璃瓶中,添加2 mL超纯水和0.05 g MnO2。试验设定TCS的初始浓度为12.5 mg/L,锰氧化物的初始浓度为25 g/L。
2) 锰氧化物浓度对TCS降解的影响:称取质量为0.5 g江西鹰潭红壤置于8 mL棕色玻璃瓶中,添加2 mL超纯水和不同质量的MnO2。试验设定TCS的初始浓度为12.5 mg/L,锰氧化物的初始浓度为5、10、25和50 g/L。
3) 有机酸种类和浓度对TCS降解的影响:配制100 mmol/L 3种农田常见的有机酸(酒石酸、柠檬酸、草酸)溶液,称取质量为0.5 g江西鹰潭红壤置于8 mL棕色玻璃瓶中,添加2 mL超纯水、0.05 g MnO2和不同体积的有机酸溶液。试验设定TCS的初始浓度为12.5 mg/L,锰氧化物的初始浓度为25 g/L,不同有机酸溶液的初始浓度为1、5、10 mmol/L。
反应试验和TCS的提取测定方法均参照1.4.1节。
1.5 分析方法 1.5.1 TCS分析从土壤中提取的TCS浓度采用高效液相色谱仪测定,HPLC条件:色谱柱为C18柱(4.6 mm×150 mm,5 μm),流动相为甲醇/0.1% 甲酸= 85/15(V/V),流速为1.0 mL/min,检测波长为275 nm,柱温为30 ℃,在此条件下,TCS的保留时间为7.9 min。
通过一级反应动力学方程描述前2 h反应过程中TCS的降解:
| $ \ln \left(C_t / C_0\right)=-k_{\mathrm{obs}} \times t$ |
式中:Ct 和C0分别表示t时刻和0时刻TCS的浓度(mmol/L),kobs是伪一级动力学常数(h-1),表示TCS的降解速率。
1.5.2 TCS降解产物分析为鉴定土壤中TCS的转化产物,采用减压旋蒸法对样品进行浓缩纯化。取出反应后的土壤冻干后置于8 mL的玻璃瓶中,加入5 mL甲醇溶液,置于超声波提取仪中超声1 h,然后在转速5 000 r/min条件下离心10 min后收集上清液,重复提取2次。将提取液在旋转蒸发仪上浓缩至小于1 mL,用甲醇定容,超声溶解10 min,过0.22 μm有机滤膜后,采用HPLC-TOF-MS定性分析产物。
HPLC-TOF-MS条件:色谱柱为C18柱(2.1 mm × 100 mm),载气为高纯氮气,50 kPa:流动相由0.1% 甲酸溶液(A相)和甲醇(B相)组成,采用梯度洗脱的方式,梯度洗脱从90% 的A开始,持续2 min,然后线性将A降低到10%,再持续1 min,保持23 min,然后在1 min内恢复到初始条件,接着进行2 min的平衡。采用电喷雾电离(ESI)在负离子模式下进行扫描,扫描范围m/z为60 ~ 800。
2 结果与讨论 2.1 锰氧化物材料表征锰氧化物的扫描电镜和XRD图谱如图 1所示。根据扫描电镜的结果可知,合成的锰氧化物为絮状结构。XRD图谱中,在2θ为37°和68°处出现了明显的特征衍射峰,与黄成等[20]和Sun等人[19]报道的结果一致,表明制备得到的产物为δ-MnO2,其结晶度较差,为无定形态。

|
图 1 锰氧化物扫描电镜图和XRD图谱 Fig. 1 SEM image and X-ray diffraction pattern of manganese oxide |
江西鹰潭红壤、云南金墩红壤和河南封丘潮土的pH分别为4.74、5.93和8.34(表 1)。如图 2所示,TCS在不同土壤中8 h的降解率分别为67%、30% 和11%。该结果表明不同类型土壤中降解效率差异显著,并且TCS在土壤中的降解效率与土壤pH呈负相关性,即随着土壤pH的升高,其明显抑制锰氧化物对TCS的氧化降解作用。这主要是由于TCS的存在形态和锰氧化物表面带电性质均受pH的影响[21],从而产生不同的降解效果。
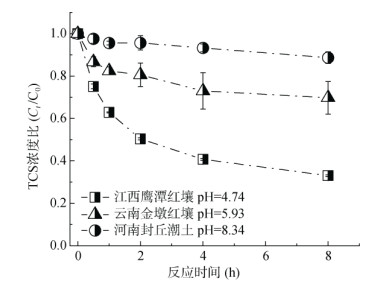
|
图 2 不同土壤中TCS降解效率 Fig. 2 TCS degradation efficiencies in different soils |
据报道[22],锰氧化物在酸性条件下具有较高的氧化活性,其标准氧化还原电位为1.23 V,但随着pH的升高,其氧化活性逐渐减弱,从而导致了TCS在不同pH的土壤中降解效率具有明显的差异。此外,pH也会影响锰氧化物和TCS的表面电位,从而改变二者的表面络合物的状态和电子转移速率,影响氧化还原过程[23]。δ-MnO2零电点pHpzc为2.25,当环境pH > 2.25时,其表面带负电荷,并且随着pH的升高其负电性也随之增强[24]。由于TCS在环境中主要以去质子化的形式存在[25],pH的升高使得TCS和锰氧化物之间在静电作用下的斥力增强,从而抑制了TCS的降解效率[26]。
2.3 锰氧化物添加量对TCS降解的影响上述结果表明锰氧化物在江西鹰潭红壤中对TCS有显著的降解作用,因此后续将以鹰潭红壤作为主要供试土壤研究锰氧化物浓度的影响。TCS的降解动力学曲线如图 3A所示,在未添加MnO2的对照组中,土壤介质中TCS的浓度随时间没有明显的变化,说明供试土壤中锰矿物浓度不足以有效降解TCS。但在添加MnO2后,TCS的降解速率随着MnO2浓度的增加逐渐提升,当MnO2浓度为5 g/L时,TCS在8 h的降解率仅为22%,进一步增加MnO2浓度至50 g/L时,TCS的降解率高达81%。一级反应动力学方程可以较好地描述反应初期MnO2对TCS的降解作用(表 2),在锰氧化物浓度从5 g/L增加到50 g/L的过程中,一级动力学速率常数从0.062 3 h-1增加到0.525 2 h–1。将不同浓度MnO2与一级反应速率常数进行拟合,结果如图 3B所示,二者之间存在明显的线性关系,拟合方程为:kobs = 0.0102[MnO2] + 0.0314。尽管反应初期TCS的浓度迅速下降,但其降解速率在2 h后明显减慢,当MnO2的浓度为25 g/L时,TCS的降解率在前2 h内达到50%,但在随后的6 h内TCS的降解率仅为17%。以往研究报道发现锰氧化物氧化四环素类[27]、磺胺类[28]和苯酚[17, 29]等有机化合物时也出现了类似的反应动力学特征。这可能与锰氧化物降解有机物的机理有关,即锰氧化物氧化TCS的过程是首先TCS和MnO2形成表面络合物,随后TCS分子和锰氧化物之间以电子转移方式形成降解产物和Mn2+[26, 30]。随着反应的进行,TCS的降解产物和MnO2的还原产物Mn2+吸附到了MnO2表面,减少了TCS在MnO2表面的反应活性位点,从而抑制了后续TCS降解效率。

|
图 3 TCS在不同MnO2浓度下的降解动力学(A)和MnO2浓度与一级反应速率常数的相关性(B) Fig. 3 Degradation kinetics of TCS at different MnO2 concentrations(A) and relationship between MnO2 concentration and first-order reaction rate constants (B) |
|
|
表 2 不同锰氧化物浓度下TCS降解一级动力学 Table 2 First order kinetics of TCS degradation at different MnO2 concentrations |
为了进一步确认锰氧化物的化学氧化作用,测定了土壤悬液中Mn2+的含量变化。如图 4所示,在Soil和Soil(TCS)的对照组中,Mn2+的浓度几乎不变;在Soil添加MnO2的一组中,Mn2+的浓度在反应8 h后,相对于对照组增加了62.4 μg/L,说明锰氧化物与土壤中还原性物质发生反应导致了Mn2+的释放;另外在Soil(TCS)添加MnO2组别中,相对于土壤中含MnO2而不含TCS组别,其Mn2+浓度在8 h后增加了156.3 μg/L,而增加的Mn2+浓度则是由MnO2与TCS反应所产生的。

|
图 4 不同处理土壤中Mn2+浓度的变化情况 Fig. 4 Changes of Mn2+ concentrations under different treatments |
土壤环境中存在着大量溶解性有机质,其中小分子有机酸是一类活性较强的有机物质[31],如草酸、酒石酸和柠檬酸等,能够还原和溶解MnO2[32],对MnO2降解有机污染物的效率有一定影响[33-34]。有机酸种类和浓度对TCS的影响如图 5所示,草酸和柠檬酸在1 mmol/L时,一定程度上促进了TCS的降解,这可能与MnO2与有机酸反应生成Mn(Ⅲ)-有机酸配合物有关[35],Huang等人[36]提出Mn(Ⅲ) 可以促进MnO2与污染物之间的电子转移而加速污染物的降解。但是,高浓度的有机酸则明显抑制了MnO2对TCS的降解作用,并且随着浓度的增加抑制效果越明显。以往的研究表明[37-38],过量的有机酸会与MnO2反应生成Mn2+,从而占据MnO2表面的吸附位点抑制污染物的降解,并且有机酸对抗生素的抑制作用会随着有机酸浓度的增加而增强。酒石酸对TCS降解的影响与柠檬酸和草酸不同,TCS在1 mmol/L酒石酸参与下的降解率仅为56%,并且其降解率会随着酒石酸的浓度升高而增强。这可能是由于酒石酸的结构使其难以络合Mn(Ⅲ),低浓度的酒石酸无法与MnO2反应生成足量的Mn(Ⅲ)-有机酸配合物而抑制TCS的降解[35],而随着浓度的升高,则促使更多的MnO2转化为Mn(Ⅲ)。

|
图 5 小分子酸种类和浓度对TCS降解效率的影响 Fig. 5 Effects of small molecule acid types and concentrations on TCS degradation efficiency |
本试验利用甲醇从土壤中提取TCS反应8 h后的产物进行液相色谱-飞行时间质谱分析,用以探究TCS的降解产物。测定采取负离子模式,检测到的离子为[M-H]–型,在物质的质荷比(m/z)数值上加一个质子可推知其相对分子质量。通过分析,检测到了5个主要产物,其质谱图如图 6所示,图 6A为TCS母体(m/z = 288.9)提取的离子流谱图,图 6B为从m/z = 574.9处提取的离子流谱图,结合二级质谱图 6C可以进一步确定TCS的降解产物为二聚体,并且未检测到其他转化产物。因此我们推断TCS的转化途径如图 6D所示,酚羟基被Mn4+氧化失去一个电子形成苯氧自由基,随后苯氧自由基通过羟基邻位、对位C-C键或C-O键耦合生成5个不同结构的二聚体[17]。尽管之前的研究发现TCS在MnO2作用下的降解产物除了二聚体产物,还有被氧化形成的对苯醌和断裂醚键的产物[39],但由于其浓度极低,因此在本次试验中未能检测到。
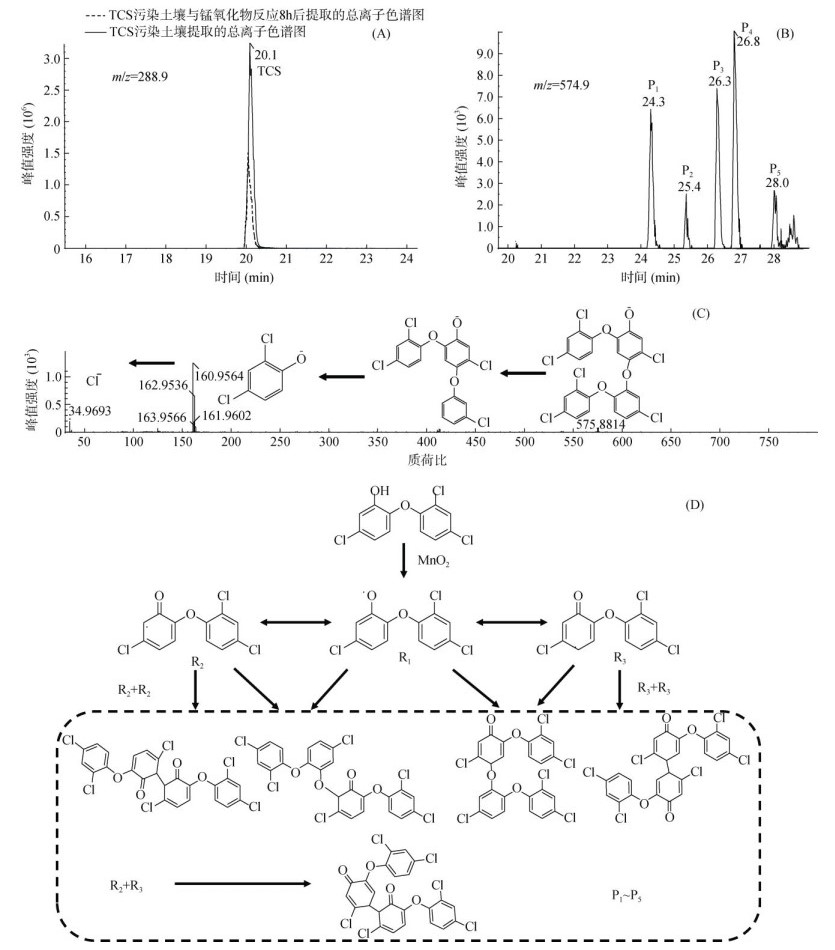
|
图 6 TCS的提取峰(A)、降解产物的提取峰(B)、降解产物的二级质谱图(C)和TCS的降解产物及其转化路径(D) Fig. 6 Extraction peaks of TCS(A), extraction peaks of degradation products (B), secondary mass spectra of degradation products (C) and degradation products of TCS and their transformation pathways (D) |
1) 不同类型土壤中锰氧化物对TCS的降解效率主要受土壤pH的影响。不同pH会直接影响锰氧化物的氧化还原电位,促使其在酸性条件下具有较高的氧化活性。
2) TCS的降解速率随着锰氧化物添加量的增加而增大,其降解动力学常数与锰氧化物的浓度成正比,同时土壤中Mn2+随着反应的进行而快速地释放,表明该降解反应是一个氧化还原反应。
3) 不同有机酸对TCS降解效率影响不同,随着有机酸浓度的升高,草酸和柠檬酸对TCS的降解效率从促进转为抑制,而酒石酸则从抑制转为促进。
4) 通过对TCS的降解产物进行分析,发现降解产物主要以二聚体为主,其反应途径为三氯生的酚羟基被锰氧化物剥夺失去一个电子形成苯氧自由基,进一步发生自耦合反应。
| [1] |
Halden R U, Paull D H. Co-occurrence of triclocarban and triclosan in U. S. water resources[J]. Environmental Science & Technology, 2005, 39(6): 1420-1426 (  0) 0) |
| [2] |
Yee A L, Gilbert J A. Microbiome is triclosan harming your microbiome?[J]. Science, 2016, 353(6297): 348-349 DOI:10.1126/science.aag2698 (  0) 0) |
| [3] |
Oh S, Choi D, Cha C J. Ecological processes underpinning microbial community structure during exposure to subinhibitory level of triclosan[J]. Scientific Reports, 2019, 9: 4598 DOI:10.1038/s41598-019-40936-5 (  0) 0) |
| [4] |
Adhikari S, Kumar R, Driver E M, et al. Mass trends of parabens, triclocarban and triclosan in Arizona wastewater collected after the 2017 FDA ban on antimicrobials and during the COVID-19 pandemic[J]. Water Research, 2022, 222: 118894 DOI:10.1016/j.watres.2022.118894 (  0) 0) |
| [5] |
Chen Y S, Shi R, Luo H J, et al. Alkali-catalyzed hydrothermal oxidation treatment of triclosan in soil: Mechanism, degradation pathway and toxicity evaluation[J]. Science of the Total Environment, 2023, 856: 159187 DOI:10.1016/j.scitotenv.2022.159187 (  0) 0) |
| [6] |
Liang Y, Song H, Wu Y, et al. Occurrence and distribution of triclosan and its transformation products in Taihu Lake, China[J]. Environmental Science and Pollution Research, 2022, 29(56): 84787-84797 DOI:10.1007/s11356-022-21568-1 (  0) 0) |
| [7] |
Milanović M, Đurić L, Milošević N, et al. Comprehensive insight into triclosan-from widespread occurrence to health outcomes[J]. Environmental Science and Pollution Research International, 2023, 30(10): 25119-25140 (  0) 0) |
| [8] |
Pycke B F G, Roll I B, Brownawell B J, et al. Transformation products and human metabolites of triclocarban and triclosan in sewage sludge across the United States[J]. Environmental Science & Technology, 2014, 48(14): 7881-7890 (  0) 0) |
| [9] |
刘欣雨, 张建强, 黄雯, 等. 中国土壤中抗生素赋存特征与影响因素研究进展[J]. 土壤, 2021, 53(4): 672-681 (  0) 0) |
| [10] |
Prins G S. Endocrine disruptors and prostate cancer risk[J]. Endocrine Related Cancer, 2008, 15(3): 649-656 DOI:10.1677/ERC-08-0043 (  0) 0) |
| [11] |
李林朋, 马慧敏, 胡俊杰, 等. 三氯生和三氯卡班对人体肝细胞DNA损伤的研究[J]. 生态环境学报, 2010, 19(12): 2897-2901 (  0) 0) |
| [12] |
汤艳杰, 贾建业, 谢先德. 铁锰氧化物在污染土壤修复中的作用[J]. 地球科学进展, 2002, 17(4): 557-564 (  0) 0) |
| [13] |
于天仁. 水稻土的物理化学[M].
科学出版社, 北京, 1983
(  0) 0) |
| [14] |
徐仁扣, 刘志光. 土壤中的氧化锰对酚类化合物的氧化降解作用[J]. 土壤学报, 1995, 32(2): 179-185 (  0) 0) |
| [15] |
Zhao L, Yu Z Q, Peng P A, et al. Oxidation kinetics of pentachlorophenol by manganese dioxide[J]. Environmental Toxicology and Chemistry, 2006, 25(11): 2912-2919 DOI:10.1897/06-001R.1 (  0) 0) |
| [16] |
Wang X H, Wang S Y, Qu R J, et al. Enhanced removal of chlorophene and 17β-estradiol by Mn(Ⅲ) in a mixture solution with humic acid: Investigation of reaction kinetics and formation of co-oligomerization products[J]. Environ mental Science & Technology, 2018, 52(22): 13222-13230 (  0) 0) |
| [17] |
Ge C, Wang X H, Yu F R, et al. Mechanistic insight into manganese oxidation induced by sulfite under aerobic condition: Implication of triclosan degradation[J]. Separation and Purification Technology, 2023, 306: 122583 DOI:10.1016/j.seppur.2022.122583 (  0) 0) |
| [18] |
鲁安怀. 矿物学研究从资源属性到环境属性的发展[J]. 高校地质学报, 2000, 6(2): 245-251 (  0) 0) |
| [19] |
Sun Q A, Cui P X, Wu S, et al. Role of reduced sulfur in the transformation of Cd(Ⅱ) immobilized by δ-MnO2[J]. Environmental Science & Technology, 2020, 54(23): 14955-14963 (  0) 0) |
| [20] |
黄成, 姜理英, 陈建孟, 等. δ-MnO2/水界面17β-雌二醇的氧化转化[J]. 环境科学, 2009, 30(8): 2271-2276 (  0) 0) |
| [21] |
Sun K, Li S Y, Waigi M G, et al. Nano-MnO2-mediated transformation of triclosan with humic molecules present: Kinetics, products, and pathways[J]. Environmental Science and Pollution Research, 2018, 25(15): 14416-14425 DOI:10.1007/s11356-018-1637-7 (  0) 0) |
| [22] |
Wang Z M, Giammar D E. Metal contaminant oxidation mediated by manganese redox cycling in subsurface environment[M]//ACS Symposium Series. Washington, DC: American Chemical Society, 2015: 29–50.
(  0) 0) |
| [23] |
陈高, 赵玲, 董元华. 二氧化锰氧化降解金霉素的动力学研究[J]. 环境科学, 2009, 30(9): 2773-2778 (  0) 0) |
| [24] |
Rubert, Pedersen J A. Kinetics of oxytetracycline reaction with a Hydrous manganese oxide[J]. Environmental Science & Technology, 2006, 40(23): 7216-7221 (  0) 0) |
| [25] |
Jiang J, Pang S Y, Ma J. Oxidation of triclosan by permanganate (Mn(Ⅶ)): Importance of ligands and in situ formed manganese oxides[J]. Environmental Science & Technology, 2009, 43(21): 8326-8331 (  0) 0) |
| [26] |
Barrett K A, McBride M B. Oxidative degradation of glyphosate and aminomethylphosphonate by manganese oxide[J]. Environmental Science & Technology, 2005, 39(23): 9223-9228 (  0) 0) |
| [27] |
Chen W R, Huang C H. Transformation kinetics and pathways of tetracycline antibiotics with manganese oxide[J]. Environmental Pollution, 2011, 159(5): 1092-1100 DOI:10.1016/j.envpol.2011.02.027 (  0) 0) |
| [28] |
Gao J A, Hedman C, Liu C, et al. Transformation of sulfamethazine by manganese oxide in aqueous solution[J]. Environmental Science & Technology, 2012, 46(5): 2642-2651 (  0) 0) |
| [29] |
Zhang S, Hedtke T, Wang L, et al. Engineered nanoconfinement accelerating spontaneous manganese-catalyzed degradation of organic contaminants[J]. Environ mental Science & Technology, 2021, 55(24): 16708-16715 (  0) 0) |
| [30] |
Lu K, Huang Q G, Wang P, et al. Physicochemical changes of few-layer graphene in peroxidase-catalyzed reactions: Characterization and potential ecological effects[J]. Environmental Science & Technology, 2015, 49(14): 8558-8565 (  0) 0) |
| [31] |
Strobel B W. Influence of vegetation on low-molecular-weight carboxylic acids in soil solution—a review[J]. Geoderma, 2001, 99(3/4): 169-198 (  0) 0) |
| [32] |
Zhu L J, Cheng H, Ma J F, et al. Decolorization of methyl orange by MnO2/organic acid system: The role of Mn(Ⅲ)[J]. Materials Research Bulletin, 2020, 122: 110670 DOI:10.1016/j.materresbull.2019.110670 (  0) 0) |
| [33] |
Saha S, Pal A. Microporous assembly of MnO2 nanosheets for malachite green degradation[J]. Separation and Purification Technology, 2014, 134: 26-36 DOI:10.1016/j.seppur.2014.07.021 (  0) 0) |
| [34] |
Shi Z Y, Zhang J, Zhu L. Role of oxalate in permanganate oxidation of 4-chlorophenol[J]. Chemosphere, 2018, 203: 117-122 DOI:10.1016/j.chemosphere.2018.03.119 (  0) 0) |
| [35] |
Sun S Y, Wang Y H, Zhou L, et al. Enhanced degradation mechanism of tetracycline by MnO2 with the presence of organic acids[J]. Chemosphere, 2022, 286: 131606 DOI:10.1016/j.chemosphere.2021.131606 (  0) 0) |
| [36] |
Huang J Z, Zhong S F, Dai Y F, et al. Effect of MnO2 phase structure on the oxidative reactivity toward bisphenol A degradation[J]. Environmental Science & Technology, 2018, 52(19): 11309-11318 (  0) 0) |
| [37] |
Klausen J, Haderlein S B, Schwarzenbach R P. Oxidation of substituted anilines by aqueous MnO2: effect of co-solutes on initial and quasi-steady-state kinetics[J]. Environmental Science & Technology, 1997, 31(9): 2642-2649 (  0) 0) |
| [38] |
Xu L, Xu C, Zhao M R, et al. Oxidative removal of aqueous steroid estrogens by manganese oxides[J]. Water Research, 2008, 42(20): 5038-5044 DOI:10.1016/j.watres.2008.09.016 (  0) 0) |
| [39] |
李媛, 魏东斌, 杜宇国. 锰氧化物对有机污染物的转化机制研究进展[J]. 环境化学, 2013, 32(7): 1288-1299 (  0) 0) |
2. Key Laboratory of Soil and Sustainable Agriculture, Chinese Academy of Sciences, Nanjing 210008, China
 2024, Vol. 56
2024, Vol. 56


