2. 浙江省农业科学院, 杭州 310021;
3. 清华苏州环境创新研究院, 江苏苏州 215000
盐渍土是由于自然和人为因素所导致的低产盐土和碱土的总称。据统计,我国盐渍土面积约为3.69× 107 hm2,主要分布在东北、华北、西北内陆地区以及滨海滩涂[1]。江苏的盐渍土主要分布在东部滨海滩涂,对其改良利用的主要方式包括化学、工程及生物措施,化学和工程措施改良盐渍土投资大、成本高,相比之下,生物改良方法具有投资少、效益好等特点[2],而通过绿肥或秸秆还田进行盐渍土改良则是一种重要的生物改良措施。
绿肥是最清洁的有机肥资源,无重金属、抗生素及激素等残留,能提供大量有机质,改善土壤结构和理化性质,提高土壤质量[3]。近年来,很多学者在绿肥种质资源的筛选、绿肥种植与利用模式、绿肥对土壤理化性质的影响等领域开展了大量研究,但试验地大多为旱地、水田或植烟土壤等,在绿肥对滩涂盐渍土改良效应方面还缺乏系统深入的研究[3-5]。由此,本试验以江苏沿海新围垦滩涂盐渍土为研究对象,探讨了不同施氮处理对田菁生长及翻压后土壤碳氮、pH、水溶性盐及细菌群落结构的影响,以为滩涂盐渍土的生物改良及资源利用提供理论依据与技术支持。
1 材料与方法 1.1 试验地概况试验于2019年6—8月在江苏省东台市弶港镇条子泥垦区进行,地理位置32°51′6″ N,120°53′31″E。该区地处北亚热带大陆性气候带,年均气温13 ~ 16 ℃,日照充足,雨量丰沛,土壤类型为滨海潮土。试验地土壤基础理化性状见表 1。
|
|
表 1 供试土壤基本性状 Table 1 Basic properties of tested soil |
供试绿肥田菁,品种为盐菁胶1号。根据前期试验结果并参考相关文献资料[6-7],试验设5个施氮处理CK、SN1、SN2、SN3、SN4,对应的氮水平分别为0、90、135、180和225 kg/hm2,每处理3次重复,随机区组设计,每小区面积24 m2。各处理磷钾肥施用量一致,为P2O5 90 kg/hm2,K2O 75 kg/hm2。供试肥料为尿素(N,460 g/kg)、过磷酸钙(P2O5,120 g/kg)和硫酸钾(K2O,520 g/kg),磷钾肥全部作基肥于当季施入,氮肥按基肥50%+追肥50% 的比例施入。2019年6月上旬播种,8月下旬田菁盛花期测产并翻压还田,同时采集植株样品用于碳氮含量的测定。翻压25 d后采集0 ~ 20 cm深度土壤样品,鲜样用于土壤细菌高通量测序分析和微生物生物量碳氮的测定,风干样用于土壤pH、全氮、有机碳和水溶性盐总量的测定。
1.3 测定项目与方法 1.3.1 植株生物量测定每小区随机选取3个1 m2样方,先刈割地面50 cm以上部分植株,再把根部取出去泥后合并称重,统计田间实际产量。
1.3.2 植株碳氮和土壤理化性状测定绿肥植株碳氮含量和土壤pH、全氮、有机碳及水溶性盐总量采用常规方法测定[8]。土壤微生物生物量碳氮采用氯仿熏蒸–K2SO4浸提法测定[9-10]。
1.3.3 土壤DNA提取及高通量测序使用QIAGEN试剂盒提取土壤微生物DNA。采用细菌16S rDNA V3+V4区域引物338F (5´-CCTACGGRRBGC ASCAGKVRVGAAT-3′)和806R(5′-GGACTACNVGG GTWTCTAATCC-3′)对样品目的片段进行PCR扩增。对PCR扩增产物用琼脂糖凝胶电泳检测,并根据电泳结果进行纯化、定量和均一化处理形成测序文库。构建好的文库经文库检测合格后,使用Illumina Miseq测序仪进行测序,由苏州金唯智生物科技有限公司完成。
1.3.4 生物信息数据分析对双端测序得到的正反向reads进行两两组装连接,过滤拼接结果中含有氮(N)的序列,保留序列长度大于200 bp的序列。经过质量过滤,去除嵌合体序列,得到最终的有效数据。利用VSEARCH软件对所有样品的全部有效数据进行聚类(序列相似性设为97%),获得OTU(操作分类单元),并基于Silva(细菌)分类学数据库对OTU进行分类学注释。然后用RDP classifier (Ribosomal Database Program) 贝叶斯算法对OTU的代表性序列进行物种分类学分析,并在不同物种分类水平下统计每个样本的群落组成。基于OTU的分析结果,采用对样本序列进行随机抽样的方法,分别计算Shannon、Chao1等α多样性指数,并作稀释曲线。
1.3.5 土壤微生物熵计算方法[11]土壤微生物熵=土壤微生物生物量碳/土壤总有机碳。
1.4 数据处理与分析试验数据采用Excel 2013和SPSS 26.0进行整理与统计分析。
2 结果与分析 2.1 不同施氮处理田菁生物量、碳氮养分累积量及其碳氮比由表 2可知,施肥可明显提高田菁生物量与碳累积量,SN2、SN3和SN4处理均较CK处理显著增加,且以SN3处理最高,增幅分别为21.0% 和26.4%。各施肥处理田菁氮累积量均显著高于CK处理,其含量高低顺序以SN3 > SN2 > SN4 > SN1 > CK,SN3处理氮累积量较CK处理增加23.9 kg/hm2。各施氮处理下田菁碳氮比(C/N)与CK处理相比无显著差异,仅SN2、SN3处理C/N略低,可见施氮对植株C/N的影响不大。
|
|
表 2 田菁生物量、碳氮养分累积量与C/N Table 2 The biomass, C and N accumulation, and C/N of Sesbania cannabina |
图 1显示,随着施氮水平的增加,田菁翻压后土壤pH呈逐步降低的趋势,SN1、SN2和SN3处理下土壤pH与CK处理无显著差异,SN4处理下土壤pH与CK处理相比显著降低。不同施氮水平下生长的田菁翻压还田后,各施氮处理土壤水溶性盐总量均明显高于CK处理,其中以SN3处理最高,为1.66 g/kg,但与种植前相比均明显降低。

|
(图中不同小写字母表示处理间差异在P < 0.05水平显著;下同) 图 1 不同施氮水平下田菁翻压后土壤pH (A)和水溶性盐总量(B) Fig. 1 Soil pH (A) and water-soluble salt contents (B) after Sesbania cannabina overturning under different nitrogen application levels |
表 3数据表明,SN1、SN2和SN3处理田菁翻压后提升了土壤总有机碳和全氮含量,且均以SN2处理含量最高,与CK处理相比,分别增加0.25 g/kg和0.172 g/kg,而SN4处理土壤总有机碳和全氮含量则显著低于CK处理。与CK处理相比,各施氮处理田菁翻压还田后土壤微生物生物量碳、氮含量与CK处理相比均显著降低,降幅分别为14.0% ~ 20.4% 和8.4% ~ 19.5%。土壤微生物熵是土壤微生物生物量碳与土壤总有机碳的比值,表征土壤中输入的有机质向微生物生物量碳的转化效率,反映土壤微生物对土壤碳损失和土壤有机碳固存的贡献,是评价土壤有机碳动态及质量的有效指标[11]。本试验中,土壤微生物熵范围为2.65% ~ 3.44%,与前人研究的土壤微生物熵(0.27% ~ 7.00%)[12]相比,处于偏低水平。各施氮处理下田菁翻压后的土壤微生物熵均显著低于CK处理,且以总有机碳含量最高的SN2处理最低。
|
|
表 3 田菁翻压还田对土壤碳氮及微生物熵的影响 Table 3 Effects of Sesbania cannabina overturning on soil carbon, nitrogen and microbial quotient |
稀释曲线能够反映土壤样品序列的测序深度,图 2显示,在97% 的相似度下,本试验5个处理的稀释曲线趋于平稳,说明测序深度和测序数据量合理,序列信息能够充分反映样本总体信息。Venn图能够反映不同处理下土壤样品共有或特有OTU数目,本试验5个处理土壤共有细菌OTU数量为2 423个,约占土壤细菌OTU数目的3.2%;CK、SN1、SN2、SN3、SN4处理特有OTU数量分别为183、160、408、448和377个,SN1处理土壤细菌特有OTU数量与CK处理差异不大,SN2、SN3和SN4处理土壤细菌特有OTU数量是CK处理的2倍~3倍。

|
图 2 不同处理下土壤细菌稀释曲线(A)和Venn图(B) Fig. 2 Soil bacterial rarefaction curves (A) and Venn diagram (B) of soil bacterial communities under different treatments |
Simpson指数和Shannon指数可反映群落物种多样性,Chao1指数和ACE指数可衡量群落物种丰度即物种数量的多少。由表 4可知,不同施氮处理下田菁翻压还田后土壤细菌Simpson指数和Shannon指数与CK处理相比,均无显著变化。各处理土壤Chao1和ACE指数显著高于CK处理,且均以SN2和SN3处理最高。可见,不同施氮处理即不同田菁翻压量对土壤细菌群落多样性无显著影响,但适量的绿肥翻压可提高土壤细菌群落物种丰度。
|
|
表 4 田菁翻压还田后土壤细菌群落多样性指数 Table 4 Soil bacteria community diversity indexes after Sesbania cannabina overturning |
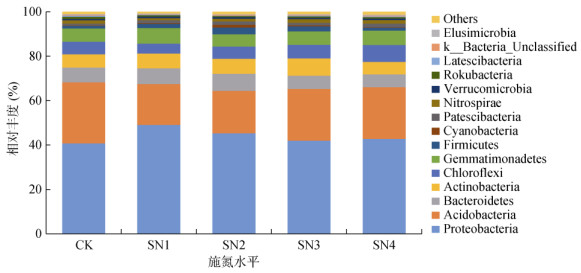
由图 3知,不同施氮处理田菁翻压后土壤中优势菌群主要为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)和芽单胞菌门(Gemmatimonadetes),相对丰度分别为40.8% ~ 49.1%、18.3% ~ 27.5%、5.8% ~ 7.7%、5.6% ~ 7.8%、4.4% ~ 7.6% 和5.6% ~ 7.1%,约占总菌群数的90% 以上。变形菌门、拟杆菌门和放线菌门相对丰度均随田菁翻压量的增加呈先升高再降低的趋势,丰度最高值分别出现在SN1、SN2和SN3处理。酸杆菌门和绿弯菌门的相对丰度则随田菁翻压量的增加先降低后又逐渐上升,丰度最高值分别为CK和SN4处理。厚壁菌门为参与秸秆降解的重要菌群[13],其丰度在SN2处理下最高,占菌群比例的3.04%,是CK处理的2.8倍,SN3、SN4处理下该菌群相对丰度逐渐降低。
|
图 3 门水平各处理土壤样品细菌群落结构 Fig. 3 Soil bacterial community structures at phylum level |
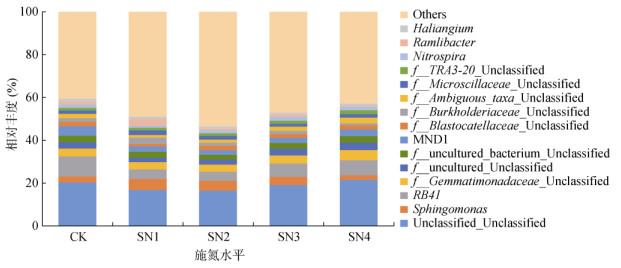
除Unclassified_Unclassified外,不同处理田菁翻压还田后土壤各菌属的相对丰度均小于10%(图 4),优势菌属有Unclassified_Unclassified、鞘氨醇单胞菌属(Sphingomonas)、RB41、未识别芽单胞菌属(f_Gemmatimonadaceae_Unclassified)和MND1等。其中,RB41是土壤中的常见菌属;鞘氨醇单胞菌属则可存在于轻度至重度盐化土层中,对植株残体或比较复杂的大分子有机物有降解作用[14]。与其他优势菌属在SN1、SN2处理下相对丰度较低的情况不同,鞘氨醇单胞菌属相对丰度在SN1、SN2处理下较高,随着田菁翻压量增加,其相对丰度又呈逐步递减趋势。
|
图 4 属水平各处理土壤样品细菌群落结构 Fig. 4 Soil bacterial community structures at genus level |
表 5显示,拟杆菌门相对丰度与土壤有机碳、全氮含量呈显著或极显著正相关。放线菌门相对丰度与土壤微生物生物量氮含量呈极显著负相关。绿弯菌门相对丰度分别与土壤pH和有机碳含量呈显著或极显著负相关。厚壁菌门相对丰度与土壤全氮、微生物生物量碳含量分别呈显著正相关或负相关。蓝菌门相对丰度仅与土壤全氮含量呈极显著正相关。肉芽孢杆菌门、六核杆菌门及Latescibacteria相对丰度与土壤碳氮含量、pH部分指标间也呈显著或极显著正负相关性。
|
|
表 5 土壤优势细菌群落(门水平)与土壤碳氮、pH及水溶性盐的相关性 Table 5 Correlations between soil dominant microorganisms (phylum) with soil carbon, nitrogen, pH and water soluble salt |
田菁为豆科植物,本身具有固氮功能,但在施氮条件下优先吸收利用外源氮肥,当施氮量为SN2、SN3水平时,其生物量与CK处理相比显著增加,而达到SN4水平后,其生物量则较SN3水平时有所下降,这可能与基肥施用量偏高抑制了田菁前期生长有关。本试验中,不同氮肥施用水平下,田菁植株翻压时的C/N为36.5 ~ 38.4,差异不显著。资料显示,田菁的C/N为24.5[15],本课题前期试验中田菁地上部C/N为16 ~ 22,根部为48 ~ 52,各处理间C/N也无显著差异[7]。可见,植株C/N与田菁生长部位及生长时期密切相关,而施肥水平对其影响不明显。
3.2 田菁翻压还田对土壤pH和水溶性盐的影响本试验中,随着施氮水平的提高,田菁翻压还田后土壤pH呈逐步下降的趋势,这是因为随着田菁翻压量的增加,植株降解过程中释放出的腐殖酸类物质也越多,使土壤pH在短期内呈降低态势,这与何宏斌等[16]的研究结论相一致。与种植前相比,田菁翻压还田显著降低了土壤水溶性盐总量,但与CK处理相比,随田菁翻压量的增加,土壤水溶性盐总量呈逐步上升趋势,原因可能在于虽然田菁翻压还田使土壤中水稳性团聚体含量增加,有效阻断了地下部盐分向地表的迁移,大大降低了土壤耕作层的水溶性盐总量[17],但因试验施入的肥料在土壤中分解为各类养分离子并被植株吸收后,又以还田的形式回归土壤,使土壤中水溶性总量随翻压量的增加而上升。
3.3 田菁翻压还田对土壤有机碳、全氮及微生物生物量碳氮的影响研究表明,绿肥翻压还田可显著提高土壤养分含量,调节土壤养分平衡[3-5]。本试验中,与种植前相比,田菁作绿肥翻压还田可显著提高土壤有机碳、全氮含量,与前人研究结果基本一致[16-17]。差异之处在于,基于高量施肥水平的SN3和SN4处理田菁生物量和碳、氮累积量最高,但作绿肥翻压还田后,对土壤有机碳、全氮提升的贡献却显著弱于低施氮水平、低生物量的SN2处理,其可能原因:一是SN3和SN4处理田菁翻压量较高,超出了土壤微生物对绿肥植株消解吸纳的最大承载量,使其未能在固定时段内有效腐解;二是土壤胶体对大量外源养分的吸附和融合具有滞后性,使SN3和SN4处理下田菁还田后土壤有机碳与全氮含量偏低。
土壤微生物生物量碳、氮是土壤有机养分的活性部分,可反映土壤有效养分状况和生物活性,对土壤养分的转化和供应至关重要,是评价土壤微生物数量和活性及土壤肥力的重要指标[18]。有研究表明,绿肥或秸秆翻压还田可显著提高土壤微生物生物量碳、氮含量,且高量秸秆还田处理下土壤微生物量碳、氮含量高于低量秸秆还田处理,并随秸秆还田量的增加提高幅度更大[19]。本试验中,CK处理田菁翻压还田量约为34.6 t/hm2,各施肥处理翻压还田量较CK处理高10.8% ~ 21.0%,微生物生物量碳、氮含量则较CK处理分别低14.0% ~ 20.4% 和8.4% ~ 19.5%,这与吴立鹏等[20]与郑佳舜等[21]所述水稻秸秆单倍还田量处理的土壤微生物生物量碳、氮含量高于秸秆双倍还田量处理的研究结果基本一致,但与汤宏等[18]的相关研究结论相悖。本研究认为,这可能与绿肥自身C/N及其翻压还田基数有关。土壤微生物适宜活动的C/N一般为25∶1,当碳源过量而氮源相对不足时会引起C/N失衡,土壤微生物体的构建只能根据氮的含量来决定,微生物数量达不到峰值,有机质的分解也受到影响。本试验中,田菁翻压时C/N为36.5 ~ 38.4,碳源的单一过量使微生物的C/N失衡而不能满足微生物正常生长与繁殖,抑制了微生物的数量和活性,使微生物生物量碳、氮含量低于CK处理。这也从侧面验证了前人有关22.5 t/hm2的绿肥翻压量是绿肥腐解与作物生长过程中氮素“固定–释放–吸收”平衡阈值的研究结论[22]。
3.4 田菁翻压还田对土壤细菌群落结构的影响资料显示,Chao1指数和Ace指数可反映群落物种的丰度,Simpson和Shannon指数则可衡量群落物种的丰富度和均匀度。有研究表明,绿肥翻压为土壤微生物提供了大量碳源和氮源,使细菌Shannon指数与Simpson指数明显提高[23],但也有研究指出,秸秆还田或施用氮肥降低了土壤细菌丰富度和均匀度[24]。本研究中,随田菁翻压量增加,土壤细菌Chao1指数和Ace指数显著提高,Shannon指数与Simpson指数无明显变化,说明其多样性基本不受施氮量或翻压量的影响,这与Yan等[25]提出的秸秆还田或施用氮肥可提高土壤细菌丰富度但对其均匀度没有影响的研究结论较一致。究其原因可能与不同区域原生土壤细菌群落差异及秸秆腐解对土壤基础性状影响大小有关。
本研究中,不同处理田菁翻压还田后,土壤优势菌群中的变形菌门、绿弯菌门和厚壁菌门均为典型的富营养细菌类群,直接参与秸秆的降解;酸杆菌门的某些菌群已被证明具有纤维素降解功能;拟杆菌门、放线菌门细菌也与有机物质的分解利用密切相关[13, 26-28]。可见,田菁翻压还田后土壤中以具有有机降解功能的细菌群落占主导地位。有研究表明,紫云英作绿肥翻压还田后分别提高了土壤酸杆菌门、绿弯菌门或放线菌门相对丰度,但降低厚壁菌门相对丰度[4]。杨思等[23]的研究则表明,随苜蓿压青量的增加,酸杆菌门、绿弯菌门和疣微菌门丰度呈明显上升趋势,变形菌门、放线菌门、芽单胞菌门和拟杆菌门丰度则略呈上升趋势。本试验中,不同处理细菌群落丰度变化与上述结论有所不同,随着田菁翻压量的增加,主要优势菌群丰度多呈抛物线式变化,变形菌门、拟杆菌门、放线菌门和绿弯菌门相对丰度最高分别出现在SN1、SN2、SN3和SN4处理,这可能是翻压量的不同引起田菁腐解进程及土壤环境的差异,使不同营养型细菌繁殖与生活能力有所变化,从而导致相对丰度的改变。前人有关施氮对细菌群落结构影响的研究表明,变形菌门、拟杆菌门、放线菌门和厚壁菌门相对丰度随施氮量增加而上升,而寡营养细菌酸杆菌却表现出相反的趋势[26, 29]。酸杆菌门为本试验中相对丰度仅次于变形菌门的第二大细菌类群,相对丰度最高的处理为CK,其嗜酸及寡营养特性是导致该菌群在翻压量上升的情况下相对丰度下降的重要因素之一。整体来看,不同施肥处理或田菁翻压量下,土壤中各优势菌群处于此消彼长的动态平衡状态,且相对丰度总和均保持在90% 左右。可见,经过一个生长季后,由于施氮量不同而产生的田菁生物量的差异,会在翻压后使部分细菌群落的结构产生一定变化,但总体有利于绿肥降解和土壤改良培肥。
前人的研究表明,土壤细菌群落结构受土壤碳氮的影响较大,各细菌类群相对丰度与土壤碳氮含量间存在一定的相关性[27]。本研究中,变形菌门和拟杆菌门相对丰度与土壤有机碳和全氮含量、绿弯菌门相对丰度与土壤有机碳含量间的显著正相关关系均与前人的研究结论基本一致[23]。而酸杆菌门相对丰度与有机碳含量间呈一定负相关性,这与杨思等[23]有关酸杆菌门相对丰度与有机碳含量呈显著正相关的研究结论相悖。这种土壤微生物群落结构与土壤碳氮关系的变化是否与耕作方式、施肥处理、土壤类型及气候变化等人为或自然因素有关还有待进一步研究[30]。
4 结论1) 随着施氮量的增加,田菁植株生物量和碳、氮累积量总体呈逐渐增加趋势,最高均为SN3处理,而植株C/N均在36.5 ~ 38.4,无显著变化。
2) 不同施氮水平下生长的田菁作绿肥翻压后,土壤有机碳、全氮含量最高均为SN2处理,分别为6.51 g/kg和0.637 g/kg。土壤微生物生物量碳、氮含量及微生物熵均以CK处理最高。土壤pH随翻压量增加而降低,而水溶性盐总量则随翻压量增加呈上升趋势。
3) 不同施氮处理下,田菁翻压后土壤优势菌群中的变形菌门、拟杆菌门和放线菌门细菌相对丰度均随田菁翻压量的增加呈先升高再降低的趋势,丰度最高值分别出现在SN1、SN2和SN3处理。酸杆菌门和绿弯菌门的相对丰度则以CK和SN4处理最高。土壤优势菌属中的鞘氨醇单胞菌属相对丰度则随着田菁翻压量的增加呈逐步递减趋势。整体来看,不同施氮处理或田菁翻压量下,土壤中各优势菌群处于此消彼长的动态平衡状态,且相对丰度总和均保持在90% 左右,总体有利于绿肥降解和土壤改良培肥。
4) 田菁翻压还田后,土壤门水平优势菌群丰度与土壤碳氮含量、pH和水溶性盐总量等指标间均呈一定的相关关系。其中,拟杆菌门、放线菌门、绿弯菌门、厚壁菌门、蓝菌门、肉芽孢杆菌门、六核杆菌门、迷踪菌门和Latescibacteria相对丰度与土壤有机碳、全氮、微生物生物量碳氮含量及pH的相关性较显著。可见,土壤碳氮、pH差异是影响土壤细菌群落组成的重要因素。
| [1] |
杨劲松, 姚荣江, 王相平, 等. 中国盐渍土研究: 历程、现状与展望[J]. 土壤学报, 2022, 59(1): 10-27 (  0) 0) |
| [2] |
黄晶, 孔亚丽, 徐青山, 等. 盐渍土壤特征及改良措施研究进展[J]. 土壤, 2022, 54(1): 18-23 DOI:10.13758/j.cnki.tr.2022.01.003 (  0) 0) |
| [3] |
曹卫东, 包兴国, 徐昌旭, 等. 中国绿肥科研60年回顾与未来展望[J]. 植物营养与肥料学报, 2017, 23(6): 1450-1461 (  0) 0) |
| [4] |
林叶春, 李雨, 陈伟, 等. 绿肥压青对喀斯特地区植烟土壤细菌群落特征的影响[J]. 中国土壤与肥料, 2018(3): 161-167 (  0) 0) |
| [5] |
Thomsen I K, Thomsen I K, Christensen B T. Yields of wheat and soil carbon and nitrogen contents following long-term incorporation of barley straw and ryegrass catch crops[J]. Soil Use and Management, 2004, 20(4): 432-438 (  0) 0) |
| [6] |
郭小倩, 朱广龙, 季中亚, 等. 密度和施氮量对盐碱地田菁生长生理特性及产量的影响[J]. 扬州大学学报(农业与生命科学版), 2019, 40(1): 20-25 (  0) 0) |
| [7] |
朱小梅, 王甫同, 邢锦城, 等. 田菁翻压还田对滩涂土壤碳氮及微生物生物量的影响[J]. 土壤, 2021, 53(3): 529-536 DOI:10.13758/j.cnki.tr.2021.03.012 (  0) 0) |
| [8] |
鲍士旦. 土壤农化分析(3版)[M].
中国农业出版社, 北京, 2000
(  0) 0) |
| [9] |
Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry, 1987, 19(6): 703-707 DOI:10.1016/0038-0717(87)90052-6 (  0) 0) |
| [10] |
Brookes P C, Landman A, Pruden G, et al. Chloroform fumigation and the release of soil nitrogen: A rapid direct extraction method to measure microbial biomass nitrogen in soil[J]. Soil Biology and Biochemistry, 1985, 17(6): 837-842 DOI:10.1016/0038-0717(85)90144-0 (  0) 0) |
| [11] |
徐阳春, 沈其荣, 冉炜. 长期免耕与施用有机肥对土壤微生物生物量碳、氮、磷的影响[J]. 土壤学报, 2002, 39(1): 83-90 (  0) 0) |
| [12] |
Omay A B, Rice C W, Maddux L D, et al. Changes in soil microbial and chemical properties under long-term crop rotation and fertilization[J]. Soil Science Society of America Journal, 1997, 61(6): 1672-1678 DOI:10.2136/sssaj1997.03615995006100060019x (  0) 0) |
| [13] |
Liu L, Ding M J, Zhou L K, et al. Effects of different rice straw on soil microbial community structure[J]. Agronomy Journal, 2021, 113(2): 794-805 DOI:10.1002/agj2.20509 (  0) 0) |
| [14] |
张云龙, 郜春花, 靳东升, 等. 矿区复垦土壤中鞘氨醇单胞菌促进秸秆腐解性能分析[J]. 山西农业科学, 2022, 50(1): 67-77 (  0) 0) |
| [15] |
北京农业大学. 农业化学: 总论[M].
中国农业出版社, 北京, 2003
(  0) 0) |
| [16] |
何宏斌, 张钰薇, 程俊康, 等. 冬闲期种植多花黑麦草对稻田土壤性状的影响[J]. 生态科学, 2019, 38(2): 155-161 (  0) 0) |
| [17] |
任承钢, 李岩, 刘卫, 等. 高效双接种田菁修复黄河三角洲盐碱土壤研究[J]. 海洋科学, 2017, 41(5): 1-7 (  0) 0) |
| [18] |
汤宏, 沈健林, 张杨珠, 等. 秸秆还田与水分管理对稻田土壤微生物量碳、氮及溶解性有机碳、氮的影响[J]. 水土保持学报, 2013, 27(1): 240-246 (  0) 0) |
| [19] |
高嵩涓, 曹卫东, 白金顺, 等. 长期冬种绿肥改变红壤稻田土壤微生物生物量特性[J]. 土壤学报, 2015, 52(4): 902-910 (  0) 0) |
| [20] |
吴立鹏, 张士荣, 娄金华, 等. 秸秆还田与优化施氮对稻田土壤碳氮含量及产量的影响[J]. 华北农学报, 2019, 34(4): 158-166 (  0) 0) |
| [21] |
郑佳舜, 胡钧铭, 韦翔华, 等. 绿肥压青对粉垄稻田土壤微生物量碳和有机碳累积矿化量的影响[J]. 中国生态农业学报, 2021, 29(4): 691-703 (  0) 0) |
| [22] |
李正, 刘国顺, 敬海霞, 等. 翻压绿肥对植烟土壤微生物量及酶活性的影响[J]. 草业学报, 2011, 20(3): 225-232 (  0) 0) |
| [23] |
杨思, 杨文平, 景豆豆, 等. 麦后复种苜蓿压青还田改善土壤微生物群落结构[J]. 应用与环境生物学报, 2021, 27(4): 978-987 (  0) 0) |
| [24] |
Zhao S C, Qiu S J, Xu X P, et al. Change in straw decomposition rate and soil microbial community composition after straw addition in different long-term fertilization soils[J]. Applied Soil Ecology, 2019, 138: 123-133 DOI:10.1016/j.apsoil.2019.02.018 (  0) 0) |
| [25] |
Yan S S, Song J M, Fan J S, et al. Changes in soil organic carbon fractions and microbial community under rice straw return in Northeast China[J]. Global Ecology and Conservation, 2020, 22: e00962 DOI:10.1016/j.gecco.2020.e00962 (  0) 0) |
| [26] |
王光华, 刘俊杰, 于镇华, 等. 土壤酸杆菌门细菌生态学研究进展[J]. 生物技术通报, 2016, 32(2): 14-20 (  0) 0) |
| [27] |
李丽娜, 席运官, 陈鄂, 等. 耕作方式与绿肥种植对土壤微生物组成和多样性的影响[J]. 生态与农村环境学报, 2018, 34(4): 342-348 (  0) 0) |
| [28] |
赵文慧, 马垒, 徐基胜, 等. 秸秆与木本泥炭短期施用对潮土有机质及微生物群落组成和功能的影响[J]. 土壤学报, 2020, 57(1): 153-164 (  0) 0) |
| [29] |
Fierer N, Lauber C L, Ramirez K S, et al. Comparative metagenomic, phylogenetic and physiological analyses of soil microbial communities across nitrogen gradients[J]. The ISME Journal, 2012, 6(5): 1007-1017 DOI:10.1038/ismej.2011.159 (  0) 0) |
| [30] |
高晶晶, 刘红梅, 杨殿林, 等. 不同耕作方式对玉米田土壤微生物功能多样性的影响[J]. 中国农学通报, 2021, 37(3): 98-104 (  0) 0) |
2. Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China;
3. Research Institute for Environmental Innovation (Suzhou) Tsinghua, Suzhou, Jiangsu 215000
 2024, Vol. 56
2024, Vol. 56


