2. 中国科学院大学, 北京 100049;
3. 甘肃省农业科学院土壤肥料与节水农业研究所, 兰州 730070;
4. 农业部甘肃耕地保育与农业环境科学观测实验站, 甘肃武威 733017
土壤有机碳(SOC)周转在农业生态系统中十分重要,因为它是调节土壤肥力、提高作物产量的关键因子。绿肥和秸秆还田在同时刺激有机碳周转和增加有机碳库容方面已被很多研究证明具有显著的效果[1]。然而,在长期植物残体还田的条件下,植物衍生的成分如何促进SOC的形成和积累,对了解土壤碳动态和对全球变化的响应非常关键[2]。植物残留物由多种生物分子组成,如纤维素、半纤维素、木质素、蛋白质、脂质和单宁。在这些植物来源的分子中,木质素通常被认为是植物碳输入土壤的主要来源,由于它的难降解性,木质素还被认为是缓效碳库的重要来源[3]。木质素酚作为植物衍生组分的生物标志物已被广泛应用[4]。然而,对于长达30 a的不同外源植物残体还田对木质素酚浓度有何影响并不清楚。本研究将木质素酚的含量与有机碳含量的比值作为木质素酚的浓度,旨在了解不同处理间植物源有机碳在土壤有机碳库中的相对重要性。
土壤微生物作为植物残体分解的驱动力,其生态生理作用决定了外源有机底物的转化方向[5]。研究表明,不同的植物残体碳输入决定了微生物关键种对有机碳周转的影响[1]。关键种是在网络中高度相关的微生物物种,它们单独或在群体中对群落结构和功能产生影响。网络分析已经成为从微生物群落中鉴定关键类群的有力工具。不同的植物残体还田可能通过影响关键种的生活史策略从而影响有机碳的周转。例如,长期有机物料还田会促进富营养型微生物的显著富集[6],它们偏好利用植物组分中的易分解部分从而可能使大量的难分解组分累积。长期施加无机肥或者不施肥的土壤可能大量富集寡营养型微生物,它们通常善于挖掘难分解的碳资源,可能导致木质素等难分解碳的损失[7]。然而目前仍不清楚在不同植物残体还田的条件下哪些关键种如何影响木质素酚的变化。
因此,本文基于30 a的长期定位田间试验,研究了不同植物残体还田条件下植物衍生的木质素酚的含量与浓度,旨在了解SOC的形成和累积机制。结合高通量测序手段,利用共现性网络和随机森林模型等方法探究微生物关键种如何影响木质素酚,以期更科学地了解长期施用不同有机底物对提高土壤肥力的微生物学机制。
1 材料与方法 1.1 研究区概况研究区位于中国甘肃省武威市凉洲区永昌镇甘肃省农科院土肥所白云试验站(102°40’E、38°37’N),海拔1 504 m。研究区气候干旱,灌溉良好,年平均气温和降水量分别为7.7 ℃和150 mm。供试土壤为灌漠灰钙土。1988年试验开始时测定0 ~ 20 cm基础土样,有机质16.35 g/kg、全氮1.06 g/kg、全磷1.5 g/kg、速效氮64.4 mg/kg、有效磷13 mg/kg、速效钾150 mg/kg、pH 8.8。
1.2 试验设计与样品采集本研究选取长期定位有机培肥试验(开始于1988年)的6个处理进行分析,分别包括:CK (不施肥)、GM (施加绿肥45 000 kg/hm2)、SW (小麦秸秆10 500 kg/hm2)、N (氮肥375 kg/hm2)、GMN (22 500 kg/hm2绿肥配施187.5 kg/hm2氮肥)和SWN (5 250 kg/hm2小麦秸秆配施187. 5 kg/hm2氮肥)。除CK处理,其余处理均施磷肥150 kg/hm2作为基肥。所有施肥处理,均在3月下旬完成。
于2018年采集0 ~ 15 cm耕层土壤,随机区组,每个处理3个重复,共有18个小区,小区面积31 m2。在每个小区布设7个点进行“S”形采样,采集样品充分混合,共获得18个土壤样品。样品分成2部分保存,一部分自然风干过2 mm筛用于木质素酚和有机碳测定,另一部分4 ℃保存用于微生物DNA提取。
1.3 土壤有机碳和木质素酚的测定及计算 1.3.1 土壤有机碳测定土壤有机碳采用重铬酸钾容量法–外加热法测定[8]。
1.3.2 土壤木质素酚测定根据改进Ma等人[4]的方法进行土壤木质素酚的测定。将2 g土壤与1 g CuO、100 mg Fe(NH4)2(SO4)2·6H2O和20 mL氮气净化的NaOH溶液(2 mol/L)混合在聚四氟乙烯内衬的消解罐中。所有消解罐在头部用氮气冲洗10 min,并在150 ℃加热3 h,冷却后加入3-乙氧基-4-羟基苯甲醛,用6 mol/L HCl酸化至pH=1,并在黑暗条件下保存1 h,离心(2 500 r/min,30 min)后,用乙酸乙酯萃取,重复3次,合并萃取液于30 mL玻璃离心管中,并在氮气下浓缩后加入2 mL 10% 甲醇溶液溶解待测。最后通过气相色谱仪TRACE™ 1300E进行测定。
1.3.3 土壤木质素酚含量计算土壤样品中的各木质素酚类单体含量的计算公式是:单体含量=已知内标含量×(内标物各木质素酚类单体峰面积/土壤样品中各木质素酚类单体的峰面积)×校正因子。总木质素酚含量=对香豆醇含量+松柏醇含量+芥子醇含量。
1.3.4 土壤木质素酚浓度计算总木质素酚浓度通过总木质素酚含量与有机碳含量的比值计算得到。各单体的浓度等于各单体含量与有机碳含量的比值。
1.4 土壤微生物分析和关键种鉴定使用SPINeasy土壤DNA旋转试剂盒(MP Biomedicals,Santa Ana,CA)从新鲜土壤样品中提取微生物群落基因组DNA。用细菌引物341F和806R[9]和真菌引物ITS1F和ITS2R[10]进行PCR扩增。扩增后的PCR产物经2% 浓度的琼脂糖凝胶电泳检测合格后进行纯化。使用Illumina Miseq PE300平台,进行测序。原始数据根据序列质量进行筛选,其中碱基平均质量≥Q20以及序列≥150 bp。使用FLASH (V1.2.7) [11]对通过质量筛选的双端序列根据重叠碱基进行配对连接。通过Uparse software (Uparse v7.0.1001) [12]以97% 的相似性对操作分类单位(OTU)进行聚类。Silva (http://www.arb-silva.de/)[13]数据库和unit (https://unite.ut.ee/)[14]数据库分别用于细菌和真菌的物种注释。然后,在每个分类级别(界、门、纲、目、科、属、种)上计算每个样本的群落组成。
在种水平上进行网络分析以筛选出微生物关键种。本研究中共测定出3 131个细菌种和1 201个真菌种。保留每个处理中2/3以上的样品进行网络分析。使用基于Spearman相关矩阵的“WGCNA”R包,利用调整后的P值构建共现网络[15]。R语言的“igraph”包用于计算网络属性(http://igraph.org),用Gephi进行网络的可视化。根据模块内连通性(zi)和参与系数(pi) 的值, 网络中的节点被分为网络中心点(zi > 2.5;pi > 0.62),模块中心点(zi > 2.5;pi<0.6),连接节点(zi<2.5;pi > 0.6)和外围节点(zi<2.5;pi<0.6) [16]。关键种通过在共现性网络中的平均度在前5%,并且结合根据zi和pi值确定的network hubs、module hubs或者connectors所获得。
1.5 数据统计分析采用单因素方差分析(One-way ANOVA)并利用Tukey检验法进行木质素酚和土壤有机碳以及微生物关键种在各个处理间的显著性差异统计。利用GraphPad Prism 9.0绘制图表。
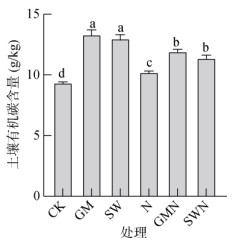
2 结果与分析 2.1 外源植物残体还田对土壤有机碳含量的影响GM和SW处理30 a后土壤有机碳含量显著(P<0.05)高于其他处理(图 1),其中GM处理分别是CK、N、GMN和SWN处理的1.42倍、1.30倍、1.11倍和1.17倍,SW处理分别比CK、N、GMN和SWN提高了39%、27%、9% 和14%,GM和SW处理间没有显著差异。CK处理的有机碳含量最低,其次是N处理。GMN和SWN处理有机碳含量显著高于CK和N处理,GMN和SWN处理之间没有显著性差异。
|
(图柱上方不同小写字母表示不同处理间差异达P<0.05显著水平,下图同) 图 1 不同处理土壤有机碳含量 Fig. 1 Soil organic carbon contents under different treatments |
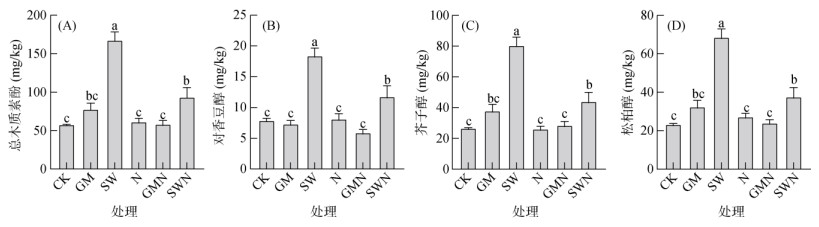
SW处理下总木质素酚、对香豆醇、芥子醇和松柏醇含量均显著高于其他处理(P<0.05),其次为SWN处理(图 2)。其中,SW处理总木质素酚含量为167.61 mg/kg,SWN处理含量为93.53 mg/kg,并且SW处理的总木质素酚含量分别是CK、GM、N、GMN和SWN的2.90倍、2.16倍、2.72倍、2.86倍和1.79倍,说明30 a的秸秆还田使木质素酚大量累积在土壤中。总木质素酚和3种木质素单体在CK、N、GM和GMN处理间没有显著性差异。
|
图 2 不同处理木质素酚含量 Fig. 2 Lignin phenol contents under different treatments |
利用线性分析评估了木质素酚含量以及3种单体含量与土壤有机碳含量之间的相关性(图 3)。总木质素酚、芥子醇和松柏醇含量与土壤有机碳含量之间呈显著的正相关关系。R2介于0.254 ~ 0.294,说明土壤中的有机碳累积和木质素酚中的芥子醇和松柏醇显著相关。而对香豆醇含量与土壤有机碳含量之间无显著相关关系(P = 0.256)。

|
图 3 木质素酚含量与土壤有机碳含量的相关性 Fig. 3 Correlation between contents of lignin phenols and soil organic carbon |
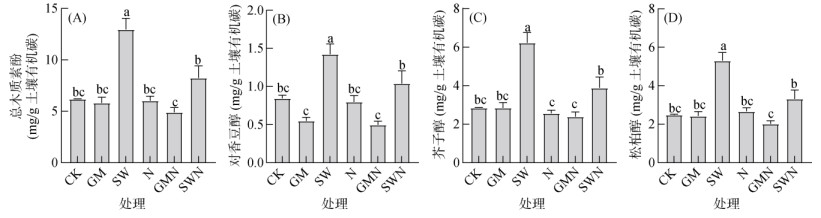
总体而言,SW处理的总木质素酚浓度最高,其均值为12.95 mg/g(总木质素酚含量与有机碳含量的比值),SWN处理次之(图 4A)。其中,SW处理分别比CK、GM、N、GMN和SWN处理高了109%、122%、115%、164% 和57%;而SWN处理分别是CK、GM、N和GMN处理的1.33倍、1.42倍、1.37倍和1.68倍。3种木质素酚类单体浓度与总木质素酚浓度在各个处理间的差异基本相似,均表现出在SW处理下最高,SWN处理下次之的规律。
|
图 4 不同处理木质素酚浓度 Fig. 4 Lignin phenol concentrations under different treatments |
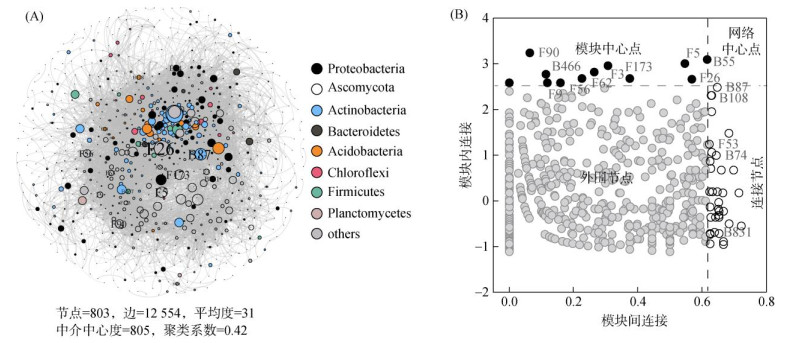
共现性网络分析表明,微生物之间存在强烈的相关性(R2 > 0.6,P<0.05)。803个微生物种共形成12 554条相关性边(图 5A)。平均度、中介中心度和聚类系数分别为31、805和0.42。共有12个模块中心点和36个连接节点被鉴定,并在图 5A中标注,其中包含36个细菌种和12个真菌种,大部分细菌来自于变形菌门(Proteobacteria)和放线菌门(Actinobacteria),真菌种源于子囊菌门(Ascomycota)较多(图 5A)。为了进一步鉴定出本研究中的关键种,在这48个网络中心节点中挑平均度在5% 的微生物作为关键种,最终鉴定出15个微生物关键种,其名称在图 5B中显示。
|
图 5 微生物之间的共现性网络(A)和基于网络角色的细菌和真菌物种的分布图(B) Fig. 5 The co-occurrence network between microorganisms (A) and distribution of bacterial and fungal species based on their network roles (B) |
进一步确定了15个微生物关键种的分类学信息,它们分布在10类纲水平下(表 1)。总体而言,关键种F3(盘菌纲,Pezizomycetes)、F26(被孢霉菌纲,Mortierellomycetes)、F173(粪壳菌纲,Sordariomycetes)、B74(阿尔法变形菌纲,Alphaproteobacteria)和B87(放线菌纲,Actinobacteria)在有绿肥以及秸秆配施的处理中显著高于不施肥和施化肥处理(表 1)。值得注意的是,关键种B74、B87、B466(芽孢菌纲,Bacilli)、F3、F26、F90(被孢霉菌纲,Mortierellomycetes)和F173在GM处理中最高。此外,B831(生丝微菌科,Hyphomicrobiaceae)在SW处理下显著高于其他处理,其值分别是CK、GM、N,GMN和SWN处理的19倍、4.75倍、19倍、9.5倍和2.1倍。而B55(拟杆菌纲,Bacteroidia)、B108(酸杆菌门组6,Subgroup 6)和F5(粪壳菌纲,Sordariomycetes)同时在CK和N处理中显著高于其他处理。
|
|
表 1 不同处理下微生物关键种的相对丰度(%) Table 1 Relative abundance of microbial keystone species under different treatments |
为了探究微生物关键种是否影响木质素酚浓度,开展了随机森林分析以揭示哪些关键种是木质素酚浓度的重要预测因子。结果表明,B831、F62、F3、F26和F5是影响木质素酚浓度的重要因子(图 6A)。然而,利用线性分析,仅观察到了B831与木质素酚浓度呈显著的正相关性(R2=0.738,P<0.0001)(图 6B),而其他几个关键种与木质素酚浓度之间并没有观察到统计学相关性。B831属于生丝微菌科,在SW中显著富集,表明它可能是调控木质素酚浓度的有力预测因子。
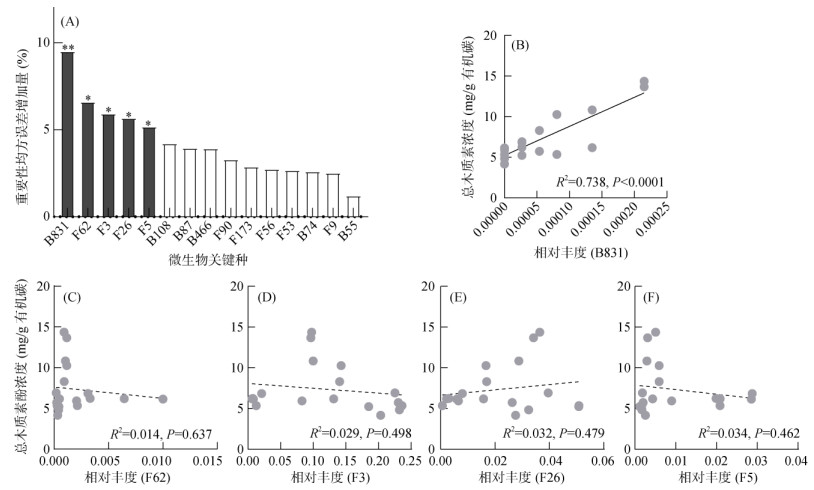
|
(A. 随机森林分析15个微生物关键种对木质素酚浓度的影响;*、**分别表示影响达P<0.05和P<0.01显著水平;B~F:关键种B831(B)、F62(C)、F3(D)、F26(E)和F5(F)的相对丰度和木质素酚浓度之间的线性关系,实线表示显著性相关关系,虚线表示无显著性相关关系) 图 6 微生物关键种对木质素酚浓度的影响 Fig. 6 Effects of microbial keystone species on lignin phenol concentration |
本研究中,绿肥和秸秆还田的处理,其有机碳含量显著高于不施肥和施化肥的处理,长期的有机物料还田能够增加土壤有机碳含量,该结论与其他研究结果一致[17]。而绿肥和秸秆配施氮肥的处理比直接施加绿肥和秸秆处理的有机碳含量显著降低,很有可能是因为氮肥的配施降低了土壤C/N,加速了土壤中原有有机碳的分解,从而导致土壤有机碳含量的下降[18]。不施肥和施用化肥的处理有机碳含量低,究其原因,这两个处理的土壤有机碳主要来源是作物根茬和作物的根系分泌物以及土壤中有机体的代谢产物等,在无外源有机碳输入的条件下,相比于其他有外源碳输入的处理,有机碳含量显著较低[19]。
在有秸秆参与的还田条件下,土壤总木质素酚以及其3种单体的含量和浓度显著高于其他处理(图 2和图 4)。外源植物残体还田后,它们在土壤中的分解与其自身的碳和氮组成密切相关[20]。秸秆作为一种高C/N的有机物料,其中难分解的植物组分如木质素可能很难被微生物利用,从而大量地累积在土壤中。一项长期试验发现在秸秆还田13 a后土壤中木质素含量显著累积,并且浓度增加[21],本研究结果与其一致。对比秸秆,绿肥是一种高质量的外源有机底物(低C/N)。绿肥还田十分有利于微生物的分解,尤其是细菌会对这种低C/N的植物残体进行快速的利用分解,从而可能不利于木质素酚的累积。而施加绿肥的处理总体有机碳含量增加可能是由于绿肥在降解的过程中产生了大量的可溶性有机质,这有利于微生物周转产生大量的微生物残体从而直接贡献于土壤有机碳[22]。但有关这方面的机制,还需在未来的研究中进一步地证实。
本研究鉴定出了15个微生物关键种。其中绿肥以及秸秆配施的处理显著提高了关键种F3(盘菌纲,Pezizomycetes)、F26(被孢霉菌纲,Mortierellomycetes)、F173(粪壳菌纲,Sordariomycetes)、B74(阿尔法变形菌纲,Alphaproteobacteria)和B87(放线菌纲,Actinobacteria)的相对丰度,尤其是在施加绿肥的处理中更为显著。盘菌纲和被孢霉菌属于腐生真菌,它们被认为是土壤碳及养分转化的关键微生物,能够快速利用植物残体中多种糖类化合物[23-24],因此它们很有可能成为外源有机物料还田处理下的优势菌纲。粪壳菌纲、阿尔法变形菌纲以及放线菌纲已被证实属于富营养型微生物,成为长期有机物料还田后的优势菌纲[25]。B55(拟杆菌纲,Bacteroidia)和B108(酸杆菌门,Acidobacteria)在不施肥和施化肥的处理中显著富集,这和以前的研究结果一致[26]。拟杆菌纲和酸杆菌门在很多的研究中已被证实是寡营养环境的优势物种[27]。在不施肥或者长期施加化肥的土壤中,由于缺少碳资源的供应,拟杆菌纲和酸杆菌门的微生物可能会分解土壤中本有的高分子量的难分解碳来获取能量,从而可能导致木质素酚浓度的下降[28]。
外源添加的有机底物质量是影响微生物群落结构的重要因素。高C/N的秸秆还田后,微生物生长繁殖所需的氮元素受到限制,可能促使固氮菌的不断繁殖以应对高C/N资源的输入[29]。而在本研究中单独秸秆还田的处理下B831显著富集,它属于Alphaproteobacteria下的生丝微菌科(Hyphomicrobiaceae),这一类微生物有丰富的氮固定基因,能够在氮饥饿的条件下发挥作用[30]。此外,B831丰度与木质素酚浓度呈显著正相关关系,很有可能是因为Alphaproteobacteria在利用低分子量碳如葡萄糖和氨基酸方面是活跃的[27],这会导致高分子量如木质素酚在土壤中的累积,从而提高了秸秆还田处理下木质素酚浓度。
4 结论长期不同植物残体还田均比单施化肥和不施肥处理显著提高了土壤有机碳含量。有秸秆参与还田的处理能够显著提高土壤木质素酚的累积。本研究鉴定出15个微生物关键种,其中绿肥和秸秆参与还田的处理显著提高了关键种F3(盘菌纲,Pezizomycetes)、F26(被孢霉菌纲,Mortierellomycetes)、F173(粪壳菌纲,Sordariomycetes)、B74(阿尔法变形菌纲,Alphaproteobacteria)和B87(放线菌纲,Actinobacteria)的相对丰度。此外,本研究揭示了关键种B831(隶属于阿尔法变形菌纲的生丝微菌科)在调控植物源有机碳组分(木质素酚)的重要作用。本研究强调了有机物料还田在提高土壤碳汇能力方面的重要作用。也为深入理解土壤微生物对木质素酚的降解和转化过程提供了新的线索,有助于揭示土壤有机碳形成和累积的机制。
| [1] |
Bian Q, Wang X Y, Bao X G, et al. Exogenous substrate quality determines the dominant keystone taxa linked to carbon mineralization: Evidence from a 30-year experiment[J]. Soil Biology and Biochemistry, 2022, 169: 108683 DOI:10.1016/j.soilbio.2022.108683 (  0) 0) |
| [2] |
Schmidt M W I, Torn M S, Abiven S, et al. Persistence of soil organic matter as an ecosystem property[J]. Nature, 2011, 478(7367): 49-56 DOI:10.1038/nature10386 (  0) 0) |
| [3] |
Thevenot M, Dignac M F, Rumpel C. Fate of lignins in soils: A review[J]. Soil Biology and Biochemistry, 2010, 42(8): 1200-1211 DOI:10.1016/j.soilbio.2010.03.017 (  0) 0) |
| [4] |
Ma T, Zhu S S, Wang Z H, et al. Divergent accumulation of microbial necromass and plant lignin components in grassland soils[J]. Nature Communications, 2018, 9: 3480 DOI:10.1038/s41467-018-05891-1 (  0) 0) |
| [5] |
汪景宽, 徐英德, 丁凡, 等. 植物残体向土壤有机质转化过程及其稳定机制的研究进展[J]. 土壤学报, 2019, 56(3): 528-540 (  0) 0) |
| [6] |
孙波, 陆雅海, 张旭东, 等. 耕地地力对化肥养分利用的影响机制及其调控研究进展[J]. 土壤, 2017, 49(2): 209-216 DOI:10.13758/j.cnki.tr.2017.02.001 (  0) 0) |
| [7] |
Lorenz K, Lal R, Preston C M, et al. Strengthening the soil organic carbon pool by increasing contributions from recalcitrant aliphatic bio(macro)molecules[J]. Geoderma, 2007, 142(1/2): 1-10 (  0) 0) |
| [8] |
Nelson D W, Sommers L E. Total carbon, organic carbon, and organic matter[M]//Page A L, Miller R H, Keeney D R. Methods of soil analysis: Part 2 Chemical and microbiological properties. Madison, WI: ASA-SSSA, 1996. : 961–1010.
(  0) 0) |
| [9] |
Zakrzewski M, Goesmann A, Jaenicke S, et al. Profiling of the metabolically active community from a production-scale biogas plant by means of high-throughput metatranscriptome sequencing[J]. Journal of Biotechnology, 2012, 158(4): 248-258 DOI:10.1016/j.jbiotec.2012.01.020 (  0) 0) |
| [10] |
Mueller R C, Paula F S, Mirza B S, et al. Links between plant and fungal communities across a deforestation chronosequence in the Amazon rainforest[J]. The ISME Journal, 2014, 8(7): 1548-1550 DOI:10.1038/ismej.2013.253 (  0) 0) |
| [11] |
Magoč T, Salzberg S L. FLASH: Fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011, 27(21): 2957-2963 DOI:10.1093/bioinformatics/btr507 (  0) 0) |
| [12] |
Edgar R C. UPARSE: Highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996-998 DOI:10.1038/nmeth.2604 (  0) 0) |
| [13] |
Wang Q, Garrity G M, Tiedje J M, et al. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267 DOI:10.1128/AEM.00062-07 (  0) 0) |
| [14] |
Kõljalg U, Nilsson R H, Abarenkov K, et al. Towards a unified paradigm for sequence-based identification of fungi[J]. Molecular Ecology, 2013, 22(21): 5271-5277 DOI:10.1111/mec.12481 (  0) 0) |
| [15] |
Langfelder P, Horvath S. Fast R functions for robust correlations and hierarchical clustering[J]. Journal of Statistical Software, 2012, 46(11): i11 (  0) 0) |
| [16] |
Poudel R, Jumpponen A, Schlatter D C, et al. Microbiome networks: A systems framework for identifying candidate microbial assemblages for disease management[J]. Phytopathology, 2016, 106(10): 1083-1096 DOI:10.1094/PHYTO-02-16-0058-FI (  0) 0) |
| [17] |
栾璐, 郑洁, 程梦华, 等. 不同秸秆还田方式对旱地红壤细菌多样性及群落结构的影响[J]. 土壤, 2021, 53(5): 991-997 DOI:10.13758/j.cnki.tr.2021.05.014 (  0) 0) |
| [18] |
曾骏, 董博, 张东伟, 等. 不同施肥方式对灌漠土土壤有机碳、无机碳和微生物量碳的影响[J]. 水土保持通报, 2013, 33(2): 35-38 (  0) 0) |
| [19] |
吴科生, 车宗贤, 包兴国, 等. 灌漠土长期有机配施土壤肥力特征和作物产量可持续性分析[J]. 水土保持学报, 2021, 35(3): 333-340 (  0) 0) |
| [20] |
Khan M I, Gwon H S, Alam M A, et al. Short term effects of different green manure amendments on the composition of main microbial groups and microbial activity of a submerged rice cropping system[J]. Applied Soil Ecology, 2020, 147: 103400 DOI:10.1016/j.apsoil.2019.103400 (  0) 0) |
| [21] |
Chen X B, Hu Y J, Feng S Z, et al. Lignin and cellulose dynamics with straw incorporation in two contrasting cropping soils[J]. Scientific Reports, 2018, 8: 1633 DOI:10.1038/s41598-018-20134-5 (  0) 0) |
| [22] |
王杉杉, 徐秋芳, 范博, 等. 毛竹扩张对杉木林土壤微生物残体碳积累的影响[J]. 生态学报, 2023, 43(5): 1902-1912 (  0) 0) |
| [23] |
Hansen K R, Perry B A, Dranginis A W, et al. A phylogeny of the highly diverse cup-fungus family Pyronemataceae (Pezizomycetes, Ascomycota) clarifies relationships and evolution of selected life history traits[J]. Molecular Phylogenetics and Evolution, 2013, 67(2): 311-335 DOI:10.1016/j.ympev.2013.01.014 (  0) 0) |
| [24] |
宁琪, 陈林, 李芳, 等. 被孢霉对土壤养分有效性和秸秆降解的影响[J]. 土壤学报, 2022, 59(1): 206-217 (  0) 0) |
| [25] |
Wang X Y, Liang C, Mao J D, et al. Microbial keystone taxa drive succession of plant residue chemistry[J]. The ISME Journal, 2023, 17(5): 748-757 DOI:10.1038/s41396-023-01384-2 (  0) 0) |
| [26] |
Leff J W, Jones S E, Prober S M, et al. Consistent responses of soil microbial communities to elevated nutrient inputs in grasslands across the globe[J]. PNAS, 2015, 112(35): 10967-10972 DOI:10.1073/pnas.1508382112 (  0) 0) |
| [27] |
Zhao Z, Gonsior M, Schmitt-Kopplin P, et al. Microbial transformation of virus-induced dissolved organic matter from picocyanobacteria: Coupling of bacterial diversity and DOM chemodiversity[J]. The ISME Journal, 2019, 13(10): 2551-2565 DOI:10.1038/s41396-019-0449-1 (  0) 0) |
| [28] |
Li X M, Chen Q L, He C, et al. Organic carbon amendments affect the chemodiversity of soil dissolved organic matter and its associations with soil microbial communities[J]. Environmental Science & Technology, 2019, 53(1): 50-59 (  0) 0) |
| [29] |
陈凯鹏, 韦菊娴, 陈丹, 等. 化肥减量配施秸秆对双季稻田固氮微生物群落的影响[J]. 环境科学, 2022, 43(10): 4725-4734 (  0) 0) |
| [30] |
Xun W B, Li W, Huang T, et al. Long-term agronomic practices alter the composition of asymbiotic diazotrophic bacterial community and their nitrogen fixation genes in an acidic red soil[J]. Biology and Fertility of Soils, 2018, 54(3): 329-339 DOI:10.1007/s00374-018-1264-y (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Institute of Soil and Fertilizer and Water-saving Agriculture, Gansu Academy of Agriculture Science, Lanzhou 730070, China;
4. Gansu Scientific Observing and Experimental Station of Agri-Environment and Arable Land Conservation, Ministry of Agriculture, Wuwei, Gansu 733017, China
 2024, Vol. 56
2024, Vol. 56


