土壤是陆地生态系统中重要的有机碳库,其碳储量约为大气中碳储量的2倍、植被中碳储量的3倍,因而土壤碳库的微小损失可能会对未来大气CO2浓度产生重大影响[1],土壤碳固存问题成为当前的研究热点之一。
生物固碳是陆地生态系统中最直接有效的CO2固定途径[2],其中自养微生物是将CO2转化为有机碳的重要触发器,在土壤有机碳库的积累中起着关键作用[3]。自养微生物具有很强的环境适应能力,广泛地分布在各生态系统中,并能在植物难以生存的各种极端环境下进行CO2的固定,如深部高盐缺氧盆地[4]、南极常年冰封湖泊[5]、火山沉积物[6]等。据研究,全球陆地土壤的自养微生物每年可捕获大气0.5% ~ 4.1%的CO2,总量达C 0.6 ~ 4.9 Gt [7]。
在全球CO2循环中,热带雨林由于其巨大的初级生产力,是除海洋外最重要的源与汇。全球热带雨林在自然状态下是一个净汇,热带雨林的碳储量达7.65×1011 t以上[8],与全球大气中的碳储量几乎相当。有研究表明,热带地区土壤碳库对温度和CO2浓度变化极为敏感[9],其中热带森林土壤碳库对温度变化尤为敏感[10],因而在全球气候变化背景下,对热带雨林土壤碳库的研究尤为重要。
尖峰岭自然保护区是我国保存最为完整的热带原始森林林区之一,属热带北缘类型,是生物多样性研究热点地区。在微生物层面,已对该保护区细菌[11]、真菌[12]和植物内生菌[13]的群落特征展开了较多的研究,但关于土壤固碳微生物群落结构特征的研究尚未见报道。依据能量来源可将自养微生物分为光能自养微生物与化能自养微生物,目前探明的自养微生物固碳途径共有6条。其中,卡尔文循环是光能型与化能型自养微生物固定CO2的主要途径,核酮糖-1, 5-二磷酸羧化/加氧酶(RubisCO)是该循环中的关键酶。RubisCOⅠ大亚基的编码基因cbbL基因具有高度的保守性[14-15],因而常作为固碳细菌标记物用于不同生态系统土壤固碳微生物群落特征的研究[7, 16-17]。基于以上,本研究以尖峰岭热带雨林下低地雨林次生林、山地雨林次生林和山地雨林原始林3种林型土壤为研究对象,以cbbL基因为标记物,利用绝对定量PCR和高通量测序技术对林下土壤固碳微生物的群落结构与多样性进行分析,并对影响尖峰岭热带雨林土壤固碳微生物群落变化的环境因子进行探讨,以期为提高热带雨林土壤固碳潜力和林业可持续管理提供理论依据与数据支撑。
1 材料与方法 1.1 研究区概况研究区位于海南省西南部尖峰岭国家级自然保护区(18°20′ N ~ 18°57′ N, 108°41′ E~ 109°12′ E),属低纬度热带岛屿季风气候,年均温为19.7 ℃,年均降水量2 651.6 mm,降水集中在5—10月,干湿两季明显。尖峰岭自然环境十分优越,植被类型丰富,在海拔800 m以下地段分布着低地雨林,以青梅林、鸭脚木林以及海南榄仁、厚皮林常见,在海拔800 ~ 1 200 m地段分布着山地雨林,以陆均松林、海南紫荆林以及栲林常见,土壤类型以砖黄壤、黄壤为主。
1.2 样品采集2023年5月于尖峰岭低地雨林次生林(DC)、山地雨林次生林(SC)以及山地雨林原始林(SY)3个林型进行土壤样品采集。每个林型设置3块样地(20 m×20 m),各样地内设置6个重复,每个重复土样在去除地表约5 cm厚的地表植被和覆盖物后,由直径7 cm的土钻取6钻土壤混合而成,取样深度为0 ~ 20 cm,3种林型共采集54个(3×3×6)土样。新鲜土样去除植物根系和石块等侵入体,过2 mm筛后分成2份,一份用灭菌离心管封装后放入冰桶带回实验室,并于–70 ℃冷冻保存用于分子生物学分析,另一份土样待室内自然风干后用于土壤基本理化性质的测定。样地基本情况如表 1所示。
|
|
表 1 样地基本情况 Table 1 Basic information of sampling sites |
采用酸度计测定土壤pH,水土比(V︰m)为2.5︰1[18];土壤含水量(SWC)在105 ℃烘箱中过夜干燥至恒重后测定,用质量分数表示[18];土壤全氮(TN)采用凯氏定氮法测定[18];土壤全磷(TP)采用碱熔–钼锑抗比色法测定[18];土壤有机碳(SOC)采用重铬酸钾–浓硫酸加热法测定[18];土壤易氧化有机碳(ROC) 采用高锰酸钾氧化法测定[19];土壤粒径采用激光粒度仪测定[20]。
1.3.2 土壤总DNA提取采用Powersoil DNA Isolation Kit(MOBIO.USA)试剂盒提取土壤总DNA,操作流程按照试剂盒说明书进行。DNA提取完毕后,取2 μL DNA溶液使用超微量紫外可见分光光度计(Nanodrop ND1000,USA)检测浓度和纯度,并用1% 琼脂糖凝胶电泳检测DNA完整性。
1.3.3 土壤固碳功能基因cbbL扩增与测序固碳功能基因cbbL扩增的上游引物为K2f (ACCAYCAAGCCSAAGCTSGG),下游引物为V2r (GCCTTCSAGCTTGCCSACCRC),片段长度为492 ~ 495 bp。PCR反应体系(25 μL):5×Reaction Buffer缓冲液5 μL,5×High GC Buffer缓冲液5 μL,2.5 mmol/L dNTPs 2 μL,正、反向引物各1 μL,Q5 DNA聚合酶0.25 μL,模板DNA 2 μL,ddH2O 8.75 μL。PCR反应条件:98℃预变性30 s,使模板DNA充分变性,然后进入扩增循环(98 ℃保持15 s使模板变性,后降温至50 ℃保持30 s退火,在72 ℃保持30 s使引物在模板上延伸合成DNA,完成1个循环),重复循环27次使扩增的DNA片段大量累积,最后在72 ℃保持5 min使产物延伸完整,4 ℃保存。PCR扩增反应仪为ABI 2720。
PCR产物纯化后送至上海派森诺公司采用Illumina平台对群落DNA片段进行双端测序。使用Vsearch方法对原始测试数据进行拼接、质控、优化,获得高质量序列,在97%[21]相似度水平下对高质量序列进行聚类,输出代表序列和操作分类单元(OTU)表,通过比对NT数据库(Nucleotide Sequence Database),对OTU代表序列进行物种分类注释,得到分类鉴定结果。
1.3.4 土壤固碳细菌数量测定采用绝对定量PCR(AQ-PCR)方法检测固碳微生物cbbL基因丰度,采用同上K2f/V2r引物。反应体系:2×SYBR real-time PCR premixture 10 µL,10 μmol/L上游和下游引物各0.4 μL。反应条件:95 ℃预变性5 min,后进入扩增循环(95 ℃变性15 s,后降温至60 ℃保持退火30 s,完成1个循环),重复40个循环。实时荧光定量PCR仪:LightCycler480I.384,Roche。
1.4 数据处理与分析使用Excel 2010和SPSS 19.0软件对数据进行处理与统计分析,利用单因素方差分析(one-way ANOVA)与最小显著性差异(LSD)法对各样地间变量进行多重比较(α=0.05);使用Origin 2021绘制固碳基因定量丰度图,使用QIIME2(2019.4)程序进行固碳微生物门、属水平的群落组成分析;采用R 4.3.0程序的“ape”包进行主坐标分析(PCoA)、“Vegan”包进行冗余分析(RDA),并使用“rdacca.hp”包基于冗余分析的校正R2结果进行层次分割确定单个环境变量对群落结构差异的贡献率[22],同时借助“ggplot2”包进行相应的绘图。
2 结果与分析 2.1 各林型土壤理化性质尖峰岭热带雨林不同林型土壤理化性质存在差异,山地雨林原始林土壤pH及TN、SOC、ROC含量总体上高于其他林型,但TP、Clay含量低于其他林型。低地雨林次生林的Clay、Silt含量高于其他林型,但TN含量低于其他林型。山地雨林次生林SWC高于其他林型,其余指标总体上均介于其他两个林型之间(表 2)。
|
|
表 2 各林型土壤基本理化参数 Table 2 Soil basic physicochemical parameters under different forest types |
对各林型土壤固碳微生物进行高通量测序分析,山地雨林原始林3块样地分别得到61 007、54 305、71 572条有效序列,山地雨林次生林3块样地分别得到62 289、654 112、617 689条有效序列,低地雨林次生林3块样地分别得到55 801、56 152、71 950条有效序列。可以看出,随着测序深度的加深,群落的Chao1丰富度估计指数以及Shannon多样性指数逐渐到达平台,表明测序结果足够反映当前样本所包含的多样性,已基本覆盖土壤中的所有物种(图 1)。

|
图 1 尖峰岭热带雨林土壤固碳微生物稀释曲线 Fig. 1 Rarefaction curves of soil CO2-fixing microorganisms in Jianfengling tropical rainforests |
土壤固碳微生物群落多样性主要是由反映群落多样性的Shannon指数、Simpson指数以及表征群落丰度的Chao1指数、Observed species指数来表示(表 3)。3个林型的土壤固碳微生物群落α多样性指数总体呈现低地雨林次生林 > 山地雨林次生林 > 山地雨林原始林趋势。除Simpson指数外,山地雨林次生林与其他两个林型的多样性指数均无显著差异。
|
|
表 3 各林型土壤固碳微生物多样性指数 Table 3 Diversity indexes of soil CO2-fixing microorganisms in different forest types |
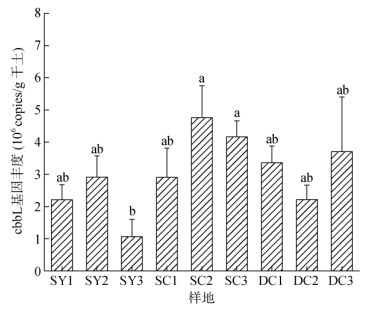
绝对定量PCR分析结果表明(图 2),山地雨林原始林土壤固碳微生物的基因丰度在1.06×106 ~ 2.91×106 copies/g干土,山地雨林次生林基因丰度在2.91×106 ~ 4.76×106 copies/g干土,低地雨林次生林基因丰度在2.21×106 ~ 3.70×106 copies/g干土,基因丰度总体呈现山地雨林次生林 > 低地雨林次生林 > 山地雨林原始林,其中SC2、SC3样地基因丰度显著高于SY3样地(P < 0.05),其余样地间均无显著差异。
|
(柱图上方不同小写字母表示各样地间差异显著(P < 0.05)) 图 2 各林型土壤cbbL基因丰度 Fig. 2 Abundances of cbbL genes in soils of different forest types |
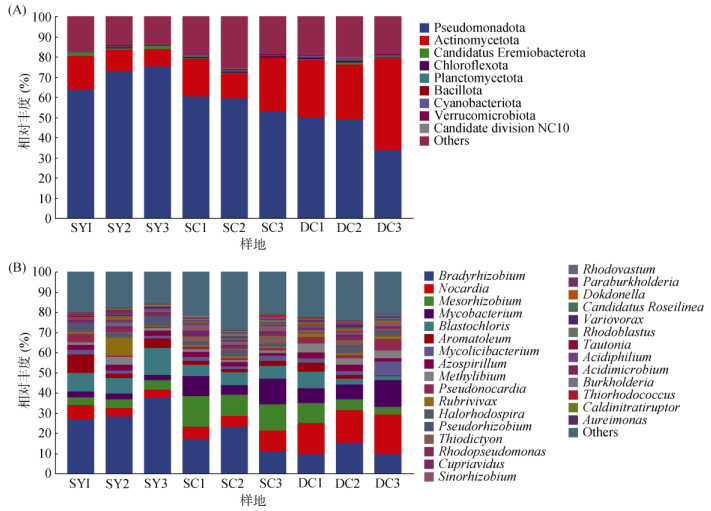
本研究中,3个林型土壤所得序列共注释到固碳微生物归属9个门,15个纲,27个目,55个科,95个属。门水平上(图 3A),假单胞菌门(Pseudomonadota)和放线菌门(Actinomycetota)为各林型的主要菌门,两大菌门在山地雨林原始林的3个样地中平均占比为70.6%、11.95%,在山地雨林次生林中平均占比为50.76%、19.28%,在低地雨林次生林中平均占比为44.28%、33.73%。在属水平上(图 3B),对前30个属进行分析,慢生根瘤菌属(Bradyrhizobium,11.53% ~ 31.06%)、诺卡氏菌属(Nocardia,4.97% ~ 17.07%)、中慢生根瘤菌属(Mesorhizobium,4.44% ~ 12.97%)、分枝杆菌属(Mycobacterium,2.62% ~ 9.20%)、芽绿菌属(Blastochloris,4.34% ~ 10.12%)、固氮弧菌属(Aromatoleum,1.97% ~ 5.39%)、分枝菌酸杆形菌属(Mycolicibacterium,1.71% ~ 3.78%)、固氮螺菌属(Azospirillum,1.97% ~ 2.65%)、Methylibium (1.22% ~ 3.77%)9个属在各林型样地中的相对丰度均大于1%,为优势菌属。其中,在山地雨林原始林中主要的优势菌属为慢生根瘤菌属(31.06%)和芽绿菌属(10.12%);在山地雨林次生林中主要的优势菌属为慢生根瘤菌属(17.15%)和中慢生根瘤菌属(12.97%);在低地雨林次生林中主要的优势菌属为诺卡氏菌属(17.07%)和慢生根瘤菌属(11.53%)。
|
图 3 不同林型土壤固碳微生物在门(A)、属(B)水平上的群落结构组成 Fig. 3 Community structure compositions of CO2-fixing microorganisms at phylum(A) and genus(B) levels in soil of different forest types |
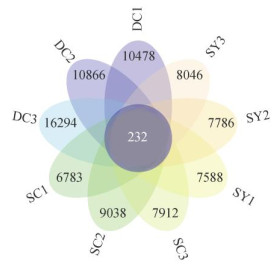
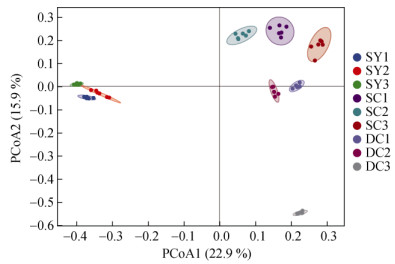
本研究共得到113 496个OTU。其中,样地DC1、DC2、DC3独有的OTU分别为10 478、10 866、16 294个,样地SC1、SC2、SC3独有的OTU分别为6 783、9 038、7 912个,样地SY1、SY2、SY3独有的OTU分别为7 588、7 786、8 046个,但仅有232个OTU由所有林型共有(图 4)。为分析群落差异情况,基于不同林型各样地OTU丰度进行PCoA分析(图 5),发现总体上各样地按林型集聚,其中山地雨林原始林的固碳微生物群落结构与另外两个林型的距离较远即差异较大,山地雨林次生林与低地雨林次生林间的群落结构差异较小。
|
图 4 各林型土壤固碳微生物OTU花瓣图 Fig. 4 OTU flower of soil CO2-fixing microorganisms in different forest types |
|
图 5 基于OTU丰度的PCoA分析 Fig. 5 PCoA analysis based on OTU abundance |
为进一步确定不同林型间的差异物种即标志物种,基于物种相对丰度进行LEfSe分析(LDA > 4),结果显示,在不同林型间共得到38个差异标志物(图 6A)。在属水平上,低地雨林次生林中的标志物种为放线菌纲下的诺卡菌属(Nocardia)、分枝杆菌属(Mycobacterium)、分枝菌酸杆形菌属(Mycolicibacterium)、假诺卡氏菌属(Pseudonocardia)、Phaeovulum和γ-变形菌纲下的嗜盐红螺菌属(Halorhodospira),山地雨林次生林的标志物种为γ-变形菌纲下的硫网菌属(Thiodictyon)、α-变形菌纲下的中华根瘤菌属(Sinorhizobium)和中慢生根瘤菌属(Mesorhizobium),山地雨林原始林中为α-变形菌纲下的芽绿菌属(Blastochloris)、慢生根瘤菌(Bradyrhizobium)、假根瘤菌属(Pseudorhizobium)和β-变形菌纲下的红长命菌属(Rubrivivax)、固氮弧菌属(Aromatoleum)(图 6B)。
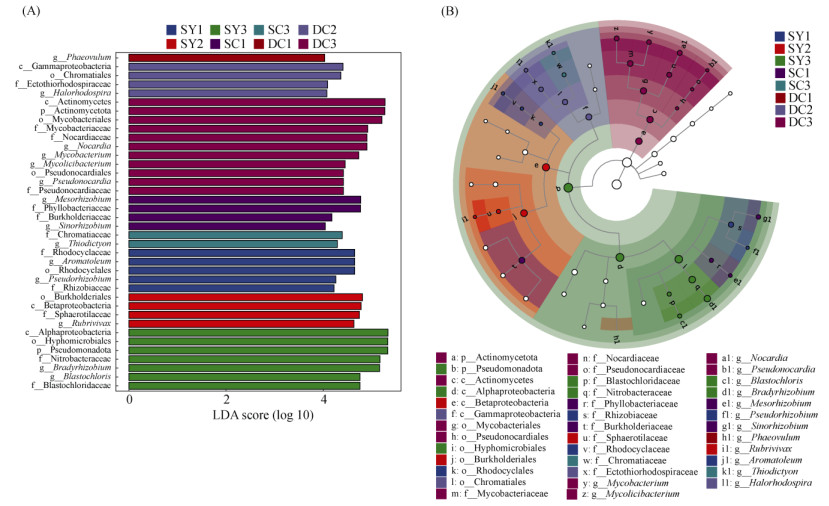
|
(A:得分大于4的物种显示在柱状图中,LDA得分越高表明差异越显著;B:从内到外的彩色节点代表从门至属的分类学水平,无显著差异以空心圆圈表示,实心圆为差异物种,圆圈的直径代表物种的丰度) 图 6 不同林型中差异物种的LDA得分情况(A)和进化分支图(B) Fig. 6 LDA scores (A) and evolutionary branches of different species (B) in different forest types |
为分析影响尖峰岭热带雨林土壤固碳微生物群落的影响因素,基于属水平对固碳微生物群落结构与环境因子进行了RDA分析,结果表明,固碳微生物群落组成与环境因子的变化显著相关(校正R2= 0.706,P=0.001),第一、二排序轴共解释了37.87% 的固碳微生物群落差异。其中ROC(P=0.001)、SOC (P=0.001)、TP(P=0.001)、TN(P=0.001)、SWC(P= 0.006)、Clay(P=0.017)、Find sand(P=0.013)对土壤固碳微生物的属水平达到显著影响(图 7A)。环境因子贡献率表明其在驱动群落组成差异中的重要性,其中ROC、SOC、TP、TN对群落差异的贡献率较大,分别为13.20%、10.25%、10.57%、11.04%(图 7B)。
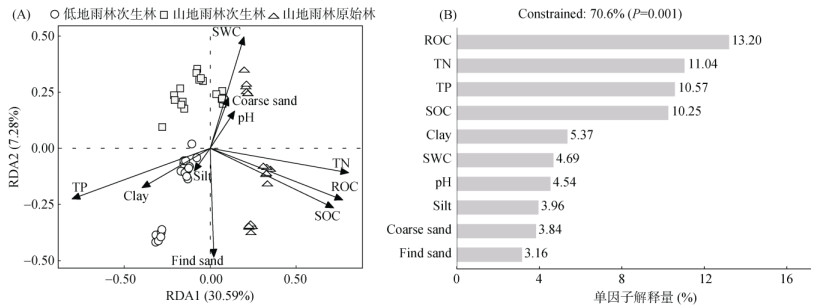
|
图 7 尖峰岭热带雨林固碳微生物群落结构与环境因子的冗余分析 Fig. 7 Redundancy analysis between CO2-fixing microorganisms community structure and environmental factors in Jianfengling tropical rainforest |
本研究通过绝对定量PCR分析,在尖峰岭热带雨林中发现了相当数量的土壤固碳微生物,其cbbL基因数量高于湿地[23]、旱地[24],低于稻田[2]、草原[25],但其检出的OTU丰度普遍高于上述生态系统。在本系统内,cbbL基因数量、群落多样性均表现为低地雨林次生林高于山地雨林原始林。目前关于森林类型对土壤微生物群落的影响机制尚无统一的结论,但大量研究表明土壤微生物多样性随着海拔的升高而减小[11, 26-27]。本研究中,样地海拔梯度较大,海拔可对区域尺度下的水热条件进行再分配,温度深刻地影响着微生物的活性与组成[28-29],因此高海拔地区的低温可能会阻碍微生物生长并降低其多样性[30]。一般而言,土壤有机质含量与固碳微生物数量呈正相关[2, 17]。但本研究中山地雨林原始林表现出较低的固碳微生物数量和更高的有机碳含量,这可能是由于低地雨林次生林多受人类活动干扰,地上植被密度较小,植物根系对土壤的固定能力较弱,因而土壤中的有机质易受雨水淋溶作用而流失,区内原始林则由于相对稳定的环境使得土壤中有机碳得以长期积累。
尖峰岭热带雨林中的固碳微生物主要分属假单胞菌门(Pseudomonadota)和放线菌门(Actinomycetota),这与大多数学者关于土壤固碳微生物的研究一致[31-33]。自养固碳微生物依据碳源获取途径不同可分为专性自养微生物与兼性自养微生物,本研究中的优势菌属以兼性自养微生物为主,与在火山沉积物[6]、毛竹林[33]以及农田[34]中关于土壤固碳微生物的研究结果一致,如慢生根瘤菌属(Bradyrhizobium)、中慢生根瘤菌属(Mesorhizobium)、诺卡氏菌属(Nocardia)、分枝杆菌属(Mycobacterium)、固氮螺菌属(Azospirillum)、Methylibium等均为兼性自养菌[6, 35-36]。专性自养菌以CO2为碳源,利用光或无机物(硫化氢、铵盐、氢气等)氧化产生的化学能作为能量自养生长,而兼性自养菌能适应更多的环境条件,其还可利用有机物为碳源,从光与有机物的氧化中获得能量进行异养生长,如在各林型中均为优势种群的慢生根瘤菌,既可以利用CO2为碳源,以氢气为供氢体还原CO2合成有机质进行自养生长,还可利用有机酸为碳源进行异养生长[37]。因而,在有机物质与无机物质共存的土壤环境中,适应能力更强的兼性自养菌成为土壤中优势的固碳种群。
本研究中,TN、TP以及SOC、ROC解释了较多的固碳微生物群落差异,是驱动尖峰岭热带雨林固碳微生物群落结构变化的重要环境因子,这与当前多数的研究结果一致[7, 31-32]。但当前许多研究表明pH是影响土壤固碳微生物群落结构的重要环境因子,如在Qin等[25]、苏鑫等[32]、刘彩霞等[33]的研究中分别在pH 5.82 ~ 7.19、6.43 ~ 6.61、3.99 ~ 4.48发现土壤固碳微生物群落结构受到pH的显著影响,但本研究中土壤pH在3.77 ~ 4.90,表现为对土壤固碳微生物群落无显著影响,这可能是由于在各环境因子的综合作用下掩盖了pH对土壤固碳微生物群落结构的影响,具体情况还有待进一步研究。
4 结论尖峰岭热带雨林生态系统中低地雨林次生林土壤固碳微生物群落的多样性与数量均高于热带雨林原始林,但或因热带雨林原始林拥有更稳定的固碳环境导致其有机碳含量更高,这表明低地雨林次生林有相当的固碳潜力,后续森林管理中建议加大对低地雨林次生林的保护。在群落组成方面,尖峰岭热带雨林固碳微生物组成十分丰富,主要分属放线菌门与假单胞菌门两大菌门,优势菌属以兼性自养菌为主。热带雨林中各林型固碳微生物群落结构差异较大,具体表现为低地雨林次生林、山地雨林次生林二者与山地雨林原始林的差异较突出,TN、TP、SOC、ROC是驱动固碳微生物群落差异的重要因素。
| [1] |
Smith P, Fang C M, Dawson J J C, et al. Impact of global warming on soil organic carbon[J]. Advances in Agronomy, 2008, 97: 1-43 (  0) 0) |
| [2] |
袁红朝, 秦红灵, 刘守龙, 等. 长期施肥对稻田土壤固碳功能菌群落结构和数量的影响[J]. 生态学报, 2012, 32(1): 183-189 (  0) 0) |
| [3] |
孔亚丽, 秦华, 朱春权等. 土壤微生物影响土壤健康的作用机制研究进展[J/OL]. 土壤学报: 1–19 [2023-12-26]. http://kns.cnki.net/kcms/detail/32.1119.P.20230621.2004.002.html.
(  0) 0) |
| [4] |
Van Der Wielen P W J J. Diversity of ribulose-1, 5-bisphosphate carboxylase/oxygenase large-subunit genes in the MgCl2-dominated deep hypersaline anoxic basin discovery[J]. FEMS Microbiology Letters, 2006, 259(2): 326-331 DOI:10.1111/j.1574-6968.2006.00284.x (  0) 0) |
| [5] |
Kong W D, Ream D C, Priscu J C, et al. Diversity and expression of RubisCO genes in a perennially ice-covered Antarctic Lake during the polar night transition[J]. Applied and Environmental Microbiology, 2012, 78(12): 4358-4366 DOI:10.1128/AEM.00029-12 (  0) 0) |
| [6] |
Nanba K, King G M, Dunfield K. Analysis of facultative lithotroph distribution and diversity on volcanic deposits by use of the large subunit of ribulose 1, 5-bisphosphate carboxylase/oxygenase[J]. Applied and Environmental Microbiology, 2004, 70(4): 2245-2253 DOI:10.1128/AEM.70.4.2245-2253.2004 (  0) 0) |
| [7] |
刘茗, 曹林桦, 刘彩霞, 等. 亚热带4种典型森林植被土壤固碳细菌群落结构及数量特征[J]. 土壤学报, 2021, 58(4): 1028-1039 (  0) 0) |
| [8] |
张洪波, 管东生, 郑淑颖. 热带雨林的碳循环及其意义[J]. 热带地理, 2001, 21(2): 178-182 (  0) 0) |
| [9] |
Cox P M, Pearson D, Booth B B, et al. Sensitivity of tropical carbon to climate change constrained by carbon dioxide variability[J]. Nature, 2013, 494(7437): 341-344 DOI:10.1038/nature11882 (  0) 0) |
| [10] |
Nottingham A T, Meir P, Velasquez E, et al. Soil carbon loss by experimental warming in a tropical forest[J]. Nature, 2020, 584(7820): 234-237 DOI:10.1038/s41586-020-2566-4 (  0) 0) |
| [11] |
黄正谊, 苏延桂, 黄刚, 等. 尖峰岭热带天然林不同土层细菌群落多样性和组成的海拔变异规律[J]. 生态学报, 2023, 43(7): 2891-2902 (  0) 0) |
| [12] |
林思诺, 苏延桂, 吕坤, 等. 尖峰岭热带森林土壤真菌群落的海拔变化格局及驱动因素[J]. 应用生态学报, 2023, 34(2): 349-358 (  0) 0) |
| [13] |
吴春玲, 罗竹慧, 李意德, 等. 热带山地雨林木本豆科和樟科植物叶内生细菌群落: 物种与功能群多样性及驱动因子[J]. 生物多样性, 2023, 31(8): 73-82 (  0) 0) |
| [14] |
刘洋荧, 王尚, 厉舒祯, 等. 基于功能基因的微生物碳循环分子生态学研究进展[J]. 微生物学通报, 2017, 44(7): 1676-1689 (  0) 0) |
| [15] |
袁红朝, 秦红灵, 刘守龙, 等. 固碳微生物分子生态学研究[J]. 中国农业科学, 2011, 44(14): 2951-2958 (  0) 0) |
| [16] |
刘琼, 魏晓梦, 吴小红, 等. 稻田土壤固碳功能微生物群落结构和数量特征[J]. 环境科学, 2017, 38(2): 760-768 (  0) 0) |
| [17] |
Bu L Y, Peng Z H, Tian J, et al. Core autotrophic microbes drive functional stability of soil cbbL-containing autotrophic microbes during desertification[J]. Applied Soil Ecology, 2023, 190: 105027 DOI:10.1016/j.apsoil.2023.105027 (  0) 0) |
| [18] |
鲍士旦. 土壤农化分析(第三版)[M].
中国农业出版社, 北京, 2000
(  0) 0) |
| [19] |
Blair G J, Lefroy R D B, Lise L. Soil carbon fractions based on their degree of oxidation, and the development of a carbon management index for agricultural systems[J]. Australian Journal of Agricultural Research, 1995, 46(7): 1459-1466 DOI:10.1071/AR9951459 (  0) 0) |
| [20] |
庞奖励, 乔晶, 黄春长等. 前处理过程对汉江上游谷地"古土壤"粒度测试结果的影响研究[J]. 地理科学, 2013, 33(06): 748-754 (  0) 0) |
| [21] |
张红雪, 朱巧莲, 郭力铭, 等. 烟秆生物质炭与化肥配施对植烟土壤有机碳组分及微生物的影响[J]. 土壤, 2022, 54(6): 1149-1156 (  0) 0) |
| [22] |
Lai J S, Zou Y, Zhang J L, et al. Generalizing hierarchical and variation partitioning in multiple regression and canonical analyses using the rdacca. hp R package[J]. Methods in Ecology and Evolution, 2022, 13(4): 782-788 DOI:10.1111/2041-210X.13800 (  0) 0) |
| [23] |
曹煦彬, 林娣, 蔡璐, 等. 鄱阳湖南矶山湿地不同植被类型对土壤碳组分、羧化酶及cbbl基因的影响[J]. 土壤学报, 2017, 54(5): 1269-1279 (  0) 0) |
| [24] |
Tang Z X, Fan F L, Wan Y F, et al. Abundance and diversity of RuBisCO genes responsible for CO2 fixation in arid soils of northwest China[J]. Pedosphere, 2015, 25(1): 150-159 DOI:10.1016/S1002-0160(14)60085-0 (  0) 0) |
| [25] |
Qin J, Li M, Zhang H F, et al. Nitrogen deposition reduces the diversity and abundance of cbbL gene-containing CO2-fixing microorganisms in the soil of the Stipa baicalensis steppe[J]. Frontiers in Microbiology, 2021, 12: 570908 DOI:10.3389/fmicb.2021.570908 (  0) 0) |
| [26] |
Ji L, Shen F Y, Liu Y, et al. Contrasting altitudinal patterns and co-occurrence networks of soil bacterial and fungal communities along soil depths in the cold-temperate montane forests of China[J]. CATENA, 2022, 209: 105844 DOI:10.1016/j.catena.2021.105844 (  0) 0) |
| [27] |
Luo Z M, Liu J X, Zhao P Y, et al. Biogeographic patterns and assembly mechanisms of bacterial communities differ between habitat generalists and specialists across elevational gradients[J]. Frontiers in Microbiology, 2019, 10: 169 DOI:10.3389/fmicb.2019.00169 (  0) 0) |
| [28] |
常琳溪, 梁新然, 王磊, 等. 中国稻田土壤有机碳汇特征与影响因素的研究进展[J]. 土壤, 2023, 55(3): 487-493 (  0) 0) |
| [29] |
Zhou J Z, Deng Y, Shen L N, et al. Temperature mediates continental-scale diversity of microbes in forest soils[J]. Nature Communications, 2016, 7: 12083 DOI:10.1038/ncomms12083 (  0) 0) |
| [30] |
Zhu B J, Li C N, Wang J M, et al. Elevation rather than season determines the assembly and co-occurrence patterns of soil bacterial communities in forest ecosystems of Mount Gongga[J]. Applied Microbiology and Biotechnology, 2020, 104(17): 7589-7602 DOI:10.1007/s00253-020-10783-w (  0) 0) |
| [31] |
Wang X Y, Li W, Xiao Y T, et al. Abundance and diversity of carbon-fixing bacterial communities in Karst wetland soil ecosystems[J]. CATENA, 2021, 204: 105418 DOI:10.1016/j.catena.2021.105418 (  0) 0) |
| [32] |
苏鑫, 郭迎岚, 卢嫚, 等. 3种碳添加对退化农田土壤固碳细菌群落结构多样性的影响[J]. 环境科学学报, 2020, 40(1): 234-241 (  0) 0) |
| [33] |
刘彩霞, 周燕, 徐秋芳, 等. 毛竹林集约经营对土壤固碳细菌群落结构和多样性的影响[J]. 生态学报, 2018, 38(21): 7819-7829 (  0) 0) |
| [34] |
钱明媚, 肖永良, 彭文涛, 等. 免耕水稻土固定CO2自养微生物多样性[J]. 中国环境科学, 2015, 35(12): 3754-3761 (  0) 0) |
| [35] |
周集体, 王竞, 杨凤林. 微生物固定CO2的研究进展[J]. 环境科学进展, 1999(1): 1-9 (  0) 0) |
| [36] |
张双双, 靳振江, 贾远航, 等. 岩溶地区不同土地利用方式土壤固碳细菌群落结构特征[J]. 环境科学, 2019, 40(1): 412-420 (  0) 0) |
| [37] |
Falcone D L, Tabita F R. Expression and regulation of Bradyrhizobium japonicum and Xanthobacter flavus CO2 fixation genes in a photosynthetic bacterial host[J]. Journal of Bacteriology, 1993, 175(3): 866-869 DOI:10.1128/jb.175.3.866-869.1993 (  0) 0) |
 2024, Vol. 56
2024, Vol. 56


