五氯酚(Pentachlorophenol,PCP)是一种毒性较强、可离子化的氯代有机污染物,在酸性条件下以PCP的形式存在,在碱性条件下转化为易溶于水的五氯酚盐类,五氯酚钠(PCP-Na)是PCP在碱性环境下的一种钠盐形式。PCP及其钠盐PCP-Na曾作为杀虫剂、除草剂以及木材防腐剂被广泛用于农业和工业[1-3]。PCP-Na还常被用作水产养殖中的清塘药物来杀灭钉螺[4]。虽然PCP及其钠盐PCP-Na早已被禁用,但由于其历史使用量大,以及稳定性强难以降解等原因,对环境造成的严重危害仍然存在。
植物作为生态系统中的主体,对污染物的环境归趋具有非常重要的影响作用,植物吸收也是污染物进入陆生食物网的首要步骤[5-6]。目前已有大量研究表明,植物可以通过根系吸收并富集有机污染物[7-8]。盆栽试验发现,莎草、小飞蓬、垂柳等9种植物,均对PCP有富集现象,并发现9种植物地下部分吸收均大于地上部分[9],这可能是由于PCP的疏水性所致。通常认为疏水性强(logKow > 3)的有机物,更容易被植物根系的脂质固定,而难以穿过内表皮进入木质部实现径向运输[10]。水生植物芦苇、香蒲和水葱也被证实对PCP具有吸收累积的能力,可以富集沉积物中的PCP[11]。在水葱对PCP富集的研究中还发现,水葱对PCP存在降解行为[12]。同时,也有研究证实PCP-Na可被植物富集吸收[13]。但目前对PCP及其钠盐PCP-Na在植物体中吸收累积的研究多侧重于疏水性的PCP,植物对亲水性的PCP-Na的研究还存在很大的空白。植物的种类也是影响其吸收的一大因素,不同品种的植物对有机物的吸收也存在差异。用20种不同的紫花苜蓿品种修复石油烃发现,其中两种基因型的苜蓿与对照相比差异达显著水平,不同品种的植物因基因表达不同对有机物的吸收能力表现出差异[14]。水稻(Oryza sativa L.)是当今世界上最主要的粮食作物之一,也是许多食物链的基础[15]。污染物可以通过水稻进入食物链,从而进入人体中,影响人类的健康,因此水稻安全生产显得尤为重要。目前已经在水稻及其他植物中发现对PCP及PCP-Na的吸收行为[16]。但不同水稻品种对PCP-Na的吸收累积差异的研究还不足。
本文以15种水稻品种为研究对象,阐明不同水稻品种对亲水性氯代有机污染物PCP-Na的吸收累积差异,进一步揭示水稻本体对其体内PCP- Na的降解过程,以评估水稻本体对PCP-Na毒害的耐受性。研究成果对于降低作物健康风险、筛选耐性品种和污染场地农作物的安全生产有着重要的意义。
1 材料与方法 1.1 试验材料 1.1.1 材料与试剂PCP-Na标准品(德国DRE公司,纯度 > 98%);PCP标准溶液(浓度1.01 mg/mL,中国计量院);正己烷、乙酸乙酯和甲醇(HPLC级,上海安谱实验科技有限公司);无水Na2SO4、K2CO3、乙酸酐(分析纯,国药集团化学试剂有限公司);HLB固相萃取小柱(200 mg/6 mL,青岛盛瀚色谱技术有限公司)。
1.1.2 供试水稻试验所用的15种水稻品种信息如表 1所示。
|
|
表 1 15种水稻品种基本信息 Table 1 Basic information on 15 rice varieties |
挑选颗粒均匀饱满的水稻种子,超纯水洗净后依次用70% 乙醇浸种30 s和10% NaClO溶液浸种10 min用于种子表面杀菌,再用灭菌水充分清洗。将种子置于25 ℃的恒温培养箱中用灭菌水浸泡24 h后转移到湿润的石英砂上,于25 ℃黑暗环境中培养1周左右。待种子萌发后依次转移幼苗至1/2强度和全强度的水稻营养液[17]中各培养1周,然后选择生长一致的植株进行后续试验。
1.3 不同水培污染浓度下水稻对PCP-Na吸收累积特征选取湘早籼45号水稻种子进行萌发育苗,挑选出生长一致的3周龄幼苗进行分组水培培养,其中水培溶液中的PCP-Na浓度分别设置为1、3、5、8 mg/L作为污染处理组,同时设置用未添加PCP-Na的水培溶液作为非污染对照组,用HCl将pH调至7左右以防止PCP析出。整个水稻培养周期在控制环境的温室(14 h光照,10 h黑暗;昼夜温度为28 ℃/24 ℃)中进行,在培养1、2、3、5、7、9 d后采集植物根部,用去离子水对其根部进行多次清洗以去除根部表面的PCP-Na,吸干表面水分后置于–20 ℃冰箱保存。
1.4 不同水稻品种对PCP-Na的耐受能力选取表 1中的15种不同品种的水稻种子进行萌发育苗,挑选出长势一致的3周龄幼苗分别置于5 mg/L的PCP-Na水培溶液中进行培养,温室培养条件同1.3。培养1 d后采集植物地上和地下部分,清洗保存方法如1.3。
1.5 水稻本体对PCP-Na的降解过程选取圣稻15号水稻种子进行萌发育苗,将生长一致的3周龄幼苗置于5 mg/L的PCP-Na水培溶液培养1 d后移入未添加PCP-Na的水培营养液中继续培养,温室条件同1.3。同时设置未添加PCP-Na的水培溶液种植水稻作为空白处理。分别于污染培养的1 d后,移入未污染水培溶液的0.5、1、1.5、2、3、4、5、7、9、11、14 d收获植物地上和地下部分,清洗保存方法如1.3。
1.6 PCP-Na的提取、纯化及含量的测定将植物组织样品于–20 ℃预冻后置于冷冻干燥机中干燥48 h后取出,剪成1 cm小段后在研钵中研磨成粉末状待提取。植物组织中PCP-Na的提取、净化、衍生及检测方法参考梁倩[1]、徐艳[18]和何正和等[19]的研究。称量粉碎的样品约1 g于离心管中,加入7.5 mL蒸馏水,使用6 mol/L的盐酸将pH调节至小于2。将离心管放入40 ℃水浴超声15 min,加入正己烷7.5 mL,涡旋40 s后在2 000 r/min下离心10 min,吸取上层清液,向离心管中再次加入7.5 mL正己烷,重复上述操作,合并两次提取液。向HLB固相萃取柱中分别加入3 mL甲醇、3 mL正己烷和乙酸乙酯(95︰5)混合液活化,然后将正己烷提取液加入到HLB固相萃取柱中,过完样品后加3 mL正己烷和乙酸乙酯(95︰5)混合液淋洗,吹干,加3 mL甲醇洗脱,洗脱液氮吹至近干后加入10 mL(0.2 mol/L)的K2CO3溶液,使酚类物质呈离子状态。然后加入0.5 mL乙酸酐,在200 r/min的条件下震荡25 min使PCP-Na衍生成五氯苯乙酯。最后添加2 mL正己烷萃取后过无水硫酸钠和0.22 μm有机相滤膜,于–20 ℃下储存待测。
五氯苯乙酯的分离与检测采用气相色谱质谱联用仪(GC-MS)(Agilent 7890A, Agilent, Santa Clara, CA, United States),配备色谱柱HP-5 MS(30 m×0.32 mm×0.25)(J&W Scientific, Inc., Folsom, CA, United States)。GC-MS升温条件为:初始温度设定为80 ℃,持续3 min,然后以10 ℃/min升高至250 ℃并且保持恒定5 min。
1.7 数据分析所有统计分析和图表都是在Excel和Origin 2021中进行处理。
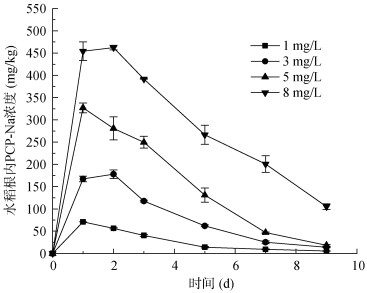
2 结果与讨论 2.1 不同PCP-Na水培浓度胁迫下的水稻吸收累积特征根系吸收是植物累积有机污染物的主要途径。不同PCP-Na水培浓度胁迫下,水稻根内吸收累积的PCP-Na浓度随时间的变化如图 1所示。在所有培养时间内水稻根部PCP-Na吸收浓度的大小顺序为:8 mg/L处理 > 5 mg/L处理 > 3 mg/L处理 > 1 mg/L处理,水稻根部PCP-Na的吸收累积浓度大小与外源水培浓度呈一致性,即水培浓度越高根系累积浓度越高。Zhang等[20]的盆栽试验也发现,水稻各组织间卤代有机物与栽培土壤中的含量呈显著的正相关性(P < 0.05)。这表明培养基质中污染物的初始浓度能够影响植物根系对污染物的吸收行为及能力。
|
图 1 不同浓度PCP-Na胁迫下水稻根内PCP-Na含量随时间变化趋势 Fig. 1 Changes of PCP-Na concentrations in rice roots over time under different concentrations of PCP-Na stress |
同时结果发现水稻根系对PCP-Na具有较强的富集能力,不同处理组水稻根部均能监测到较高含量的PCP-Na,4种处理在污染胁迫的第1~ 2天内,吸收累积浓度达到最大值。在1、3、5、8 mg/L PCP-Na浓度胁迫下,其根系吸收的最大浓度分别可以达到70.89、178.00、327.01、462.13 mg/kg。随着培养时间的延长,水稻根系内的PCP-Na浓度呈持续下降趋势。这与以往关于水葱体内富集五氯酚的变化趋势相似[12]。PCP-Na暴露培养的第9天,1、3、5 mg/L处理下的水稻根内浓度下降至较低值,分别为5.49、13.97、18.35 mg/kg,胁迫强度最大的8 mg/L处理组在第9天也下降到105.07 mg/kg。该研究结果表明当植物体受到污染胁迫时其自身具有较强的降解污染物的能力[21],当水稻自身对污染物降解的能力大于从环境中吸收污染物的能力时,根内累积浓度呈现下降的趋势。除此之外,随着植物的生长,植物根系生物量增大,植物根内的PCP-Na含量也会受生长稀释效应的影响,目前有研究已经证实了生长稀释效应会影响有机污染物在植物中的累积含量[22-23]。
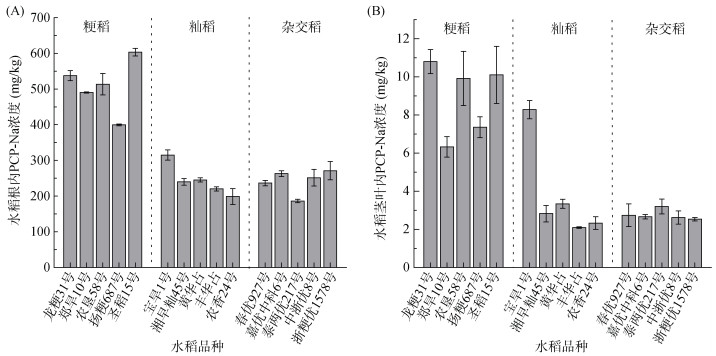
2.2 不同水稻品种对PCP-Na的吸收累积差异水稻品种繁多,环境因素使其有不同的生态表型,长期的环境选择使水稻在形态、生理和适应性特征等方面产生差异,也使不同品种间表现出耐性差异。在5 mg/L PCP-Na胁迫下,15种不同水稻品种污染24 h后其根和茎叶内的PCP-Na累积浓度差异如图 2所示。水稻根部和茎叶累积浓度分别为186.16 ~ 603.39 mg/kg和2.09 ~ 10.80 mg/kg,这一结果表明PCP-Na在水稻植株内存在径向运输行为。通常疏水性强的有机物,容易被植物根系表皮的脂质和有机物吸收和固定,不容易径向运输[10]。虽然PCP-Na具有极强的水溶性,但由结果来看,根部仍然是污染累积的主要部位,水稻体内的PCP-Na呈现由根系向上到茎叶逐渐降低的趋势,根部累积浓度远大于茎叶。以往关于玉米、南瓜、西葫芦和萝卜等多种植物的研究中也表现出相同的趋势[6, 24-27]。
|
图 2 不同水稻品种根部(A)和茎叶(B)中的PCP-Na吸收累积浓度 Fig. 2 Cumulative concentrations of PCP-Na uptake in roots (A) and shoots (B) of different rice varieties |
如图 2和表 2所示,不同基因型水稻之间的PCP-Na累积浓度以及单株水稻吸收量差异显著。粳稻、籼稻、杂交稻品种的根部累积浓度分别为399.47 ~ 603.39、198.67 ~ 315.05和186.16 ~ 271.17 mg/kg,单株根部累积量分别为3.68 ~ 5.82、2.26 ~ 3.21和2.58 ~ 4.75 μg;茎叶累积浓度分别为6.32 ~ 10.80、2.09 ~ 8.28和2.53 ~ 3.19 mg/kg,单株茎叶累积量分别为0.24 ~ 0.56、0.10 ~ 0.34和0.11 ~ 0.16 μg。不同品种中粳稻的累积浓度和单株累积量显著高于籼稻和杂交稻,籼稻和杂交稻之间的差异不大。这表明在PCP-Na污染胁迫下,粳稻更加敏感,而籼稻和杂交稻对PCP-Na的耐受性更强。这与Li等[21]研究十溴二苯醚(BDE-209)胁迫下不同水稻品种自身抵御能力的结果相似,不同水稻品种对外源胁迫产生不同的抗性。累积浓度的大小可反映出水稻对PCP-Na的敏感程度,基于上述研究结果筛选出PCP-Na的耐受型和敏感型水稻品种(表 3),为水稻优质生产提供一定的科学依据。
|
|
表 2 不同水稻品种的单株PCP-Na吸收累积量 Table 2 PCP-Na accumulations absorbed per plant of different rice varieties |
|
|
表 3 三种基因型水稻中的敏感型和耐受型品种 Table 3 Sensitive and tolerant varieties in three genotypes of rice |
结果还发现,水稻茎叶的PCP-Na累积能力与根部的累积能力不一致。如在杂交稻中,浙粳优1578号的根部累积浓度最高,但茎叶浓度在5种粳稻中最低;泰两优217号的根部累积浓度最低,但茎叶浓度最高。导致水稻根部和茎叶PCP-Na累积能力不同的主要原因可能是不同品种的径向运输能力存在差异。
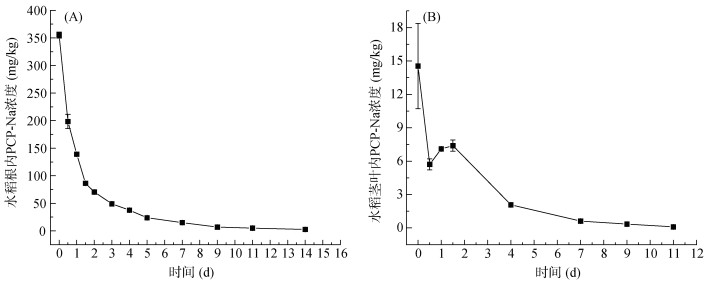
2.3 水稻本体对其体内PCP-Na的降解过程水稻在PCP-Na水培溶液污染1 d后转移到无污染营养液中,其体内PCP-Na的累积浓度随时间变化如图 3所示。水稻根内PCP-Na的浓度随时间的增加呈现出一直下降的趋势,并且在营养液中培养的前两天浓度下降幅度最大,随后下降幅度逐渐减小直到趋于平缓。在第2天,根内PCP-Na的浓度从初始的355.21 mg/kg下降到70.47 mg/kg,浓度下降了80% 左右;在第11天,根内PCP-Na的浓度下降到4.93 mg/kg,开始低于水培污染的浓度(5 mg/L),且随着培养时间的延长,根内PCP-Na的浓度变化不大,到第14天的根内浓度降为2.59 mg/kg。结果表明,水稻本体对PCP-Na表现出较强的降解能力。以往对水生植物的研究中也得到过相同的结论[11-12]。这也证实了本研究中水稻根内PCP-Na累积浓度下降的原因是由于水稻本体对PCP-Na的降解。此外,研究发现茎叶对PCP- Na的降解过程与根部具有不一致的趋势。在无污染培养的第0.5天,茎叶内PCP-Na的浓度大幅度下降,在随后的1 d内,茎叶内PCP-Na的浓度呈现先轻微上升后持续下降的趋势,这主要是由于根系内的PCP-Na随着径向运输源源不断地向上运输至茎叶中。在第11天,茎叶内PCP-Na的浓度从最初的14.55 mg/kg下降到0.098 mg/kg,浓度降低了99%,表明茎叶也具有较强的氯代有机污染物的降解能力。
|
图 3 水稻根部(A)和茎叶(B)内PCP-Na含量随时间的变化趋势 Fig. 3 Changes of PCP-Na concentrations over time in rice roots (A) and shoots (B) |
降解的发生推测是因为水稻体内的PCP-Na发生了代谢反应。PCP的降解具有还原脱氯降解和氧化脱氯降解两种途径。在厌氧条件下,PCP首先发生邻位脱氯生成四氯酚和三氯酚,而后发生间位或对位脱氯形成二氯酚[28-29]。在好氧条件下的脱氯过程比较复杂,PCP主要氧化成氯代醌类化合物或氯代二酚类化合物,然后再进行羟基化等过程实现氯原子的全部去除[30-31]。也有研究发现,PCP还可被氧化为苯氧基烯烃[32-33]。在本试验中,GC-MS色谱图中并未检测到其还原脱氯产物,推测PCP-Na在水稻体内发生氧化反应,中间代谢产物的种类及具体途径还需进一步验证猜想。
3 结论水稻根系具有吸收累积PCP-Na的能力,水培中的PCP-Na浓度越高,水稻根内的PCP-Na累积浓度越高;且随时间延长,水稻根部的PCP-Na累积量会达到最大值,随后在自身的降解作用下呈下降趋势。
不同水稻品种对PCP-Na的吸收累积及径向迁移能力都存在差异,粳稻比籼稻和杂交稻对PCP-Na更加敏感,籼稻和杂交稻之间的差异不大,基于累积结果筛选出扬粳687号(粳稻)、农香24号(籼稻)和泰两优217号(杂交稻)为耐受品种。
水稻对其体内的PCP-Na表现出较强的降解能力,14 d内水稻体中的PCP-Na基本被降解。水稻体内PCP-Na的代谢中间产物及具体代谢途径有待于下一步研究验证。
| [1] |
梁倩. 五氯酚钠的检测技术及在中华绒螯蟹中代谢规律的研究[D]. 青岛: 中国海洋大学, 2012.
(  0) 0) |
| [2] |
McGrath R, Singleton I. Pentachlorophenol transformation in soil: A toxicological assessment[J]. Soil Biology and Biochemistry, 2000, 32(8/9): 1311-1314 (  0) 0) |
| [3] |
孙磊, 蒋新, 周健民, 等. 五氯酚污染土壤的热修复初探[J]. 土壤学报, 2004, 41(3): 462-465 DOI:10.3321/j.issn:0564-3929.2004.03.021 (  0) 0) |
| [4] |
张彤晴, 蒋丽娟, 葛家春, 等. 五氯苯酚对渔业环境的危害与对策研究进展[J]. 江苏农业科学, 2007, 35(4): 256-259 DOI:10.3969/j.issn.1002-1302.2007.04.091 (  0) 0) |
| [5] |
邢维芹, 骆永明, 吴龙华, 等. 多环芳烃对冬小麦早期生长的影响研究[J]. 土壤学报, 2008, 45(6): 1170-1173 DOI:10.3321/j.issn:0564-3929.2008.06.022 (  0) 0) |
| [6] |
Wang S, Zhang S Z, Huang H L, et al. Uptake, translocation and metabolism of polybrominated diphenyl ethers (PBDEs) and polychlorinated biphenyls (PCBs) in maize (Zea mays L.)[J]. Chemosphere, 2011, 85(3): 379-385 DOI:10.1016/j.chemosphere.2011.07.002 (  0) 0) |
| [7] |
刘世亮, 骆永明, 丁克强, 等. 土壤中有机污染物的植物修复研究进展[J]. 土壤, 2003, 35(3): 187–192, 210 (  0) 0) |
| [8] |
赵志强, 牛军峰, 全燮. 氯代有机化合物污染土壤的修复技术[J]. 土壤, 2000, 32(6): 288–293, 309 DOI:10.3321/j.issn:0253-9829.2000.06.002 (  0) 0) |
| [9] |
张碧波, 王贤芳, 冉启洋, 等. 9种植物及其8种组合对五氯酚污染土壤的修复效果[J]. 湖南农业科学, 2020(1): 33-38 (  0) 0) |
| [10] |
Liu H, Weisman D, Ye Y B, et al. An oxidative stress response to polycyclic aromatic hydrocarbon exposure is rapid and complex in Arabidopsis thaliana[J]. Plant Science, 2009, 176(3): 375-382 DOI:10.1016/j.plantsci.2008.12.002 (  0) 0) |
| [11] |
Zhao L Y, Zhu C, Gao C X, et al. Phytoremediation of pentachlorophenol-contaminated sediments by aquatic macrophytes[J]. Environmental Earth Sciences, 2011, 64(2): 581-588 DOI:10.1007/s12665-011-1164-z (  0) 0) |
| [12] |
熊珺, 高创新, 袁恒, 等. 水葱对五氯酚污染土壤植物修复的初步研究[J]. 农业环境科学学报, 2006, 25(6): 1493-1497 DOI:10.3321/j.issn:1672-2043.2006.06.020 (  0) 0) |
| [13] |
彭熙. 血吸虫病疫区典型杀螺剂的检测方法与植物修复研究[D]. 长沙: 湖南农业大学, 2014.
(  0) 0) |
| [14] |
Wiltse C C, Rooney W L, Chen Z, et al. Greenhouse evaluation of agronomic and crude oil-phytoremediation potential among alfalfa genotypes[J]. Journal of Environmental Quality, 1998, 27(1): 169-173 (  0) 0) |
| [15] |
Peng S, Tang Q, Zou Y. Current status and challenges of rice production in China[J]. Plant Production Science, 2008, 12(1): 3-8 (  0) 0) |
| [16] |
王诗生, 杨兴伦, 王芳, 等. 长期不同施肥土壤中残留五氯酚在水稻中的富集特征[J]. 中国环境科学, 2008, 28(11): 1020-1025 DOI:10.3321/j.issn:1000-6923.2008.11.012 (  0) 0) |
| [17] |
冯佳胤. 水稻根系微生物组装配对林丹污染胁迫的响应研究[D]. 杭州: 浙江大学, 2020.
(  0) 0) |
| [18] |
徐艳. 厌氧条件下五氯酚还原脱氯动力学及其化学—微生物学耦合调控机制[D]. 杭州: 浙江大学, 2015.
(  0) 0) |
| [19] |
何正和, 魏云计, 朱臻怡, 等. 气相色谱-串联质谱法测定饲料中五氯酚及其钠盐的研究[J]. 饲料研究, 2021, 44(14): 120-122 (  0) 0) |
| [20] |
Zhang Y, Luo X J, Mo L, et al. Bioaccumulation and translocation of polyhalogenated compounds in rice (Oryza sativa L.) planted in paddy soil collected from an electronic waste recycling site, South China[J]. Chemosphere, 2015, 137: 25-32 DOI:10.1016/j.chemosphere.2015.04.029 (  0) 0) |
| [21] |
Li K L, Chen J, Zhu L Z. The phytotoxicities of decabromodiphenyl ether (BDE-209) to different rice cultivars (Oryza sativa L.)[J]. Environmental Pollution, 2018, 235: 692-699 DOI:10.1016/j.envpol.2017.12.079 (  0) 0) |
| [22] |
Trapp S, Cammarano A, Capri E, et al. Diffusion of PAH in potato and carrot slices and application for a potato model[J]. Environmental Science & Technology, 2007, 41(9): 3103-3108 (  0) 0) |
| [23] |
Jia J P, Bi C J, Zhang J F, et al. Atmospheric deposition and vegetable uptake of polycyclic aromatic hydrocarbons (PAHs) based on experimental and computational simulations[J]. Atmospheric Environment, 2019, 204: 135-141 DOI:10.1016/j.atmosenv.2019.02.030 (  0) 0) |
| [24] |
Huang H L, Zhang S Z, Christie P, et al. Behavior of decabromodiphenyl ether (BDE-209) in the soil-plant system: Uptake, translocation, and metabolism in plants and dissipation in soil[J]. Environmental Science & Technology, 2010, 44(2): 663-667 (  0) 0) |
| [25] |
Huang H L, Zhang S Z, Christie P. Plant uptake and dissipation of PBDEs in the soils of electronic waste recycling sites[J]. Environmental Pollution, 2011, 159(1): 238-243 DOI:10.1016/j.envpol.2010.08.034 (  0) 0) |
| [26] |
Wang S, Zhang S Z, Huang H L, et al. Behavior of decabromodiphenyl ether (BDE-209) in soil: Effects of rhizosphere and mycorrhizal colonization of ryegrass roots[J]. Environmental Pollution, 2011, 159(3): 749-753 DOI:10.1016/j.envpol.2010.11.035 (  0) 0) |
| [27] |
Zhao M M, Zhang S Z, Wang S, et al. Uptake, translocation, and debromination of polybrominated diphenyl ethers in maize[J]. Journal of Environmental Sciences, 2012, 24(3): 402-409 DOI:10.1016/S1001-0742(11)60748-1 (  0) 0) |
| [28] |
Adrian L, Hansen S K, Fung J M, et al. Growth of Dehalococcoides strains with chlorophenols as electron acceptors[J]. Environmental Science & Technology, 2007, 41(7): 2318-2323 (  0) 0) |
| [29] |
Fricker A D, LaRoe S L, Shea M E, et al. Dehalococcoides mccartyi strain JNA dechlorinates multiple chlorinated phenols including pentachlorophenol and harbors at least 19 reductive dehalogenase homologous genes[J]. Environ mental Science & Technology, 2014, 48(24): 14300-14308 (  0) 0) |
| [30] |
Reddy G B, Gold M H. Degradation of pentachlorophenol by Phanerochaete chrysosporium: Intermediates and reactions involved[J]. Microbiology, 2000, 146(Pt 2): 405-413 (  0) 0) |
| [31] |
孙世英, 陈元彩. 五氯酚在微氧条件下微生物降解途径的研究[J]. 造纸科学与技术, 2013, 32(6): 86-90 (  0) 0) |
| [32] |
Samokyszyn V M, Freeman J P, Maddipati K R, et al. Peroxidase-catalyzed oxidation of pentachlorophenol[J]. Chemical Research in Toxicology, 1995, 8(3): 349-355 DOI:10.1021/tx00045a005 (  0) 0) |
| [33] |
Kazunga C, Aitken M D, Gold A. Primary product of the horseradish peroxidase-catalyzed oxidation of pentachlorophenol[J]. Environmental Science & Technology, 1999, 33(9): 1408-1412 (  0) 0) |
 2024, Vol. 56
2024, Vol. 56


