2. 中国地质调查局昆明自然资源综合调查中心, 昆明 650111
镉(Cd)被列为全球关注的重金属污染物之一,工矿业、农业等人为活动产生的Cd污染物,会通过各种途径进入到农田土壤中,导致严重的农田土壤Cd污染[1-2]。进入农田土壤的Cd主要积累在表层,容易被作物吸收[3],并会在降雨条件下,随着地表径流和壤中流流失,成为污染农田土壤Cd向周边环境迁移的主要方式之一[4]。
丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)在自然环境中种类繁多、分布广泛,可侵染陆地生态系统90% 的高等植物根系,形成互利共生体,即使在严重重金属污染的土壤中,AMF仍普遍存在[5]。且在农业生产中AMF可以共生定殖于作物根部,AMF侵染植物根系后,减轻了重金属对植物体的毒害,植物在重金属污染土壤中的耐受能力显著提高,对于协助农作物抵御重金属污染与环境胁迫有重要作用[6]。这使得AMF在土壤中重金属的迁移、转化、固定方面发挥重要作用,所以研究AMF对植物Cd含量与土壤重金属迁移的影响具有重要意义。
施用苯菌灵是目前AMF原位试验中最常用的灭菌方法。在我国AMF的研究中,也有学者将该法用于室内盆栽试验以获得低AMF处理[7]。在抑制AMF试验中,苯菌灵被认为是最好的杀菌剂,因为它能有效减少AMF的侵染[8-9],并对植物和其他非目标生物的副作用最小[10]。O’Connor等[11]报道,反复施用苯菌灵只会稍微增加土壤毒性;Kahiluoto等[12]也通过试验证明,施用苯菌灵不会产生植物毒素。
目前对于重金属污染条件下AMF对植物生长影响作用的研究较多,而对于菌根共生体及菌根际对重金属迁移转化及植物吸收方面发挥的功能报道较少。在室内条件下,通过高温、γ射线等方法对土壤进行灭菌,很容易建立无AMF的对照,以此为对照进行AMF的生态功能研究[13]。但野外难以获得无AMF的处理,所以研究人员利用苯菌灵等特定杀真菌剂,特异性地抑制野外土著AMF生长,成功获得低AMF的处理,并对植物和其他非目标生物的副作用小[12]。因此,广泛采用苯菌灵抑制土著AMF的方法,以研究不同生态系统中土著AMF的生态功能。但野外不可控因素过多,所以以原状土壤为对照,采用施杀真菌剂抑制土著AMF的试验方法进行室内模拟试验,分析部分抑制土著AMF后,植物生长生理的变化、植物Cd累积和土壤Cd迁移,可间接反映土著AMF的生态功能,初步获悉土著AMF在土壤-植物系统Cd迁移中的作用。
云南兰坪超大型铅锌多金属矿床是我国最重要的铅锌矿产集中开发区之一,探明金属储量1 547.61万吨,矿区面积超过6.9 km2,是全球最大的铅锌矿之一[14]。该矿区大规模露天开采与冶炼历史超过50年,矿石中的重金属大量扩散到周边,导致矿区农田严重的Cd污染[15],雨季污染农田土壤Cd流失严重。此外,玉米是矿区周边的主栽作物,它是典型的AMF作物。但矿区周边农田土著AMF对土壤-玉米系统Cd环境迁移行为的影响如何,尚不清楚。
因此,以云南兰坪铅锌矿周边农田重金属污染土壤为培养基质,选择广谱内吸性苯并咪唑类杀真菌剂——苯菌灵(Benomyl)抑制AMF,开展室内试验,定期连续施用苯菌灵,测定AMF相关指标,玉米的生物量、叶绿素含量、养分含量、Cd含量与累积量以及土壤速效养分、重金属流失量等指标,研究施用苯菌灵抑制AMF对玉米生长与土壤Cd迁移的影响,探讨AMF对土壤-作物系统重金属环境迁移行为影响的生态功能,为进一步发挥AMF在土壤重金属污染治理中的作用提供科学依据。
1 材料与方法 1.1 供试土壤与植物供试土壤取自云南省兰坪县新井村铅锌矿周边Cd、Pb污染农田(26°34′N、103°38′E),海拔2 150 m,距离矿山15 km。属南温带季风性气候,干湿季节明显。年平均气温12.6 ℃,年平均降水量1 015.5 mm,降雨主要集中在5—8月,无霜期202 d,该矿床规模为特大型,是中国最大的铅锌矿,矿区集采、选、冶及辅助设施为一体,工业三废排放严重,周边农田土壤污染加剧,重金属富集。基本理化性质为:土壤pH为6.25,有机质含量34.56 g/kg,全氮、全磷、全钾含量分别为1.16、0.42、9.58 g/kg,碱解氮、有效磷、速效钾的含量分别为205.41、62.92、167.54 mg/kg。土壤Cd、Pb全量分别为2.62、76.78 mg/kg。
供试植物为玉米(Zea mays L.),品种为会单四号,种子由昆明市小板桥种子市场购得,挑选大小一致且籽粒饱满的种子播种。用10% H2O2进行表面处理,再用蒸馏水冲洗3次后,于25 ℃恒温培养箱中催芽3 d后播种。苯菌灵产自江苏蓝丰生物化工股份有限公司,Cd、Pb均未检出。
1.2 试验处理试验设置不施苯菌灵抑制AMF处理(CK)和施苯菌灵抑制AMF处理(Benomyl),每个处理均设4个重复,播种玉米种子2颗。玉米出芽后7 d开始施苯菌灵,每7 d浇灌一次苯菌灵溶液,投加量0.04 g/kg,试验周期45 d;CK处理浇灌同等体积的蒸馏水代替。试验期间采用自然光照,不施肥,各盆栽按照70% 的田间持水量添加去离子水,种植过程中采用称重法补充水分,使土壤水分维持在田间持水量的70% 左右。
试验于云南农业大学后山试验大棚中开展,供试土壤研磨至过2 mm筛后分层填入试验装置。试验装置为高50 cm、直径11 cm、底端设出水阀的PVC管,按照10、20和30 cm土壤深度设置壤中流取样点,壤中流采用0.25 μm陶瓷滤管(RHIZON MOM 19.21.21F,Rhizosphere research products)负压抽取。
1.3 采样与测定方法玉米生长45 d后采样。取25 g土反复冲洗过筛,取400目上残留物置于100 mL离心管,加入50% 的蔗糖溶液摇匀后离心,于显微镜下观测孢子数;取洗净的根部剪切至1 cm左右小段,10% KOH 90 ℃加温1 h软化后,以乳酸甘油蓝墨水染色,再以乳酸甘油脱色后制片,于显微镜下观察,计算侵染率及侵染强度;取1 g土于离心管,加8 mL柠檬酸钠溶液,高温高压1 h后加考马斯亮蓝显色,与牛血清蛋白比色测得易提取土壤球囊霉素相关蛋白(EE-GRSP);取1 g土,加8 mL柠檬酸钠溶液后高温高压1 h,并重复上述步骤5 ~ 6次后加考马斯亮蓝显色,与牛血清蛋白比色测得总土壤球囊霉素相关蛋白(T-GRSP)[16]。
玉米植株样品105 ℃杀青、75 ℃烘干后分为地上部和根部称量干重;养分含量测定的样品采用H2SO4-H2O2消煮,全氮的测定采用加奈氏试剂比色法,全磷的测定采用钼锑抗试剂比色法,全钾以火焰分光光度计测定;玉米Cd含量采用HNO3-HClO4消煮,火焰原子吸收分光光度法测定[17];叶片叶绿素a、叶绿素b含量采用80% 丙酮提取,分光光度法测定[18]。
土壤碱解氮的测定采用碱解扩散法;土壤有效磷的测定采用碳酸氢钠提取法;土壤速效钾的测定采用醋酸铵提取法;土壤Cd全量采用王水-高氯酸消解,火焰原子吸收分光光度法测定。
试验收集了2次10、20和30 cm壤中流与40 cm淋溶液。搅拌均匀的水样采用HNO3-H2O2消解,采用石墨炉测定Cd浓度。
1.4 数据处理与统计分析试验数据应用Excel进行处理,采用SPSS 23.0进行统计分析,LSD法检验处理间在P < 0.05水平的显著性差异。
2 结果与分析 2.1 施苯菌灵对AMF侵染的影响施苯菌灵能够有效抑制土壤AMF的生长,玉米根部侵染率降低8.57%,根际土壤中孢子数下降29%,总土壤球囊霉素相关蛋白和易提取土壤球囊霉素相关蛋白含量分别降低18.4% 和18.9%(表 1)。
|
|
表 1 玉米根系AMF侵染率、根际孢子数与球囊霉素相关蛋白含量 Table 1 Infection rate of AMF, number of spores in rhizosphere and content of glomalin-related protein (GRSP) in maize roots |
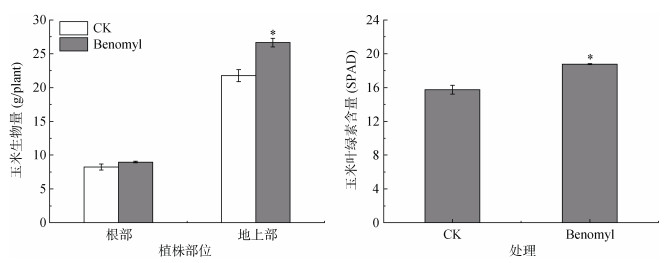
与CK相比,施苯菌灵处理,玉米叶片叶绿素含量增加19.21%,地上部生物量增加22.54%,根系生物量没有显著变化(图 1)。可见,施苯菌灵促进了玉米的生长。
|
(*表示处理间差异达P < 0.05显著水平,下同) 图 1 玉米生物量和叶绿素含量 Fig. 1 Corn biomass and chlorophyll content |
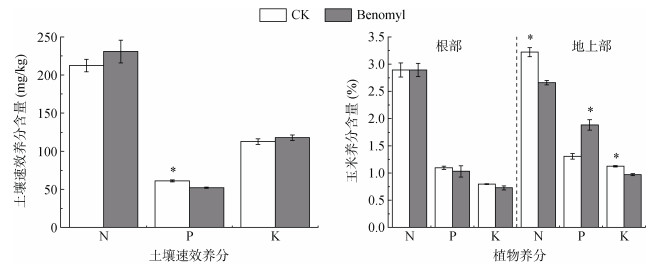
施苯菌灵处理土壤有效磷含量降低17.19%,土壤碱解氮、速效钾没有显著变化(图 2);玉米地上部全氮和全钾含量分别降低17.39% 和13.65%,全磷含量增加44.13%,根部养分含量没有显著变化(图 2)。
|
图 2 土壤速效养分和植物养分含量 Fig. 2 Soil available nutrients and plant nutrient contents |
施苯菌灵处理玉米根部和地上部Cd含量显著增加,增幅分别为37.57% 和141.49%;地上部Cd累积量增加120.31%,根部Cd累积量没有显著变化(表 2)。可见,施苯菌灵导致Cd向玉米地上部迁移。
|
|
表 2 玉米Cd含量与累积量 Table 2 Cd content and accumulation in corn |
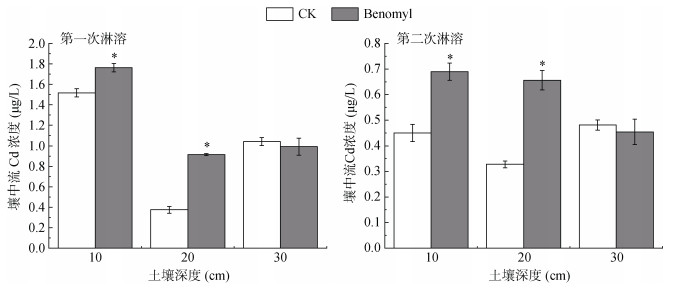
本次试验共收集了两次壤中流(10、20和30 cm),施苯菌灵处理两次10 cm和20 cm壤中流Cd浓度均显著上升,增幅为16.32% ~ 144.77%,并且两次20 cm壤中流Cd浓度增幅均大于10 cm壤中流Cd浓度;30 cm壤中流Cd浓度均没有显著变化(图 3)。可见,施苯菌灵会导致10 cm和20 cm壤中流Cd浓度增加。
|
图 3 土壤壤中流Cd浓度 Fig. 3 Cd concentration in soil subsurface flow |
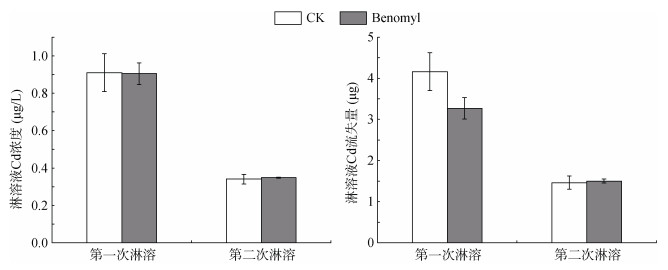
施苯菌灵抑制AMF对土壤淋溶液Cd流失浓度和流失量无显著影响(图 4)。
|
图 4 土壤淋溶液Cd浓度与流失量 Fig. 4 Cd concentration and loss in soil leaching solution |
相关分析发现,土壤球囊霉素相关蛋白(GRSP)含量与玉米地上部Cd累积量呈极显著负相关(P < 0.01),与根部Cd累积量呈显著负相关(P < 0.05)(表 3)。表明AMF菌丝分泌的GRSP有助于抑制Cd向玉米地上部转移。此外,土壤GRSP与10 cm和20 cm壤中流Cd流失浓度呈极显著负相关(P < 0.01)。表明AMF菌丝分泌的GRSP与土壤Cd流失关系密切。
|
|
表 3 AMF相关指标与玉米Cd累积量、土壤壤中流Cd浓度及流失量的相关性 Table 3 Correlation coefficients between AMF related indicators with Cd accumulation in maize, Cd concentration in soil subsurface flow and Cd loss |
矿区大规模露天开采与冶炼,矿石中的重金属大量扩散到周边,导致矿区农田严重的Cd污染[19]。进入农田土壤的Cd主要积累在表层,容易被作物吸收,并会在降雨条件下,随着地表径流和壤中流流失[20],成为污染农田土壤Cd向周边环境迁移的主要方式之一。普遍存在于污染农田土壤的AMF,会显著影响土壤-作物系统重金属的迁移行为[21]。
在重金属污染土壤中,为了避免Cd毒害植物,AMF能够以其庞大的菌丝体网络和丛枝状结构,通过螯合作用、过滤机制、固持作用等吸附固持重金属,将相当一部分重金属滞留于菌根真菌体内。菌丝还能将重金属固定在植物根部的液泡或细胞壁中,减少重金属向地上部转移[22]。真菌丛枝和细胞间菌丝具有高Cd积累,Cd主要保留在真菌结构中,并限制其向植物细胞的传递[23]。此外,AMF的菌丝分泌物能螯合重金属,降低植物对Cd的吸收累积。AMF菌丝分解后产生分泌物球囊霉素土壤相关蛋白(GRSP)可以增强土壤稳定性,改善土壤质量,与重金属有较强的结合能力。GRSP通过结合–转化作用将重金属沉淀在土壤,降低土壤中重金属的有效态,减少植物对重金属的吸收。根内AMF还会增强根系等酶的活性,提高果胶、纤维素和木质素等多糖组分含量,从而促进作物根系滞留重金属离子,抑制重金属向作物地上部转移[24]。本研究发现,AMF菌丝分泌的GRSP与玉米地上部Cd累积量呈极显著负相关,与根部Cd累积量呈显著负相关,施苯菌灵抑制土著AMF导致玉米地上部Cd吸收量增加,也间接证实AMF有助于作物根系固持Cd离子。
AMF通过根外菌丝还有助于减少污染元素随水体的流失[25]。之前的报道大多集中在AMF减少土壤N、P等矿质养分的淋溶流失[26],但也有研究发现AMF可以减少污染土壤Cd离子的流失。本研究发现,AMF菌丝分泌的GRSP与10 cm和20 cm壤中流Cd流失浓度呈极显著负相关,施苯菌灵抑制AMF会增加壤中流Cd的流失,也间接证明了AMF具有减少土壤Cd流失浓度的生态功能。
施苯菌灵抑制AMF减小了AMF对Cd的作用,迫使植株依靠自身抵御Cd胁迫,植物生长离不开N,而Cd的固定很大程度依赖P的作用,致使玉米叶片更高的N、P累积,本研究中玉米地上部P含量较高也可能是此原因;K对植株体内的部分酶可以起到激活作用,同时参与合成蛋白质、输送叶片糖分以及提高植株抗逆性,但由于K主要是通过扩散向根际运动,其中扩散效率低,不利于植物吸收利用,而AMF可以在根系周边形成菌根际,扩大根的吸收面积,也可以促进根系低分子量有机酸的分泌,有效提高植物吸收土壤中难溶性K[27]。本研究中施苯菌灵抑制AMF降低了玉米地上部K含量,可能是由于施苯菌灵抑制AMF限制了菌丝的活化吸收功能,对于土壤中K的活化作用减弱,导致灭菌土壤中的速效钾降低,致使根部可吸收利用的K含量减少,而抑制AMF也限制了菌丝的分布,影响了AMF对K的吸收利用。这些改变可以协助植物抵御Cd胁迫,在较高浓度Cd污染条件下正常生长[28-29],本研究中施苯菌灵抑制AMF显著提高地上部生物量。AMF除了可以改善植物对养分的吸收,还可以影响叶绿素的合成、分泌促进植物生长的物质。本研究中叶绿素含量的提高也证明菌根的作用。
土著AMF调控污染土壤物质迁移的效应仍存在一定争议,也有AMF对土壤污染物质迁移影响很小和无影响的报道,甚至由于根系与AMF菌丝分泌物的作用,AMF增加土壤污染物质流失的报道。考虑到目前关于AMF影响土壤污染物质受气候条件、宿主植物种类、土壤性质等诸多因素的影响,本研究在室内受控条件下开展苯菌灵抑制AMF试验,研究大田土著AMF对土壤污染物质流失的影响,但该方法忽略了土壤中除AMF外的其他土著微生物作用。因此,未来还需通过室内模拟与野外试验相结合的研究,以更好地阐明AMF在调控土壤物质迁移方面的生态效应与作用机制。
4 结论1) 施苯菌灵抑制AMF显著增加玉米地上部的Cd含量和累积量。
2) 施苯菌灵抑制AMF显著增加土壤壤中流Cd的流失浓度。
3) 土壤GRSP含量与玉米地上部Cd累积量呈极显著负相关,并且与土壤淋溶液Cd的流失浓度也呈极显著负相关,表明AMF菌丝分泌的GRSP与土壤Cd迁移关系密切。
综上所述,土壤土著AMF能够减少污染土壤–作物系统Cd的环境迁移。
| [1] |
陈能场, 郑煜基, 何晓峰, 等. 《全国土壤污染状况调查公报》探析[J]. 农业环境科学学报, 2017, 36(9): 1689-1692 (  0) 0) |
| [2] |
章海波, 骆永明, 李远, 等. 中国土壤环境质量标准中重金属指标的筛选研究[J]. 土壤学报, 2014, 51(3): 429-438 (  0) 0) |
| [3] |
Wu X S, Cai Q Y, Xu Q, et al. Wheat (Triticum aestivum L.) grains uptake of lead (Pb), transfer factors and prediction models for various types of soils from China[J]. Ecotoxicology and Environmental Safety, 2020, 206: 111387 DOI:10.1016/j.ecoenv.2020.111387 (  0) 0) |
| [4] |
Wei, Liu, Routh, et al. Release of heavy metals and metalloids from two contaminated soils to surface runoff in southern China: A simulated-rainfall experiment[J]. Water, 2019, 11(7): 1339 DOI:10.3390/w11071339 (  0) 0) |
| [5] |
余春瑰, 张世熔, 姚苹, 等. 四种生物质材料水浸提液淋洗镉污染土壤及其废水处理研究[J]. 土壤, 2015, 47(6): 1132-1138 (  0) 0) |
| [6] |
宋福强, 王立, 马放 . 丛枝菌根真菌-紫穗槐共生体系的研究[M].
科学出版社, 北京, 2013
(  0) 0) |
| [7] |
张璐, 张倩, 叶宝兴. 盐胁迫下丛枝菌根真菌(AMF)对紫花苜蓿生长的影响[J]. 山东农业科学, 2010, 42(3): 32-37 DOI:10.3969/j.issn.1001-4942.2010.03.009 (  0) 0) |
| [8] |
Pimienta-Barrios E, Gonzalez del Castillo-Aranda M E, Munoz-Urias A, et al. Effects of benomyl and drought on the mycorrhizal development and daily net CO2 uptake of a wild platyopuntia in a rocky semi-arid environment[J]. Annals of Botany, 2003, 92(2): 239-245 DOI:10.1093/aob/mcg133 (  0) 0) |
| [9] |
Zhang Q, Zhang L, Weiner J, et al. Arbuscular mycorrhizal fungi alter plant allometry and biomass-density relationships[J]. Annals of Botany, 2011, 107(3): 407-413 DOI:10.1093/aob/mcq249 (  0) 0) |
| [10] |
Fitter A H, Nichols R. The use of benomyl to control infection by vesicular–arbuscular mycorrhizal fungi[J]. New Phytologist, 1988, 110(2): 201-206 DOI:10.1111/j.1469-8137.1988.tb00253.x (  0) 0) |
| [11] |
O'Connor P, Manjarrez M, Smith S E. The fate and efficacy of benomyl applied to field soils to suppress activity of arbuscular mycorrhizal fungi[J]. Canadian Journal of Microbiology, 2009, 55(7): 901-904 DOI:10.1139/W09-035 (  0) 0) |
| [12] |
Kahiluoto H, Ketoja E, Vestberg M. Creation of a non- mycorrhizal control for a bioassay of AM effectiveness[J]. Mycorrhiza, 2000, 9(5): 241-258 DOI:10.1007/PL00009989 (  0) 0) |
| [13] |
Ferlian O, Biere A, Bonfante P, et al. Growing research networks on mycorrhizae for mutual benefits[J]. Trends in Plant Science, 2018, 23(11): 975-984 DOI:10.1016/j.tplants.2018.08.008 (  0) 0) |
| [14] |
Leach D L, Song Y C, Hou Z Q. The world-class Jinding Zn–Pb deposit: Ore Formation in an evaporite dome, Lanping Basin, Yunnan, China[J]. Mineralium Deposita, 2017, 52(3): 281-296 DOI:10.1007/s00126-016-0668-6 (  0) 0) |
| [15] |
Zhan F D, Zeng W Z, Yuan X C, et al. Field experiment on the effects of sepiolite and biochar on the remediation of Cd- and Pb-polluted farmlands around a Pb-Zn Mine in Yunnan Province, China[J]. Environmental Science and Pollution Research International, 2019, 26(8): 7743-7751 DOI:10.1007/s11356-018-04079-w (  0) 0) |
| [16] |
Mukerji K G, Manoharachary C, Chamola B P. Techniques in Mycorrhizal Studies[M]. Dordrecht: Springer Netherlands, 2002.
(  0) 0) |
| [17] |
鲍士旦. 土壤农化分析(3版)[M].
中国农业出版社, 北京, 2000
(  0) 0) |
| [18] |
王学奎. 植物生理生化实验原理和技术(2版)[M].
高等教育出版社, 北京, 2006
(  0) 0) |
| [19] |
Wu J, Long J, Liu L, et al. Risk assessment and source identification of toxic metals in the agricultural soil around a Pb/Zn mining and sSmelting area in Southwest China[J]. International Journal of Environmental Research and Public Health, 2018, 15(9): 1838-1838 DOI:10.3390/ijerph15091838 (  0) 0) |
| [20] |
Lee H, Lee Y. Environmental pollution from heavy metals in soil and stream near an abandoned mine in Korea[J]. Toxicology and Environmental Health Sciences, 2020, 12(2): 137-148 DOI:10.1007/s13530-020-00050-w (  0) 0) |
| [21] |
He Y M, Yang R, Lei G, et al. Arbuscular mycorrhizal fungi reduce cadmium leaching from polluted soils under simulated heavy rainfall[J]. Environmental Pollution, 2020, 263: 114406 DOI:10.1016/j.envpol.2020.114406 (  0) 0) |
| [22] |
滕秋梅, 张中峰, 李红艳, 等. 丛枝菌根真菌对镉胁迫下芦竹生长、光合特性和矿质营养的影响[J]. 土壤, 2020, 52(6): 1212-1221 (  0) 0) |
| [23] |
Chen H P, Yang X P, Wang P, et al. Dietary cadmium intake from rice and vegetables and potential health risk: A case study in Xiangtan, Southern China[J]. Science of the Total Environment, 2018, 639: 271-277 DOI:10.1016/j.scitotenv.2018.05.050 (  0) 0) |
| [24] |
Gao M Y, Chen X W, Huang W X, et al. Cell wall modification induced by an arbuscular mycorrhizal fungus enhanced cadmium fixation in rice root[J]. Journal of Hazardous Materials, 2021, 416: 125894 DOI:10.1016/j.jhazmat.2021.125894 (  0) 0) |
| [25] |
Parihar M, Meena V S, Mishra P K, et al. Arbuscular mycorrhiza: A viable strategy for soil nutrient loss reduction[J]. Archives of Microbiology, 2019, 201(6): 723-735 DOI:10.1007/s00203-019-01653-9 (  0) 0) |
| [26] |
Duffková R, Fučík P, Jurkovská L, et al. Experimental evaluation of the potential of arbuscular mycorrhiza to modify nutrient leaching in three arable soils located on one slope[J]. Applied Soil Ecology, 2019, 143: 116-125 DOI:10.1016/j.apsoil.2019.06.001 (  0) 0) |
| [27] |
张亮, 袁玲, 黄建国. 自生固氮菌对土壤钾的活化作用[J]. 土壤学报, 2015, 52(2): 399-405 (  0) 0) |
| [28] |
Chauhan A, Kumar V. Effect of graded levels of nitrogen and VAM on growth and flowering in Calendula (Calendula officinalis linn.)[J]. Journal of Ornamental Horticulture, 2007, 10: 61-63 (  0) 0) |
| [29] |
Zaller J G, Saccani F, Frank T. Effects of earthworms and mycorrhizal fungi on the growth of the medicinal herb Calendula officinalis (Asteraceae)[J]. Plant, Soil and Environment, 2011, 57(11): 499-504 DOI:10.17221/189/2011-PSE (  0) 0) |
2. Kunming Natural Resources Comprehensive Survey Center, China Geological Survey, Kunming 650111, China
 2024, Vol. 56
2024, Vol. 56


