2. 中国科学院大学, 北京 100049;
3. 江苏省淡水水产研究所, 南京 210017
河蟹学名中华绒螯蟹(Eriocheir sinesis),又称螃蟹、大闸蟹,是我国重要的特色淡水养殖品种之一。自20世纪80年代初开始进行人工养殖以来,养殖规模不断扩大。目前,长江中下游地区是河蟹养殖的优势主产区,其中江苏省河蟹产量占全国总产量的1/2以上[1]。河蟹养殖产业的发展迅猛,在带来巨大经济价值的同时,也带来了潜在的环境影响,如养殖过程中产生的残饵、粪便等有机物,以及渔药、水体消毒剂、微生态制剂等投入品的使用对底层沉积物和微生物群落产生的影响[2-4]。大量投入品和过量养分的输入沉降于养殖池塘底部,容易造成养殖系统呈现高营养负荷和低溶氧的特征[5-6]。河蟹作为底栖生物,长期生活于水中,当生长环境不稳定或遭到破坏,容易导致病害爆发,造成大量经济损失。池塘底泥不仅是各种化学物质与营养盐的循环场所,同时也是微生物、底栖动物和植物的生存场所[7]底泥微生物群落作为养殖生态系统的重要组成部分,不仅是评价养殖环境状况的重要生态学指标,而且在促进底泥有机质分解、营养盐释放和保持良好水质等方面也具有重要意义[8]。目前对于河蟹养殖环境的研究主要集中于不同养殖模式和投喂方式等对水环境的影响[9-12]。
本试验以江苏省镇江市扬中地区河蟹养殖池塘为研究对象,采集健康和患病区域的池塘底泥为研究样本,对其微生物群落特征和主要驱动因素进行分析,探究池塘底泥关键微生物和环境因子与河蟹健康养殖之间的潜在联系,为河蟹池塘生态养殖、病害防控和养殖环境底质改良提供参考。
1 材料与方法 1.1 池塘概况与样品采集池塘底泥样品采自江苏省淡水水产研究所扬中基地(119.80° E,32.31° N),池塘呈长方形(52 m × 38.3 m),面积约2 000 m2,水深约1 m,池塘淤泥深度约30 ~ 40 cm。养殖用水取自附近的长江水源,经过滤沉淀消毒后引入养殖池塘使用。池塘养殖河蟹投放密度为18 000只/hm2,塘底栽种有伊乐藻,池塘配有纳米微孔增氧设施。养殖前期投喂河蟹配合饲料,9月底以后搭配冰鱼投喂。5—9月,每隔15 ~ 20 d使用一次水体和底泥改良剂。于2021年9月分别在4个池塘采集样品,包括2个患病池塘(disease,D)和2个健康池塘(control,C)。患病池塘在采样前期连续15 d以上均出现死蟹,采集底泥后也还存在死蟹现象,而健康池塘养殖全程均未发现死蟹现象。采取五点取样法分别采集0 ~ 5 cm和5 ~ 10 cm深度的底泥样品,然后将同一深度的5份底泥充分混匀后得到1个样品,每个池塘在不同深度分别采集3个重复,共24个样品。所有样品装入无菌自封袋后置于干冰条件下的泡沫箱中运回实验室,每个样品分为2份,其中一份经风干后用于底泥理化性质测定,另一份取鲜样装入50 mL灭菌离心管保存于–80 ℃冰箱中,用于底泥DNA的提取和后续微生物分析。
1.2 池塘底泥理化性质测定池塘底泥容重测定使用容积100 cm3的环刀收集0 ~ 5 cm和5 ~ 10 cm深度的底泥样品,在105 ℃下烘干至恒重,计算烘干后质量占烘干前体积的比值。底泥pH的测定采用电位法[13];碳酸钙(CaCO3)测定采用气量法[14];水溶性盐总量采用水土质量比5∶1制备浸提液,以残渣烘干–质量法测定[15];有机质(OM)采用重铬酸钾氧化–浓硫酸外加热法测定[16],通过转换系数1.724计算有机质;全氮(TN)采用凯氏法测定[17];全磷(TP)[18]和全钾(TK)[19]参照相关国家标准进行测定;全硫(TS)采用碱熔–离子色谱法测定[20]。
1.3 DNA提取、PCR扩增每个样品称取0.3 g,根据E.Z.N.A. soil试剂盒(Omega Bio-tek, Norcross, GA, U.S.)的说明书进行总DNA提取,DNA的浓度和纯度利用NanoDrop 2000进行检测,DNA提取的质量用1% 的琼脂糖凝胶电泳进行验证。用338F (5’-ACTCCTACGGGAGG CAGCAG-3’) 和806R (5’- GGACTACHVGGGTWT CTAAT-3’) 引物对细菌16S rRNA基因的V3 ~ V4可变区进行PCR扩增。PCR扩增体系(20 µL) 为:4 μL的5×FastPfu Buffer,2 μL的2.5 mmol/L dNTPs,正向引物(5 μmol/L) 0.8 μL,反向引物(5 μmol/L) 0.8 μL,0.4 μL的FastPfu Polymerase,0.2 μL的BSA,10 ng的DNA模板,用ddH2O补足至20 μL。PCR反应在ABI GeneAmp 9700 PCR仪上进行,反应条件为:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,27个循环;72 ℃总延伸10 min,最后10 ℃保存。扩增产物由上海美吉生物医药科技有限公司在Miseq PE300平台上进行高通量测序。
1.4 高通量数据分析原始测序序列使用Trimmomatic软件质控,使用FLASH软件进行拼接[21]。使用UPARSE软件根据97% 的相似度对序列进行OTU聚类,再使用UCHIME软件剔除嵌合体[22]。利用RDP classifier贝叶斯算法对97% 相似水平的OTU每条序列进行物种分类注释,比对物种分类数据库为Silva 138/16s_ bacteria (https://www.arb-silva.de/)。所有生物信息学分析使用美吉生物云平台(www.majorbio.com)的环境微生物多样性模块进行在线交互分析。
1.5 数据处理与分析采用SPSS 26.0软件对试验数据进行单因素方差分析(one-way ANOVA),结合邓肯多重检验(P < 0.05)。在进行数据处理分析时,将两个患病池塘0 ~ 5 cm和5 ~ 10 cm深度底泥的数据分别合并为D0-5和D5-10组;将两个健康池塘0 ~ 5 cm和5 ~ 10 cm深度底泥的数据分别合并为C0-5和C5-10组。此外,对患病组和健康组0 ~ 10 cm (D和C) 深度底泥的数据进行独立样本t检验。以上所有数据最终都用平均值±标准差表示。
2 结果与分析 2.1 池塘底泥理化性质由表 1可知,患病组0 ~ 5 cm底泥(D0-5) 的容重、pH和CaCO3分别为1.20 g/cm3、7.69和40.10 g/kg,均显著低于健康组同深度底泥(C0-5) (P < 0.05),而水溶性盐(1.58 g/kg) 和有机质(23.43 g/kg) 则显著高于C0-5组(P < 0.05);患病组5 ~ 10 cm底泥(D5-10) 的pH和TK分别为7.86和1.82 g/kg,显著低于健康组(C5-10) (P < 0.05),而水溶性盐总量(1.43 g/kg) 则显著高于C5-10组(P < 0.05)。在底泥同一深度,患病组和健康组的TN、TP和TS没有显著差异。如果不对底泥进行分层,从池塘底泥整体上看,患病组(D) 底泥的pH和TK分别为7.77和1.78 g/kg,显著低于健康组(C),而水溶性盐总量(1.50 g/kg) 则显著高于健康组。
|
|
表 1 池塘底泥的理化性质 Table 1 Physiochemical properties of pond sediments |
两种池塘底泥共24个样本,经双端序列质控拼接后获得优化序列1 297 003条,平均序列长度为419 bp,共得到OTU分类单元13 189个,涉及70个门、210个纲、491个目、770个科、1 395个属。随着样本数据增多,Pan/Core分析的稀释曲线趋于平缓(图 1),说明本次测序深度足够反映池塘底泥中的微生物信息。
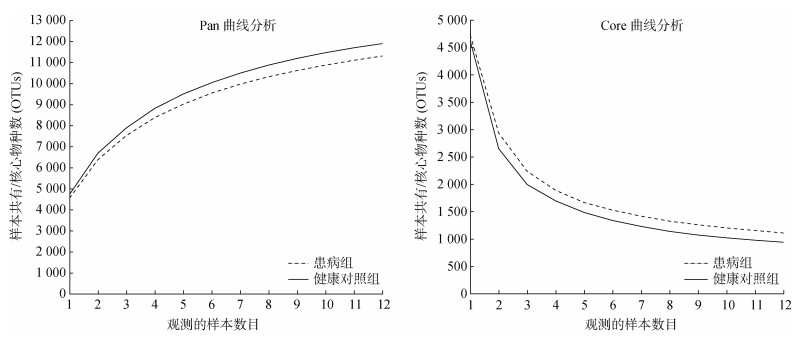
|
图 1 Pan/Core曲线分析图 Fig. 1 Curves of Pan/Core analysis |
由表 2可以看出,两组池塘底泥的微生物多样性Coverage指数均在96% 以上,表明样品测序结果合理。患病组D5-10的微生物Sobs、Shannon、ACE和Chao指数均显著高于D0-5 (P < 0.05),表明随着深度增加,患病组底泥微生物群落丰富度和多样性升高;健康组C5-10的微生物Shannon指数显著高于C0-5 (P < 0.05),表明健康组C5-10底泥微生物群落丰富度一般,但多样性较高。在0 ~ 5 cm深度底泥中,健康组和患病组各α多样性指数均无显著差异;在5 ~ 10 cm深度底泥中,患病组池塘微生物的ACE指数和Chao指数显著高于健康组(P < 0.05)。由此可知,在0 ~ 10 cm的底泥范围内,患病池塘的微生物群落丰富度和多样性随深度不同而存在显著差异,而健康池塘随深度不同仅存在群落多样性的差异。
|
|
表 2 池塘底泥微生物的α多样性 Table 2 α diversity index of microbial communities in pond sediments |
PCA结果分析(图 2)表明,不同分组底泥微生物群落结构存在显著差异(P=0.001)。其中,PC1和PC2轴分别解释了13.97% 和9.12% 的群落变异。在PC1轴中,C5-10组呈正向分布,且单独聚为一组,与其余3组存在显著差异。从数据离散分布情况来看,D0-5和D5-10有显著分离,但两者与C0-5均存在交集。
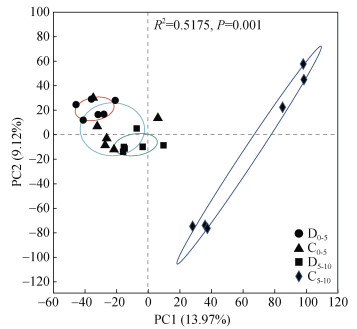
|
图 2 不同分组底泥微生物的主成分(PCA)分析 Fig. 2 PCA plot of bacterial communities in pond sediments at OTU level |
从图 3可以看出,在0 ~ 5 cm深度底泥中,健康组和患病组微生物的OTU数目分别为9 673和9 206个,共有OTU 7 657个;在5 ~ 10 cm深度底泥中,健康组和患病组微生物的OTU数目分别为9 935和10 102个,共有OTU 7 926个。
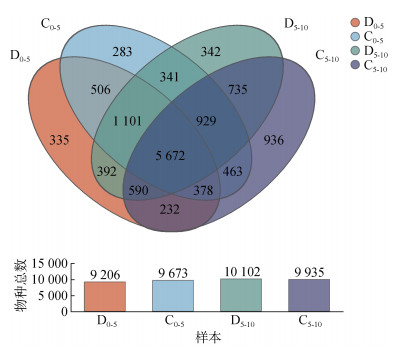
|
图 3 池塘底泥微生物基于OTU水平的Venn图 Fig. 3 Venn plot of bacterial communities in pond sediments at OTU level |
在门水平上(图 4A),健康组和患病组池塘底泥微生物中注释到的优势菌群为变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteriota),相对丰度依次为D0-5 (24.27%、14.93% 和12.32%),D5-10 (20.14%、18.01% 和11.80%),C0-5 (23.06%、14.84% 和10.27%),C5-10 (12.86%、21.45% 和12.23%)。
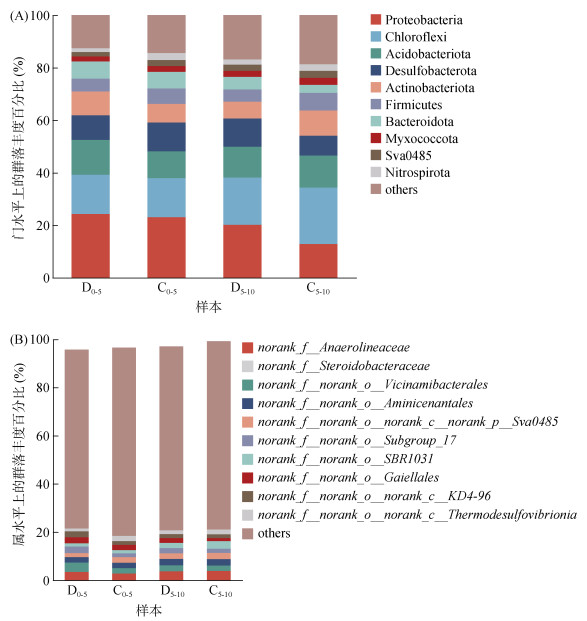
|
图 4 池塘底泥微生物在门(A)和属(B)水平的物种组成 Fig. 4 Structures of bacterial communities at phylum (A) and genus (B) levels in pond sediments |
在属水平上(图 4B),健康组和患病组池塘底泥微生物中有大量未注释到的菌种,归类为others。此外,类固醇杆菌属(norank_f__Steroidobacteraceae)为D0-5和C0-5的优势菌群,丰度分别为4.35% 和3.53%;厌氧绳菌属(norank_f__Anaerolineaceae)为D5-10和C5-10的优势菌种,丰度分别为3.65% 和3.78%。
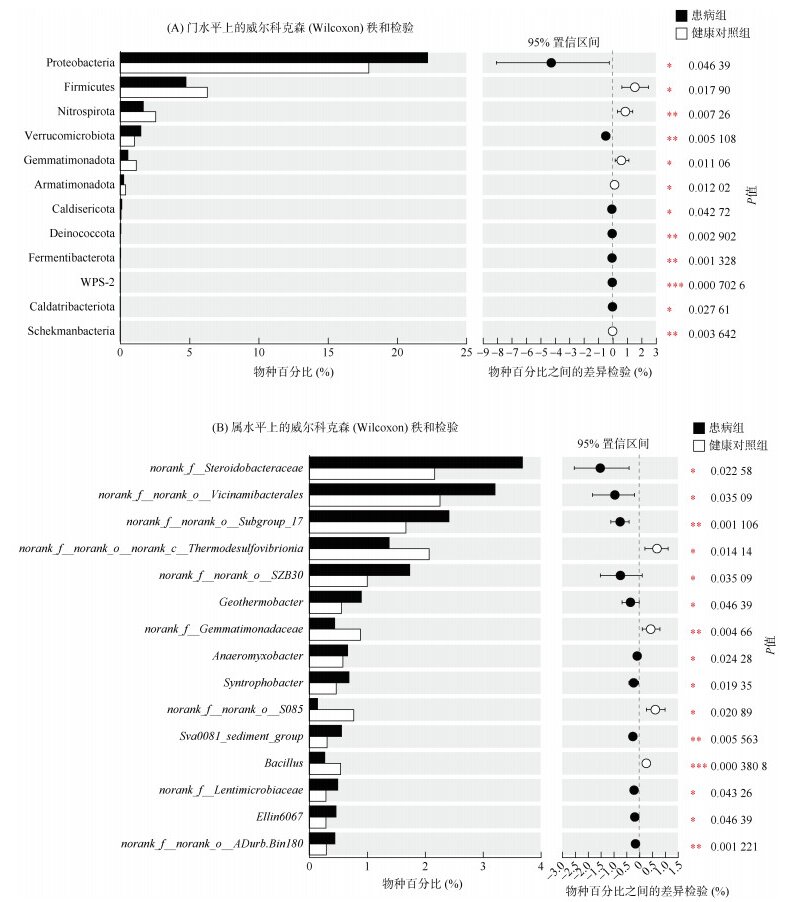
2.3.3 差异物种对患病组和健康组样本进行Wilcoxon秩和检验,筛选出丰度存在显著差异的微生物(图 5)。结果显示,在门水平上,患病组的变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobiota)、Caldisericota、Deinococcota、Fermentibacterota、WPS-2和Caldatribacteriota的丰度显著高于健康组(P < 0.05),而厚壁菌门(Firmicutes)、硝基螺旋体门(Nitrospirota)、芽单胞杆菌门(Gemmatimonadota)、装甲菌门(Armatimonadota)和谢克曼菌门(Schekmanbacteria)丰度显著低于健康组(P < 0.05)。在属水平上,患病组中norank_f__Steroidobacteraceae、Vicinamibacterales、地热杆菌属(Geothermobacter)、厌氧粘杆菌属(Anaeromyxobacter)和合成杆菌属(Syntrophobacter)的丰度显著高于健康组(P < 0.05),而norank_f__norank_ o__norank_c__Thermodesulfovibrionia、norank_f__ Gemmatimonadaceae、芽孢杆菌属(Bacillus)的丰度显著低于健康组(P < 0.05)。
|
(A:门水平;B:属水平。*、**、***分别表示差异达P < 0.05、P < 0.01、P < 0.001显著水平) 图 5 两种池塘底泥微生物差异物种分析 Fig. 5 Differential species analysis of bacterial communities at phylum (A) and genus (B) levels between the two groups |
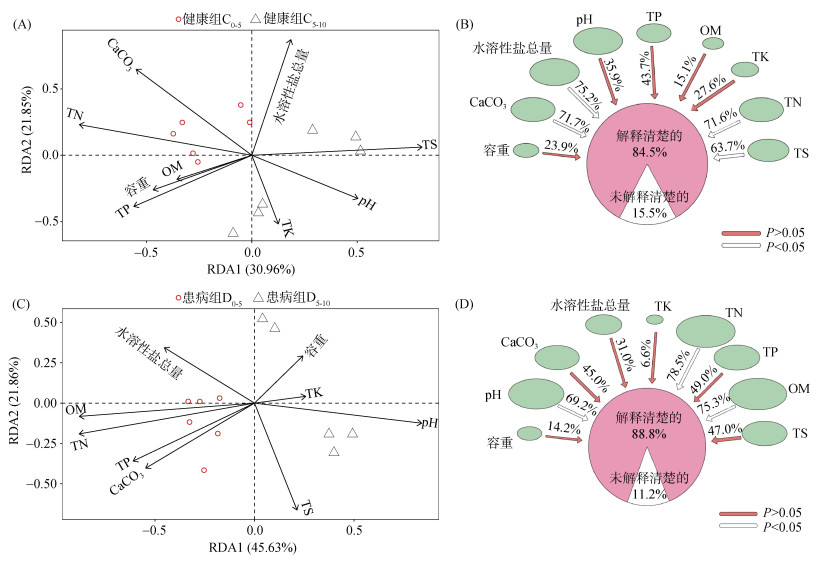
RDA分析(图 6)揭示了不同池塘中微生物组成与环境因子的相关性,采用envfit函数检验各个环境因子的显著性。健康池塘的RDA分析中,第一坐标轴和第二坐标轴共贡献解释量分别为30.96% 和21.85%(图 6A),其中,TN(P=0.007)、CaCO3(P=0.008)、水溶性盐总量(P=0.003)和TS(P=0.010)对细菌群落结构具有显著影响(图 6B)。患病池塘的RDA分析中第一坐标轴和第二坐标轴共贡献解释量分别为45.63% 和21.86%(图 6C),其中,TN(P=0.002)、OM(P=0.001) 和pH(P=0.005)对细菌群落结构具有显著影响(图 6D)。
|
图 6 健康组(A、B)和患病组(C、D)池塘底泥微生物与环境因子的RDA分析 Fig. 6 RDA analysis of bacterial communities and environmental factors of healthy (A, B) and diseased (C, D) pond sediments |
不同环境因子在健康和患病的池塘中对于细菌群落变化的解释度不一致,所有环境因子在健康和患病的池塘底泥中分别解释了84.5% 和88.8% 的细菌群落变化(图 6B、6D)。健康池塘中,TN、水溶性盐总量和CaCO3是影响细菌群落结构的主要环境因子;患病池塘中解释度较高的环境因子主要为TN、OM和pH。其中,TN与健康组和患病组底泥微生物群落结构均显著相关。
3 讨论 3.1 池塘底泥理化因子变化底泥理化因子是衡量池塘底泥质量的重要指标。过量的氮、磷会诱发水体富营养化,进而导致水质的恶化。王立鹏[23]研究发现,底泥是水体内源磷释放的主要来源,且表层底泥是短时间内影响水环境的核心区域,这也就解释了为什么患病池塘表层底泥氮磷含量显著高于深层底泥。在养殖系统中,养殖动物的粪便、残饵和死亡生物通过厌氧分解产生大量有机酸,从而降低pH[24]。患病池塘由于其大量的残饵和死亡生物导致其底泥pH显著低于健康池塘,同时较低的pH也会抑制和危害河蟹的生长和生存。由于水溶性盐总量与植物的生长密切相关,当底泥中水溶性盐总量达0.1% 时开始轻微地影响植物的生长,而患病池塘的水溶性盐总量达0.15%,底泥发生盐化现象,影响了河蟹养殖池塘中轮叶黑藻、伊乐藻等水草的生长,这可能是造成患病河蟹养殖池塘水草大量腐烂而死亡的原因之一。
3.2 池塘底泥微生物多样性与细菌群落结构组成差异本研究分析了患病池塘和健康池塘表层以及深层底泥的微生物多样性变化及群落结构组成。结果显示,在深层底泥中,患病组池塘微生物的ACE指数和Chao指数显著高于健康组,说明患病组池塘微生物丰富度更高,这可能是因为河蟹发病后的病原菌和尸体腐败衍生的细菌大量沉积在底泥中。
基于OTU水平的池塘底泥微生物PCA分析表明,各组样品的细菌群落组成存在显著差异,Venn图显示出各组样品均注释到数百个独有的OTU,进一步体现健康和患病池塘底泥微生物多样性的差异。刘志刚等[25]在尼罗罗非鱼养殖研究中发现,健康池塘底泥中位于前三的优势菌群门类为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi);患病池塘底泥中的优势菌群门类组成与健康池塘底泥完全一致,两组中均为变形菌门所占比例最大,各门类的丰度之间差异较小。本研究结果与此类似,河蟹健康组和患病组中的细菌菌群优势门类相同,排名前三的优势菌门分别为变形菌门、绿弯菌门和酸杆菌门。江玉梅等[26]研究表明,变形菌门、疣微菌门(Verrucomicrobiota)等在受污染的鄱阳湖底泥中均为优势菌群。本研究也发现患病组的变形菌门和疣微菌门的丰度均显著高于健康组。这可能是与患病河蟹大量的病原菌隶属于变形菌门有关,此外,有研究报道变形菌门中一些菌种具有脱氮除磷、降解有机质和降低化学需氧量(COD)的功能,在污染严重的废水中具有较高的丰度[27]。同时,疣微菌门的一些菌属可通过自身的氨氧化代谢途径,参与底泥中的氮循环,从而将池塘底泥中硫酸盐还原氨氧化,有助于受污染池塘底泥的修复[28-29]。
在属水平上,健康河蟹池塘的芽孢杆菌属(Bacillus)丰度显著高于患病河蟹池塘。芽孢杆菌属大多菌种含有较高的蛋白酶、脂肪酶和淀粉酶活性,对有机物质有很强的降解能力;芽孢杆菌的抗菌谱广泛,有些种类可分泌多种抗菌活性物质,对多种病原、弧菌及其他细菌的生长具有极强的抑制能力,能通过改善水体微生物群落的代谢功能从而改善水质。一些芽孢杆菌产生多种酶类和多糖,还能一定程度上促进和提高水生动物的生长和非特异性免疫[30-31]。因此,健康池塘底泥中更高丰度的芽孢杆菌可能是河蟹患病较少的主要原因之一。
3.3 两种池塘底泥微生物与环境因子的相关性池塘底泥微生物与理化因子的相关性分析结果显示,健康池塘门水平物种组成和群落结构主要受到环境因子TN、CaCO3、水溶性盐总量和TS的显著影响,而患病池塘门水平物种组成和群落结构主要受到TN、OM和pH的显著影响。在健康和患病的池塘中,两者都受到TN的影响,其中氮循环是水–泥界面的重要的元素循环之一,而微生物是这些循环的主要参与者和驱动者,因此他们与微生物群落的显著相关性毋庸置疑[32]。除此之外,患病池塘还受到自身显著变化因素的影响,包括pH、OM和TP。Amal等[33]研究表明,水温、氨氮、溶解氧、pH和透明度等水质指标的差异与罗非鱼感染无乳链球菌显著相关,同时也会对养殖水体和底泥中细菌种群产生重要影响,水产动物疾病的发生与养殖环境密切相关[34]。本研究中患病池塘pH显著低于健康池塘且与患病池塘微生物群落显著相关的研究结果与此相一致,而健康池塘微生物群落结构却不受pH影响。研究结果表明健康和患病池塘的群落结构受到不同因素驱动。
4 结论健康组和患病组河蟹养殖池塘底泥细菌菌群结构排名前三的优势菌门为变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteriota)。在属水平上,患病组的标志菌群为Steroidobacteraceae、Vicinamibacterales、地热杆菌属(Geothermobacter)、厌氧粘杆菌属(Anaeromyxobacter)和合成杆菌属(Syntrophobacter),而健康组的标志菌群为Thermodesulfovibrionia、Gemmatimonadaceae和芽孢杆菌属(Bacillus)。通过与环境因子相关性分析,健康组底泥微生物群落的主导环境因子为TN、水溶性盐、CaCO3和TS,而患病则为TN、OM和pH。本研究仅局限于河蟹养殖池塘底泥单一环境介质,后续需进一步结合水体环境进行分析,以期为河蟹养殖池塘管理及病害防控提供科学指导。
| [1] |
陈立侨, 堵南山 . 中华绒螯蟹生物学[M].
科学出版社, 北京, 2017: 158-160
(  0) 0) |
| [2] |
刘晓伟, 谢丹平, 李开明, 等. 投加生物促生剂对底泥微生物群落及氮磷的影响[J]. 中国环境科学, 2013, 33(S1): 87-92 (  0) 0) |
| [3] |
Chen L P, Zhang Y, Liu Q G, et al. Spatial variations of macrozoobenthos and sediment nutrients in Lake Yangcheng: Emphasis on effect of pen culture of Chinese mitten crab[J]. Journal of Environmental Sciences, 2015, 37: 118-129 DOI:10.1016/j.jes.2015.06.008 (  0) 0) |
| [4] |
张维娜, 高亮, 于丹, 等. 解淀粉芽孢杆菌对河蟹养殖水体中致病菌的抑制作用及对水质的调控作用[J]. 水产科技情报, 2017, 44(4): 169-172 (  0) 0) |
| [5] |
Leigh C, Hiep L H, Stewart-Koster B, et al. Concurrent rice-shrimp-crab farming systems in the Mekong Delta: Are conditions (sub) optimal for crop production and survival?[J]. Aquaculture Research, 2017, 48(10): 5251-5262 DOI:10.1111/are.13338 (  0) 0) |
| [6] |
Dien L D, Hiep L H, Van Hao N, et al. Comparing nutrient budgets in integrated rice-shrimp ponds and shrimp grow- out ponds[J]. Aquaculture, 2018, 484: 250-258 DOI:10.1016/j.aquaculture.2017.11.037 (  0) 0) |
| [7] |
路斌, 魏南, 余德光, 等. 添加硝酸钙对池塘沉积物中理化因子的影响研究[J]. 中国农学通报, 2015, 31(26): 51-55 DOI:10.11924/j.issn.1000-6850.casb15040034 (  0) 0) |
| [8] |
马英, 钱鲁闽, 王永胜. 对虾养殖池沉积物细菌的遗传多样性[J]. 海南大学学报(自然科学版), 2009, 27(4): 369-374 DOI:10.3969/j.issn.1004-1729.2009.04.013 (  0) 0) |
| [9] |
周露洪, 谷孝鸿, 曾庆飞, 等. 固城湖围垦区池塘河蟹养殖环境影响及模式优化研究[J]. 生态与农村环境学报, 2013, 29(1): 36-42 DOI:10.3969/j.issn.1673-4831.2013.01.006 (  0) 0) |
| [10] |
戴丹超, 马旭洲, 张勇, 等. 宜兴滆湖地区河蟹生态养殖池塘对水环境的影响[J]. 环境化学, 2019, 38(11): 2573-2582 (  0) 0) |
| [11] |
Sun Y F, Han W F, Liu J, et al. Bacterial community compositions of crab intestine, surrounding water, and sediment in two different feeding modes of Eriocheir sinensis[J]. Aquaculture Reports, 2020, 16: 100236 DOI:10.1016/j.aqrep.2019.100236 (  0) 0) |
| [12] |
兰艳, 俞锦辰, 刘怡琳, 等. 河蟹池塘生态养殖对水环境的影响[J]. 水产科技情报, 2021, 48(3): 166-172 (  0) 0) |
| [13] |
中华人民共和国农业部. 土壤pH的测定: NY/T 1377—2007[S]. 北京: 中国标准出版社, 2007.
(  0) 0) |
| [14] |
国家林业局. 森林土壤碳酸钙的测定: LY/T 1250—1999[S]. 北京: 中国标准出版社, 2000.
(  0) 0) |
| [15] |
中华人民共和国农业部. 土壤检测. 第16部分: 土壤水溶性盐总量的测定: NY/T 1121.16—2006[S]. 北京: 中国标准出版社, 2006.
(  0) 0) |
| [16] |
中华人民共和国农业部. 土壤检测. 第6部分: 土壤有机质的测定: NY/T 1121.6—2006[S]. 北京: 中国标准出版社, 2006.
(  0) 0) |
| [17] |
中华人民共和国环境保护部. 土壤质量–全氮的测定–凯氏法: HJ 717—2014[S]. 北京: 中国环境出版社, 2014.
(  0) 0) |
| [18] |
中华人民共和国农业部. 土壤全磷测定法: NY/T 88—1988[S]. 北京: 中国标准出版社, 1988.
(  0) 0) |
| [19] |
中华人民共和国农业部. 土壤全钾测定法: NY/T 87—1988[S]. 北京: 中国标准出版社, 1988.
(  0) 0) |
| [20] |
孙翠香, 刘婷琳, 毕鸿亮, 等. 碱熔–离子色谱法测定土壤中全硫的研究[J]. 生态环境学报, 2009, 18(5): 1980-1983 DOI:10.3969/j.issn.1674-5906.2009.05.072 (  0) 0) |
| [21] |
Martin M. Cutadapt removes adapter sequences from high- throughput sequencing reads[J]. EMBnet Journal, 2011, 17(1): 10 DOI:10.14806/ej.17.1.200 (  0) 0) |
| [22] |
Edgar R C, Haas B J, Clemente J C, et al. UCHIME improves sensitivity and speed of chimera detection[J]. Bioinformatics, 2011, 27(16): 2194-2200 DOI:10.1093/bioinformatics/btr381 (  0) 0) |
| [23] |
王立鹏. 微山湖湖东区入湖河流磷污染特征及生态控制技术研究[D]. 济南: 山东建筑大学, 2010: 37–56.
(  0) 0) |
| [24] |
王志谦, 项仁农. 河蟹病害预防应从冬季抓起[J]. 农家致富, 2006(2): 43 (  0) 0) |
| [25] |
刘志刚, 卢迈新, 可小丽, 等. 尼罗罗非鱼肠道及养殖环境中菌群结构与链球菌病的相关性[J]. 水产学报, 2018, 42(10): 1635-1647 DOI:10.11964/jfc.20170910951 (  0) 0) |
| [26] |
江玉梅, 张晨, 黄小兰, 等. 重金属污染对鄱阳湖底泥微生物群落结构的影响[J]. 中国环境科学, 2016, 36(11): 3475-3486 DOI:10.3969/j.issn.1000-6923.2016.11.034 (  0) 0) |
| [27] |
王海燕, 周岳溪, 戴欣, 等. 16SrDNA克隆文库方法分析MDAT-IAT同步脱氮除磷系统细菌多样性研究[J]. 环境科学学报, 2006, 26(6): 903-911 DOI:10.3321/j.issn:0253-2468.2006.06.006 (  0) 0) |
| [28] |
秦伟, 周鑫, 徐增洪, 等. 不同放养密度和水草覆盖率下克氏原螯虾池塘底泥中微生物群落特征[J]. 水产科学, 2015, 34(10): 621-628 (  0) 0) |
| [29] |
张肖静, 位登辉, 张红丽, 等. 城市河道底泥中微生物组成及其转化氮、硫污染物的潜力[J]. 环境污染与防治, 2022, 44(4): 425-430 (  0) 0) |
| [30] |
李卓佳, 林亮, 杨莺莺, 等. 芽孢杆菌制剂对凡纳滨对虾Litopenaeus vannamei肠道微生物群落的影响[J]. 南方水产, 2005, 1(3): 54-59 (  0) 0) |
| [31] |
Jiang L J, Zheng Y P, Peng X T, et al. Vertical distribution and diversity of sulfate-reducing prokaryotes in the Pearl River estuarine sediments, Southern China[J]. FEMS Microbiology Ecology, 2009, 70(2): 93-106 (  0) 0) |
| [32] |
张正, 廖梅杰, 李彬, 等. 两种疾病发生对养殖半滑舌鳎肠道菌群结构的影响分析[J]. 水产学报, 2014, 38(9): 1565-1572 (  0) 0) |
| [33] |
Amal M N A, Saad M Z, Zahrah A S, et al. Water quality influences the presence ofStreptococcus agalactiaein cage cultured red hybrid Tilapia, Oreochromis niloticus × Oreochromis mossambicus[J]. Aquaculture Research, 2015, 46(2): 313-323 (  0) 0) |
| [34] |
张皓. 养殖环境微生物群落的动态变化及与水环境的互作[D]. 苏州: 苏州大学, 2015.
(  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Freshwater Fisheries Research Institute of Jiangsu Province, Nanjing 210017, China
 2024, Vol. 56
2024, Vol. 56


