由土壤病原菌引起的土传病害导致农作物产量和质量下降,严重威胁农业生态环境,制约农业经济发展[1]。目前土传病害的防控手段主要包括抗病品种培育、化学防控、生物防控等[2],其中,生物防控旨在通过利用生物或其代谢产物降低病原菌的数量从而减轻其带来的危害[3]。目前生物防控因其环境友好的特点已成为防控土传病害的主要研究方向。土壤病原菌的入侵往往需要经历从土壤迁移到植物根表、进而进入植物体内增殖致病两个阶段,因此可以通过根际防控与茎部防控分别对其进行阻控。根际是防控土传病害的重要屏障,因此利用有益微生物在根际抵御病原菌的入侵至关重要[4]。目前,主要的根际生物防控包括施用生物有机肥[5]、菌剂灌根[6]等,这种防控方式操作简单,但效果也常常受到土壤环境因素的制约[7-8]。然而,一旦病原菌突破根际防线入侵到植物体内后,根际生物防控起到的作用微乎其微。此时就需要采取茎部生物防控手段,才能有效遏制病原菌在植物体内的增殖与扩散。茎部注射是茎部生物防控的常见措施,其优势在于所需的菌剂或抑菌物质用量较少[9-10]。
目前关于土传病害生物防控的研究大多聚焦于根际防控,忽视了植物体内防控的重要性。为了进一步提高生物防控的效果,本研究以病原青枯菌(Ralstonia solanacearum)引起的番茄青枯病为研究对象,根际生物防控选用以菜粕堆肥为载体、添加有益菌解淀粉芽孢杆菌(Bacillus amyloliquefaciens)QL-18的生物有机肥,其中QL-18能够通过产生次生代谢产物抑制病原青枯菌[11],茎部生物防控选用与病原青枯菌同属的非致病性有益菌皮氏罗尔斯顿菌(Ralstonia pickettii)QL-A6,其可以在植物体内大量增殖抢占生态位[12],通过温室与田间试验,考察二者联用防控番茄青枯病的效果,以为土传病害的生物防控提供新的思路。
1 材料与方法 1.1 供试材料与培养基供试番茄品种为“合作903”。
供试病原菌为青枯菌QL-Rs1115[13];供试有益菌为解淀粉芽孢杆菌QL-18[11]与皮氏罗尔斯顿菌QL- A6[12]。
病原青枯菌和有益菌皮氏罗尔斯顿菌培养时采用改良NB培养基(葡萄糖10 g/L、蛋白胨5 g/L、牛肉膏3 g/L、酵母粉0.5 g/L);筛选则采用选择性SMSA培养基[14](葡萄糖10 g/L、蛋白胨5 g/L、牛肉膏3 g/L、酵母粉0.5 g/L、琼脂2 ~ 3 g/L,冷却后加入结晶紫5 mg/L、多粘菌素100 mg/L、杆菌肽25 mg/L、氯霉素5 mg/L、青霉素5 mg/L、TTC 50 mg/L、放线菌酮100 mg/L)。
有益菌解淀粉芽孢杆菌培养时采用LB培养基(蛋白胨10 g/L、酵母粉5 g/L、氯化钠10 g/L)。芽胞杆菌属的筛选则采用半选择性V8培养基[15](V8果蔬汁340 mL/L、NaCl 33 g/L、葡萄糖0.8 g/L、琼脂2 ~ 3 g/L,冷却后加入放线菌酮45 mg/L和多粘菌素22.5 mg/L)。
生物有机肥(BOF)的制备:将解淀粉芽孢杆菌QL-18菌液按每吨50 L添加至菜粕堆肥(pH 6.75,全碳(C) 413.1 g/kg,全氮(N)86.4 g/kg,全磷(P2O5)11.5 g/kg,全钾(K2O)5.6 g/kg)进行二次发酵,发酵过程中每天翻堆1次,发酵7 d后结束,最终芽孢杆菌含量达到109 cfu/g即可。
1.2 方法 1.2.1 温室试验试验共设置4个处理:①对照:育苗基质中不添加生物有机肥且茎部注射无菌水;②茎部防控:育苗基质中不添加生物有机肥,茎部注射皮氏罗尔斯顿菌QL-A6;③根际防控:育苗基质中加入生物有机肥,茎部注射无菌水;④联合防控:育苗基质中加入生物有机肥,茎部注射皮氏罗尔斯顿菌QL-A6。
将表面灭菌的番茄种子分别在添加1%(m/m)生物有机肥或不做任何处理的育苗基质中培养。待番茄苗生长至三叶期时移栽至温室盆栽土中。温室的温度介于25 ~ 35 ℃。移栽7 d后向每株番茄植株茎部注射10 μL皮氏罗尔斯顿菌QL-A6(浓度为108 cfu/mL)或等量无菌水,8 d后采用灌根法接种病原青枯菌QL-Rs1115(每盆终浓度约为105 cfu/g干重)。每个处理3个重复,每个重复12株番茄。根据番茄植株萎蔫程度,将发病级别分为5级:植株未出现发病症状记为0,萎蔫叶片程度小于25% 记为1,介于25% ~ 50% 记为2,介于50% ~ 75% 记为3,大于75% 或整株死亡记为4。病原菌接种35 d后,发病趋于稳定,温室试验结束。记录发病阶段各处理的病情指数并计算生防率[16]:
| $ 病情指数(\%)=\frac{\sum {n}_{i}\times i}{N\times {i}_{max}}\times 100 $ | (1) |
| $ 生防率(\%)=\frac{\left(对照病情指数-处理病情指数\right)}{对照病情指数}\times 100 $ | (2) |
式中:i为发病等级代表数值,imax为发病最高等级代表值,ni为发病等级为i的株数,N为某一处理考察总株数。
每个处理分别在接种病原青枯菌后1、7、14、21、28和35 d随机选择3株番茄植株,采集根际土和植株茎部样品用于检测病原菌与有益菌的数量。
1.2.2 田间试验于2—6月和7—11月分别于江苏省南京市麒麟镇后村(118°57′E,32°03′N)番茄大棚开展春季和秋季田间试验。试验设计与温室试验一致,共设置4个处理,每个处理3个小区,每小区种植40棵番茄。根据试验设置向育苗基质中添加1%(m/m)生物有机肥。春季育苗40 d后移栽,秋季育苗30 d后移栽至。移栽20 d后在植株茎部注射10 μL QL-A6(108 cfu/mL)或无菌水,春季田间试验持续60 d,秋季持续47 d。参照温室试验的方法,统计病情指数并计算各处理生防率。在田间试验结束时,每个处理随机选择3株番茄植株,采集根际土和植株茎部样品,检测病原菌与有益菌的数量。
1.2.3 病原菌与有益菌数量的检测采集根际土壤测定病原青枯菌和有益菌芽孢杆菌的数量:将根际土壤悬液稀释涂布于SMSA平板于30 ℃静置培养24 h,统计根际青枯菌的数量;将根际土壤悬液稀释涂布至V8培养基平板,30 ℃静置培养24 h后,统计根际芽孢杆菌的数量,若大于对照处理,则说明生物有机肥中的解淀粉芽孢杆菌QL-18定殖成功。结果以每克烘干土所含微生物菌落形成单位数量(cfu/g干重)表示。
采集植株茎部测定病原青枯菌和有益菌皮氏罗尔斯顿菌的数量:茎部经无菌水轻微漂洗3次后,用75% 乙醇表面消毒3 min进行表面灭菌;将灭菌后的茎部样品用无菌剪刀剪碎,称取1 g样品至无菌研钵,加入9 mL无菌水,用研棒磨成浆后,稀释涂布至SMSA平板,30 ℃静置培养24 h后,观察平板上的菌落形态,流动型菌落计为病原青枯菌,非流动型菌落计为皮氏罗尔斯顿菌[12]。结果以每克鲜样所含微生物菌落形成单位数量(cfu/g鲜重)表示。
1.3 数据处理有益菌与病原青枯菌的数量与二者的数量比在统计前先进行对数(lg)转换。若有益菌与青枯菌数量比小于0,说明有益菌数量低于青枯菌数量;若有益菌与青枯菌数量比大于0,则说明有益菌数量高于青枯菌数量。数据分析使用R 3.5.3和SPSS 20.0程序,采用单因素方差分析,并进行邓肯多重检验以及t检验。
2 结果与分析 2.1 生物有机肥与茎部注射联合防控的效果温室试验中各处理的病情指数如表 1所示。仅添加青枯菌的对照处理病情指数高达81.56%,茎部防控处理为33.28%,根际防控处理为23.83%,联合防控处理最低,仅为15.67%;通过计算3种防控方式的生防率,发现三者均能降低番茄植株的发病,其中联合防控处理的生防率高达80.79%,显著高于2种单一的生防处理(根际防控:70.78%;茎部防控:59.20%)。
|
|
表 1 温室试验与田间试验各处理的病情指数(%)与生防率(%) Table 1 Disease severity (%) and biocontrol efficacy (%) of greenhouse experiment and field trials |
进一步通过两季的田间试验检测不同防控方式在实际应用中的效果。结果表明,在春季田间试验中,对照处理的病情指数为20.98%,茎部防控处理为14.72%,根际防控处理与联合防控处理无显著差异,分别为9.50% 和5.90%;而在秋季田间试验中,对照处理的病情指数为48.17%,根际防控处理为33.50%,茎部防控处理与联合防控处理的病情指数较低,分别为9.67% 和7.00%(表 1)。通过比较3种防控方式的生防率,发现春季田间试验中联合防控处理生防率最高,达到71.88%,根际防控处理次之(54.72%),茎部防控处理生防率最低(31.98%);秋季田间试验中联合防控处理(85.47%)和茎部处理处理(79.93%)生防率显著高于根际防控处理(30.45%,表 1)。
综上可见,3种防控手段中联合防控的效果最佳且最稳定,但就单一生防方式,春季采用根际防控效果更佳,而秋季则是茎部防控更具优势。
2.2 温室试验中不同防控方式下病原菌与有益菌数量的动态变化采用平板计数法分别统计了温室试验过程中番茄根际和茎部的病原菌与有益菌数量的动态变化,结果见图 1。由图 1A可知,所有处理根际青枯菌的数量均随时间递增,但茎部防控(1.90×107 cfu/g干重)、根际防控(4.70×106 cfu/g干重)与联合防控(3.40×106 cfu/g干重)3个处理在番茄植株发病末期(病原菌接种后35 d)的根际青枯菌数量均低于对照处理(5.88×108 cfu/g干重,图 1A)。同时,生物有机肥的添加导致了根际防控与联合防控这2个处理根际芽孢杆菌数量始终高于对照与茎部防控处理(图 1B)。通过进一步计算不同时期根际芽孢杆菌与青枯菌的数量比发现,尽管所有处理均呈下降趋势,但根际防控与联合防控2个处理的数量比始终高于对照与茎部防控处理(图 1C)。
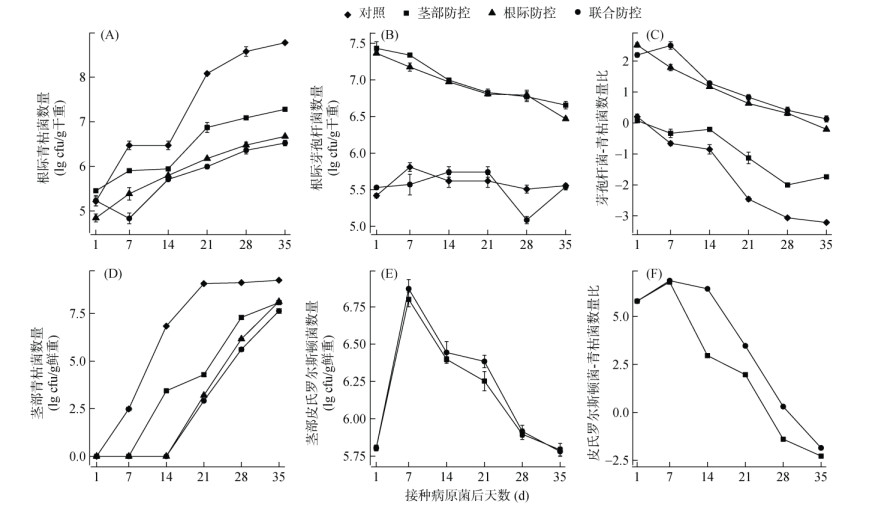
|
图 1 不同处理番茄根际病原青枯菌与有益菌芽孢杆菌(A ~ C)、茎部病原青枯菌与有益菌皮氏罗尔斯顿菌(D ~ F)数量的动态变化 Fig. 1 Dynamics of densities of R. solanacearum and Bacillus spp. in tomato rhizosphere (A–C) and R. solanacearum and R. pickettii in tomato stems (D–F) |
对番茄茎部病原青枯菌和有益菌皮氏罗尔斯顿菌的检测发现,所有处理番茄茎部青枯菌数量均随时间上升。然而,与对照处理相比,茎部防控处理的青枯菌数量在7 d后呈现上升的趋势,而根际防控与联合防控2个处理的青枯菌数量在14 d才呈现上升的趋势,由此可见,这3个处理能够延缓青枯菌在茎部的增殖(图 1D)。茎部皮氏罗尔斯顿菌数量的动态变化如图 1E所示,在接种初期皮氏罗尔斯顿菌的数量急剧增加,但在青枯菌接种7 d后,其数量开始逐渐减少(图 1E)。同样,茎部皮氏罗尔斯顿与青枯菌的数量比也在青枯菌接种7 d后开始呈现明显下降的趋势(图 1F)。
2.3 田间试验中不同防控方式下病原菌与有益菌数量的比较通过春季田间试验发现,根际防控与联合防控2个处理根际中的青枯菌数量最低,分别为1.66×106 cfu/g干重和1.43×106 cfu/g干重,显著低于茎部防控处理(1.50×107 cfu/g干重,图 2A)。虽然4个处理根际中有益菌芽孢杆菌的数量无显著差异(图 2B),但施用生物有机肥的2个处理(根际防控:2.42×106 cfu/g干重;联合防控:2.22×106 cfu/g干重)的芽孢杆菌数量仍高于未施用的2个处理(茎部防控:1.69×106 cfu/g干重;对照处理:1.50×106 cfu/g干重;t检验:P = 0.041)。进一步计算芽孢杆菌与青枯菌的数量比,同样发现联合防控(0.18)与根际防控处理(0.15)要显著高于对照(–1.22)与茎部防控处理(–0.97,图 2C),并且联合防控和根际防控处理的数量比大于0,说明生物有机肥的施用导致根际中有益菌芽孢杆菌的数量多于病原青枯菌数量。然而,秋季试验结果与春季不同,4个处理的根际芽孢杆菌与青枯菌的数量以及二者的数量比均无显著差异(图 2D ~ 2F),并且4个处理的数量比均小于0,说明根际中病原青枯菌数量更多,这可能是导致秋季添加生物有机肥效果不佳的原因。
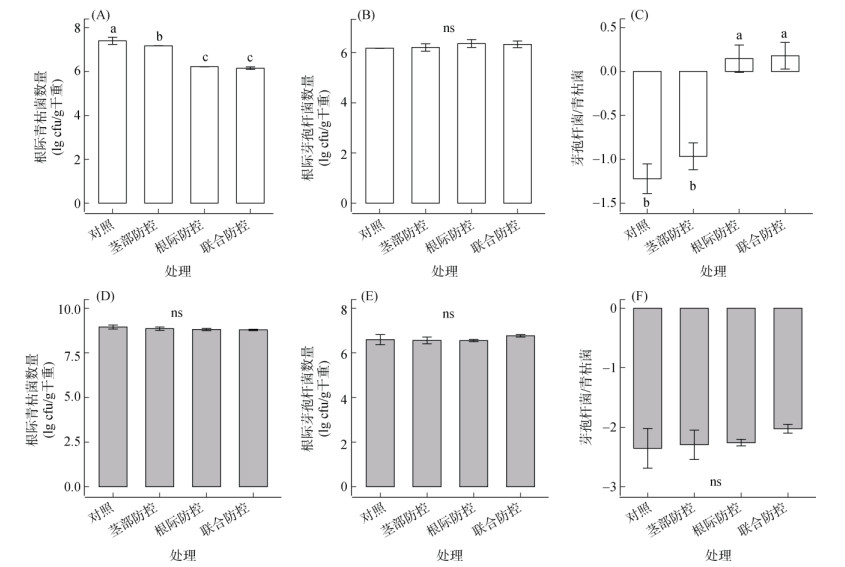
|
(图中不同小写字母代表基于邓肯多重检验处理间在P < 0.05水平上有显著的差异,ns表示无显著差异) 图 2 田间试验下春季(A ~ C)与秋季(D ~ F)番茄根际病原青枯菌与有益菌芽孢杆菌的数量及比例 Fig. 2 Densities and ratios of R. solanacearum and Bacillus spp. in tomato rhizosphere at spring (A–C) and fall (D–F) crop seasons under field condition |
此外,对不同季节番茄茎部青枯菌与有益菌皮氏罗尔斯顿菌的检测还发现,在春季田间试验中,对照处理茎部青枯菌数量最高(1.00×109 cfu/g鲜重),茎部防控处理次之(6.80×107 cfu/g鲜重),根际防控(1.97×106 cfu/g鲜重)与联合防控(6.37×105 cfu/g鲜重)处理最低(图 3A)。虽然茎部防控和联合防控处理茎部有益菌皮氏罗尔斯顿菌的数量没有显著差异(图 3B),但对于皮氏罗尔斯顿菌与青枯菌的数量比,联合防控处理(0.77)要显著高于茎部防控处理(–1.28,图 3C),并且茎部防控处理下皮氏罗尔斯顿菌与青枯菌数量比小于0,说明在植株茎部青枯菌更占优势,进而导致了春季茎部防控的生防率较低。然而,在秋季田间试验中,茎部注射QL-A6能够显著降低茎部青枯菌数量(茎部防控:3.73×106 cfu/g鲜重;联合防控:5.78×105 cfu/g鲜重;图 3D)。与春季结果相似,虽然秋季茎部防控与联合防控处理中茎部有益菌皮氏罗尔斯顿菌的数量没有显著差异(图 3E),但联合防控处理的皮氏罗尔斯顿菌与青枯菌的数量比(1.26)显著高于茎部防控处理(0.07,图 3F)。
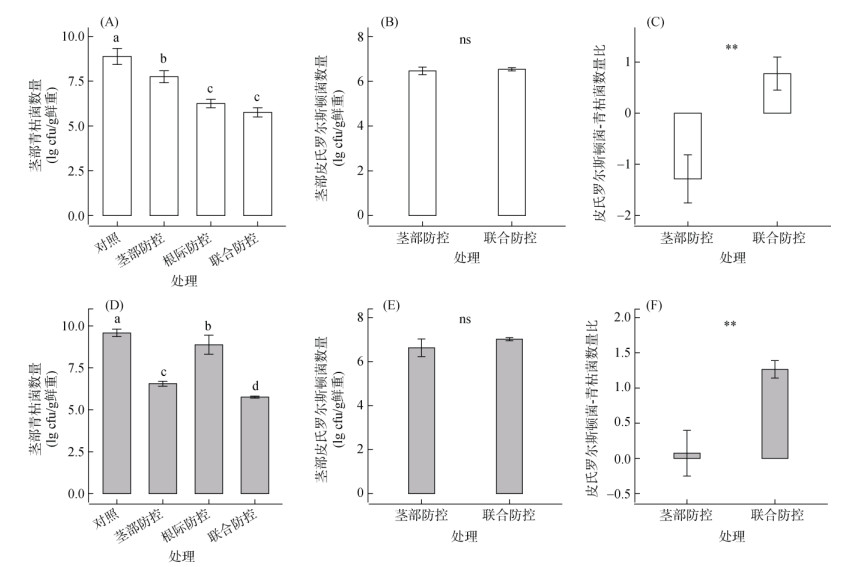
|
(图A和D中不同小写字母代表基于邓肯多重检验处理间在P < 0.05水平上有显著的差异;图B、C、E和F中采用单因素方差分析:**表示两处理在P < 0.01水平上差异显著,ns表示无显著差异) 图 3 田间试验下春季(A ~ C)与秋季(D ~ F)番茄植株茎部病原青枯菌与有益菌皮氏罗尔斯顿菌的数量及比例 Fig. 3 Densities and ratios of R. solanacearum and R. pickettii in tomato stem at spring (A–C) and fall (D–F) crop seasons under field condition |
根际是植物抵御病原菌入侵的第一道防线,利用根际微生物提高根际免疫力可以有效维护土壤–植物系统健康,减少土壤病原菌的数量,从而降低土传病害的发生[17]。然而,一旦病原菌达到一定数量,突破根际防线并成功入侵植物体内后,会在茎部快速增殖,分泌大量的胞外多糖,堵塞木质部导管,使植物体水分运输受阻,进而导致植株萎蔫[18]。因此,植株茎部是抵御病原菌入侵的最后防线。本研究将有益菌解淀粉芽孢杆菌QL-18与菜粕堆肥混合进行二次发酵制备的生物有机肥作为根际防控手段。解淀粉芽孢杆菌是一类已被广泛用于生物防控的有益微生物,能够通过产生抗菌物质从而抑制病原青枯菌的生长[19]。通过在育苗基质中添加该生物有机肥,能够有助于解淀粉芽孢杆菌QL-18在番茄植株根系提前定殖,优先占据生态位。而有益菌在茎基部维管束组织定殖后与病原菌竞争生态位是茎部防控青枯病的关键[20]。因此,本研究选择了一株与病原青枯菌亲缘关系较近且存在营养竞争关系的皮氏罗尔斯顿菌QL-A6用于茎部防控[12]。通过温室试验与春、秋两季田间试验,比较了两种防控手段与二者联用防控土传青枯病的效果,结果表明,联合防控在不同试验环境下均能够高效抑制番茄土传青枯病的发生,其生防率显著高于单一防控处理。
已有大量研究表明,番茄青枯病的发病严重程度受温度影响较大,高温环境有利于病原青枯菌的生长繁殖与根际入侵[21-22]。在本研究中也发现春季田间试验中对照处理的发病指数低于秋季,这可能是因为与秋季相比,春季温度较低(春季平均温度为10.8 ~ 20.4 ℃,秋季平均温度为18.2 ~ 25.2 ℃),限制了病原青枯菌的增殖。后续进一步检测番茄根际和茎部的青枯菌数量,也发现春季田间试验中对照处理的青枯菌数量低于秋季(图 2A、2D,图 3A、3D)。
本研究还比较了单一防控在不同季节田间试验中的生防效果,发现在春季根际防控处理的生防率要显著高于茎部防控处理,而在秋季根际防控处理的生防率却显著低于茎部防控处理(表 1)。这表明单一防控处理在田间应用时效果不稳定,导致这一现象的原因可能是有益菌在土壤中的存活和生防功能的发挥同样也会受到温度的影响[23-25]。尽管春季温度较低,但根际防控中使用的有益菌解淀粉芽孢杆菌QL-18具有抗逆性强的特点[26],能够在根际大量存活,并且由于此时病原青枯菌的生长受限,解淀粉芽孢杆菌QL-18能够优先抢占新生根根表的生态位,从而有效抵御病原青枯菌入侵植物体内[27]。但低温也会导致番茄植株蒸腾速率减慢,茎部防控中采用的皮氏罗尔斯顿菌QL-A6在茎部的定殖和迁移能力也受到低温的影响,难以有效阻遏病原青枯菌的快速扩散。相反,秋季的环境温度较高,病原青枯菌此时大量增殖,仅靠单一的根际防控难以有效抵御病原青枯菌的入侵。但较高的温度使得植株蒸腾速率加快并且代谢旺盛,茎部防控中使用的皮氏罗尔斯顿菌QL-A6在这种环境下迁移速度快且定殖能力强,能够与病原青枯菌竞争营养资源与空间生态位[28-29],从而抑制茎内青枯菌的增殖,降低植株发病率。因此,根际防控在春季田间试验中效果相对较好,而茎部防控更适合在秋季田间试验中使用。联合防控则弥补了单一防控的缺陷,对环境的适应性强,在春季和秋季田间试验中均能大幅减轻番茄青枯病的发生。
利用有益微生物及其代谢产物生物防控土传病害的相关研究已经开展数十年[30]。但是,在温室可控条件下表现出高效抑病的有益微生物,在应用于田间进行生物防控时,效果往往会受到多种环境因素的限制。本研究选择从温度这一因素解析春、秋两季田间试验中不同防控方式效果的差异,但环境湿度、土壤理化以及微生物区系等差异均会影响植株最终的发病情况[31-32]。因此,在利用有益微生物进行生物防治时,需要充分考虑环境因素的影响,有针对性地选择能够适应当下环境的有益微生物,才使其功能得到最大限度的发挥。
4 结论施用生物有机肥的根际防控与茎部注射的茎部防控均能降低番茄土传青枯病的发生,但田间防效受季节限制。根际防控与茎部防控二者联用在温室和田间均表现出高效生防水平。进一步分析有益菌与病原菌的数量及比例,发现根际防控与茎部防控分别显著促进有益菌在根际与茎部的定殖,而联合防控可以“立体”抵御病原菌的入侵,更能适应复杂的田间环境,稳定生物防治效果。
| [1] |
黄新琦, 蔡祖聪. 土壤微生物与作物土传病害控制[J]. 中国科学院院刊, 2017, 32(6): 593-600 (  0) 0) |
| [2] |
曹坳程, 刘晓漫, 郭美霞, 等. 作物土传病害的危害及防治技术[J]. 植物保护, 2017, 43(2): 6-16 DOI:10.3969/j.issn.0529-1542.2017.02.002 (  0) 0) |
| [3] |
卢维宏, 张乃明, 包立, 等. 我国设施栽培连作障碍特征与成因及防治措施的研究进展[J]. 土壤, 2020, 52(4): 651-658 (  0) 0) |
| [4] |
韦中, 沈宗专, 杨天杰, 等. 从抑病土壤到根际免疫: 概念提出与发展思考[J]. 土壤学报, 2021, 58(4): 814-824 (  0) 0) |
| [5] |
杨天杰, 王玉鑫, 王佳宁, 等. 不同基质生物有机肥防控番茄土传青枯病及促生效果研究[J]. 土壤, 2021, 53(5): 961-968 (  0) 0) |
| [6] |
Tan S Y, Gu Y A, Yang C L, et al. Bacillus amyloliquefaciens T-5 may prevent Ralstonia solanacearum infection through competitive exclusion[J]. Biology and Fertility of Soils, 2016, 52(3): 341-351 DOI:10.1007/s00374-015-1079-z (  0) 0) |
| [7] |
Tabassum B, Khan A, Tariq M, et al. Bottlenecks in commercialisation and future prospects of PGPR[J]. Applied Soil Ecology, 2017, 121: 102-117 DOI:10.1016/j.apsoil.2017.09.030 (  0) 0) |
| [8] |
Timmusk S, Behers L, Muthoni J, et al. Perspectives and challenges of microbial application for crop improvement[J]. Frontiers in Plant Science, 2017, 8: 49 (  0) 0) |
| [9] |
王雪琦. 茎部注射生防菌防控番茄土传青枯病的效果及机制研究[D]. 南京: 南京农业大学, 2017.
(  0) 0) |
| [10] |
王孝芳, 侯玉刚, 杨可铭, 等. 一株青枯菌专性噬菌体的分离及应用效果研究[J]. 生物技术通报, 2020, 36(9): 194-201 (  0) 0) |
| [11] |
Wei Z, Huang J F, Yang C L, et al. Screening of suitable carriers for Bacillus amyloliquefaciens strain QL-18 to enhance the biocontrol of tomato bacterial wilt[J]. Crop Protection, 2015, 75: 96-103 DOI:10.1016/j.cropro.2015.05.010 (  0) 0) |
| [12] |
Wei Z, Huang J F, Tan S Y, et al. The congeneric strain Ralstonia pickettii QL-A6 of Ralstonia solanacearum as an effective biocontrol agent for bacterial wilt of tomato[J]. Biological Control, 2013, 65(2): 278-285 DOI:10.1016/j.biocontrol.2012.12.010 (  0) 0) |
| [13] |
Wei Z, Yang X M, Yin S X, et al. Efficacy of Bacillus-fortified organic fertiliser in controlling bacterial wilt of tomato in the field[J]. Applied Soil Ecology, 2011, 48(2): 152-159 DOI:10.1016/j.apsoil.2011.03.013 (  0) 0) |
| [14] |
Elphinstone J G, Hennessy J, Wilson J K, et al. Sensitivity of different methods for the detection of Ralstonia solanacearum in potato tuber extracts[J]. EPPO Bulletin, 1996, 26(3/4): 663-678 (  0) 0) |
| [15] |
Turner J T. Factors relating to peanut yield increases after seed treatment withBacillus subtilis[J]. Plant Disease, 1991, 75(4): 347 DOI:10.1094/PD-75-0347 (  0) 0) |
| [16] |
Guo J H, Qi H Y, Guo Y H, et al. Biocontrol of tomato wilt by plant growth-promoting rhizobacteria[J]. Biological Control, 2004, 29(1): 66-72 DOI:10.1016/S1049-9644(03)00124-5 (  0) 0) |
| [17] |
Wei Z, Friman V P, Pommier T, et al. Rhizosphere immunity: Targeting the underground for sustainable plant health management[J]. Frontiers of Agricultural Science and Engineering, 2020, 7(3): 317-328 DOI:10.15302/J-FASE-2020346 (  0) 0) |
| [18] |
Gerlin L, Escourrou A, Cassan C, et al. Unravelling physiological signatures of tomato bacterial wilt and xylem metabolites exploited by Ralstonia solanacearum[J]. Environmental Microbiology, 2021, 23(10): 5962-5978 DOI:10.1111/1462-2920.15535 (  0) 0) |
| [19] |
Chowdhury S P, Hartmann A, Gao X W, et al. Biocontrol mechanism by root-associated Bacillus amyloliquefaciens FZB42-a review[J]. Frontiers in Microbiology, 2015, 6: 780 (  0) 0) |
| [20] |
Maldonado-González M M, Prieto P, Ramos C, et al. From the root to the stem: Interaction between the biocontrol root endophyte Pseudomonas fluorescens PICF7 and the pathogen Pseudomonas savastanoi NCPPB 3335 in olive knots[J]. Microbial Biotechnology, 2013, 6(3): 275-287 DOI:10.1111/1751-7915.12036 (  0) 0) |
| [21] |
Bittner R J, Arellano C, Mila A L. Effect of temperature and resistance of tobacco cultivars to the progression of bacterial wilt, caused by Ralstonia solanacearum[J]. Plant and Soil, 2016, 408(1): 299-310 (  0) 0) |
| [22] |
马超, 杨欣润, 江高飞, 等. 病原青枯菌土壤存活的影响因素研究进展[J]. 土壤学报, 2021, 58(6): 1359-1367 (  0) 0) |
| [23] |
Humair B, González N, Mossialos D, et al. Temperature-responsive sensing regulates biocontrol factor expression in Pseudomonas fluorescens CHA0[J]. The ISME Journal, 2009, 3(8): 955-965 DOI:10.1038/ismej.2009.42 (  0) 0) |
| [24] |
Wei Z, Huang J F, Yang T J, et al. Seasonal variation in the biocontrol efficiency of bacterial wilt is driven by temperature-mediated changes in bacterial competitive interactions[J]. Journal of Applied Ecology, 2017, 54(5): 1440-1448 DOI:10.1111/1365-2664.12873 (  0) 0) |
| [25] |
杨跃发, 王春霞, 梁飞, 等. 冬灌条件下季节性冻融期农田土壤可培养微生物数量变化及其影响因素[J]. 土壤, 2023, 55(3): 569-577 (  0) 0) |
| [26] |
Losick R M. Bacillus subtilis: A bacterium for all seasons[J]. Current Biology: CB, 2020, 30(19): R1146-R1150 DOI:10.1016/j.cub.2020.06.083 (  0) 0) |
| [27] |
van Overbeek L S, Cassidy M, Kozdroj J, et al. A polyphasic approach for studying the interaction between Ralstonia solanacearum and potential control agents in the tomato phytosphere[J]. Journal of Microbiological Methods, 2002, 48(1): 69-86 DOI:10.1016/S0167-7012(01)00347-5 (  0) 0) |
| [28] |
Marian M, Nishioka T, Koyama H, et al. Biocontrol potential of Ralstonia sp. TCR112 and Mitsuaria sp. TWR114 against tomato bacterial wilt[J]. Applied Soil Ecology, 2018, 128: 71-80 DOI:10.1016/j.apsoil.2018.04.005 (  0) 0) |
| [29] |
Wei Z, Yang T J, Friman V P, et al. Trophic network architecture of root-associated bacterial communities determines pathogen invasion and plant health[J]. Nature Communications, 2015, 6: 8413 DOI:10.1038/ncomms9413 (  0) 0) |
| [30] |
Baker K. Evolving concepts of biological control of plant pathogens[J]. Annual Review of Phytopathology, 1987, 25: 67-85 DOI:10.1146/annurev.py.25.090187.000435 (  0) 0) |
| [31] |
Narisawa K, Shimura M, Usuki F, et al. Effects of pathogen density, soil moisture, and soil pH on biological control of clubroot in Chinese cabbage by Heteroconium chaetospira[J]. Plant Disease, 2005, 89(3): 285-290 DOI:10.1094/PD-89-0285 (  0) 0) |
| [32] |
Ownley B H, Duffy B K, Weller D M. Identification and manipulation of soil properties to improve the biological control performance of phenazine-producing Pseudomonas fluorescens[J]. Applied and Environmental Microbiology, 2003, 69(6): 3333-3343 DOI:10.1128/AEM.69.6.3333-3343.2003 (  0) 0) |
 2024, Vol. 56
2024, Vol. 56


