2. 福建师范大学地理研究所, 福州 350117;
3. 中国农业科学院农业经济与发展研究所, 北京 100081;
4. 福建顺茗道茶业有限公司, 福建宁德 355200
土壤作为生物地球化学循环过程的重要载体,在全球碳平衡中起着至关的重要作用[1]。土壤有机碳(SOC)不仅是土壤–植物生态系统的重要组成部分,也是影响土壤质量、功能的关键因素,并对土壤物理、化学和生物特征的变化起着关键调节作用,但其总量变化缓慢,难以观测到短期内的微小变化[2]。相比之下,活性有机碳不仅移动性强、变化快,且易发生矿化,是土壤微生物利用效率较高的有机碳。虽然活性有机碳总量较少,但对土壤质量的影响深刻[3]。此外,土壤活性有机碳能够反映土壤管理措施和环境变化引起的土壤有机碳的微小变化,管理和保护好土壤活性有机碳,是有效提高碳汇效应的主要途径[4]。不同活性有机碳组分一般包括易氧化态有机碳(EOC)、可溶性有机碳(DOC)、微生物生物量碳(MBC)和颗粒态有机碳(POC)等[5]。以往国内外研究中,活性有机碳通常被作为土壤质量和潜在生产力的敏感指标,并应用到不同类型生态系统中。例如在森林生态系统中,孙思琦等[6]通过比较降解剂处理下不同类型凋落物DOC动态变化与降解模式的差异为帽儿山地区森林凋落物分解及碳管理提供了科学依据;在农业生态系统中,Munda等[7]通过田间试验,观察施用生物质炭后导致土壤碳的矿化和活性有机碳组分变化的差异,从而明晰了生物质炭对土壤碳循环过程的影响。但是对于茶树这类特殊经济作物土壤活性有机碳的研究甚少。同时,和其他经济作物相比,茶树具有代谢过程旺盛,养分需求大等特点[8]。因此,通过探究不同土壤活性有机碳组分及其与环境因子的相关性可为评价茶园环境质量、优化茶园管理提供科学参考。
土壤微生物作为土壤中最活跃且多样性最为丰富的组分之一,其群落组成结构、多样性以及群落功能等特征很大程度上决定了土壤中的营养元素循环和土壤肥力。例如植被的类型以及多样性、土壤类型及其理化性状、土地利用方式等均与微生物群落特征相互影响。因此,微生物群落特征常被作为土壤质量以及评估生态系统可持续性的重要指标。茶树作为我国南方常见经济作物,与其他经济作物相比,在长期种植过程中更易导致土壤理化性质发生变化,进而影响土壤微生物群落结构[9]。目前,茶园类型以及年限[10]、管理措施[11]等方面对土壤细菌群落影响的报道相对较多,针对新老茶园[9]以及不同培肥管理茶园[12]的土壤真菌群落也有一些报道,如万人源等[13]通过研究云南地区古茶园与现代茶园真菌群落组成结构的差异与影响因素,发现真菌群落对茶园环境以及种植管理模式的响应更为敏感。但关于不同茶园环境下土壤真菌群落特征及其对土壤活性有机碳组分的影响却鲜有报道。
茶树属于多年生作物,土壤作为茶树生长养分的主要来源,其质量会对茶叶产量及品质产生较大影响[14]。在长期栽培中茶树不断适应热带和亚热带气候及土壤环境条件,逐渐形成了其特有的土壤生态环境特征[15]。近年来,国内外学者对于植茶土壤特征的研究多集中于土壤性状及有机碳库[16]和土壤根际微生物群落结构特征[9]等方面。当前从茶园土壤活性有机碳组分出发,探讨不同区域土壤中真菌群落特征对茶园土壤不同活性有机碳组分影响的研究仍然较少。鉴于此,本研究试图揭示不同茶园土壤中真菌群落特征对土壤活性有机碳的影响,以期为茶园生态管理提供理论参考。
1 材料与方法 1.1 研究区与采样点研究区所在的福建省福鼎市种植茶叶历史悠久,现有茶叶种植面积21.2万亩(1亩=667 m2),主要品种为福鼎大白和大毫,是中国白茶的发源地和主产区,也是全国十大产茶大县(市)之一。福鼎市地处闽浙交界的东海之滨,属中亚热带海洋性季风气候,四季分明,年平均气温为19.2 ℃,1月平均气温为10.5 ℃,7月平均气温为30.5 ℃,平均相对湿度为80%,多年平均降水量为1 720.0 mm,多年平均日照时数为1 727.3 h[17-18]。本研究选取福鼎市具有典型性和代表性的5个乡镇茶园土壤作为研究对象,分别为:白琳镇(27°10′45″N,120°10′22″E)、磻溪镇(27°6′45″N,120°8′11″E)、管阳镇(27°15′11″N,120°1′59″E)、太姥山镇(27°6′59″N,120°11′32″E)、点头镇(27°13′2″N,120°3′10″E)。5个不同乡镇茶园海拔在400 ~ 800 m,茶树耕层深度为30 ~ 35 cm,茶树品种主要为大白、大毫,茶树管理与收获方式以人工为主。
1.2 样品采集2022年4月,于白琳镇、磻溪镇、管阳镇、太姥山镇、点头镇茶园进行土壤样品采集。每个样区随机设置3个采样点,使用小型采土器采集各采样点内的上层(0 ~ 15 cm)与下层(15 ~ 30 cm)土壤。为了避免土钻重复采样时土壤残留的影响,采集不同样品时对土钻进行清理。采集的土样挑去肉眼可见的动植物残体和杂质后混合均匀装入无菌自封袋,且每个土样一分为三:一份置于4 ℃便携式冷藏箱中带回实验室,储存于–20 ℃的冰箱中,用于提取土壤真菌基因组DNA;另外两份分别放在4 ℃冰箱保存和自然风干待用。鉴于上层土壤对外界环境以及人为管理的响应更为敏感,真菌测定主要选择上层土壤。
1.3 样品测定 1.3.1 土壤理化特征土壤pH采用便携式pH计(SI400, USA)测定;土壤容重采用环刀法测定[19];土壤含水量采用烘干法测定[19]。
1.3.2 有机碳组分土壤有机碳(SOC)采用土壤碳氮元素分析仪(Elementar Vario MAX CN, Germany)测定[19];易氧化态有机碳(EOC)采用333 mmol/L高锰酸钾氧化法提取[20],紫外分光光度计(Shimadzu UV-1800, Japan)测定;微生物生物量碳(MBC)采用氯仿熏蒸–硫酸钾浸提法提取,并在总有机碳分析仪(Shimadzu TOC-VCPH, Japan)上测定,MBC为熏蒸土样与未熏蒸土样的含量差;可溶性有机碳(DOC)采用硫酸钾浸提,通过总有机碳分析仪(Shimadzu TOC-VCPH, Japan)测定[21]。
1.3.3 真菌群落特征根据E. Z. N. A.® 土壤DNA提取试剂盒(Omega Bio-tek Norcross, GA, USA)说明书提取茶园土壤真菌的总DNA,并用1% 琼脂糖凝胶电泳检测DNA浓度与纯度,经纯化、质检合格后,通过真菌转录间隔区(ITS)通用引物ITS1F (CTTGGTCATTTAGAGGAAGTAA)与ITS2R(GCTG CGTTCTTCATCGATGC)对真菌rRNA的ITS1~ ITS2区域进行PCR扩增。PCR反应体系为:2.5 mmol/L dNTPs 2 μL,5×TransStart FastPfu缓冲液4 μL,上游引物(5 μmol/L) 0.8 μL,下游引物(5 μmol/L) 0.8 μL,模板DNA 10 ng,TransStart FastPfu DNA聚合酶0.4 μL,ddH2O添加到20 μL。测序数据分析基于上海美吉生物医药科技有限公司所提供的交互式微生物多样性云分析平台(https://www.majorbio.com)进行。从测序平台得到的下机数据,进行拼接、质控和嵌合体过滤,得到可用于后续分析的有效数据。采用QIIME(1.8.0版)软件UCLUST功能对测序所得序列在97% 相似度水平下进行聚类并获取OUT,接着通过与真菌分类学数据库(UNITE, https://unite.ut.ee/index.php)和NCBI数据库(https://www.ncbi.nlm.nih.gov)比对,在门与属层面上进行分类学注释。利用PICRUSt2软件进行16S rRNA基因数据功能预测,将QIME获得的OTU信息与KEEG数据库进行比对,获得预测功能的基因信息。真菌群落数据分析基于上海美吉生物医药科技有限公司所提供的云服务进行(https://www.isanger.com),数据分析前以“按最小样本序列数”进行数据抽平处理。
1.4 数据处理与图形绘制本研究原始数据平均值及标准误差的计算采用Excel 2016和SPSS 25程序完成。采用单因素方差分析(One-way ANOVA)比较不同采样点间相关指标的差异性,当P < 0.05时达到显著性水平。使用Bary-curtis距离表征真菌群落β多样性特征,并采用主坐标分析(Principal co-ordinates analysis)对其分布格局进行可视化。真菌群落β多样性分布格局与活性有机碳组分间的关系分析选择冗余分析(Redundancy analyais, RDA),该分析在Canoco 5软件上进行。采用斯皮尔曼(Spearman)相关性分析对土壤真菌群落α多样性指数、优势菌属和群落功能结构与不同活性有机碳组分之间的综合关系进行分析,该分析采用Origin 2022b软件进行,并结合Correlation Plot插件完成。
2 结果与分析 2.1 土壤有机碳及其不同活性组分特征不同乡镇典型茶园土壤活性有机碳组分在各土层均表现出显著性差异(图 1)。对比不同乡镇茶园上层和下层土壤的有机碳组分(图 1),DOC平均含量分别介于13.54 ~ 117.28、12.36 ~ 99.94 mg/kg,除点头镇外,其他乡镇上层土壤DOC含量均大于下层土壤,其中白琳镇茶园上层土壤DOC含量最高,管阳镇茶园下层土壤DOC含量最低;MBC平均含量分别介于177.46 ~ 349.06、84.75 ~ 226.30 mg/kg,除管阳镇外,其他乡镇上层土壤MBC含量均大于下层土壤,其中白琳镇茶园上层土壤MBC含量最高,点头镇茶园下层土壤MBC含量最低;EOC平均含量分别介于3.41 ~ 11.89、2.18 ~ 8.14 mg/g,所有乡镇茶园上层土壤EOC含量均大于下层土壤,其中磻溪镇茶园上层土壤EOC含量最高,白琳镇茶园下层土壤EOC含量最低。
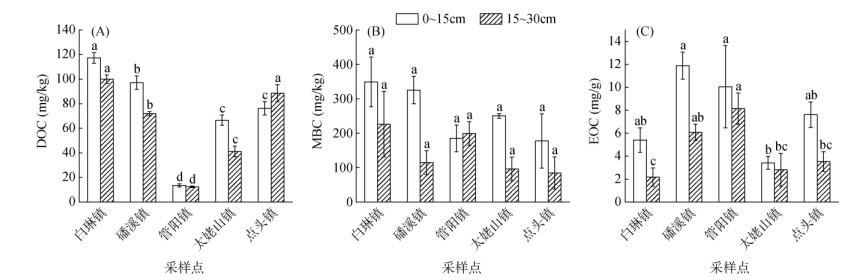
|
(图中误差线表示标注误差,柱图上方不同小写字母表示同一土层不同采样点间差异显著(P < 0.05);下同) 图 1 茶园不同土层DOC(A)、MBC(B)与EOC(C)分布特征 Fig. 1 Distribution of DOC(A), MBC(B) and EOC(C) in different soil layers of tea gardens |
不同乡镇茶园土壤活性有机碳含量占总有机碳含量的比例见图 2。由图 2A可知,所有乡镇茶园土壤中DOC含量占总有机碳含量的比例(DOC/SOC)均低于1%,上层土壤为0.06% ~ 0.50%,下层为0.06% ~ 0.72%,上层土壤平均值为0.33%,下层为0.52%,DOC/SOC比值随土层加深有上升的趋势。除白琳镇与磻溪镇之间未存在显著性差异外,其余乡镇茶园上层和下层土壤DOC/SOC比值均存在显著性差异(P < 0.05),且管阳镇茶园土壤DOC/SOC比值显著低于其他乡镇茶园。
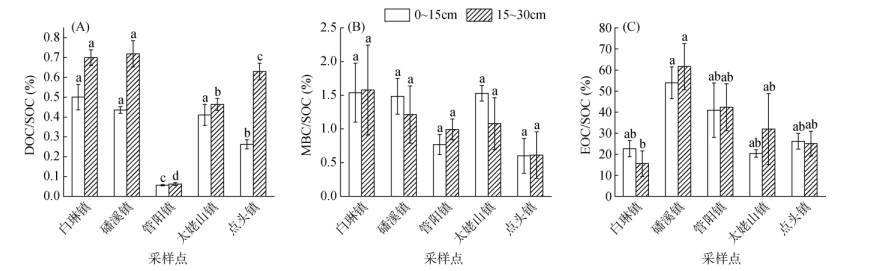
|
图 2 茶园不同土层DOC(A)、MBC(B)和EOC(C)与DOC比值特征 Fig. 2 Percentages of DOC (A), MBC (B) and EOC (C) to SOC in different soil layers of tea gardens |
由图 2B可知,5个乡镇茶园土壤中MBC含量占总有机碳含量的比例(MBC/SOC)上层土壤为0.60% ~ 1.54%,下层为0.61% ~ 1.58%,上层土壤平均值为1.18%,下层为1.10%,MBC/SOC比值随土层深度变化趋势无明显规律。所有乡镇茶园上层和下层土壤的MBC/SOC比值均未表现出显著性差异(P > 0.05)。
由图 2C可知,不同乡镇茶园土壤中的EOC含量占总有机碳含量的比例(EOC/SOC)上层为20.36% ~ 53.91%,下层为15.53% ~ 61.61%,上层土壤平均值为32.80%,下层为35.29%,EOC/SOC比值随土层深度变化趋势无明显规律。磻溪镇茶园上层与下层土壤的EOC/SOC比值与其他乡镇相比存在显著性差异(P < 0.05),且磻溪镇茶园上层与下层土壤中EOC/SOC比值最大。
2.2 土壤真菌群落特征 2.2.1 土壤真菌群落α多样性特征不同茶园上层土壤各样本文库的覆盖度均达到99.85% 及以上,说明土壤样品中被检测到的基因序列概率较高,此次测序结果能够真实有效地反映样本环境中的真菌群落组成。由表 1可知,不同乡镇茶园土壤真菌有效OTU数目为点头镇 > 白琳镇 > 管阳镇 > 太姥山镇 > 磻溪镇;Shannon与Simpson指数为多样性指数,其数值越大说明物种多样性越高,其中不同茶园之间Shannon指数未表现出显著差异性(P > 0.05),Simpson指数为白琳镇 > 太姥山镇 > 点头镇 > 磻溪镇 > 管阳镇;ACE和Chao1指数为菌群丰度指数,其值越大,土壤样品中真菌群落丰富度越高,不同茶园ACE指数为点头镇 > 白琳镇 > 管阳镇 > 太姥山镇 > 磻溪镇,Chao1指数为点头镇 > 白琳镇 > 管阳镇 > 太姥山镇 > 磻溪镇。综上,点头镇与白琳镇茶园土壤中真菌群落多样性程度较高,且ACE和Chao1指数与OTU数的变化规律基本一致。
|
|
表 1 不同茶园土壤真菌的α多样性 Table 1 α diversity of soil fungi in different tea gardens |
为了更清楚地呈现不同茶园土壤真菌群落结构之间的差异,对每个茶园土壤上层样品基于OTU水平进行主坐标分析。如图 3所示,选择的前两个主坐标成分累计方差贡献率为57.12%,说明这两个主坐标成分(PCoA1与PCoA2)是导致不同茶园表层土壤真菌群落组成差异的主要贡献者。图 3中不同的点表示不同茶园土壤,点与点之间的距离越近,说明真菌群落结构越相似;反之,点距离越远,群落结构差异越大。由此可以看出,白琳镇、磻溪镇、太姥山镇3个地区之间的点距离较近,而管阳镇与点头镇以及分别与其他3个乡镇之间点距离较远,表明这两个乡镇茶园之间,以及与其他3个乡镇茶园土壤真菌群落结构在OTU水平上有较为显著的差异。
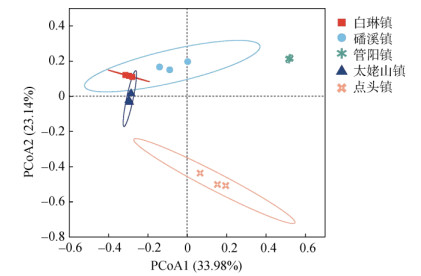
|
图 3 不同茶园土壤真菌群落的主坐标分析 Fig. 3 PCoA of soil fungal community structure in different tea gardens |
如图 4A所示,不同乡镇茶园土壤真菌门水平的群落组成主要包括子囊菌门(Ascomycota,33.38% ~ 69.18%)、担子菌门(Basidiomycota,11.61% ~ 52.87%)、毛霉门(Mucoromycota,3.69% ~ 33.01%)、壶菌门(Chytridiomycota,0.08% ~ 0.80%)和捕虫霉菌门(Zoopagomycota,0 ~ 0.16%)。不同乡镇茶园土壤真菌群落在门水平上种类相同但在组成丰度上存在差异,其中磻溪镇与点头镇茶园土壤中子囊菌门的相对丰度均超过50%,而白琳镇与太姥山镇茶园土壤中担子菌门的相对丰度均超过50%。
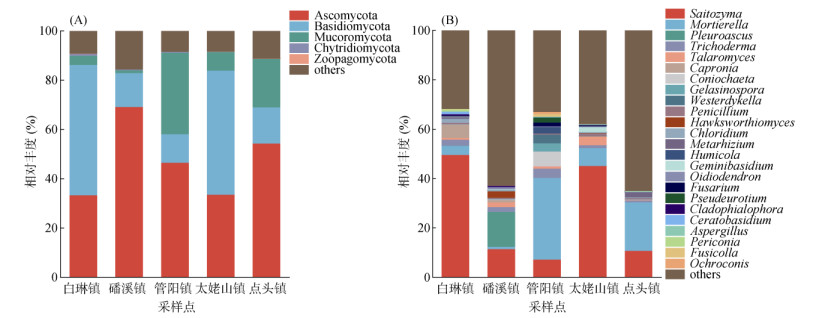
|
(图中相对丰度在每个处理中均小于1% 的物种,合并为“others”) 图 4 茶园土壤真菌门(A)水平及属(B)水平群落组成 Fig. 4 Community compositions of soil fungi at phylum (A) and genus (B) levels in different tea gardens |
如图 4B所示,不同乡镇茶园土壤真菌属水平的群落组成包括原隐球菌属(Saitozyma,7.23% ~ 49.62%)、被孢霉属(Mortierella,0.98% ~ 33.00%)、Pleuroascus (0 ~ 14.16%)、木霉属(Trichoderma,0.76% ~ 3.79%)、黄丝曲霉属(Talaromyces,0.20% ~ 3.53%)、Capronia(0 ~ 5.32%)、锥毛壳属(Coniochaeta,0 ~ 6.05%)、麻孢壳菌属(Gelasinospora,0 ~ 3.27%)、Westerdykella(0 ~ 3.52%)和青霉菌属(Penicillium,0.52% ~ 1.04%)。在属水平上,无论是物种组成还是组成丰度不同乡镇茶园土壤均存在一定的差异。
2.2.4 土壤真菌群落功能结构借助FUNGuild对真菌群落功能进行预测,不同茶园土壤真菌包括共生、腐生、病理和复合4种营养型,本文选取了相对丰度前10位的真菌群落进行分析(图 5A)。未界定腐生菌(Undefined-aprotroph)与粪腐生菌(Dung- aprotroph)属于腐生营养型,共占白琳镇、磻溪镇、管阳镇、太姥山镇和点头镇不同茶园的8.87%、28.49%、24.56%、14.78%、4.14%,其中Undefined- aprotroph相对丰度最高,腐生营养型为磻溪镇、管阳镇茶园土壤最主要的功能群落组成;真菌寄生菌–未界定腐生菌(Fungal parasite-undefined saprotroph)和动物病原体–真菌寄生虫–未定义的腐生菌(Animal pathogen-fungal parasite-undefined saprotroph)属于病原–腐生营养型真菌,共占不同茶园的49.95%、28.49%、7.54%、45.34%、10.89%,其中Fungal parasite-undefined saprotroph相对丰度最高,病原–腐生营养型为白琳镇、太姥山镇茶园土壤最主要的功能群落组成。综上可见,不同乡镇茶园土壤主要真菌功能群落结构存在显著差异。另外,本研究发现专性腐生营养型与兼性腐生营养型共占不同茶园真菌群落的67.17%、37.07%、79.20%、60.48%、69.71%(图 5B),即当地茶园土壤真菌群落以腐生营养型为主。
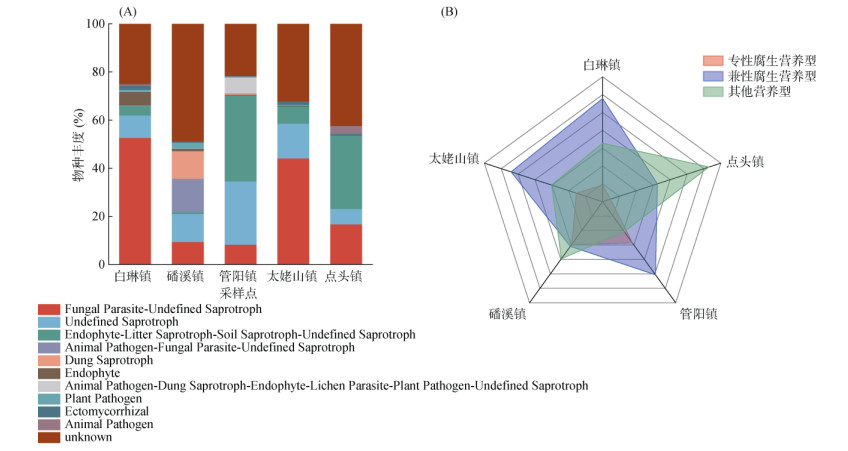
|
图 5 茶园土壤真菌功能群的相对丰度(A)及腐生营养型雷达图(B) Fig. 5 Relative abundances of functional groups of soil fungi in tea gardens (A) and saprophytic trophic radar (B) |
为了进一步阐明不同乡镇茶园土壤真菌群落特征对土壤活性有机碳组分的影响,在真菌群落多样性特征方面,选取不同茶园土壤真菌α多样性指数以及β多样性格局特征分别与各茶园活性有机碳组分作Spearman相关性分析以及冗余分析(图 6)。通过Spearman相关性分析(图 6A),发现不同土壤真菌α多样性指数与有机碳组分存在显著性相关,其中EOC含量与代表土壤真菌数量和丰度的(ACE指数、Chao1指数和OTU数) 3个指数均呈显著正相关,DOC含量与Simpson指数呈显著正相关。冗余分析结果显示(图 6B),茶园土壤中真菌β多样性格局与DOC和EOC显著相关(P < 0.05)。这说明真菌群落多样性特征对土壤中EOC与DOC分布具有显著影响。
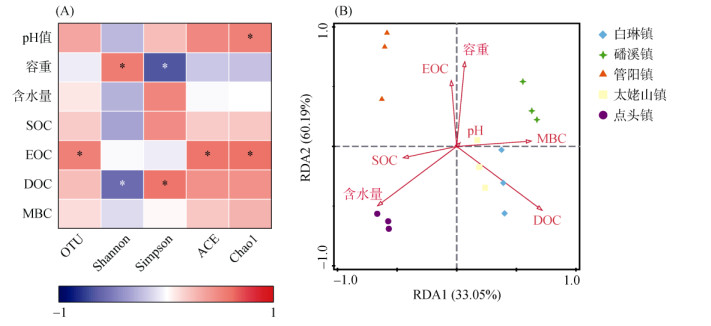
|
(图6A中*表示呈显著性相关(P < 0.05)) 图 6 真菌群落α多样性(A)和β多样性(B)与不同活性有机碳组分的关系 Fig. 6 Relationships between α diversity (A) and β diversity (B) of fungal communities with different active organic carbon components |
另外,在真菌群落结构组成方面,选取相对丰度排名前20位的真菌属与不同活性有机碳组分进行Spearman相关性分析,探究土壤真菌群落结构与不同活性有机碳组分的关系。如图 7A所示,对于DOC,Mortierella (被孢霉属)、Oidiodendron、Fusarium (镰刀属)与之呈显著负相关(P < 0.01),Pleuroascus、Cpronia、Chloridum、Cladophialophora、Periconia与之呈显著正相关(P < 0.01);对于MBC,被孢霉属、Westerdykella与之呈显著负相关(P < 0.05),Pleuroascus、Cpronia、Cladophialophora、Hawksworthiomyces、Chloridum与之呈显著正相关行(P < 0.05);对于EOC,Saitozyma (原隐球菌属)、Periconia与之呈显著负相关(P < 0.05),Gelasinospora (麻孢壳菌属)与之呈显著正相关(P < 0.05)。
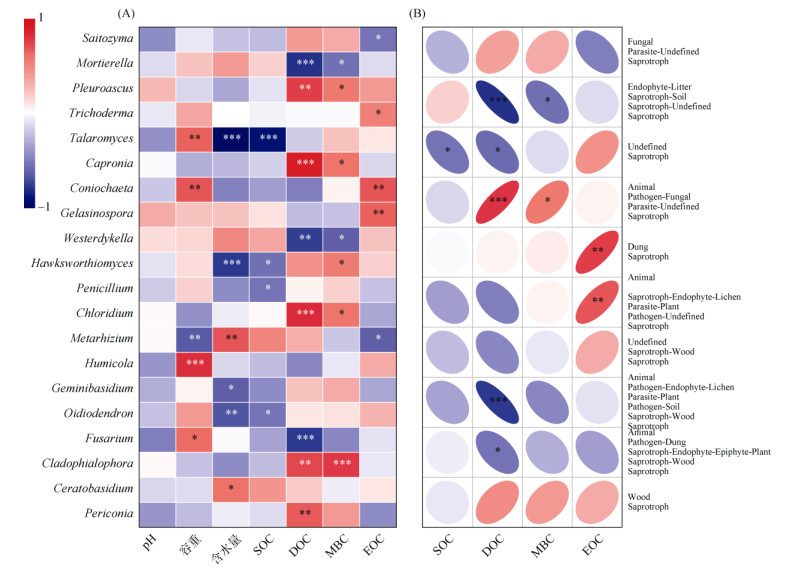
|
(图中*、**、***分别表示在P < 0.05、P < 0.01、P < 0.001水平显著相关) 图 7 真菌优势菌属(A)和真菌功能群落(B)与不同活性有机碳组分的关系 Fig. 7 Relationships between dominant genus of fungi (A) and fungal functional communities (B) with different active organic carbon components |
在真菌群落功能方面,如图 7B所示,选取相对丰度排名前10位的腐生营养型真菌与土壤中不同活性有机碳组分进行Spearman相关性分析,探究真菌功能群落特征对不同有机碳组分的影响。研究发现,对于SOC,专性腐生菌Undefined saprotroph与之呈显著负相关(P < 0.05);对于DOC,一类专性腐生菌以及三类兼性腐生菌与之呈显著负相关(P < 0.05),此外还有一种兼性腐生菌与之呈显著正相关(P < 0.05);对于MBC,一类兼性腐生菌与其呈显著正相关(P < 0.05),一类兼性腐生菌呈显著负相关(P < 0.05);对于EOC,一类专性腐生菌和一类兼性腐生菌与其呈显著正相关(P < 0.05)。综上,茶园土壤中腐生营养型真菌对土壤中不同有机碳组分存在一定程度的影响,其中兼性腐生菌的影响更为明显。
3 讨论 3.1 不同茶园土壤活性有机碳组分特征在活性有机碳组分分布特征方面,不同乡镇茶园上层与下层土壤活性有机碳组分含量中,由于近地表受到植被凋落物的分解及其根系分泌物的影响,基本为茶园上层土壤的活性有机碳组分含量高于下层土壤[22]。土壤中的EOC、MBC和DOC是主要活性有机碳组分,对土壤与外部环境变化的响应十分敏感,土壤中不同活性有机碳组分占总有机碳的比例与不同活性有机碳含量相比更能反映不同茶园土壤中有机碳转化与积累的过程[23]。本研究发现,各茶园土壤EOC占总有机碳的比例均大于DOC和MBC。土壤EOC占比能从有机碳自身分解特征方面来指示有机碳的活性强度,比值越大说明土壤有机碳稳定性越弱,被分解的潜力越大[24]。磻溪镇茶园土壤中的EOC占比显著大于其他茶园土壤,有机碳活性较高。土壤MBC与总有机碳的比值即微生物熵可以反映土壤活性有机碳库的周转速率,一般在1% ~ 5%[25]。不同乡镇茶园土壤MBC占比差异性不显著,且平均值在1.14% 左右,处于较低水平,这有利于促进有机碳在土壤中的积累。土壤中DOC占比能够反映土壤总有机碳的稳定性和损失情况,一般DOC占比越高,土壤有机碳的活性越大,但稳定性越差[26]。各茶园土壤中DOC占比均小于1%,且管阳镇茶园土壤中的DOC占比小于其他茶园,说明该地茶园土壤中的有机碳表现出一定的稳定性,这与植茶年限延长后,土壤微生物活性降低从而降低有机矿化能力有关[27],本研究中较低的微生物熵也支持这一观点。
3.2 不同茶园土壤真菌群落特征土壤微生物在土壤–植物系统中扮演着重要角色[28]。土壤真菌多样性及群落结构可以作为评价土壤健康状况的一项重要指标[29]。研究发现,福鼎市典型茶园土壤真菌群落多样性指数即Shannon与Simpson指数处于适宜水平,具有较好的环境可持续性[30]。本研究借助PCoA分析进一步发现,来自同一茶园的土壤样品总体上呈聚集分布,而来自不同茶园的土壤样品则相对分散,表明土壤真菌群落组成在茶园空间序列上存在着一定差异,这可能是由于局地微环境以及人为活动导致的,但相关机理仍比较匮乏。关于茶园土壤真菌群落演变机制还有待于深入探究。不同乡镇茶园土壤真菌群落结构门水平中子囊菌门和担子菌门均是优势菌门,这与前人研究结果较为相符[9]。其中,子囊菌可调节土壤中动植物残体的分解[31],担子菌门与植物共生形成菌根,能有效提高土壤肥力,有利于作物的生长[32]。
3.3 真菌群落对活性有机碳组分的影响真菌群落的多样性对于维系元素平衡具有重要意义[33]。本研究表明不同茶园土壤真菌群落特征对活性有机碳组分存在一定影响。通过Spearman相关性分析,发现子囊菌门中Pleuroascus、Capronia、Chloridium等菌属与DOC和MBC呈显著正相关,但Westerdykella和镰刀菌属与DOC和MBC呈负相关,原隐球菌属和Periconia菌属与EOC具有显著负相关关系,被孢霉属与DOC与MBC具有显著负相关关系,因此可以判断上述子囊菌门真菌对茶园土壤中DOC、MBC的动态变化有着重要作用,是土壤碳库及养分转化的关键真菌类群。这主要是因为子囊菌门能够快速代谢植物根际沉积的有机物,加快碳循环[34],并且可通过释放有机酸来溶解难利用的磷,这对于提高茶树对病原体的抵抗力、促进茶树生长有重要意义[35]。此外,腐生营养型真菌对于土壤固碳潜力具有较大影响,不同营养型真菌之间的相互作用会导致真菌组成结构变化,腐生营养型真菌对植物致病菌会产生一定的拮抗作用,从而达到抑制病理性真菌、保护植物免受病害的效果[36]。综上,茶园土壤真菌群落特征变化的科学管理与监控是十分必要的,其可作为茶园碳库维系的一种潜在的生态调控方式,可为深入了解茶园生态系统增汇减排影响因素、准确掌握茶园各组成碳周转奠定基础,有利于构建低碳生态茶园模式。
4 结论1) 福鼎典型茶园土壤表现出上层活性有机碳组分含量大于下层土壤的分布规律,且在各活性有机碳组分占总有机碳的比例上,易氧化有机碳所占比例最大。
2) 福鼎典型茶园土壤真菌群落多样性呈现一定地域性特征,以点头镇与白琳镇真菌群落多样性最为显著,优势菌门为子囊菌门、担子菌门等,优势菌属为原隐球菌属、被孢霉属和Pleuroascus等。
3) 通过冗余分析和Spearman相关性分析发现,土壤中活性有机碳结构受到真菌群落多样性特征的显著影响,在真菌群落组成结构中子囊菌门与腐生营养型真菌在茶园土壤碳代谢过程中发挥着重要作用。
致谢: 本研究在野外采样和室内分析过程中得到了福建师范大学地理科学学院、碳中和未来技术学院刘旭阳、黑杰、王亚非和胥佳忆等的帮助,在此一并表示由衷的感谢。
| [1] |
陈晓琳, 李忠武, 王晓燕, 等. 中亚热带红壤丘陵区松林生态系统表层土壤活性有机碳空间分异规律[J]. 地理研究, 2011, 30(10): 1825-1834 (  0) 0) |
| [2] |
Bolinder M A, Angers D A, Gregorich E G, et al. The response of soil quality indicators to conservation management[J]. Canadian Journal of Soil Science, 1999, 79(1): 37-45 DOI:10.4141/S97-099 (  0) 0) |
| [3] |
刘琳, 余佳洁, 周文静. 不同园林植物土壤活性有机碳组分及有机碳储量[J]. 水土保持研究, 2020, 27(5): 38-44 (  0) 0) |
| [4] |
罗斯生, 罗碧珍, 魏书精, 等. 森林火灾对马尾松次生林土壤活性有机碳的影响[J]. 西南林业大学学报(自然科学), 2021, 41(5): 121-130 (  0) 0) |
| [5] |
Haynes R J. Labile organic matter fractions as central components of the quality of agricultural soils: An overview[M]//Advances in Agronomy. Amsterdam: Elsevier, 2005: 221–268.
(  0) 0) |
| [6] |
孙思琦, 裴晓娜, 韩锐, 等. 降解剂对森林凋落物可溶性有机碳含量的影响及凋落物降解模式比较研究[J]. 生态学报, 2023, 43(5): 2005-2012 (  0) 0) |
| [7] |
Munda S, Bhaduri D, Mohanty S, et al. Dynamics of soil organic carbon mineralization and C fractions in paddy soil on application of rice husk biochar[J]. Biomass and Bioenergy, 2018, 115: 1-9 DOI:10.1016/j.biombioe.2018.04.002 (  0) 0) |
| [8] |
刘美雅, 伊晓云, 石元值, 等. 茶园土壤性状及茶树营养元素吸收、转运机制研究进展[J]. 茶叶科学, 2015, 35(2): 110-120 (  0) 0) |
| [9] |
奎玲, 王子君, 李国荣, 等. 临沧市古茶园土壤细菌和真菌群落组成与多样性研究[J]. 生态环境学报, 2020, 29(12): 2307-2321 (  0) 0) |
| [10] |
顾松松, 胡秋龙, 刘仲华, 等. 不同类型茶园土壤细菌多样性及群落结构研究[J]. 茶叶通讯, 2019, 46(2): 162-169 DOI:10.3969/j.issn.1009-525X.2019.02.008 (  0) 0) |
| [11] |
李俊强, 林利华, 张帆, 等. 施肥模式对茶树根际土壤微生物数量及酶活性的影响[J]. 水土保持研究, 2019, 26(3): 22-28 (  0) 0) |
| [12] |
傅海平, 周品谦, 王沅江, 等. 绿肥间作对茶树根际土壤真菌群落的影响[J]. 茶叶通讯, 2020, 47(3): 406-415 DOI:10.3969/j.issn.1009-525X.2020.03.007 (  0) 0) |
| [13] |
万人源, 马会杰, 蒋宾, 等. 茶园土壤真菌群落组成及影响因素研究[J]. 中国农学通报, 2021, 37(33): 88-97 (  0) 0) |
| [14] |
曹培, 徐莹, 朱杰, 等. 不同种植模式对稻田土壤活性有机碳组分及产量的短期影响[J]. 生态学杂志, 2019, 38(9): 2788-2798 (  0) 0) |
| [15] |
杨广容, 马燕, 蒋宾, 等. 基于16S rDNA测序对茶园土壤细菌群落多样性的研究[J]. 生态学报, 2019, 39(22): 8452-8461 (  0) 0) |
| [16] |
朱仁欢, 郑子成, 李廷轩, 等. 退耕植茶对川西低山丘陵区土壤活性有机碳组分的影响[J]. 环境科学学报, 2018, 38(2): 744-751 (  0) 0) |
| [17] |
陈国奖. 福鼎白茶园地土壤养分现状分析及施肥建议[J]. 农业科技通讯, 2021(7): 175-180 (  0) 0) |
| [18] |
林喜盈. 福鼎白茶产业发展现状与对策建议[J]. 基层农技推广, 2019, 7(8): 87-89 (  0) 0) |
| [19] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000
(  0) 0) |
| [20] |
鲍士旦. 土壤农化分析(3版)[M].
中国农业出版社, 北京, 2000
(  0) 0) |
| [21] |
Murphy D V, MacDonald A J, Stockdale E A, et al. Soluble organic nitrogen in agricultural soils[J]. Biology and Fertility of Soils, 2000, 30(5): 374-387 (  0) 0) |
| [22] |
李玮, 郑子成, 李廷轩, 等. 退耕植茶对川西低山丘陵区土壤有机碳库的影响[J]. 中国农业科学, 2014, 47(8): 1642-1651 (  0) 0) |
| [23] |
许梦璐, 吴炜, 颜铮明, 等. 滨海滩涂不同土地利用类型土壤活性有机碳含量与垂直分布[J]. 南京林业大学学报(自然科学版), 2020, 44(4): 167-175 (  0) 0) |
| [24] |
Wang Y, Ruan H H, Huang L L, et al. Soil labile organic carbon with different land uses in reclaimed land area from Taihu Lake[J]. Soil Science, 2010, 175(12): 624-630 (  0) 0) |
| [25] |
Insam H, Domsch K H. Relationship between soil organic carbon and microbial biomass on chronosequences of reclamation sites[J]. Microbial Ecology, 1988, 15(2): 177-188 (  0) 0) |
| [26] |
Xu X, Zhou Y, Ruan H H, et al. Temperature sensitivity increases with soil organic carbon recalcitrance along an elevational gradient in the Wuyi Mountains, China[J]. Soil Biology and Biochemistry, 2010, 42(10): 1811-1815 (  0) 0) |
| [27] |
Yao H, He Z, Wilson M J, et al. Microbial biomass and community structure in a sequence of soils with increasing fertility and changing land use[J]. Microbial Ecology, 2000, 40(3): 223-237 (  0) 0) |
| [28] |
Urbina H, Breed M F, Zhao W Z, et al. Specificity in Arabidopsis thaliana recruitment of root fungal communities from soil and rhizosphere[J]. Fungal Biology, 2018, 122(4): 231-240 (  0) 0) |
| [29] |
陈历睿, 林佳妮, 沈蓉, 等. 三峡库区马尾松林土壤真菌群落特征及影响因素[J]. 应用生态学报, 2022, 33(9): 2397-2404 (  0) 0) |
| [30] |
张健, 徐明, 陈驰, 等. 黔中山地不同种植方式茶园土壤真菌群落特征[J]. 茶叶学报, 2022, 63(1): 1-10 (  0) 0) |
| [31] |
Mendes R, Kruijt M, de Bruijn I, et al. Deciphering the rhizosphere microbiome for disease-suppressive bacteria[J]. Science, 2011, 332(6033): 1097-1100 (  0) 0) |
| [32] |
陈力力, 刘金, 李梦丹, 等. 水稻-油菜双序列复种免耕、翻耕土壤真菌多样性[J]. 激光生物学报, 2018, 27(1): 60–68, 59 (  0) 0) |
| [33] |
van Elsas J D, Garbeva P, Salles J. Effects of agronomical measures on the microbial diversity of soils as related to the suppression of soil-borne plant pathogens[J]. Biodegradation, 2002, 13(1): 29-40 (  0) 0) |
| [34] |
张胜男, 闫德仁, 黄海广, 等. 短期封育对科尔沁沙地榆树疏林土壤微生物群落结构的影响[J]. 生态学杂志, 2020, 39(9): 2860-2867 (  0) 0) |
| [35] |
Osorio N W, Habte M. Soil phosphate desorption induced by a phosphate-solubilizing fungus[J]. Communications in Soil Science and Plant Analysis, 2014, 45(4): 451-460 (  0) 0) |
| [36] |
赵珮杉, 郭米山, 高广磊, 等. 半干旱-亚湿润干旱沙区樟子松根内真菌群落结构和功能时空动态特征[J]. 环境科学, 2023, 44(1): 502-511 (  0) 0) |
2. Institute of Geography, Fujian Normal University, Fuzhou 350117, China;
3. Institute of Agricultural Economics and Development, Chinese Academy of Agricultural Sciences, Beijing 100081, China;
4. Fujian Shun Mingdao Tea Industry Co., Ltd., Ningde, Fujian 355200, China
 2024, Vol. 56
2024, Vol. 56


