2. 华北电力大学环境科学与工程学院, 北京 102206
碘是人体合成甲状腺激素必不可少的微量元素,在人体的新陈代谢与生长发育过程中有着举足轻重的作用。人体碘摄入不足会导致多种疾病,甲状腺肿大、甲状腺功能亢进、生殖衰竭和智力迟钝等[1]。环境中的碘主要以5种形式存在:碘离子(I–)、碘(I2)、低碘酸(HIO)、碘酸根(IO3–)和有机碘[2]。大气中的碘通过湿沉降和干沉降回到土壤。土壤中Fe/Mn氧化物或氢氧化物吸附氧化I–使其成为碘有机化中间体(I2或HIO)[3],中间体在土壤介质中通过化学途径和生物途径生成有机碘。土壤中生成的有机碘(甲基碘(CH3I)、乙基碘(C2H5I)、1-碘丙烷(1-C3H7I)、2-碘丙烷(2-C3H7I)、1-碘丁烷(1-C4H9I)和2-碘丁烷(2-C4H9I)等其他类型的烷基碘[4])又挥发至大气圈,完成碘在海洋、大气、土壤中的循环。其中,一些具有羰基部分的土壤有机化合物可以增强挥发性碘化合物的形成,而具有芳香环的化合物易与碘结合生成有机碘[5]。
人体所摄取的碘主要来自碘盐和植物可食用部分,而植物体内的碘主要来自土壤。因此,有必要研究土壤中的碘循环从而对人体内碘进行调控。土壤中碘的存在形式分为无机碘和有机碘两大类,无机碘利于人体的吸收,有机碘可以储存在体内备用,待需要时再进行分解吸收。目前,关于土壤碘的研究工作主要集中在无机碘上,对无机碘在土壤中循环过程的认知已比较清楚。Humphrey等[6]用微渗析法提取含碘的土壤溶液,发现IO3–的瞬时吸附量大于I–的吸附量,并且在短时间内,土壤中检测到可溶性有机结合碘的存在。通过向土壤中外加I–,其研究还发现I–吸附在土壤中的Fe/Mn氧化物上,被其氧化为HIO或I2,从而与有机质(如苯酚)发生反应,形成有机碘[7]。但是,目前关于土壤有机碘形成和转化等过程的机制和影响因素尚缺乏系统、深入的论述。
基于此,本文在总结有机碘最新研究进展的基础上,对土壤中碘的形态和含量、有机碘的形成途径和影响因素(如土壤pH、氧化还原电位、土壤有机质含量、酶活性和Fe/Mn氧化物或氢氧化物等)及有机碘的挥发途径等进行综述。
1 土壤中碘的形态和含量 1.1 土壤中碘的形态土壤是地球系统大气圈、水圈、岩石圈及生物圈相互作用最复杂、最活跃的交界面[8]。土壤中碘以多种形态存在,目前研究学者主要关注的有:水溶性碘(IO3–和I–)、HIO、I2、可溶性有机碘复合物和挥发性碘(图 1)。I–和IO3–能够吸附在矿物表面;I2既能吸附在天然基质上,也可以与有机物发生反应生成有机碘或形成CH3I挥发到大气中。土壤的pH和氧化还原条件是影响碘形态的主要因素,在中性和酸性条件下,H2O2将HIO还原为I–的反应随着溶液pH的降低而减缓。增加水中的溶解氧会增加IO3–的产生,这表明高浓度溶解氧有利于氧化物质的形成,因为还原物质(•H)可以被溶解氧消耗,从而使更多I–氧化成为IO3–[9]。Yamaguchi等[10]向水中添加KI、KIO3灌溉淹水稻田,研究氧化还原条件对碘形态转化的影响,发现在氧化条件下,碘主要以IO3–形式存在;随着环境转变为还原条件,当土壤中含有足够多的有机质时,无机碘会转化为有机碘;直至极端还原条件下,I–成为碘的唯一优势形态[11]。
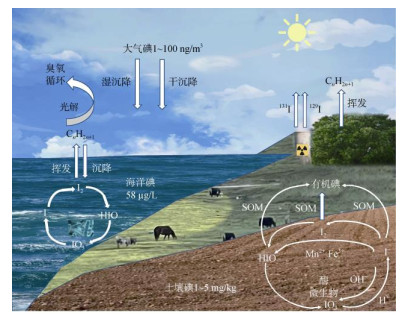
|
图 1 海洋–大气–陆地系统中的碘循环[5] Fig. 1 Iodine cycle in marine-atmosphere-land system |
土壤中富含由有机质和金属氧化物组成的胶体颗粒(尺寸为1 ~ 1 000 nm),比表面积大,与碘的结合能力较强,但是目前关于胶体态碘的形成、分布和迁移等过程仍不清楚,阻碍了对土壤碘循环的认识。
1.2 土壤中有机碘的含量目前,关于土壤中有机碘含量的数据较少,主要研究的是土壤中各种碘形态的占比。Yamada等[12]利用连续萃取技术对两个土壤(SA-3和KU-7)中的碘进行分馏,采用高效液相色谱法测定碘含量,得到KU-7土壤中与胡敏酸结合的碘(HA-I)占比19%,与富里酸结合的碘(FA-I)占比17%;SA-3土壤中HA-I占比38%,FA-I占比14%。Alicke等[13]研究爱尔兰海沉积物中有机碘含量,得出有机碘占比40% ~ 48%。Shimamoto等[14]分析0 ~ 12 cm土层土壤和孔隙水中的碘含量,测得土壤中有机碘占比为87%。Hou等[15]提取受放射性污染的切尔诺贝利土壤(MaB-3)和爱尔兰海沉积物中129I的各形态组分,通过分析测定,得到MaB-3中有机碘占比39.20%,沉积物中有机碘占比47.42%。Schwehr等[16]为了测试碘与土壤和含水层沉积物的相互作用,在萨凡纳河站点对129I污染的沉积物进行试验,测定得到有机碘占土壤总碘67%。Hansen等[17]选取两种受放射性碘污染的土壤,采用连续萃取技术对碘组分进行分馏并测定,得到丹麦土壤中HA-I占比39.8%,FA-I的占比16.5%;切尔诺贝利土壤HA-I占比37.6%,FA-I占比0.9%。
Duborská等[18]从斯洛伐克采集5个表层土壤样品,包括薄层黑钙土(CH)、黑土(PH)、冲积土(FL)、表皮淋溶土(LV)、滞水形成土(CM)、浅成红层(CMro)和潜育性潮土(glFLV),分析其HA-I、FA-I占比,发现CH中,HA-I占比35.3%,FA-I占比5.1%;PH中,HA-I占比38.7%,FA-I占比3.7%;LV中,HA-I占比12.2%,FA-I占比15.5%;CM中,HA-I占比34.8%,FA-I占比15.5%;CMro中,HA-I占比32.2%,FA-I占比11.3%;FL中,HA-I占比28.9%,FA-I占比3.4%;glFLV中,HA-I占比4.2%,FA-I占比6.6%。
综上可见,土壤中有机碘占比大多在50% 左右,有些甚至高达87%。目前,虽然没有得到关于土壤中有机碘含量的确切数据,但是以上研究说明土壤中碘主要贮存在有机质中。关于土壤中总碘含量和有机质含量,虽然已有一定的数据以及相关性研究,但是由于连续萃取技术的不准确性和测定条件的特殊性等原因,导致土壤有机碘含量的测定受限,今后需要进一步探索有机碘含量的测定方法并逐步完善土壤碘数据库。
2 碘与土壤有机质的反应土壤有机质(SOM)包括腐殖质类物质和非腐殖质类物质,腐殖质是指新鲜有机质经过微生物分解转化所形成的一类特殊、复杂、性质比较稳定的有机混合物,该过程称为腐殖化过程,即从一种有机碳转化为另一种有机碳的过程[19-21]。根据溶解度将腐殖质分为:富里酸(FA)、胡敏酸(HA)和胡敏素(HM)。FA在酸性和碱性条件下均可溶解;HA不溶于酸;胡敏素(HM)不溶于酸也不溶于碱。FA和HA都是多元羧酸。
腐殖酸与I2反应形成各种有机碘化合物,从而限制I2在土壤环境中氧化为IO3–[22]。土壤有机质在氧化还原转化过程中既可以作为电子供体,将IO3–还原为I2、HIO;也可以作为电子受体,将HI氧化为I2、HIO,I2和HIO结合到有机质中,从而生成有机碘。HA含有大量的芳香族物质,烷基链烃物质多且支链长;FA以碳水化合物多糖为主,烷基链烃含量少,支链短,分支多,以大量的羧基为主要结构特征[23]。Li等[3]使用碘X射线吸收近边结构谱(I K-edge XANES)和碳X射线吸收近边结构谱(C K-edge XANES)研究了HA-I体系中碘和碳的形态,发现样品HA中主要含有4种碳官能团(即苯醌、芳香碳、酚碳和羧基碳)。I2或HIO主要与HA的芳香环结合,并对芳香环进行共价修饰[24]。Moulin等[25]用电喷雾(ESI)耦合四极飞行时间质谱仪(Q-TOF)研究了碘与腐殖质中FA的反应,经串联质谱(MS/MS)分析表明碘在FA上发生芳香族取代,生成有机碘。
土壤pH在5.0 ~ 5.5时,碘主要与HA结合,而在pH > 6时,碘主要与FA结合[17]。Xu等[26]利用1H-13C异质核单量子相干(HSQC)核磁共振(NMR)光谱分析HA和FA结构得到,尽管从分子水平来看,HA比FA有更多的芳香基团,会导致有更多的碘潜在结合位点,但非酶作用和酶作用可以促进FA都生成新的芳香C—H,使FA与碘结合成有机碘的反应增强。碘有机化途径如图 2[6]所示,有机质与碘结合的途径主要有两种:第一,能够将I–和IO3–通过非酶的途径化学转化为反应中间体物质(HIO或I2),然后与有机质结合形成C—I键,这个反应主要发生在芳香区域;第二,I–也可以通过酶途径(氧化酶或过氧化物酶)生物转化为有机碘。并且低分子量腐殖质物质因较大比表面积及提供更多的芳香族结合位点更容易与碘反应。
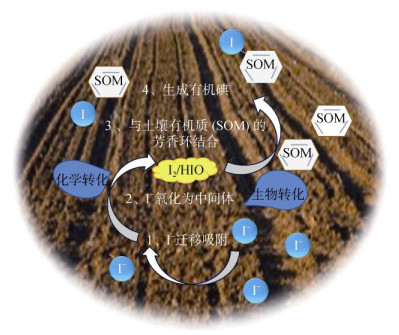
|
图 2 碘有机化的两种途径[6] Fig. 2 Two ways of organic iodization |
有机质是土壤中影响无机碘转化为有机碘最为重要的因素。Xu等[27]在福岛第一核电站附近采集土壤样品,研究发现红壤127I含量与土壤有机质含量呈显著正相关。Yamaguchi等[28]研究了不同有机质含量的土壤中无机碘(I–和IO3–)的转化,结果显示,反应60 d后,在有机质含量充足的表层土壤中,I–和IO3–均转化为有机碘,而在有机质含量较低土壤中,无机碘含量保持不变。Schwehr等[16]采集被放射性碘污染的表层土壤和沉积物,经证明,有机碳可能限制有机碘的形成。Kaplan等[29]采集萨凡纳河的F区四个土芯研究发现有机质促进可溶性有机碘的形成。Bowley等[30]通过向种植黑麦草的土壤中添加IO3–,建立碘与土壤有机质的动力学模型,得到碘含量与有机质含量之间存在显著的正相关关系。Pisarek等[31]研究落叶对土壤腐殖层以及其中碘含量和形态的影响,发现了类似的结果,即土壤中有机碘含量与溶解有机碳含量呈正相关。Takeda等[32]在森林土壤中外源添加I–和IO3–,采集不同深度(0 ~ 10、10 ~ 30、30 ~ 70 cm)土壤样品研究碘的形态和含量,结果显示,I–加入土壤1 d后,只在10 ~ 30 cm土层中发现少部分有机碘;IO3–加入土壤1 d后,在0 ~ 10和10 ~ 30 cm土层均发现了有机碘,10 ~ 30 cm土层相对于0 ~ 10 cm土层有机碘含量较少;加入两种形式的碘14 d后,0 ~ 10 cm土层和10 ~ 30 cm土层土壤样品中的大部分碘都以有机碘形式存在,相比于0 ~ 10 cm土层,在10 ~ 30 cm土层有机碘的含量更高,而在30 ~ 70 cm土层几乎没有有机碘生成;且随着土壤深度增加,土壤中总碳含量降低(0 ~ 10、10 ~ 30和30 ~ 70 cm土层土壤的总碳含量分别为383、78和10 g/kg),生成的有机碘含量随之减少。
3.2 pHSöderlund等[33]研究了不同pH对土壤吸附I–和IO3–的影响,发现在好氧土壤条件下,I–和IO3–的吸附系数(Kd)随pH的增加而下降,对于I–,pH为4.1时,Kd值为10 mL/g;pH为9.2时,Kd值降为2.5 mL/g。Keppler等[4]在外加HA和Fe(Ⅲ) 的条件下,研究pH(1.2 ~ 8.8)对3种类型土壤(草原、原始森林和泥炭地)中挥发性有机碘化物生成的影响,发现随着pH的增加,CH3I的释放量明显降低。Allard等[34]在天然有机物和氧化锰存在的水溶液中添加I–,对比了pH为5.0和7.0时CH3I的生成量,发现当pH从7.0降到5.0时,CH3I生成率增加了5倍,作为反应物的I2也在低pH下迅速参与反应。
酸性条件下土壤对碘的吸附能力更强,原因可能是:①在酸性条件下,矿物表面的羟基会质子化,增加了土壤颗粒的正净电荷密度,I–和IO3–更容易吸附到土壤颗粒上[35];②IO3–通过置换羟基,键合到土壤中的铁氧化物表面的能力变强[36]。
3.3 氧化还原电位氧化还原电位是反映氧化还原反应强度的指标。Xue等[37]在岩心深度80 ~ 410 m范围内采集26个沉积物样品,对比研究发现氧化还原电位较高时,碘呈氧化状态;氧化还原电位较低时,碘还原作用较强。在好氧条件下碘的有机化明显强于厌氧条件,Keppler等[4]研究发现有机化作用强的主要原因是酶活性相对更强,使I–容易氧化为I2或HIO与有机质结合,促进有机碘的生成。
在厌氧条件下,土壤和孔隙水中有机碘浓度随时间而降低,其原因是I–从有机碘中解离[14]。Moriyasu等[38]通过在富碘和腐殖质的无氧海水中添加硫离子和硫代硫酸盐进行试验,发现有机碘中大量碘丢失,可能是S–取代了I–。以上研究均证实I–会从有机碘中解离,将有机碘转化为无机碘。强还原条件促进I–从有机物中解离,可能是由于S–和I–同样作为亲核试剂,S–比I–亲核性强,所以有机物中的碘在缺氧条件下可以被亲核试剂(硫离子和硫代硫酸根离子)取代,使I–解离,有机碘含量变少。
3.4 Fe/Mn氧化物及其氢氧化物Fe/Mn氧化物及其氢氧化物在土壤中广泛存在,在有机和无机化合物的转化以及生物地球化学循环中起着重要作用[39]。以I–吸附为例,常见的吸附/氧化剂是Mn氧化物(例如,δ-MnO2),I–的氧化速率随Mn氧化物浓度的增加而增加[22],且I–在MnO2表面的吸附过程是MnO2氧化I–的限速步骤。MnO2在I2和有机化合物之间的亲电碘化反应中充当催化剂,加速形成有机碘[40]。自然环境中,Fe主要以Fe(Ⅱ) 和Fe(Ⅲ)形式存在[41],Fe(Ⅲ) 可以将I–氧化为中间体物质(I2或HIO),氧化产物易与有机质形成共价键,生成有机碘。
如图 3所示,金属氧化物和氢氧化物(MnO2、Fe3O4和Fe(OH)3)吸附I–,将其氧化为I2或HIO,进一步氧化为IO3–;在酸性环境下,I2或HIO不会完全氧化为IO3–,而是与腐殖质反应生成有机碘[42]。
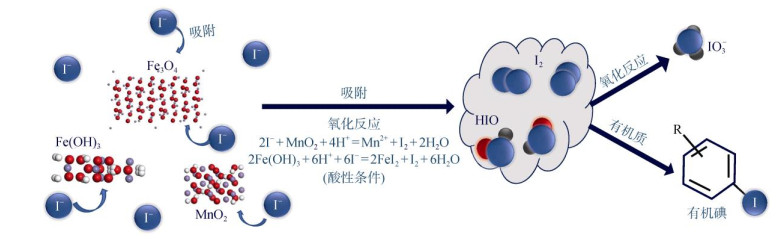
|
图 3 I−与Fe/Mn氧化物及其氢氧化物的反应[42] Fig. 3 Reaction of iodide with iron manganese oxides and their hydroxides |
土壤酶主要是由微生物、植物细根、土壤动物分泌或释放的具有催化活性的蛋白组成[43]。而参与碘转化的酶主要是真菌和细菌产生的多铜氧化酶,其可以催化氧化I–形成I2和HIO中间体与有机质结合形成土壤有机碘。最为常见的漆酶是由植物、真菌和细菌产生的一种含铜氧化酶[44]。2, 2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸基(ABTS)是一种介体物质,在漆酶催化碘有机化过程中充当介体。漆酶催化下,ABTS分子被氧化为相应的阳离子自由基(ABTS.+),ABTS.+可以接受来自I–的电子,形成I2或HIO,在反应中,I2或HIO结合到HA组分的芳香环中,甚至可以结合到酚氧化形成的苯醌中,形成有机碘[45]。
近年来,国内外对于有机碘形成的影响因素研究较多,其中对土壤pH、氧化还原电位、有机质含量、酶活性、Fe/Mn氧化物及其氢氧化物浓度都进行了探究。腐殖质和Fe/Mn氧化物及其氢氧化物在土壤中广泛存在,因此,I–很容易转化为有机碘。腐殖质成分复杂,其结构未知,目前只有部分构建模块存在,下一步的研究方向应是探索有机质和有机碘的具体结构。此外,当土壤氧化还原电位充分降低时,I–从有机碘中解离而导致有机碘含量减少的机理尚不清楚,今后还须进行更加深入的研究和探索。
4 土壤中有机碘的挥发 4.1 烷基碘的生成途径在有机碘的研究中,有关烷基碘的挥发过程占有十分重要的地位。Keppler等[4]研究得到土壤中烷基碘形成的两种途径。腐殖质的单元有2-甲氧基苯酚和邻苯二酚,它们与Fe(Ⅲ)、I–反应生成烷基碘:①在I–、2-甲氧基苯酚和Fe(Ⅲ) 所发生的氧化还原反应中,I–形成了CH3I;而当使用2-乙氧基苯酚或2-丙氧基苯酚作为有机质源时,可形成相应的C2H5I和1-C3H7I;②Fe(Ⅲ)催化邻苯二酚的环断裂,与I–反应,通过带有电子捕获检测器的气相色谱(GC-ECD)分析发现,生成的烷基碘种类有:CH3I、C2H5I、1-C3H7I、2-C3H7I、1-C4H9I和2-C4H9I。
4.2 微生物、高等植物释放烷基碘 4.2.1 微生物释放烷基碘当土壤中存在足够的有机质时,微生物开始生长繁殖,微生物从土壤中捕获不同形态的碘进入体内进行迁移转化。真菌从土壤中捕获IO3–、I–到体内,一部分累积并发生氧化还原反应:I–氧化为I2或HIO,IO3–还原为I2或HIO,进而生成有机碘;另一部分则在体内转化为CH3I挥发到大气中。此外,链格孢菌属和枝孢菌属的一些常见的土生丝状真菌物种也可通过在生物质中的积累而影响碘的迁移、转化和累积[46]。
细菌对碘的转化也具有影响,I–在碘氧化细菌存在的情况下生成有机碘[47];Lee等[2]从Hanford地下水中分离含I–的细菌在培养基中培养,检测细菌是否能产生有机碘,结果表明许多革兰氏阳性细菌(DVZ2,芽孢杆菌,是一类能产生抗力内生孢子的革兰氏阳性菌;等等)和革兰氏阴性细菌(DVZ23,假单胞菌,专性需氧的革兰氏染色阴性无芽胞菌;等等)都能生成有机碘。Amachi等[48]从加I–土壤中随机分离40株细菌,用GC-MS测定挥发性有机碘,研究表明CH3I主要由好氧土壤细菌产生。
4.2.2 高等植物释放烷基碘Saini等[49]研究发现,供试118种植物中有87种具有合成CH3I的能力,其中,甘蓝显示出最高的CH3I释放率。负责CH3I生物合成的基因被命名为HOL基因,在植物、真菌和细菌中,HOL基因的酶产物是SAM(S-腺苷-L-甲硫氨酸)。I–在卤化物甲基转移酶(HMT)/卤化物/硫醇甲基转移酶(HTMT)的催化下,产生CH3I。Itoh等[50]用35种高等植物进行试验,研究发现,由于禾本科高等植物(小麦和水稻)以及十字花科植物(萝卜)体内HMT/HTMT活性较高,导致其具有较高的CH3I排放量。
如图 4所示,I–和SAM在甲基转移酶催化下,生成S-腺苷-同型半胱氨酸(SAH)和CH3I[51]。甲基转移酶在高等植物中广泛存在,如木质素特异性O-甲基转移酶、γ-生育酚甲基转移酶和甾醇甲基转移酶等,由于这些酶催化I–的甲基化,I–可以很容易地嵌入甲基转移酶的活性位点,从而生成CH3I[52]。
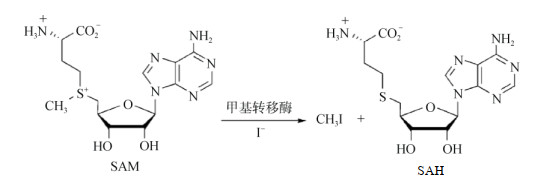
|
图 4 SAM(S-腺苷-L-甲硫氨酸)与I−生成CH3I[51] Fig. 4 SAM (S-adenosine-L-methionine) forms methyl iodine with iodide |
土壤中生成挥发性有机碘的过程主要包括化学转化和生物转化,其中化学转化有两种途径生成烷基碘,其他化学途径尚待研究;而生物方式,主要利用土壤中的生物摄取无机碘转化为挥发性甲基碘。尽管土壤微生物在土壤环境中的生物量很大,但关于其产生CH3I的研究却很少。因此,了解土壤微生物挥发碘的确切途径,对于认识有机碘的生物地球化学循环以及环境中放射性碘(129I)的评价具有重要意义;高等植物中的HTM/HTMT参与有机碘生成的反应是理解自然界中生物转化为CH3I的关键,控制HMT和HTMT的基因已经从拟南芥等高等植物中克隆出来,该基因生成的CH3I具有增强植物耐盐性等功能,但是当前缺乏有关这些酶的信息,导致其在体内的确切作用尚不清楚,需要后续进行进一步的研究。
5 土壤中有机碘的测定方法土壤中总碘含量通常采用分光光度法、X射线荧光法、电化学法、中子活化分析法(NAA)和离子色谱法等方法测定。但是有机碘的测定较为困难,目前常用的方法分为以下3类。
第一类是单独分离出有机碘组分,随后对其碘含量进行分析测定,得到有机碘含量。这类方法的难点在于如何高效地提取有机碘组分。Schmitz等[53]使用一种连续萃取法,对含127I、129I土壤进行分馏,提取组分包括水溶性碘、与有机物结合的碘、残留的碘等,其中,有机碘是通过向土壤样品中加入NH2OH·HCl/ (NH4)2CO3溶液提取得到的。这种提取方法容易造成残留组分碘占比高,而有机碘组分提取的不够完全。Hou等[15]研究被129I污染的土壤,对Schmitz等[53]的分馏程序进行了改进,其中有机碘部分用30% 的H2O2和HNO3的混合物提取,该方法提高了有机碘的萃取效率。提取出有机碘组分之后,采用NAA法对有机碘含量进行测定[54]。
第二类是利用差减法得到有机碘含量,即有机碘含量等于总碘含量与无机碘含量的差值。采用NAA法可以直接测定提取出来的有机碘含量,且高度灵敏和准确,但需要核反应堆,相对成本高,对设备要求精准,无法普及和通用。目前常用的是差减法测定有机碘的含量。Yamada等[55]假设土壤中有4种形态碘:I–、IO3–、HA-I和FA-I,无机碘含量通过添加试剂转化为I–进行测定,总碘通过消化、还原等方法转化为I–间接测定,采用差减法得到有机碘含量;之后其课题组采用改进的连续萃取法[12],用电感耦合等离子体质谱仪测得总碘含量C1,再向其中加入抗坏血酸,沉淀HA-I,得到溶液A,测得A溶液中碘含量C2,HA-I含量为C1和C2的差值;A溶液中加入草酸铵,沉淀FA-I,得到溶液B,测得B溶液中碘含量C3,FA-I含量为C2和C3的差值。胡梦娜等[56]建立了一种有效分离检测土壤中不同形态无机碘(I–和IO3–)的高效液相色谱–电感耦合等离子体质谱法(HPLC-ICP-MS)。Smoleń等[57]使用ICP-MS测定植物中总碘含量,用HPLC-ICP-MS/MS测定植物中I–、IO3–含量,使用液相色谱–质谱法(LC-MS/MS)对植物根系分泌物进行有机碘含量的测定,并将这种方法改善和应用到土壤中测定有机碘,为有机碘含量的测定提供了一种可靠的方法。而对于土壤中有机碘测定的最优方法,还需继续研究。
第三类是利用先进的表征技术对不同形态的碘进行鉴定分析。尺寸排除色谱(SEC)可以根据分子大小分离水样品中的化学物质,当SEC与ICP-MS联用时,可以识别有机碘种类[58]。电喷雾电离(ESI)技术是一种低碎片“软”电离方法,与单质谱仪(MS)或串联质谱仪(MS/MS)结合使用时,可以分析有机碘分子量和结构组成[59]。连续萃取过程中的交叉污染以及化学形式的转化都会引起测定结果的不准确性。为了避免这种现象,可以采用不需要萃取的方法进行碘的形态分析,X射线吸收近边结构(XANES)法是用于直接测定有机碘的有力工具[28]。Shimamoto等[14]用碘K边X射线吸收近边结构(K-edge XANES)和常用的连续萃取法分别测定土壤中的有机碘,前者测得有机碘占比为87%,后者结果偏低,为63%,原因可能是一部分碘结合到胡敏素上,而该组分不溶于酸碱提取液。由此可见,XANES法是直接测定土壤样品中有机碘占比的较好方法。
综上,NAA法测定所需条件特殊,由于核衰变及其计数的统计性,致使该法存在独特的分析误差。采用离子质谱法的顺序提取法,操作程序复杂,重现性较差,导致结果出现偏差。如果碘浓度 < 10 mg/kg,由于背景干扰,XANES分析有机碘将会变得困难。因此,简单高效、费用合理的土壤有机碘的测定方法需要继续探索。
6 总结与展望土壤中有机碘的形成、转化、挥发对自然界碘的迁移转化和生态安全具有重要意义。土壤中IO3–、I–发生氧化还原反应,形成中间体(HIO、I2),在酶存在的情况下,中间体掺入有机质的苯环结合形成有机碘,或者I–在生物体内发生生物转化合成有机碘。土壤pH、有机质含量、酶活性等影响有机碘的形成和转化。由于有机碘的相关研究较少,缺乏相关数据支持,并且有机碘在土壤中的转化十分复杂,因此有机碘研究面临着许多问题与挑战。主要为:①土壤中有机碘的成分繁多,确切的分子结构尚不清楚,阻碍了对有机碘生物地球化学循环的认识,因此下一步的工作需要明确有机碘的具体结构;②HMT和HTMT参与高等植物生成CH3I的过程,当前关于这些酶的信息不够全面,导致其在体内的确切作用尚不清楚,需要后续加强研究补充相关资料;③目前关于胶体态碘的形成、分布和迁移等过程仍没有全面地进行研究,限制了对土壤碘循环的系统认识,了解胶体态碘的形成过程至关重要,今后需要进一步加强该方面的研究。
| [1] |
Budke C, thor Straten S, Mühling K H, et al. Iodine biofortification of field-grown strawberries-Approaches and their limitations[J]. Scientia Horticulturae, 2020, 269: 109317 DOI:10.1016/j.scienta.2020.109317 (  0) 0) |
| [2] |
Lee B D, Moser E L, Brooks S M, et al. Microbial contribution to iodine speciation in hanford's central plateau groundwater: Iodide oxidation[J]. Frontiers in Environmental Science, 2020, 7: 145 DOI:10.3389/fenvs.2019.00145 (  0) 0) |
| [3] |
Li D E, Xu C, Yeager C M, et al. Molecular interaction of aqueous iodine species with humic acid studied by I and C K-edge X-ray absorption spectroscopy[J]. Environmental Science & Technology, 2019, 53(21): 12416-12424 (  0) 0) |
| [4] |
Keppler F, Borchers R, Elsner P, et al. Formation of volatile iodinated alkanes in soil: Results from laboratory studies[J]. Chemosphere, 2003, 52(2): 477-483 DOI:10.1016/S0045-6535(03)00198-X (  0) 0) |
| [5] |
Zhang Y, Cao H, Wang M, et al. A review of iodine in plants with biofortification: Uptake, accumulation, transportation, function, and toxicity[J]. Science of the Total Environment, 2023, 878: 163203 DOI:10.1016/j.scitotenv.2023.163203 (  0) 0) |
| [6] |
Humphrey O S, Young S D, Crout N M J, et al. Short-term iodine dynamics in soil solution[J]. Environmental Science & Technology, 2020, 54(3): 1443-1450 (  0) 0) |
| [7] |
Humphrey O S, Young S D, Bailey E H, et al. Iodine soil dynamics and methods of measurement: A review[J]. Environmental Science: Processes & Impacts, 2018, 20(2): 288-310 (  0) 0) |
| [8] |
史方颖, 张风宝, 杨明义. 基于文献计量分析的土壤有机碳矿化研究进展与热点[J]. 土壤学报, 2022, 59(2): 381-392 (  0) 0) |
| [9] |
Yang Y, Zhang Q, Chen B Y, et al. Toward better understanding vacuum ultraviolet-Iodide induced photolysis via hydrogen peroxide formation, iodine species change, and difluoroacetic acid degradation[J]. Frontiers of Environmental Science & Engineering, 2021, 16(5): 55 (  0) 0) |
| [10] |
Yamaguchi N, Nakano M, Tanida H, et al. Redox reaction of iodine in paddy soil investigated by field observation and the I K-Edge XANES fingerprinting method[J]. Journal of Environmental Radioactivity, 2006, 86(2): 212-226 DOI:10.1016/j.jenvrad.2005.09.001 (  0) 0) |
| [11] |
Li J X, Wang Y X, Guo W, et al. Iodine mobilization in groundwater system at Datong Basin, China: Evidence from hydrochemistry and fluorescence characteristics[J]. Science of the Total Environment, 2014, 468/469: 738-745 DOI:10.1016/j.scitotenv.2013.08.092 (  0) 0) |
| [12] |
Yamada H, Kiriyama T, Onagawa Y, et al. Speciation of iodine in soils[J]. Soil Science and Plant Nutrition, 1999, 45(3): 563-568 DOI:10.1080/00380768.1999.10415819 (  0) 0) |
| [13] |
Alicke B, Hebestreit K, Stutz J, et al. Iodine oxide in the marine boundary layer[J]. Nature, 1999, 397: 572-573 (  0) 0) |
| [14] |
Shimamoto Y S, Takahashi Y, Terada Y. Formation of organic iodine supplied as iodide in a soil-water system in Chiba, Japan[J]. Environmental Science & Technology, 2011, 45(6): 2086-2092 (  0) 0) |
| [15] |
Hou X L, Fogh C L, Kucera J, et al. Iodine-129 and Caesium-137 in Chernobyl contaminated soil and their chemical fractionation[J]. Science of the Total Environment, 2003, 308(1/2/3): 97-109 (  0) 0) |
| [16] |
Schwehr K A, Santschi P H, Kaplan D J, et al. Organo-iodine formation in soils and aquifer sediments at ambient concentrations[J]. Environmental Science & Technology, 2009, 43(19): 7258-7264 (  0) 0) |
| [17] |
Hansen V, Roos P, Aldahan A, et al. Partition of iodine (129I and 127I) isotopes in soils and marine sediments[J]. Journal of Environmental Radioactivity, 2011, 102(12): 1096-1104 DOI:10.1016/j.jenvrad.2011.07.005 (  0) 0) |
| [18] |
Duborská E, Bujdoš M, Urík M, et al. Iodine fractionation in agricultural and forest soils using extraction methods[J]. CATENA, 2020, 195: 104749 DOI:10.1016/j.catena.2020.104749 (  0) 0) |
| [19] |
武天云, Jeff J. Schoenau, 李凤民, 等. 土壤有机质概念和分组技术研究进展[J]. 应用生态学报, 2004, 15(4): 717-722 DOI:10.3321/j.issn:1001-9332.2004.04.036 (  0) 0) |
| [20] |
Roulier M, Carasco L, Orjollet D, et al. Iodine distribution and volatilization in contrasting forms of forest humus during a laboratory incubation experiment[J]. Journal of Environmental Radioactivity, 2022, 248: 106872 DOI:10.1016/j.jenvrad.2022.106872 (  0) 0) |
| [21] |
常琳溪, 梁新然, 王磊, 等. 中国稻田土壤有机碳汇特征与影响因素的研究进展[J]. 土壤, 2023, 55(3): 487-493 (  0) 0) |
| [22] |
Duborská E, Matulová M, Vaculovič T, et al. Iodine fractions in soil and their determination[J]. Forests, 2021, 12(11): 1512 DOI:10.3390/f12111512 (  0) 0) |
| [23] |
周江敏, 代静玉, 潘根兴. 土壤中水溶性有机质的结构特征及其与富里酸、胡敏酸的比较[J]. 土壤, 2004, 36(1): 46-50 DOI:10.3321/j.issn:0253-9829.2004.01.010 (  0) 0) |
| [24] |
Schlegel M L, Reiller P, Mercier-Bion F, et al. Molecular environment of iodine in naturally iodinated humic substances: Insight from X-ray absorption spectroscopy[J]. Geochimica & Cosmochimica Acta, 2006, 70(22): 5536-5551 (  0) 0) |
| [25] |
Moulin V, Reiller P, Amekraz B, et al. Direct characterization of iodine covalently bound to fulvic acids by electrospray mass spectrometry[J]. Rapid Communications in Mass Spectrometry: RCM, 2001, 15(24): 2488-2496 DOI:10.1002/rcm.503 (  0) 0) |
| [26] |
Xu C, Lin P, Garimella R, et al. 1H-13C heteronuclear single quantum coherence NMR evidence for iodination of natural organic matter influencing organo-iodine mobility in the environment[J]. Science of the Total Environment, 2022, 814: 152546 DOI:10.1016/j.scitotenv.2021.152546 (  0) 0) |
| [27] |
Xu C, Zhang S, et al. Role of natural organic matter on iodine and 239, 240 Pu distribution and mobility in environmental samples from the northwestern Fukushima Prefecture, Japan[J]. Journal of Environmental Radioactivity, 2016, 153: 156-166 DOI:10.1016/j.jenvrad.2015.12.022 (  0) 0) |
| [28] |
Yamaguchi N, Nakano M, Takamatsu R, et al. Inorganic iodine incorporation into soil organic matter: Evidence from iodine K-edge X-ray absorption near-edge structure[J]. Journal of Environmental Radioactivity, 2010, 101(6): 451-457 DOI:10.1016/j.jenvrad.2008.06.003 (  0) 0) |
| [29] |
Kaplan D I, Zhang S, et al. Radioiodine concentrated in a wetland[J]. Journal of Environmental Radioactivity, 2014, 131: 57-61 DOI:10.1016/j.jenvrad.2013.09.001 (  0) 0) |
| [30] |
Bowley H E, Young S D, Ander E L, et al. Iodine bioavailability in acidic soils of Northern Ireland[J]. Geoderma, 2019, 348: 97-106 DOI:10.1016/j.geoderma.2019.04.020 (  0) 0) |
| [31] |
Pisarek P, Bueno M, Thiry Y, et al. Influence of tree species on selenium and iodine partitioning in an experimental forest ecosystem[J]. Science of the Total Environment, 2022, 809: 151174 DOI:10.1016/j.scitotenv.2021.151174 (  0) 0) |
| [32] |
Takeda A, Tsukada H, Takahashi M, et al. Changes in the chemical form of exogenous iodine in forest soils and their extracts[J]. Radiation Protection Dosimetry, 2015, 167(1/2/3): 181-186 (  0) 0) |
| [33] |
Söderlund M, Virkanen J, Aromaa H, et al. Sorption and speciation of iodine in boreal forest soil[J]. Journal of Radioanalytical and Nuclear Chemistry, 2017, 311(1): 549-564 DOI:10.1007/s10967-016-5022-z (  0) 0) |
| [34] |
Allard S, Gallard H, Fontaine C, et al. Formation of methyl iodide on a natural manganese oxide[J]. Water Research, 2010, 44(15): 4623-4629 DOI:10.1016/j.watres.2010.06.008 (  0) 0) |
| [35] |
Duborská E, Urík M, Bujdoš M, et al. Influence of physicochemical properties of various soil types on iodide and iodate sorption[J]. Chemosphere, 2019, 214: 168-175 DOI:10.1016/j.chemosphere.2018.09.041 (  0) 0) |
| [36] |
Irshad M, Mohiuddin M, Hussain Z, et al. Leachability of iodine from soils of different land uses as affected by selected amendments[J]. Environmental Engineering and Management Journal, 2019, 18(9): 2095-2103 DOI:10.30638/eemj.2019.199 (  0) 0) |
| [37] |
Xue X B, Li J X, Wang Y X. Implications of depositional environment on the iodine enrichment in the sedimentary system: Evidences from the N-alkane in sediments[J]. E3S Web of Conferences, 2019, 98: 09033 DOI:10.1051/e3sconf/20199809033 (  0) 0) |
| [38] |
Moriyasu R, Evans N, Bolster K M, et al. The distribution and redox speciation of iodine in the eastern tropical North Pacific Ocean[J]. Global Biogeochemical Cycles, 2020, 34(2): e2019GB00630 (  0) 0) |
| [39] |
Gao Y, Jiang J, Zhou Y, et al. Does soluble Mn(Ⅲ) oxidant formed in situ account for enhanced transformation of triclosan by Mn(Ⅶ) in the presence of ligands?[J]. Environmental Science & Technology, 2018, 52(8): 4785-4793 (  0) 0) |
| [40] |
Gallard H, Allard S, Nicolau R, et al. Formation of iodinated organic compounds by oxidation of iodide- containing waters with manganese dioxide[J]. Environmental Science & Technology, 2009, 43(18): 7003-7009 (  0) 0) |
| [41] |
姚远, 余光辉, 滕辉. 土壤铁氧化物–亚铁的相互作用及其环境影响研究进展[J]. 土壤, 2023, 55(4): 718-728 (  0) 0) |
| [42] |
Shetaya W H, Young S D, Watts M J, et al. Iodine dynamics in soils[J]. Geochimica & Cosmochimica Acta, 2012, 77: 457-473 (  0) 0) |
| [43] |
谭向平, 何金红, 郭志明, 等. 土壤酶对重金属污染的响应及指示研究进展[J]. 土壤学报, 2023, 60(1): 50-62 (  0) 0) |
| [44] |
Anusaraporn S, Dolphen R, Thiravetyan P. Importance of laccase enzyme and triiodide for gold leaching from silicate ore by marine bacterium Acinetobacter sp[J]. Process Safety and Environmental Protection, 2022, 161: 788-800 DOI:10.1016/j.psep.2022.03.054 (  0) 0) |
| [45] |
Sdahl M, Conrad J, Braunberger C, et al. Efficient and sustainable laccase-catalyzed iodination of p-substituted phenols using KI as iodine source and aerial O2 as oxidant[J]. RSC Advances, 2019, 9(34): 19549-19559 DOI:10.1039/C9RA02541C (  0) 0) |
| [46] |
Duborská E, Urík M, Bujdoš M. Comparison of iodide and iodate accumulation and volatilization by filamentous fungi during static cultivation[J]. Water, Air, & Soil Pollution, 2017, 228(6): 225 (  0) 0) |
| [47] |
严爱兰. 碘生物地球化学行为的125Ⅰ示踪与植物中生物碘的稳定性研究[D]. 杭州: 浙江大学, 2008.
(  0) 0) |
| [48] |
Amachi S, Kasahara M, Hanada S, et al. Microbial participation in iodine volatilization from soils[J]. Environmental Science & Technology, 2003, 37(17): 3885-3890 (  0) 0) |
| [49] |
Saini H S, Attieh J M, Hanson A D. Biosynthesis of halomethanes and methanethiol by higher plants via a novel methyltransferase reaction[J]. Plant, Cell & Environment, 1995, 18(9): 1027-1033 (  0) 0) |
| [50] |
Itoh N, Toda H, Matsuda M, et al. Involvement of S- adenosylmethionine-dependent halide/thiol methyltransferase (HTMT) in methyl halide emissions from agricultural plants: Isolation and characterization of an HTMT-coding gene from Raphanus sativus (daikon radish)[J]. BMC Plant Biology, 2009, 9: 116 DOI:10.1186/1471-2229-9-116 (  0) 0) |
| [51] |
Schmidberger J W, James A B, Edwards R, et al. Halomethane biosynthesis: Structure of a SAM-dependent halide methyltransferase from Arabidopsis thaliana[J]. Angewandte Chemie (International Ed in English), 2010, 49(21): 3646-3648 DOI:10.1002/anie.201000119 (  0) 0) |
| [52] |
Manley S L. Phytogenesis of halomethanes: A product ofselection or a metabolic accident?[J]. Biogeochemistry, 2002, 60(2): 163-180 DOI:10.1023/A:1019859922489 (  0) 0) |
| [53] |
Schmitz K, Aumann D C. A study on the association of two iodine isotopes, of natural 127I and of the fission product 129I, with soil components using a sequential extraction procedure[J]. Journal of Radioanalytical and Nuclear Chemistry, 1995, 198(1): 229-236 DOI:10.1007/BF02038260 (  0) 0) |
| [54] |
李雅琦. 黄土高原土壤中微量元素的中子活化分析[J]. 光谱实验室, 2000, 17(3): 350-354 DOI:10.3969/j.issn.1004-8138.2000.03.027 (  0) 0) |
| [55] |
Yamada H, Sugahara M, Kosaka H, et al. Determination of total and water soluble iodine in soil by high performance liquid chromatography[J]. Soil Science and Plant Nutrition, 1996, 42(2): 367-374 DOI:10.1080/00380768.1996.10415107 (  0) 0) |
| [56] |
胡梦娜, 周启星, 陈翠红, 等. 高效液相色谱–电感耦合等离子体质谱法测定土壤中不同形态的无机碘[J]. 分析测试学报, 2019, 38(11): 1389-1392 DOI:10.3969/j.issn.1004-4957.2019.11.018 (  0) 0) |
| [57] |
Smoleń S, Czernicka M, Kowalska I, et al. New aspects of uptake and metabolism of non-organic and organic iodine compounds-the role of vanadium and plant-derived thyroid hormone analogs in lettuce[J]. Frontiers in Plant Science, 2021, 12: 653168 DOI:10.3389/fpls.2021.653168 (  0) 0) |
| [58] |
Bowley H E, Young S D, Ander E L, et al. Iodine binding to humic acid[J]. Chemosphere, 2016, 157: 208-214 DOI:10.1016/j.chemosphere.2016.05.028 (  0) 0) |
| [59] |
Moulin C, Amekraz B, Hubert S, et al. Study of thorium hydrolysis species by electrospray-ionization mass spectrometry[J]. Analytica Chimica Acta, 2001, 441(2): 269-279 DOI:10.1016/S0003-2670(01)01084-4 (  0) 0) |
2. College of Environmental Science and Engineering, North China Electric Power University, Beijing 102206, China
 2024, Vol. 56
2024, Vol. 56


