2. 贵州省烟草公司遵义市公司, 贵州遵义 563000;
3. 南通大学地理科学学院, 江苏南通 226019
烟草是一种重要的经济作物,我国烟草种植面积及产量长期位居世界首位,在国民经济中具有非常重要的地位[1]。优质的土壤条件是烟草健康生长和产量形成的重要前提[2]。长期以来,我国普遍存在着重化肥而轻有机肥且偏施氮肥的现象,不仅导致肥料利用率较低、土壤肥力和生物功能下降,还严重限制了农作物产量和品质的提高[3]。研究表明,通过有机肥料结合化肥施用,既能降低养分损失,又能提高肥料利用率,从而提高作物产量和品质[4-5]。在为烟草植株提供全方位营养的同时,有机肥施用还能增强根际微生物活性,改善土壤理化特性,为烟草根系健康发展创造有利环境,从而实现烟草的高产优质[6]。
中国是世界上最大的白酒生产国和消费国,根据国家统计局数据,2018年以来中国白酒年均产量达到了7.6×106 t[7],而生产1 t白酒会伴随产生3 ~ 4 t酒糟废弃物,因此每年酒糟产量约为2.4×107 t[8]。白酒酒糟中含有一些营养物质如蛋白质、纤维素、淀粉、脂肪等,可用于堆肥或作为畜禽高营养饲料[9]。以酒糟为原料制作有机肥不仅可以为作物生长提供良好的有机环境,同时还兼具环保的功效,具有较高的生态效益和经济效益[10]。有研究表明,利用特殊发酵技术可将酒糟充分腐熟转化为速效养分含量较很高的有机肥,将其施入土壤后,可以促进烟株生长发育,提高土壤养分和根系指标及对烟株病害的抗性[11]。因此,合理利用酒糟资源可促进烟草农业的绿色、生态与可持续发展。
土壤微生物对土壤新陈代谢、生态系统功能维持、土壤肥力形成、养分有效利用具有十分重要的意义[12]。真菌是土壤微生物群落的重要组成部分,对生态系统的结构与功能具有重要的影响,具有寄生、分解、致病和共生等一系列重要作用。以往研究发现,氮肥的施用可导致土壤中真菌数量减少、物种多样性下降、菌群结构发生明显改变[13],而施用有机肥则改变土壤真菌群落的结构,提高腐生营养型真菌的比例,促进土壤生态功能的稳定与健康[14]。近年来,许多学者研究了施用有机肥对土壤理化性质和烟草产量及品质的影响。然而,酒糟有机肥在烤烟土壤上的应用及其对土壤真菌群落的影响却鲜有报道。因此,本研究探究了施用酒糟有机肥对土壤主要化学性质和真菌群落的影响,分析了土壤化学性质与真菌群落结构和组成之间的关系,以期为酒糟有机肥在植烟土壤上的推广和应用提供理论依据。
1 材料与方法 1.1 试验点信息试验地位于贵州省遵义市播州区(106°81´E, 27°51´N)。遵义是全国最大的烟草主产区,拥有丰富的资源和优良的生态环境,是全国重要的烟草生产基地。其地处亚热带,属于湿润的季风气候区域。试验点土壤类型为黄壤,该地区年平均降水量968 mm,平均气温15.0 ℃。
1.2 试验设计田间试验设置酒糟有机肥施用量为0(CK)和1.5 t/hm2 (DG)两个处理,每个处理3次重复,共计6个小区,每个小区面积为200 m2,采用完全随机区组试验设计。供试酒糟有机肥的全氮、全磷、全钾、有机质及总腐殖酸的含量分别为29、15、118、632和256 g/kg,pH为6.9,由遵义市播州区紫星有机肥厂提供。各处理化肥施用和田间管理技术相同,均按当地优质烟标准化生产技术规范执行。在起垄前施用525 kg/hm2复合肥(N-P2O5-K2O : 10-10-24)作为基肥;15 d后,用井窖式移栽机在田间垄上钻取直径8 cm、深20 cm、孔距50 cm的圆坑移栽烟苗,随后,将45 kg/hm2复合肥(N-P2O5-K2O : 22-14-10)用水溶解后作为苗肥喷洒在靠近幼苗的土壤表面;移栽7 d后,在距离植株约15 cm处打孔追肥105 kg/hm2溶于水的复合肥(N-P2O5-K2O: 15-0-30),移栽30 d后追施120 kg/hm2。追肥结束5 d后,在井窖中施加酒糟有机肥,并用土壤填充覆盖。各小区试验于烟草打顶后第6 d分别选择代表性烟株5株,选取烟株中部最大叶片,用卷尺测量叶长和叶宽;对各处理以小区为单位单采单收挂牌烘烤,分别统计其产量。本研究中所用烟草品种为云烟87,于2022年5月8日移栽,2022年8月29日最终收获。
1.3 土壤样品采集与分析利用土钻分别于团棵期(2022年6月5日)、旺长期(2022年7月12日)和成熟期(2022年8月15日)采集距离烟株5 cm的0~20 cm土层土壤样品,每个小区设置6个采样点并混合成1个样品。收集到的土壤样品立刻放入塑封袋中,然后迅速转移到装有冰袋的保温箱中,并尽快转运到实验室。所有新鲜土壤样品首先通过2.0 mm网筛,去除细根和凋落物,留取大约25 g新鲜土壤保存于–80 ℃冰箱用于土壤DNA的提取。剩余的土壤样品在阴凉处风干,研磨后通过0.85 mm和0.149 mm的网筛以备土壤化学性质的分析。土壤化学性质的测定包括土壤pH、有效磷(AP)、有机质(SOM)、全碳(TC)、全氮(TN)、铵态氮(NH4+-N)和硝态氮(NO3−-N),各指标具体分析方法参照《土壤农业化学分析方法》[15]。
1.4 土壤DNA提取及PCR扩增土壤DNA提取和PCR扩增:称取0.5 g新鲜土壤样品并利用FastDNA SPIN试剂盒(MP Biomedicals, Santa Ana, CA, USA)进行土壤DNA的提取,操作步骤按说明书进行。用1% 琼脂糖凝胶电泳检测提取的土壤DNA质量,利用NanoDrop-2000分光光度计(NanoDrop Technologies, Wilmington, NC, USA)定量测定土壤样品DNA浓度。使用引物ITS1F/ITS2R (ITS1F: 5’-CTTGGTCATTTAGAGGAAGTAA-3’,ITS2R: 5’- GCTGCGTTCTTCATCGATGC-3’)对真菌ITS1区域进行PCR扩增。ITS基因PCR扩增在50 µL反应体系中进行,其中包括25 µL GoTaq®Green Master Mix 2x(Promega),正反向引物各1.5 µL(10 µmol/L),稀释10倍的模板DNA 10 µL,用ddH2O调节终体积至50 µL,每个样品进行3次重复并合并为1个样品。利用Illumina公司的Miseq PE300平台进行测序(上海美吉生物医药科技有限公司)。
1.5 数据分析使用R语言(v4.2.3)对测序数据进行处理和分析。其中,使用DADA2包对双端测序的原始序列进行质量控制和拼接,物种注释参考的数据库为UNITE(v8.0);利用vegan包和microeco包对真菌群落α多样性指数进行计算和真菌群落主坐标分析(PCoA)、基于距离的冗余分析(db-RDA)和置换多元方差分析(PERMANOVA);使用Hmisc包对土壤化学性质与真菌多样性指数和主要真菌在门水平上的相对丰度进行Pearson相关性分析,其结果用linkET包进行了可视化。
2 结果与分析 2.1 施用酒糟有机肥对烟草产量和土壤化学性质的影响由表 1可知,施用酒糟有机肥显著增加了烟草叶片的最大叶长和叶宽,烟草产量较对照显著提高了14.8%。比较不同采样时期土壤化学指标发现(表 2),施加酒糟有机肥后,团棵期、旺长期、成熟期的土壤有机质和全碳含量均显著高于CK处理,而土壤全氮含量仅在成熟期显著高于CK处理。酒糟有机肥处理的土壤有效磷含量在团棵期和旺长期显著高于CK处理,但在成熟期无显著差异。施用酒糟有机肥对烟草不同生长时期的土壤pH和无机氮(NH4+-N和NO3−-N)无显著影响。
|
|
表 1 酒糟有机肥施用对烟叶特征和产量的影响 Table 1 Effects of distillers' grain organic fertilizer on agronomic traits and yields of tobacco leaves |
|
|
表 2 酒糟有机肥对不同采样时期土壤化学性质的影响 Table 2 Effects of distillers' grain organic fertilizer on soil chemical properties at different sampling time |
从18份土壤样品中共鉴定出4 063种扩增子序列变体(ASV),其中CK和DG处理之间共享1 017个ASV,其序列数占序列总数的89.4%(图 1)。在门分类水平上,所有土壤样品的真菌群落均以子囊菌门(Ascomycota)、被孢霉门(Mortierellomycota)、担子菌门(Basidiomycota)和罗兹菌门(Rozellomycota)占优势,4个门的相对丰度总和大于90%(图 2A)。在团棵期,DG处理中的子囊菌门和担子菌门的相对丰度略低于CK处理,被孢霉门和罗兹菌门相对丰度略高于CK处理;在旺长期,DG处理中被孢霉门相对丰度高于CK处理,而罗兹菌门相对丰度低于CK处理;在成熟期,DG处理中的被孢霉门相对丰度低于CK处理,担子菌门相对丰度则高于CK处理(图 2A)。
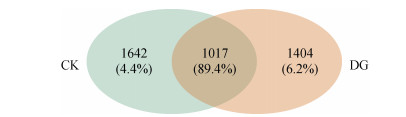
|
(图中的数字表示ASV数,括号内百分数为序列数与总序列数的比值) 图 1 土壤扩增子序列变体(ASV)维恩图 Fig. 1 Venn diagram of soil amplicon sequence variants (ASVs) |

|
(处理代号中数字表示采样时期,下同) 图 2 不同采样时期土壤中优势菌门(TOP 10)和优势菌属(TOP 20)的相对丰度 Fig. 2 Relative abundance of dominant bacteria phyla (TOP 10) and genera (TOP 20) in soils at different sampling times |
在属分类水平上,烟草生长的3个不同时期镰刀菌属(Fusarium)、被孢霉属(Mortierella)和枝顶孢霉属(Acremonium)的相对丰度均较高。DG处理下真菌属水平相对丰度与CK处理相比均存在一定的差异,如在团棵期和旺长期,DG处理提高了毛葡孢属(Botryotrichum)、瓶毛壳属(Lophotrichus)和无茎霉菌属(Acaulium)的相对丰度;在成熟期,DG处理的篮状菌属(Talaromyces)和Rhodosporidiobolus属的相对丰度较高(图 2B)。
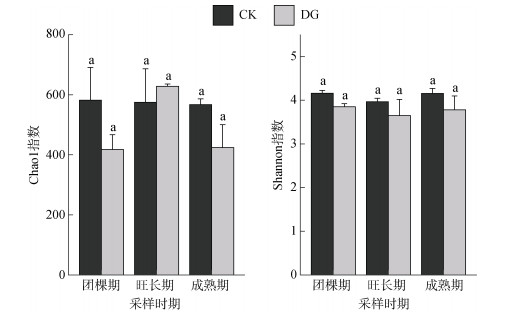
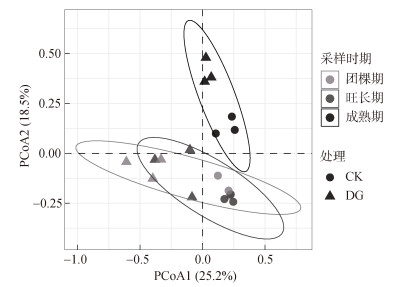
对于土壤真菌α多样性指数,方差分析显示,在3个不同采样时期,CK处理与DG处理的Chao1指数和Shannon指数均未表现出显著差异(图 3)。PCoA结果显示(图 4),CK处理与DG处理的真菌群落结构存在显著差异,CK处理和DG处理样本点沿PCoA1方向分离,成熟期土壤样品点沿PCoA2方向与团棵期和旺长期的样本点分离,说明在成熟期土壤真菌的群落组成与团棵期和旺长期存在较大差异(PERMANOVA,P < 0.05,表 3);团棵期和旺长期的样本点在PCoA图上的距离较近(图 4),说明这两个时期土壤真菌群落的差异较小。
|
(图中相同小写字母表示同一时期CK与DG处理间不存在显著差异(t检验,P < 0.05)) 图 3 土壤真菌Chao1和Shannon指数 Fig. 3 Chao1 and Shannon indices of soil fungi |
|
图 4 不同采样时期施用和未施用酒糟有机肥土壤真菌群落的主坐标分析 Fig. 4 PCoA of soil fungal communities with and without distillers' grain organic fertilizer at different sampling times |
|
|
表 3 烟草不同生长时期土壤真菌群落多元置换方差分析表 Table 3 PErMANOVA of soil fungal communities at different tobacco-growing stages |
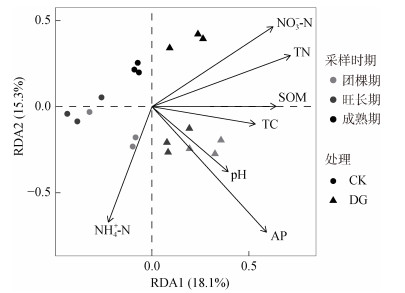
db-RDA用于确定土壤化学性质与真菌群落之间的关系(图 5)。db-RDA分析的前两个主要轴分别解释了18.1% 和15.3% 的真菌群落变异。土壤AP是驱动土壤真菌群落变化的主导因子,它可以单独解释8.10% 的真菌群落变化(表 4);其次是TN (6.65%)、NO3--N(6.42%)、NH4+-N(5.65%)、SOM(5.49%)、pH(4.58%)、TC(4.51%)。从表 4中可以观察到AP(P= 0.007)、TN(P=0.036)、NO3--N(P=0.045)、NH4+-N(P= 0.048)与真菌群落变化之间存在显著相关性。
|
图 5 土壤真菌群落和化学性质的冗余分析 Fig. 5 Redundancy analysis of soil fungal community and chemical properties |
|
|
表 4 每种土壤化学性质可以独立解释的群落变化差异 Table 4 Differences in fungal community changes that can be independently explained by each soil chemical property |
利用Pearson法对土壤主要真菌门的相对丰度和多样性指数与土壤化学性质进行相关性分析,如图 6所示,NO3--N含量与担子菌门的相对丰度呈显著正相关,AP含量与担子菌门的相对丰度呈显著负相关,土壤pH、NH4+-N、SOM、TC、TN与真菌门均无显著相关性,AP含量与Shannon指数呈显著负相关(图 6)。
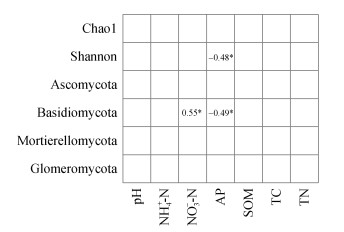
|
图 6 土壤真菌α多样性指数和主要真菌(门水平)相对丰度与土壤化学性质之间的Pearson相关性 Fig. 6 Pearson relationships between α diversity index of soil fungi and relative abundances of major fungi (phylum level) with chemical properties |
作为谷物蒸馏过程的副产品,酒糟中含有较丰富的粗蛋白、粗淀粉、粗脂肪和粗纤维以及酿酒微生物发酵产生的一定量醇类、酸类、酯类和少量醛类等有机物[16],且含有丰富的磷、钾等植物生长发育所需的矿物元素。这些营养物质和元素能够为土壤微生物提供生活物质,促进微生物的活动和根际营养,进而提升烟叶的产量和品质。将酒糟有机肥施用到土壤中,显著提高了土壤SOM和TC的含量,除酒糟有机肥的直接作用外,还可能是酒糟有机肥的加入增加了土壤的固碳速率[17]。然而,只有在成熟期本研究观察到土壤TN有显著变化,土壤无机氮(NH4+-N和NO3--N)在3个采样时期均没有显著变化。有研究表明,烟草对氮素的吸收主要发生在烟叶生长的初期,烟草植株对氮的吸收和无机氮周转速率较快可能是酒糟有机肥处理和对照相比土壤中无机氮素无显著差异的主要原因[18]。施用酒糟有机肥后,烟草植株生长前期土壤AP含量较高,酒糟有机肥的添加会影响土壤磷的有效性,也可能会影响其作用的时效性;添加酒糟有机肥较长时间后,土壤中的磷除被烟草植株吸收外,还可能和土壤颗粒结合在一起,被土壤颗粒固定,从而使可测出的土壤AP含量有所降低[19]。
3.2 施用酒糟有机肥对土壤真菌群落的影响腐烂的有机物为土壤微生物提供可利用的有机碳和必需的营养物质[20]。土壤条件或土壤环境的变化可以改变微生物的组成和特征[21]。本研究中,DG和CK处理相比,其真菌不同的ASV序列条数占总扩增条数的10.6%,在门分类水平上,与成熟期的真菌群落组成相比,烟草生长前期施用酒糟有机肥和不施用酒糟有机肥的土壤真菌群落组成更相似,这表明土壤微生物可能需要一定的演化时间才能达到新的群落平衡。尽管CK和DG处理的优势菌门相对丰度结果较为类似,子囊菌门、被孢霉门、担子菌门和罗兹菌门是烟草整个生长时期主要的真菌门,但随着烟草的生长,DG处理仍然对这些优势菌门的相对丰度产生了一定的影响。其中,被孢霉菌是白酒多微生物共发酵的常见菌种,DG处理下,其相对丰度在烟草生长的前期较高,但至烟草成熟期,DG处理下其相对丰度与CK处理无显著差异,而DG处理中担子菌门的相对丰度有所增加,这可能与担子菌易与植物形成菌根结构有关。研究表明,有机肥不仅能够改变丛菌根真菌的群落结构,还能增加其多样性,从而促进土壤磷的持续供应[22]。从属分类水平上看,在烟草生长的不同时期,酒糟有机肥处理也引起了众多菌属相对丰度的变化,而大多数相对丰度升高的菌属以腐生营养型为主。以往研究也表明,有机肥料会提高腐生营养类真菌的比例,从而促进土壤生态的稳定与健康[23]。此外,本研究中,施用酒糟有机肥对土壤真菌Chao1指数和Shannon指数均没有显著影响(图 3)。但对真菌的群落结构产生了显著影响,尤其是成熟期,与团棵期和旺长期的差异较大(图 4),这可能是由于施用酒糟并没有影响真菌的种类数,但影响了某些关键类群的相对丰度所致。
3.3 土壤化学性质与真菌群落的相关关系有机肥中含有大量的碳、氮等元素以及中、微量元素,这些元素既能为微生物生长繁殖提供丰富的物质能源,又能提高土壤的肥力,促进土壤微生物的生长,影响微生物群落的组成。PCoA分析结果显示,DG和CK处理明显分离,表明这两种处理的真菌群落组成存在明显差异(图 4)。有报道称,长期连续施用有机肥和氮肥会改变土壤养分有效性,从而对真菌群落组成产生显著影响[24]。本研究进一步通过db-RDA分析了土壤化学性质对真菌群落的影响程度,发现土壤AP是影响真菌群落的主要环境因子,其次是TN和NO3--N(图 5)。不同的土壤化学性质均可以在一定程度上解释CK和DG处理中的真菌群落差异。磷元素在生物的免疫反应中发挥重要作用,它可以避免植物受到土壤微生物群落中致病微生物的影响[25]。早前的研究也表明pH是影响真菌群落的最重要因素[26-27]。然而,在本研究中,与其他环境因子影响相比,施用酒糟有机肥对土壤pH的影响较小(表 2)。真菌是完全异养的生物群落,因此碳元素在决定真菌群落组成方面发挥了关键作用,在所有土壤化学性质中,SOM与RDA1轴高度相关,表明其在解释土壤真菌群落变异方面的重要性,酒糟有机肥对土壤中SOM含量的提升作用也会为土壤真菌的生长提供碳源和能源。
4 结论本研究表明,施用酒糟有机肥对植烟土壤真菌群落有明显的影响,且主要影响真菌的群落组成,而对真菌群落的α多样性无显著影响。子囊菌门、被孢霉门、担子菌门是烟草整个生长时期丰度较高的真菌门,施用酒糟有机肥能够调节烟草不同生长时期真菌的群落组成。酒糟有机肥对土壤真菌群落的影响也随烟草的生长而增大。土壤AP是驱动土壤真菌群落变化的主导因子。
| [1] |
苏贤坤, 张晓海, 廖德智. 烟草综合利用现状及其前景[J]. 贵州农业科学, 2006, 34(5): 120-123 (  0) 0) |
| [2] |
温烜琳, 马宜林, 周俊学, 等. 腐熟羊粪有机肥配施无机肥对植烟土壤微生物群落结构和多样性的影响[J]. 土壤, 2023, 55(4): 804-811 DOI:10.13758/j.cnki.tr.2023.04.014 (  0) 0) |
| [3] |
韦建玉, 寇智瑞, 金亚波, 等. 烤烟专用有机肥的优选及肥效验证[J]. 土壤, 2020, 52(3): 464-469 DOI:10.13758/j.cnki.tr.2020.03.006 (  0) 0) |
| [4] |
Dimkpa C O, Fugice J, Singh U, et al. Development of fertilizers for enhanced nitrogen use efficiency - Trends and perspectives[J]. The Science of the Total Environment, 2020, 731: 139113 DOI:10.1016/j.scitotenv.2020.139113 (  0) 0) |
| [5] |
Zhuang M H, Lam S K, Zhang J, et al. Effect of full substituting compound fertilizer with different organic manure on reactive nitrogen losses and crop productivity in intensive vegetable production system of China[J]. Journal of Environmental Management, 2019, 243: 381-384 DOI:10.1016/j.jenvman.2019.05.026 (  0) 0) |
| [6] |
刘勇军, 周羽, 靳志丽, 等. 有机物料类型对烟草根际微生物及烟叶产质量的影响[J]. 土壤, 2018, 50(2): 312-318 DOI:10.13758/j.cnki.tr.2018.02.013 (  0) 0) |
| [7] |
国家统计局. 中国统计年鉴[M].
中国统计出版社, 北京, 2023
(  0) 0) |
| [8] |
Gao M, Lin Y J, Wang P, et al. Production of medium-chain fatty acid caproate from Chinese liquor distillers' grain using pit mud as the fermentation microbes[J]. Journal of Hazardous Materials, 2021, 417: 126037 DOI:10.1016/j.jhazmat.2021.126037 (  0) 0) |
| [9] |
Xu H G, Xu X, Tao Y D, et al. Optimization by response surface methodology of supercritical carbon dioxide extraction of flavour compounds from Chinese liquor vinasse[J]. Flavour and Fragrance Journal, 2015, 30(4): 275-281 DOI:10.1002/ffj.3240 (  0) 0) |
| [10] |
康洋. 基于鸡粪、酒糟的有机肥配施化肥对茶园土壤与茶叶品质的影响[D]. 成都: 四川农业大学, 2018.
(  0) 0) |
| [11] |
陈雪, 翟欣, 杨振智, 等. 特制酒糟有机肥对喀斯特烟区烤烟生长与品质的影响[J]. 土壤学报, 2019, 56(5): 1151-1160 (  0) 0) |
| [12] |
Mandal A, Patra A K, Singh D, et al. Effect of long-term application of manure and fertilizer on biological and biochemical activities in soil during crop development stages[J]. Bioresource Technology, 2007, 98(18): 3585-3592 DOI:10.1016/j.biortech.2006.11.027 (  0) 0) |
| [13] |
Paungfoo-Lonhienne C, Yeoh Y K, Kasinadhuni N R P, et al. Nitrogen fertilizer dose alters fungal communities in sugarcane soil and rhizosphere[J]. Scientific Reports, 2015, 5: 8678 DOI:10.1038/srep08678 (  0) 0) |
| [14] |
何冬冬, 魏欣琪, 林紫婷, 等. 不同有机肥对植烟红壤真菌群落结构及功能的影响[J]. 植物营养与肥料学报, 2020, 26(11): 2081-2094 DOI:10.11674/zwyf.20209 (  0) 0) |
| [15] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000
(  0) 0) |
| [16] |
孔博, 蔡林洋, 徐健, 等. 浓香型白酒糟基本成分检测与酶水解[J]. 酿酒, 2020, 47(1): 79-83 DOI:10.3969/j.issn.1002-8110.2020.01.025 (  0) 0) |
| [17] |
何伟, 王会, 韩飞, 等. 长期施用有机肥显著提升潮土有机碳组分[J]. 土壤学报, 2020, 57(2): 425-434 (  0) 0) |
| [18] |
于素华. 氮钾配施对烟草生长及氮素积累和利用的影响[J]. 农业与技术, 2016, 36(20): 42–43, 48 (  0) 0) |
| [19] |
Nziguheba G, Merckx R, Palm C A, et al. Organic residues affect phosphorus availability and maize yields in a Nitisol of western Kenya[J]. Biology and Fertility of Soils, 2000, 32(4): 328-339 DOI:10.1007/s003740000256 (  0) 0) |
| [20] |
Vidal A, Klöffel T, Guigue J, et al. Visualizing the transfer of organic matter from decaying plant residues to soil mineral surfaces controlled by microorganisms[J]. Soil Biology and Biochemistry, 2021, 160: 108347 DOI:10.1016/j.soilbio.2021.108347 (  0) 0) |
| [21] |
Abdul Rahman N S N, Abdul Hamid N W, Nadarajah K. Effects of abiotic stress on soil microbiome[J]. International Journal of Molecular Sciences, 2021, 22(16): 9036 DOI:10.3390/ijms22169036 (  0) 0) |
| [22] |
胡凯婕, 栾璐, 郑洁, 等. 秸秆还田方式对丛枝菌根真菌群落和玉米磷素利用的影响[J]. 土壤学报, 2023, 60(1): 269-279 (  0) 0) |
| [23] |
张瑞平, 苟小梅, 张毅, 等. 生物有机肥与化肥配施对植烟土壤养分和真菌群落特征的影响[J]. 西北农林科技大学学报(自然科学版), 2020, 48(8): 85-92 (  0) 0) |
| [24] |
Gu S S, Hu Q L, Cheng Y Q, et al. Application of organic fertilizer improves microbial community diversity and alters microbial network structure in tea (Camellia sinensis) plantation soils[J]. Soil and Tillage Research, 2019, 195: 104356 DOI:10.1016/j.still.2019.104356 (  0) 0) |
| [25] |
Zhao M X, Cong J, Cheng J M, et al. Soil microbial community assembly and interactions are constrained by nitrogen and phosphorus in broadleaf forests of southern China[J]. Forests, 2020, 11(3): 285 DOI:10.3390/f11030285 (  0) 0) |
| [26] |
Tarin M W K, Fan L L, Xie D J, et al. Response of soil fungal diversity and community composition to varying levels of bamboo biochar in red soils[J]. Microorganisms, 2021, 9(7): 1385 (  0) 0) |
| [27] |
Zhou J, Jiang X, Zhou B K, et al. Thirty four years of nitrogen fertilization decreases fungal diversity and alters fungal community composition in black soil in Northeast China[J]. Soil Biology and Biochemistry, 2016, 95: 135-143 (  0) 0) |
2. Guizhou Provincial Tobacco Company Zunyi Branch, Zunyi, Guizhou 563000, China;
3. School of Geographical Science, Nantong University, Nantong, Jiangsu 226019, China
 2024, Vol. 56
2024, Vol. 56


