2. 黑龙江八一农垦大学农学院, 黑龙江大庆 163319;
3. 贵州大学精细化工研究开发中心, 贵阳 550025
我国拥有悠久的水稻种植历史,在水稻生长过程中水分管理是一项重要内容。水稻生长期内一般采用干湿交替模式,即土壤存在好氧和厌氧交替状态,而在我国典型热带地区海南省,农户为了更高经济收益,在稻田中往往采取稻菜轮作模式。该模式下水稻季水分充足,土壤多数时间处于水饱和状态,而在蔬菜季则常采用喷灌供水,土壤通常处于较干旱状态。Morugán-Coronado等[1]认为水分含量影响土壤团聚体、土壤呼吸以及相关细菌丰度;Huang等[2]发现水分管理对土壤pH有显著影响;Mohamed等[3]发现土壤水分含量增加会显著降低脲酶、脱氢酶和过氧化氢酶等活性;而Wang和Lu[4]发现淹水显著抑制土壤碱性和酸性磷酸酶,短期淹水不影响脲酶活性,但长期淹水则呈抑制效果。这表明土壤水分含量对土壤理化属性及微生物群落结构具有重要影响。
生物质炭具有许多优良属性,它是一种富碳且吸附性较强的固体颗粒物,通常由农林秸秆低温裂解获得,对农田水分和养分保持有重要影响[5]。Novak等[6]认为生物质炭可提高老成土(Ultisols)和旱成土(Aridisols)的储水能力,但其效果因原料选择和热解温度而异。Li等[7]研究表明生物质炭施用增加土壤有机碳、有效磷和速效钾等有效养分,显著提升土壤磷脂脂肪酸浓度,细菌丰度大量增加。Gul等[8]通过Meta分析发现施用生物质炭有助于提升土壤pH、阳离子交换量和微生物丰度以及群落结构等。Wu等[9]和Du等[10]都认为生物质炭施用显著增加土壤脲酶活性,尤其是对表层土壤。然而由于稻田水分管理以及海南地区稻菜轮作模式的特殊性,稻田土壤存在一段时间的水饱和和水缺乏状态,即淹水和好氧状态,生物质炭施用对稻田土壤性质和微生物群落影响可能存在差异。而椰壳是热区典型的农林废弃物,其制备的生物质炭具有许多优良特性[11],对土壤的调节作用可能更有效果。因此,针对热区条件下的稻菜轮作模式,本研究通过室内培养探究不同水分条件和椰壳炭用量水平对稻田土壤酸碱性、酶活性以及微生物群落结构的影响,以期为椰壳炭在热区的推广应用提供数据支撑。
1 材料与方法 1.1 试验材料土壤样品采集点位于海南省澄迈县金江镇龙坡村(110°05′8.8″E,19°46′55.4″N),该地区气候类型为热带季风气候,夏季高温多台风,冬季少雨,雨季主要集中在5—10月份,年均降水量为1 786 mm,年均气温23.8 ℃。土壤属砖红壤发育的水稻土,质地为砂壤土。该试验区长期以水稻-辣椒轮作方式种植,水稻种植期在6—9月,辣椒种植期为10月至翌年5月。
于辣椒收获后水稻种植前采集表层(0 ~ 20 cm)土壤样品,土样经室内自然风干,挑出残根和大石砾后再研磨过筛。生物质炭原料为椰子壳,研磨后于室内利用真空气氛炉(最高温度1 200 ℃)在抽真空条件下高温(700 ℃)裂解制备,升温速率10 ℃/min,保留时间1 h,待温度下降至100 ℃以下后,打开气氛炉自然冷却后取出备用。土壤和椰壳炭主要理化性质见表 1。
|
|
表 1 土壤和椰壳炭理化性质 Table 1 Physicochemical properties of tested soil and coconut shell biochar |
利用过2 mm筛的风干稻田土样开展室内培养试验。先用蒸馏水调节土样含水量至土壤湿润不沾手状态,置于恒温培养箱避光预培养两周(温度25 ℃,相对湿度95%),预培养结束后充分混匀土壤。好氧和淹水培养试验各设置3个处理,即不添加椰壳炭的对照处理(BC0)、添加2% 的椰壳炭(BC2)和添加5% 的椰壳炭(BC5),每处理3个重复。称取100 g预培养土样置于250 mL的干净培养盒中,添加相应量椰壳炭充分混匀,其中淹水培养需再加入蒸馏水淹没土样至2 cm水层,而后均盖紧盒盖(避免水分挥发),置于25 ℃培养箱中避光培养35 d。培养结束,采集土样测定pH和酶活(脲酶、酸性磷酸酶和碱性磷酸酶),部分土样置于-20 ℃冰箱用于测定土壤微生物群落结构。
1.3 测定方法土壤含水量采用烘干法测定,土壤pH和电导率分别利用pH计和电导率仪测定(土水质量比1:2.5),速效氮采用碱解扩散法测定,有效磷采用碳酸氢钠浸提-钼锑抗比色法测定,速效钾采用乙酸铵浸提-火焰光度法测定,有机质采用重铬酸钾氧化-外加热法测定,土壤质地采用比重计法测定,上述土壤性质测定方法参照土壤农化分析[12];土壤阳离子交换量(CEC)采用三氯化六氨合钴浸提-分光光度法测定(HJ 889—2017)[13]。椰壳炭pH测定参照标准GB/T 12496.7—1999[14],电导率利用电导率仪测定,碳氮含量采用元素分析仪测定(EA2400-Ⅱ,PerkinElmer),椰壳炭CEC测定与土壤一致,灰分利用干烧法测定(GB/T 12496.3—1999)[15];生物质炭产率为裂解后生物质炭质量与初始原料的比值;比表面积采用比表面仪测定(ASAP 2460,Micromeritics)。
土壤酶活性采用酶试剂盒测定(购自苏州铭科生物技术有限公司),依据酶试剂盒说明书,利用靛酚蓝比色法在波长578 nm处测定脲酶水解尿素产生的铵态氮;酸性环境中,土壤酸性磷酸酶催化磷酸苯二钠水解生成苯酚和磷酸氢二钠,在波长660 nm处测定酚的生成量即可计算出土壤酸性磷酸酶活性;而在碱性环境中,土壤碱性磷酸酶催化磷酸苯二钠水解生成苯酚和磷酸氢二钠,通过在波长660 nm处测定酚的生成量即可计算出土壤碱性磷酸酶活性[16]。土壤微生物群落送专业检测机构(杭州联川生物技术股份有限公司)进行高通量测序,使用E.Z.N.A®土壤DNA试剂盒(D4015,Omega,lnc,USA)提取土壤微生物总DNA。细菌采用引物341F(5′-CTACGGGNGGCWGCAG-3′)和805R(5′-GATCACHVGGGTATCTAATCC-3′)扩增,真菌使用引物ITS1F12(5′-GTGARTCATCGAATCTTTG-3′)和ITS2(5′-TCCTCGCTTATTGATATGC-3′)进行PCR扩增;扩增的PCR产物采用2% 琼脂糖凝胶电泳处理,并用AMPure XT beads (Beckman-Colter Genomics,Danvers,MA,USA)纯化,利用Qubit(Invitrogen,USA)定量,而后通过使用杭州联川生物技术股份有限公司提供的Illumina NovaSeq平台进行测定,最终基于得到的特征序列和丰度表格进行微生物多样性及群落结构分析。
1.4 数据分析所有数据利用Excel 2013软件整理,方差分析采用SPSS 19.0进行,多重比较采用Duncan法,显著性水平为P < 0.05。
2 结果与分析 2.1 土壤pH和酶活性未添加椰壳炭培养35 d后,淹水和好氧条件下土壤酸性磷酸酶、碱性磷酸酶和脲酶活性没有显著差异,但淹水下土壤pH显著高于好氧。添加椰壳炭后好氧和淹水下土壤pH都显著升高(表 2);当椰壳炭用量从2% 增加至5% 时,好氧下土壤pH继续显著升高,而淹水下土壤pH升高但不显著。添加椰壳炭增加好氧下土壤脲酶活性,而淹水下脲酶活性降低;随着椰壳炭用量从2% 增至5%,对好氧下脲酶活性促进作用下降,而对淹水下脲酶活性抑制作用却增强。好氧和淹水条件下椰壳炭用量增至5% 时土壤酸性磷酸酶活性显著降低。椰壳炭添加对好氧下土壤碱性磷酸酶活性有促进作用但不显著,淹水下稻田土壤碱性磷酸酶活性却显著提高。以上结果表明椰壳炭对稻田土壤pH和酶活具有调控作用且受土壤水分影响。
|
|
表 2 不同水分条件下添加椰壳炭后土壤pH和酶活性 Table 2 Soil pH and enzyme activities after coconut shell biochar addition under different water contents |
好氧条件下增施椰壳炭降低稻田土壤细菌和真菌的OTU和香农指数(表 3),表明细菌和真菌多样性下降,尤其是增施5% 椰壳炭对细菌群落影响最明显,香农指数降低达28%。淹水下椰壳炭施用提高了稻田土壤细菌和真菌多样性,香农指数增加;增施2% 的椰壳炭对淹水状态下的土壤细菌和真菌群落多样性提高最显著。同时,淹水条件下细菌和真菌多样性都高于好氧条件。
|
|
表 3 不同水分条件下添加椰壳炭后土壤微生物α-多样性 Table 3 α- diversity indices of soil microorganisms after coconut shell biochar addition under different water contents |
好氧条件下未施椰壳炭时稻田土壤以变形杆菌门(Proteobacteria)(相对丰度34.1%)、绿弯菌门(Chloroflexi)(18.6%)、放线菌门(Actinobacteria) (17.4%)、酸杆菌门(Acidobacteria)(9.82%)和芽单胞菌门(Gemmatimonadetes)(8.96%)为主(图 1)。淹水下未施椰壳炭时土壤主要细菌种群相对丰度排序与好氧下一致,但淹水下变形杆菌门、绿弯菌门、放线菌门、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)相对丰度都低于好氧下,而芽单胞菌门、酸杆菌门、浮霉菌门(Planctomycetes)、Patescibacteria、疣微菌门(Verrucomicrobia)和硝化螺旋菌门(Nitrospirae)相对丰度都高于好氧下。
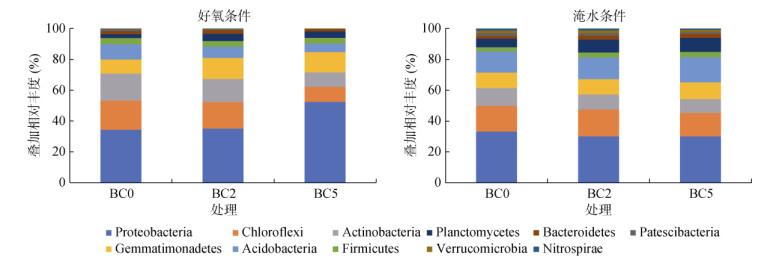
|
图 1 不同水分条件下添加椰壳炭后土壤细菌群落结构及相对丰度 Fig. 1 Soil bacterial communities and relative abundances after coconut shell biochar addition under various soil water contents |
好氧条件下椰壳炭施用提高稻田土壤细菌群落中变形杆菌门、芽单胞菌门和浮霉菌门相对丰度(图 1),但降低绿弯菌门、放线菌门、酸杆菌门、厚壁菌门、Patescibacteria、疣微菌门和硝化螺旋菌门相对丰度;对于拟杆菌门,2% 椰壳炭施用为促进作用,当施用量增至5%,则呈现抑制作用;除了芽单胞菌门和浮霉菌门,高量椰壳炭施用对细菌种群的促进或抑制作用都更强。淹水下,椰壳炭施用提高了酸杆菌门、厚壁菌门、浮霉菌门和拟杆菌门相对丰度,降低了变形杆菌门、放线菌门、Patescibacteria和硝化螺旋菌门相对丰度;同时,对于绿弯菌门和疣微菌门,随椰壳炭用量增加,呈先促进后抑制作用,而对于芽单胞菌门,则表现为先抑制后促进作用。以上结果表明稻田土壤在不同水分条件下施用椰壳炭对细菌群落影响差异较大。
2.4 真菌群落结构未添加椰壳炭时,好氧下稻田土壤真菌群落以子囊菌门(Ascomycota)(丰度88.2%)和担子菌门(Basidiomycota)(1.39%)为主(图 2);淹水下稻田土壤子囊菌门相对丰度下降至60.2%,而担子菌门相对丰度则大幅度提升,达到19.6%,其他种群如壶菌门(Chytridiomycota)、接合菌门(Zygomycota)和球囊菌门(Glomeromycota)丰度也大幅增加,同时出现了好氧下没有的罗兹菌门(Rozellomycota),表明淹水条件下真菌群落多样性提高。当添加2% 椰壳炭时,好氧条件下子囊菌门丰度下降,而淹水条件下其丰度则增加;当椰壳炭用量增至5% 时,好氧下子囊菌门丰度又大幅提高,淹水下子囊菌门丰度也继续提高。椰壳炭添加对好氧和淹水条件下担子菌门丰度均呈抑制作用,淹水下椰壳炭添加提高了壶菌门和罗兹菌门相对丰度。
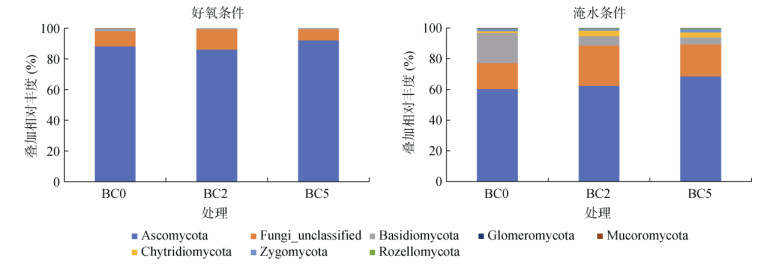
|
图 2 不同水分条件下添加椰壳炭后土壤真菌群落结构及相对丰度 Fig. 2 Soil fungal communities and relative abundances after coconut shell biochar addition under various soil water contents |
本研究发现添加椰壳炭培养35 d后,好氧和淹水条件下土壤pH均提高,这与Chen等[17]和王光飞等[18]的研究结果一致。这主要是因为生物质炭存在碱性基团,其添加进酸性土壤后,能显著提升土壤pH。许多研究表明生物质炭对土壤pH的调控作用受土壤类型、生物质炭施用量和原料类型影响[19-20]。生物质炭大量施用必然带来更多的碱性基团,同时不同原料制备的生物质炭碱性程度也不一致,因此会导致对土壤pH调节作用的差异。生物质炭主要用于改善酸性土壤pH,对碱性土壤pH提升作用不明显[21]。本研究中椰壳炭pH达到9.6(表 1),对酸性土壤pH调节效果可能会更明显。
本研究发现在好氧条件下施用椰壳炭能显著提高土壤脲酶活性,但随着椰壳炭施用量增加(用量从2% 增至5%),提升作用有所下降。Lopes等[22]通过连续两年在甘蔗地施用不同量生物质炭的田间试验也发现,当生物质炭用量低于30 000 kg/hm2时土壤脲酶活性增加,当施用量升至40 000 kg/hm2时则降低脲酶活性;许云翔等[23]通过6年田间定位试验发现施用生物质炭能显著提高稻田土壤脲酶活性,其中施用15 000 kg/hm2生物质炭处理土壤脲酶活性最大。然而在淹水条件下,施用椰壳炭后土壤脲酶活性却降低,该结论与Mohamed等[3]研究结果一致,该研究认为土壤水分含量增加显著降低脲酶活性。冯慧琳等[24]认为土壤酶活由多因子协同作用,与土壤C/N、有机质和总碳含量存在显著相关性,不同原料生物质炭对土壤酶活作用并非单一不变,这说明生物质炭对脲酶作用受施用量和生物质炭类型以及土壤水分的影响。而对于土壤酸性磷酸酶,本研究发现不论是好氧还是淹水条件,添加椰壳炭后土壤酸性磷酸酶活性都有所降低,Lopes等[22]和许云翔等[23]则认为添加生物质炭后土壤酸性磷酸酶增加,但Lopes等[22]等发现生物质炭施用量升至40 000 kg/hm2时土壤酸性磷酸酶活性降低,而许云翔等[23]则发现土壤酸性磷酸酶活性随生物质炭用量增加而增加(从0增加至22 500 kg/ hm2)。这是因为本文研究中2% 的椰壳炭用量(相当于48 000 kg/hm2)已严重过量,可能在低量施用椰壳炭情况下也会得到土壤酸性磷酸酶活性提高的结论,由此表明土壤酸性磷酸酶受生物质炭用量影响较大。对于土壤碱性磷酸酶,好氧和淹水条件下施用椰壳炭后都有所增加,淹水条件下增加更显著,这可能是由于生物质炭添加降低了土壤酸性而增加了土壤碱性物质。Pokharel等[25]也通过meta分析认为生物质炭能显著提升土壤碱性磷酸酶活性,并认为生物质炭对土壤酶活作用受土壤类型、生物质炭性质和酶活种类影响。综上所述,本研究认为除了土壤水分状况,土壤类型、生物质炭原料类型以及施用量等都可能对土壤酶活产生影响。
3.2 土壤微生物群落结构本研究认为稻田土壤在淹水条件下培养后细菌和真菌群落多样性都高于好氧条件(表 3)。王英[26]也发现淹水稻田中微生物数量高于旱作稻田,这可能是因为淹水条件下会促进厌氧和兼性厌氧菌生长,从而使得微生物多样性提高。Tate和Terry[27]认为水分增加会提高微生物活性,但当水分增至饱和时水分增加会抑制微生物好氧活动并刺激微生物厌氧过程。因此,土壤水分管理对土壤微生物群落多样性有重要影响。许多研究都发现生物质炭施用增加细菌丰度和多样性[7, 20],Gul等[8]通过meta分析大量室内短期培养和长期田间试验发现生物质炭施用提高微生物丰度和群落结构。Xu等[28]也发现增施生物质炭提高细菌多样性,并与生物质炭施用量呈正相关。本研究也发现稻田土在淹水下添加椰壳炭后,土壤细菌和真菌多样性(香农指数)都提高,且相对施用5% 椰壳炭,增施2% 生物质炭对细菌和真菌多样性提升更多。而在好氧条件下添加椰壳炭后,土壤细菌和真菌多样性(香农指数)都呈下降趋势,尤其是当施用量增至5% 时,细菌多样性下降趋势加强,而真菌多样性下降趋势减弱。这表明好氧条件下高量生物质炭施用对稻田土壤细菌抑制作用更强,而对真菌抑制减弱。陈义轩等[29]对潮土的研究认为花生壳生物质炭、玉米秸秆生物质炭和杨木屑生物质炭对土壤细菌有促进作用,但其增加幅度随生物质炭用量增加呈降低趋势,适量添加生物质炭会增加真菌数量,但大量添加花生壳生物质炭和竹炭生物质炭显著降低真菌数量。程扬等[30]也发现施加5 000 kg/hm2生物质炭后,玉米根际土壤酸杆菌门相对丰度升高,但施加10 000 kg/hm2生物质炭处理酸杆菌门相对丰度降低。这表明生物质炭添加对土壤微生物群落将产生重要影响,研究结果的差异可能是由土壤类型、生物质炭类型以及施用量不同导致,本研究中的最低施用量(2%)可能已经超过了好氧下合理施用标准,因此导致好氧下微生物多样性没有出现先增加后下降结果,而呈现一直降低趋势。
对于细菌群落,本研究发现好氧条件下椰壳炭施用提高变形杆菌门、芽单胞菌门和浮霉菌门丰度(图 1),降低酸杆菌门、绿弯菌门、放线菌门、厚壁菌门、疣微菌门和硝化螺旋菌门丰度;淹水下椰壳炭施用提高酸杆菌门、厚壁菌门、浮霉菌门和拟杆菌门丰度,降低变形杆菌门、放线菌门和硝化螺旋菌门丰度。而Xu等[28]发现在生物质炭处理下,变形杆菌门、拟杆菌门和放线菌门丰度增加,而酸杆菌门、绿弯菌门和芽单胞菌门丰度降低;Fan等[20]认为生物质炭添加使得疣微菌门和硝化螺旋菌门丰度增加,酸杆菌门丰度显著降低;Zhao等[31]发现生物质炭施用导致放线菌门丰度增加,酸杆菌门丰度降低;Gao等[32]研究植烟土壤微生物群落发现随生物质炭用量增加变形杆菌门和酸杆菌门丰度增加,放线菌门丰度降低。对于真菌群落,本研究好氧条件下添加2% 椰壳炭时子囊菌门和担子菌门丰度降低,当用量增至5% 时子囊菌门丰度又大幅提高;淹水条件下稻田土壤子囊菌门和壶菌门丰度增加,担子菌门丰度降低,同时发现随生物质炭用量增加,接合菌和担子菌丰度增加,子囊菌丰度降低。而Zhang等[33]发现施用生物质炭增加壶菌门丰度,降低子囊菌门丰度。通常情况下,生物质炭施用会提高变形杆菌门丰度,降低酸杆菌门丰度,而降低子囊菌门丰度,主要可能是因为生物质炭施用导致土壤pH升高,酸杆菌和子囊菌更适合酸性环境,同时碱性环境有利于变形杆菌生长[34-35];而研究结果不同可能是受土壤类型、生物质炭类型及其用量影响。盖霞普等[36]发现生物质炭对土壤微生物群落结构的短期影响受土壤性质影响很大;Li等[37]认为土壤属性影响微生物多样性,生物质炭更容易提高酸性和砂质土壤的微生物多样性,低温和养分丰富的生物质炭更有利于提高微生物生物量和微生物多样性。因此,除了水分管理,土壤自身属性、生物质炭原料类型以及施用量对土壤微生物群落具有重要影响,尤其是土壤类型和生物质炭施用量。
4 结论1) 添加椰壳炭后稻田土壤pH显著提升,好氧条件下椰壳炭添加提高脲酶活性,而淹水时则抑制脲酶活性;两种水分条件下添加椰壳炭都抑制土壤酸性磷酸酶活性,而提高碱性磷酸酶活性。
2) 添加椰壳炭抑制好氧条件下土壤细菌和真菌多样性,而淹水时则呈现促进作用。
3) 好氧条件下施用椰壳炭增加变形杆菌门、芽单胞菌门、浮霉菌门和子囊菌门相对丰度,降低绿弯菌门、放线菌门、酸杆菌门和担子菌门相对丰度;而淹水条件下椰壳炭降低变形杆菌门和放线菌门丰度,提高酸杆菌门、厚壁菌门、拟杆菌门和壶菌门、罗兹菌门丰度。
4) 稻田不同水分状态下添加椰壳炭对土壤性质和微生物影响呈较大差异,因此水分管理是生物质炭添加后需考虑的一个重要因素。
| [1] |
Morugán-Coronado A, García-Orenes F, McMillan M, et al. The effect of moisture on soil microbial properties and nitrogen cyclers in Mediterranean sweet orange orchards under organic and inorganic fertilization[J]. The Science of the Total Environment, 2019, 655: 158-167 DOI:10.1016/j.scitotenv.2018.11.174 (  0) 0) |
| [2] |
Huang B, Li Z W, Li D Q, et al. Effect of moisture condition on the immobilization of Cd in red paddy soil using passivators[J]. Environmental Technology, 2019, 40(20): 2705-2714 DOI:10.1080/09593330.2018.1449900 (  0) 0) |
| [3] |
Mohamed I, Bassouny M A, Abbas M H H, et al. Rice straw application with different water regimes stimulate enzymes activity and improve aggregates and their organic carbon contents in a paddy soil[J]. Chemosphere, 2021, 274: 129971 DOI:10.1016/j.chemosphere.2021.129971 (  0) 0) |
| [4] |
Wang X C, LU Q. Effect of waterlogged and aerobic incubation on enzyme activities in paddy soil[J]. Pedosphere, 2006, 16(4): 532-539 DOI:10.1016/S1002-0160(06)60085-4 (  0) 0) |
| [5] |
王梅勋, 陈利军, 王家民, 等. 玉米秸秆生物炭对烟田褐土水分库容及烤烟生物量的影响[J]. 土壤, 2015, 47(6): 1076-1084 DOI:10.13758/j.cnki.tr.2015.06.010 (  0) 0) |
| [6] |
Novak J M, Busscher W J, Watts D W, et al. Biochars impact on soil-moisture storage in an ultisol and two aridisols[J]. Soil Science, 2012, 177(5): 310-320 DOI:10.1097/SS.0b013e31824e5593 (  0) 0) |
| [7] |
Li M, Liu M, Li Z P, et al. Soil N transformation and microbial community structure as affected by adding biochar to a paddy soil of subtropical China[J]. Journal of Integrative Agriculture, 2016, 15(1): 209-219 DOI:10.1016/S2095-3119(15)61136-4 (  0) 0) |
| [8] |
Gul S, Whalen J K, Thomas B W, et al. Physico-chemical properties and microbial responses in biochar-amended soils: Mechanisms and future directions[J]. Agriculture, Ecosystems & Environment, 2015, 206: 46-59 (  0) 0) |
| [9] |
Wu F P, Jia Z K, Wang S G, et al. Contrasting effects of wheat straw and its biochar on greenhouse gas emissions and enzyme activities in a Chernozemic soil[J]. Biology and Fertility of Soils, 2013, 49(5): 555-565 DOI:10.1007/s00374-012-0745-7 (  0) 0) |
| [10] |
Du Z L, Wang Y D, Huang J, et al. Consecutive biochar application alters soil enzyme activities in the winter wheat–growing season[J]. Soil Science, 2014, 179(2): 75-83 DOI:10.1097/SS.0000000000000050 (  0) 0) |
| [11] |
邹刚华, 戴敏洁, 赵凤亮, 等. 海南典型农林废弃物生物炭特性分析[J]. 热带作物学报, 2020, 41(7): 1498-1504 DOI:10.3969/j.issn.1000-2561.2020.07.029 (  0) 0) |
| [12] |
鲍士旦. 土壤农化分析(3版)[M].
中国农业出版社, 北京, 2000
(  0) 0) |
| [13] |
HJ 889–2017, 土壤阳离子交换量的测定: 三氯化六氨合钴浸提-分光光度法[S]. 北京: 中国环境出版社, 2017.
(  0) 0) |
| [14] |
GB/T 12496.7–1999, 木质活性炭试验方法: pH值的测定[S]. 北京: 中国标准出版社, 1999.
(  0) 0) |
| [15] |
GB/T 12496.3–1999, 木质活性炭试验方法: 灰分含量的测定[S]. 北京: 中国标准出版社, 1999.
(  0) 0) |
| [16] |
关松荫. 土壤酶及其研究法[M].
科学出版社, 北京, 1982
(  0) 0) |
| [17] |
Chen L, Liu M J, Ali A, et al. Effects of biochar on paddy soil fertility under different water management modes[J]. Journal of Soil Science and Plant Nutrition, 2020, 20(4): 1810-1818 DOI:10.1007/s42729-020-00252-8 (  0) 0) |
| [18] |
王光飞, 马艳, 郭德杰, 等. 不同用量秸秆生物炭对辣椒疫病防控效果及土壤性状的影响[J]. 土壤学报, 2017, 54(1): 204-215 (  0) 0) |
| [19] |
赵牧秋, 金凡莉, 孙照炜, 等. 制炭条件对生物炭碱性基团含量及酸性土壤改良效果的影响[J]. 水土保持学报, 2014, 28(4): 299–303, 309 (  0) 0) |
| [20] |
Fan S X, Zuo J C, Dong H Y. Changes in soil properties and bacterial community composition with biochar amendment after six years[J]. Agronomy, 2020, 10(5): 746 DOI:10.3390/agronomy10050746 (  0) 0) |
| [21] |
Liu X H, Zhang X C. Effect of biochar on ph of alkaline soils in the Loess Plateau: Results from incubation experiments[J]. International Journal of Agriculture and Biology, 2012, 14(5): 745-750 (  0) 0) |
| [22] |
Lopes É M G, Reis M M, Almeida Frazão L, et al. Biochar increases enzyme activity and total microbial quality of soil grown with sugarcane[J]. Environmental Technology & Innovation, 2021, 21: 101270 (  0) 0) |
| [23] |
许云翔, 何莉莉, 刘玉学, 等. 施用生物炭6年后对稻田土壤酶活性及肥力的影响[J]. 应用生态学报, 2019, 30(4): 1110-1118 (  0) 0) |
| [24] |
冯慧琳, 徐辰生, 何欢辉, 等. 生物炭对土壤酶活和细菌群落的影响及其作用机制[J]. 环境科学, 2021, 42(1): 422-432 (  0) 0) |
| [25] |
Pokharel P, Ma Z L, Chang S X. Biochar increases soil microbial biomass with changes in extra- and intracellular enzyme activities: A global meta-analysis[J]. Biochar, 2020, 2(1): 65-79 DOI:10.1007/s42773-020-00039-1 (  0) 0) |
| [26] |
王英. 淹水和旱作稻田土壤中微生物群落多样性的研究[D]. 南京: 南京农业大学, 2006.
(  0) 0) |
| [27] |
Tate R L, Terry R E. Variation in microbial activity in histosols and its relationship to soil moisture[J]. Applied and Environmental Microbiology, 1980, 40(2): 313-317 DOI:10.1128/aem.40.2.313-317.1980 (  0) 0) |
| [28] |
Xu N, Tan G C, Wang H Y, et al. Effect of biochar additions to soil on nitrogen leaching, microbial biomass and bacterial community structure[J]. European Journal of Soil Biology, 2016, 74: 1-8 (  0) 0) |
| [29] |
陈义轩, 宋婷婷, 方明, 等. 四种生物炭对潮土土壤微生物群落结构的影响[J]. 农业环境科学学报, 2019, 38(2): 394-404 (  0) 0) |
| [30] |
程扬, 刘子丹, 沈启斌, 等. 秸秆生物炭施用对玉米根际和非根际土壤微生物群落结构的影响[J]. 生态环境学报, 2018, 27(10): 1870-1877 (  0) 0) |
| [31] |
Zhao C S, Xu Q Q, Chen L, et al. The impacts of a biochar application on selected soil properties and bacterial communities in an Albic Clayic Luvisol[J]. Soil and Water Research, 2020, 15(2): 85-92 (  0) 0) |
| [32] |
Gao L, Wang R, Shen G M, et al. Effects of biochar on nutrients and the microbial community structure of tobacco-planting soils[J]. Journal of Soil Science and Plant Nutrition, 2017, 17(4): 884-896 (  0) 0) |
| [33] |
Zhang M, Liu Y L, Wei Q Q, et al. Effects of short-term application of Moutai lees biochar on nutrients and fungal community structure in yellow soil of Guizhou[J]. Environmental Science and Pollution Research International, 2021, 28(47): 67404-67413 (  0) 0) |
| [34] |
朱孟涛, 刘秀霞, 王佳盟, 等. 生物质炭对水稻土团聚体微生物多样性的影响[J]. 生态学报, 2020, 40(5): 1505-1516 (  0) 0) |
| [35] |
Nielsen S, Minchin T, Kimber S, et al. Comparative analysis of the microbial communities in agricultural soil amended with enhanced biochars or traditional fertilisers[J]. Agriculture Ecosystems and Environment, 2014, 191: 73-82 (  0) 0) |
| [36] |
盖霞普, 翟丽梅, 王洪媛, 等. 生物炭对土壤微生物量及其群落结构的影响[J]. 沈阳农业大学学报, 2017, 48(4): 399-410 (  0) 0) |
| [37] |
Li X N, Wang T, Chang S X, et al. Biochar increases soil microbial biomass but has variable effects on microbial diversity: A meta-analysis[J]. Science of the Total Environment, 2020, 749: 141593 (  0) 0) |
2. College of Agriculture, Heilongjiang Bayi Agricultural University, Daqing, Heilongjiang 163319, China;
3. Center for Research and Development of Fine Chemicals, Guizhou University, Guiyang 550025, China
 2024, Vol. 56
2024, Vol. 56

