2. 新疆生产建设兵团绿洲生态农业重点实验室, 新疆石河子 832003
棉花是我国的主要经济作物之一,在我国有着很重要的战略地位[1]。新疆作为我国棉花的主产区,棉花种植面积和产量占我国50% 以上,随之产生了丰富的秸秆资源[2]。新疆的棉秆资源开发利用潜力巨大,但目前新疆的棉花秸秆主要用于还田,资源化利用水平低[3]。近年来,棉花秸秆综合利用越来越受到关注和重视。
生物质炭是生物质在一定条件下隔氧加热而形成的一种富含碳的生物材料,具有丰富多孔、比表面积大和阳离子交换能力强等特性,在改善土壤理化性质、促进土壤养分循环方面具有重要意义[4]。生物质炭施用会显著提高酸性白浆土pH、全氮、全磷和全钾含量[5];生物质炭也能显著提升碱性土壤微生物生物量碳和速效养分含量[6]。另外,Bai等[7]通过Meta分析发现,仅施用生物质炭会使作物平均增产25% 左右,而且在酸性土壤下施用生物质炭增产效果最好。
土壤微生物在改善土壤理化性质、促进土壤养分循环和抑制病虫害等方面有着不可忽视的作用[8]。根际是水分和养分进出植物的门户,也是土壤微生物最活跃的区域[9]。有研究发现,水稻秸秆生物质炭添加对大豆根际细菌丰度没有影响,但会通过改善土壤理化性质间接改变根际细菌和真菌群落结构[10];玉米秸秆生物质炭施用会增加玉米根际土壤酸杆菌门相对丰度[11];麦秆生物质炭可以提升棉田根际土壤微生物多样性[12]。但是,大豆秸秆生物质炭对番茄根际土壤细菌群落多样性没有显著影响[13],玉米秸秆生物质炭甚至会降低土壤细菌群落的多样性[14]。虽然有关生物质炭施用对植物根际土壤微生物群落影响的研究较多,但是研究结果不尽相同。由于棉秆生物质炭对新疆棉田土壤理化性质和根际微生物群落的相关研究较少,因此,本研究以新疆棉花秸秆为材料,研究棉秆生物质炭施用对棉田土壤理化性质和棉花根际土壤微生物群落特征的影响,以期为新疆棉秆资源合理利用提供理论参考。
1 材料与方法 1.1 试验地概况试验于2021年5月在石河子大学长期定位试验基地(44°19'N,86°03'E)进行,试验区属典型的温带大陆性气候,海拔404 m,年均温7.4 ℃,年均降水量206 mm,无霜期168 ~ 171 d,年蒸发量1 600 mm。供试土壤为灰漠土,2021年试验前土壤基本理化性质如下:土壤pH 8.55,电导率0.15 mS/cm,土壤有机质10.43 g/kg,碱解氮34.15 mg/kg,有效磷20.74 mg/kg,速效钾309.31 mg/kg。
1.2 试验设计试验设置4个处理:①不施生物质炭(CK);②施生物质炭3 t/hm2(BC1);③施生物质炭6 t/hm2 (BC2);④施生物质炭9 t/hm2(BC3)。每个处理3次重复,共12个小区,每个小区面积为15 m2,小区随机排列。每年春季施用150 t/hm2复合肥(N-P2O5- K2O配比为18-46-0)作为基肥。在棉田收获后收集所有棉花秸秆,在500 ℃条件下隔氧加热制成生物质炭。生物质炭的基本化学性质为:pH 10.13,有机质277.11 g/kg,全氮、全磷和全钾分别为9.21、1.52和56.82 g/kg。生物质炭于棉花播种前与0 ~ 20 cm耕层土壤旋耕混合。灌溉方式为膜下滴灌,整个生育期滴灌8 ~ 9次,总滴灌量为6 300 m3/hm2。棉花种植采用当地大田的常规种植模式“一膜三管6行”,品种为新陆早74。其他栽培管理措施与当地大田一致。
1.3 样品采集与测定 1.3.1 样品采集土壤样品的采集于2022年7月14日进行,每个小区随机选择3个点,用土钻采集微区0 ~ 20 cm土层土样,去除土壤中的植物根和石块等杂质,室温风干后过0.2 mm筛,用于土壤理化性质的测定。另外,每个小区随机选择5株棉花植株,采用“抖根法”收集植株根际土样[15],将土样迅速带回实验室,置于–80 ℃超低温冰箱用于根际微生物DNA提取和Illumina Miseq高通量测序。
1.3.2 土壤理化性质测定土壤理化性质测定参照《土壤农化分析》[16]。土壤pH(土水质量比1:5)用pH计(PHS-3C,上海利达仪器厂,中国)测定;土壤电导率(EC,土水质量比1: 5)采用电导率仪(DDS-11A,上海佑科仪器公司,中国)测定;土壤有机质(SOM)采用重铬酸钾容量法测定;土壤全氮(TN)采用H2SO4消煮-凯氏蒸馏法测定;土壤全磷(TP)采用NaOH熔融-钼锑抗比色法测定;土壤全钾(TK)采用NaOH熔解-火焰光度法测定;土壤碱解氮(AN)采用碱解扩散法测定;有效磷(AP)采用0.5 mol/L NaHCO3浸提取-钼锑抗比色法测定;速效钾(AK)采用NH4OAc浸提-火焰光度法测定。
1.3.3 微生物DNA提取和测序根际土壤鲜样DNA提取和测序由上海美吉生物医药科技有限公司承担。具体操作如下:用DNA Isolation Kit试剂盒,按照说明书提取并纯化土壤总DNA,以515F/907R为引物进行PCR扩增16S rRNA的V4 ~ V5高变区,用正向引物ITS1F和反向引物ITS2R通过PCR扩增真菌ITS1区,回收定量后,用Illumina平台进行测序,对非重复序列(不含单序列)进行聚类,在聚类过程中去除嵌合体,然后将所有序列聚类为用于分类的OTU (Operational taxonomic units),OTU的相似性设置为97%。
1.4 数据处理与分析试验数据采用SPSS 26.0进行单因素方差分析(ANOVA),并用Duncan法进行处理间差异性比较;相关性分析采用Pearson相关系数法。采用Sigmaplot 12.5和Canoco 5进行数据处理和绘图,采用软件Excel 365进行数据计算和表格制作。Mantel test分析通过R语言“Vegan”包实现,用微生物属水平相对丰度 > 1% 的菌属代表群落组成,微生物α多样性代表群落多样性。
2 结果与分析 2.1 土壤理化性质的变化土壤理化性质的变化如表 1所示。与CK相比,各生物质炭施用处理土壤pH、EC、TK和AK均显著下降(P < 0.05),最小值都出现在BC3或BC2处理中。生物质炭施用处理土壤SOM、TN和TP含量显著增加(P < 0.05),且三者含量均在BC3处理中达到最大。与CK相比,生物质炭施用显著(P < 0.05)提升(AK除外)土壤速效养分含量,且BC3处理提升效果最好。BC1和BC2处理土壤含水率(SWC)显著(P < 0.05)低于CK和BC3处理。
|
|
表 1 生物质炭施用对土壤理化性质的影响 Table 1 Soil physicochemical properties under biochar application |
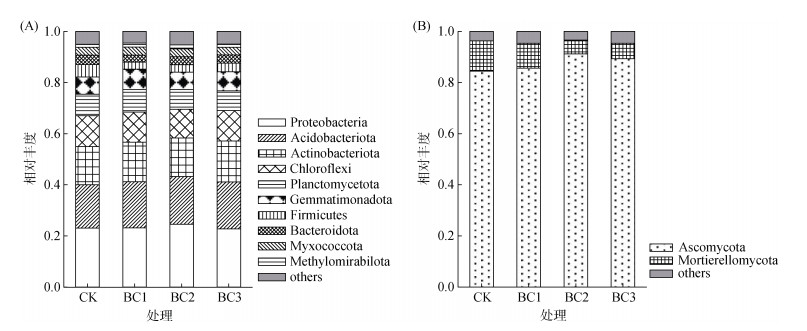
4种处理中,检测到10个相对丰度 > 1% 的细菌门(图 1A)。棉花根际土壤中前三的优势菌门为:变形菌门(Proteobacteria)、酸杆菌门(Acidobacteriota)和放线菌门(Actinobacteriota),其中Proteobacteria和Acidobacteriota的相对丰度随着生物质炭施用量的增加而出现先增后减的趋势。与CK相比,生物质炭施用显著影响浮霉菌门(Planctomycetota)、芽单胞菌门(Gemmatimonadota)和厚壁菌门(Firmicutes)的相对丰度。BC1处理使Planctomycetota和Gemmatimonadota的相对丰度分别增加了4.79% 和18.61%(P < 0.05)。生物质炭施用使Firmicutes相对丰度显著下降,BC1下降幅度最大,达44.17%,但随着生物质炭施用量的增加Firmicutes相对丰度逐渐升高。
|
图 1 不同处理下根际土壤细菌(A)和真菌(B)门水平相对丰度(> 1%) Fig. 1 Relative abundance of soil bacteria (A) and fungi (B) phyla under different treatments (> 1%) |
不同处理根际土壤优势真菌门为子囊菌门(Ascomycota)和被孢霉门(Mortierellomycota)(图 1 B)。与CK相比,生物质炭施用后Ascomycota的相对丰度显著增加(P < 0.05),而Mortierellomycota相对丰度则显著降低。Ascomycota相对丰度的最大值和Mortierellomycota相对丰度的最小值均出现在BC2处理中。
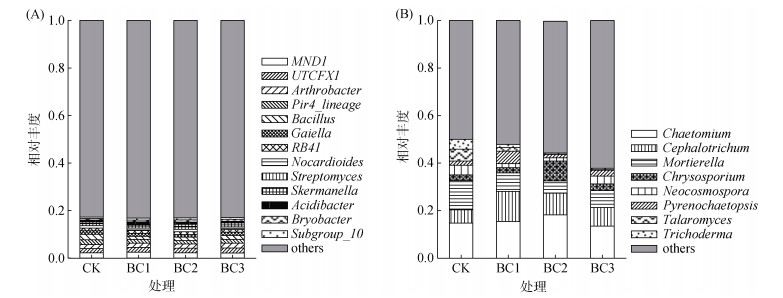
2.2.2 生物质炭对根际土壤微生物属水平相对丰度的影响测序发现各处理主要优势细菌属有13个(图 2 A),其中Pir4_lineage、Gaiella、链霉菌属(Streptomyces)、斯克尔曼氏菌属(Skermanella)和苔藓杆菌属(Bryobacter)在处理间差异显著(P < 0.05)。与CK相比,生物质炭施用降低了Pir4_lineage、Gaiella和Streptomyces的相对丰度,BC2处理下Pir4_lineage和Gaiella的相对丰度分别下降了28.4% 和27.9% (P < 0.05);而生物炭施用处理下Skermanella和Bryobacter的相对丰度有所上升,其中BC2处理对二者的相对丰度增加最显著。
|
图 2 不同处理下根际土壤细菌(A)和真菌(B)属水平相对丰度 Fig. 2 Relative abundance of soil bacteria (A) and fungi (B) genera under different treatments |
生物质炭施用显著影响真菌毛壳菌属(Chaetomium)、头束霉菌属(Cephalotrichum)、金孢属(Chrysosporium)、拟棘壳孢属(Pyrenochaetopsis)和被孢霉属(Mortierella)的相对丰度(图 2B)。随着生物质炭施用量的增加,Chaetomium和Chrysosporium相对丰度呈先增后减的趋势,且二者相对丰度最大值均出现在BC2处理中;而BC1处理中Cephalotrichum相对丰度较CK增加了64.00%,但随着生物质炭施用量增加,Cephalotrichum相对丰度逐渐下降;Pyrenochaetopsis相对丰度则随着生物质炭施用量的增加呈先减后增的趋势,各处理Pyrenochaetopsis的相对丰度高低表现为:BC2 < CK < BC3 < BC1;与CK相比,生物质炭施用显著降低Mortierella的相对丰度(P < 0.05),且BC2处理下降幅度最大,达57.89%。
2.3 根际土壤微生物多样性差异不同处理根际土壤微生物α多样性变化如表 2所示。各处理根际土壤细菌的Chao指数无显著差异,但BC2处理显著(P < 0.05)增加了真菌的Chao指数;BC2处理显著降低了细菌ACE指数,但显著增加了真菌ACE指数;与CK相比,施用生物质炭显著降低了细菌Shannon指数,且BC1处理显著降低了真菌Shannon指数(P < 0.05);与CK相比,施用生物质炭对细菌的Simpson指数的影响并不显著,但能增加真菌的Simpson指数,且BC1处理达到显著水平。总的来说,生物质炭施用降低根际土壤微生物多样性和细菌丰富度,但会增加真菌的丰富度。
|
|
表 2 施用生物质炭对根际土壤微生物α多样性的影响 Table 2 Microbial α diversity indexes in rhizosphere soils under biochar application |
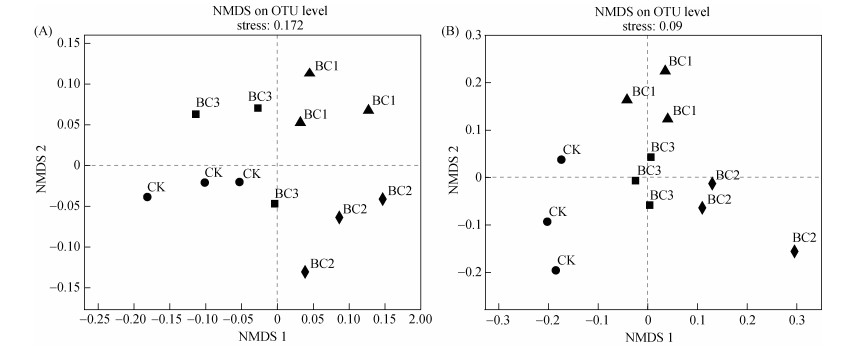
根际土壤微生物的非度量多维尺度分析(NMDS)表明(图 3),CK和BC3根际土壤细菌群落在NMDS 1方向上相似度较大,表明BC3对根际土壤细菌群落的影响较小;CK与BC2和BC3排布分散,说明较CK而言,BC2和BC3对土壤细菌群落影响较大。CK与生物质炭施用处理根际土壤真菌群落比较分散,表明CK和生物质炭施用处理土壤真菌群落组成和结构差异显著。
|
图 3 不同处理根际土壤细菌(A)和真菌(B)非度量多维尺度分析(NMDS) Fig. 3 Non metric multidimensional scale (NMDS) analysis of bacteria (A) and fungi (B) under different treatments |
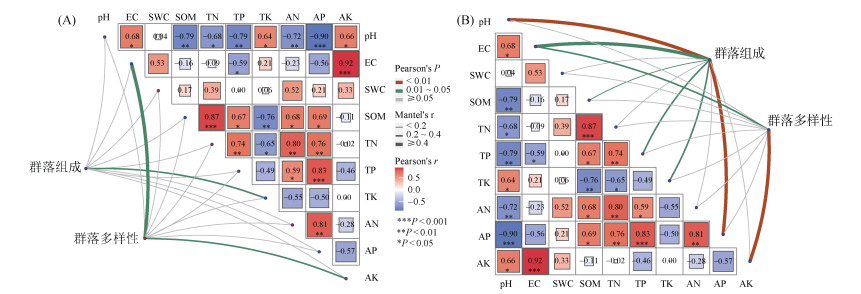
根际土壤微生物与土壤理化性质的Mantel test分析如图 4所示。结果表明,TK与根际土壤细菌群落组成存在显著相关性,EC和AK与根际土壤细菌群落多样性存在显著相关性(P < 0.05);而pH、EC、SOM、TP、TK和AP与根际土壤真菌群落组成存在显著相关性,EC和AK与根际土壤真菌群落多样性存在显著相关性(P < 0.05)。另外,土壤理化性质之间的相关性较强,多数指标间相关性显著。
|
(A. 细菌;B.真菌。EC:电导率;SOM:有机质;TN:全氮;TP:全磷;TK:全钾;AN:碱解氮;AP:有效磷;AK:速效钾;SWC:土壤含水率;下同) 图 4 土壤理化性质与根际土壤微生物的Mantel test分析 Fig. 4 Mantel test analysis of soil physicochemical properties and rhizosphere soil microorganisms |
土壤理化性质和根际土壤微生物的RDA分析如图 5所示。土壤理化性质共解释了根际土壤细菌群落变异的91.4%,RDA1轴和RDA2轴共解释了总变异的52.15%(图 5 A)。进一步分析得知,EC(19.60%)、AK(19.10%)和pH(19.00%)是影响根际土壤细菌群落变化的主要因子。RDA1轴和RDA2轴分别解释根际土壤真菌群落变异的39.07%和22.55%,其中,EC(36.00%)、AK(35.30%)和pH(30.60%)是影响根际土壤真菌群落的主要环境因子。
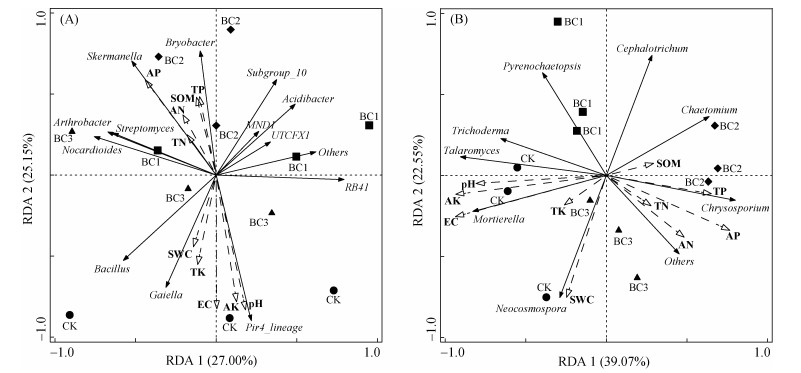
|
图 5 土壤理化性质与细菌(A)和真菌(B)属水平的冗余分析(RDA) Fig. 5 Redundancy analysis (RDA) of soil physicochemical properties of bacteria (A) and fungi (B) at genus levels |
本研究表明,随着生物质炭施用量的增加,土壤含水率逐渐增加,这与Fu等[17]的研究结果一致。说明随着生物质炭施用量的增加,土壤的保水能力在增强。另外,BC1和BC2处理土壤含水率低于CK,这可能与生物质炭的疏水性和生物质炭颗粒堵塞土壤孔隙有关[17]。生物质炭施用会增加碱性玉米地土壤EC[14],而本研究的结果与前人不一致,这可能与生物质炭的类型、施用量、生物质炭的初始盐含量、灌溉水以及试验条件等因素有关[18]。前人的研究发现,生物质炭施用显著降低了碱性土pH,本研究结果与此一致,可能与生物质炭施用后促进土壤有机质氧化产生酸性物质以及生物质炭氧化释放酸性官能团等原因有关[18]。
本研究发现,生物质炭施用显著增加了土壤有机质含量。Cen等[19]的研究发现,土壤有机质含量随着生物质炭施用量的增加而增加,这与生物质炭对有机质的强吸附能力有关。本研究还发现生物质炭施用显著提高了土壤全氮、全磷、碱解氮和有效磷的含量,这与Xiu等[5]的研究结果一致,他们发现连续两年玉米生物质炭施用会显著提高土壤养分水平。生物质炭施用后土壤钾素含量显著下降,而生物质炭施用可以增加棉花植株对钾素的吸收量[20],本试验中复合肥没有补充适量的钾肥,这导致土壤钾素含量下降。总的来说,生物质炭施用会在一定程度上改善土壤肥力水平,且BC3处理效果最好。
3.2 施用生物质炭对根际土壤微生物群落组成和结构的影响 3.2.1 生物质炭对根际土壤微生物群落组成的影响与CK相比,生物质炭施用会降低Planctomycetota和Firmicutes的相对丰度,但会增加Gemmatimonadota的相对丰度(图 1A)。据报道,Planctomycetota可以通过改善土壤肥力来促进植物生产[21]。本研究中,随着生物质炭施用量增加,Planctomycetota的相对丰度出现先增后减的趋势,这可能是因为高量生物质炭对土壤理化性质的影响过大,改变了适合Planctomycetota的生存环境。Chen等[22]发现,生物质炭施用能显著降低Firmicutes相对丰度,从而导致有机碳周转速度减慢,说明生物质炭施用可以间接增加土壤有机碳含量。Gemmatimonadota与土壤硫酸盐积累相关,具有厌氧释放磷和需氧吸收磷的特点,能够积累磷酸盐[23],这可能是生物质炭施用处理下土壤全磷显著提升的原因之一。
Ascomycota是大多数区域土壤中的优势真菌门[24]。本研究中,生物质炭施用增加了Ascomycota的相对丰度(图 1 B)。据报道,Ascomycota可以通过分泌降解植物的酶来促进土壤氮素累积[25],说明生物质炭施用会增加部分真菌门相对丰度来提高土壤氮素含量。
Gaiella在抑制土壤致病菌方面有着重要作用[26]。本研究中,生物质炭施用降低了Gaiella相对丰度(图 2A),同时,生物质炭施用增加了真菌的丰富度(表 2),说明生物质炭施用可能会增加土传病害的发生。Streptomyces在增强作物营养吸收、促进作物生长和提升抗逆能力方面有着重要的作用[27],本研究中BC2处理使Streptomyces相对丰度增加,有利于作物生长。Skermanella与pH、硝酸盐、磷、碳、亚硝酸盐浓度和固氮过程有关[28],本研究发现生物质炭施用会增加Skermanella的相对丰度,说明棉田施用生物质炭有利于土壤养分积累。Bryobacter的相对丰度随着生物质炭施用量的增加而增加(图 3A),这与Zhou等[29]的试验结果一致,他们认为Bryobacter可能参与土壤磷素循环并与土壤有效磷含量密切相关,本文RDA分析也证实了这一点(图 5A)。
本研究发现,Chaetomium、Cephalotrichum和Mortierella是根际土壤中的主要真菌属。Chaetomium多为腐生菌,具有分解纤维素和木质素的能力,在自然界的物质循环中起重要作用[30]。Chrysosporium是重要的纤维素降解真菌,可以促进植物生长[31]。本研究中,生物质炭施用下Chaetomium和Cephalotrichum的相对丰度显著升高,有利于土壤养分循环与植物生长。
3.2.2 生物质炭影响根际土壤微生物群落的驱动因子生物质炭施用对土壤微生物多样性影响的研究结果并不一致。例如,Wang等[21]发现,生物质炭施用会显著增加土壤真菌和细菌的α多样性,而微生物生物量氮(MBN)和微生物生物量碳(MBC)是主要驱动因子。而Liu等[31]发现,生物质炭施用会降低土壤细菌多样性,本研究结果与其一致。有研究发现,EC与土壤盐分含量有关,过高的EC可能会抑制土壤微生物发育,且EC是微生物群落的不良预测因子[32]。本研究也证实EC与大多数微生物属呈负相关关系(图 5)。生物质炭施用显著降低了EC,说明生物质炭施用能降低土壤盐分,促进微生物发育。本研究发现,土壤AK是影响微生物群落组成的主要驱动因素之一,说明生物质炭可以通过改善土壤养分来影响根际土壤微生物群落。关于微生物群落变化驱动因子的研究有很大差异,如,Wang等[14]发现,添加玉米生物质炭的轻壤土中,土壤有机碳和全氮含量是影响土壤微生物群落的主导因素;刘师豆等[33]开展的重金属污染土壤施炭试验发现,速效钾、土壤有机质和pH是影响水稻根际土壤真菌群落的主要环境因子;阎海涛等[34]在酸性烤烟地的生物质炭施用试验中指出,土壤可溶性有机碳、pH和含水率是影响褐土真菌群落的主要环境因子。综上,微生物群落对生物质炭响应与土壤类型、作物类型和微生物种类等因素有关,生物质炭对根际微生物的作用机制是复杂的,仍需要展开深入的研究。
4 结论生物质炭施用显著降低了土壤pH、全钾和速效钾含量,但是提高了土壤有机质、全氮、全磷、碱解氮和有效磷的含量,总体来看生物质炭施用提高了土壤养分含量。生物质炭施用的根际土壤中优势细菌门为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteriota)和放线菌门(Actinobacteriota),主要优势真菌门为子囊菌门(Ascomycota)和被孢霉门(Mortierellomycota)。生物质炭施用会降低根际土壤微生物多样性和细菌丰富度,但会增加真菌的丰富度。土壤电导率、速效钾和pH是影响根际土壤微生物群落的主要影响因子。总之,生物质炭施用可以提升土壤肥力并改善根际微生物群落结构,结合土壤肥力和根际微生物群落最终推荐9 t/hm2为最佳施用量。
| [1] |
吴沣槭, 黄伟斌, 陈家乐, 等. 中国棉花生产碳排放核算与碳达峰预测[J]. 农业环境科学学报, 2023, 42(3): 692-704 (  0) 0) |
| [2] |
卢秀茹, 贾肖月, 牛佳慧. 中国棉花产业发展现状及展望[J]. 中国农业科学, 2018, 51(1): 26-36 (  0) 0) |
| [3] |
凌一波, 薛颖昊, 王家平, 等. 近20年来新疆农作物秸秆资源量变化、现状分析及综合利用探讨[J]. 中国农业资源与区划, 2023, 44(1): 130-139 (  0) 0) |
| [4] |
巢军委, 王建国, 戴敏, 等. 生物炭对水稻土Olsen-P的影响[J]. 土壤, 2015, 47(4): 670-674 DOI:10.13758/j.cnki.tr.2015.04.008 (  0) 0) |
| [5] |
Xiu L Q, Zhang W M, Sun Y Y, et al. Effects of biochar and straw returning on the key cultivation limitations of Albic soil and soybean growth over 2 years[J]. Catena, 2019, 173: 481-493 DOI:10.1016/j.catena.2018.10.041 (  0) 0) |
| [6] |
侯建伟, 索全义, 梁桓, 等. 有机物料对沙蒿生物炭改良沙土中有效养分的增效作用[J]. 土壤, 2016, 48(3): 463-467 DOI:10.13758/j.cnki.tr.2016.03.007 (  0) 0) |
| [7] |
Bai S H, Omidvar N, Gallart M, et al. Combined effects of biochar and fertilizer applications on yield: A review and meta-analysis[J]. The Science of The Total Environment, 2022, 808: 152073 DOI:10.1016/j.scitotenv.2021.152073 (  0) 0) |
| [8] |
蔡祖聪, 黄新琦, 赵军. 作物土传病害防控的健康微生物群落构建原理与实践[J]. 土壤学报, 2023, 60(5): 1213-1220 (  0) 0) |
| [9] |
申建波, 白洋, 韦中, 等. 根际生命共同体: 协调资源、环境和粮食安全的学术思路与交叉创新[J]. 土壤学报, 2021, 58(4): 805-813 (  0) 0) |
| [10] |
高文慧, 郭宗昊, 高科, 等. 生物炭与炭基肥对大豆根际土壤细菌和真菌群落的影响[J]. 生态环境学报, 2021, 30(1): 205-212 (  0) 0) |
| [11] |
程扬, 刘子丹, 沈启斌, 等. 秸秆生物炭施用对玉米根际和非根际土壤微生物群落结构的影响[J]. 生态环境学报, 2018, 27(10): 1870-1877 (  0) 0) |
| [12] |
顾美英, 刘洪亮, 李志强, 等. 新疆连作棉田施用生物炭对土壤养分及微生物群落多样性的影响[J]. 中国农业科学, 2014, 47(20): 4128-4138 DOI:10.3864/j.issn.0578-1752.2014.20.021 (  0) 0) |
| [13] |
Liao H K, Zheng C L, Long J, et al. Effects of biochar amendment on tomato rhizosphere bacterial communities and their utilization of plant-derived carbon in a calcareous soil[J]. Geoderma, 2021, 396: 115082 DOI:10.1016/j.geoderma.2021.115082 (  0) 0) |
| [14] |
Wang X B, Song D L, Liang G Q, et al. Maize biochar addition rate influences soil enzyme activity and microbial community composition in a fluvo-aquic soil[J]. Applied Soil Ecology, 2015, 96: 265-272 DOI:10.1016/j.apsoil.2015.08.018 (  0) 0) |
| [15] |
Barillot C D C, Sarde C O, Bert V, et al. A standardized method for the sampling of rhizosphere and rhizoplan soil bacteria associated to a herbaceous root system[J]. Annals of Microbiology, 2013, 63: 471-476 DOI:10.1007/s13213-012-0491-y (  0) 0) |
| [16] |
Fu G Q, Qiu X N, Xu X Y, et al. The role of biochar particle size and application rate in promoting the hydraulic and physical properties of sandy desert soil[J]. Catena, 2021, 207: 105607 DOI:10.1016/j.catena.2021.105607 (  0) 0) |
| [17] |
Saifullah, Dahlawi S, Naeem A, et al. Biochar application for the remediation of salt-affected soils: Challenges and opportunities[J]. The Science of the Total Environment, 2018, 625: 320-335 DOI:10.1016/j.scitotenv.2017.12.257 (  0) 0) |
| [18] |
Cen R, Feng W Y, Yang F, et al. Effect mechanism of biochar application on soil structure and organic matter in semi-arid areas[J]. Journal of Environmental Management, 2021, 286: 112198 DOI:10.1016/j.jenvman.2021.112198 (  0) 0) |
| [19] |
Li Y, Yao N, Liang J P, et al. Rational biochar application rate for cotton nutrient content, growth, yields, productivity, and economic benefits under film-mulched trickle irrigation[J]. Agricultural Water Management, 2023, 276: 108079 DOI:10.1016/j.agwat.2022.108079 (  0) 0) |
| [20] |
Wang H H, Zhang R, Zhao Y Y, et al. Effect of biochar on rhizosphere soil microbial diversity and metabolism in tobacco-growing soil[J]. Ecologies, 2022, 3(4): 539-556 DOI:10.3390/ecologies3040040 (  0) 0) |
| [21] |
Chen J H, Sun X, Zheng J F, et al. Biochar amendment changes temperature sensitivity of soil respiration and composition of microbial communities 3years after incorporation in an organic carbon-poor dry cropland soil[J]. Biology and Fertility of Soils, 2018, 54(2): 175-188 DOI:10.1007/s00374-017-1253-6 (  0) 0) |
| [22] |
Sui L, Tang C Y, Cheng K, et al. Biochar addition regulates soil phosphorus fractions and improves release of available phosphorus under freezing-thawing cycles[J]. The Science of the Total Environment, 2022, 848: 157748 DOI:10.1016/j.scitotenv.2022.157748 (  0) 0) |
| [23] |
Egidi E, Delgado-Baquerizo M, Plett J M, et al. A few Ascomycota taxa dominate soil fungal communities worldwide[J]. Nature Communications, 2019, 10(1): 2369 (  0) 0) |
| [24] |
Challacombe J F, Hesse C N, Bramer L M, et al. Genomes and secretomes of Ascomycota fungi reveal diverse functions in plant biomass decomposition and pathogenesis[J]. BMC Genomics, 2019, 20(1): 976 (  0) 0) |
| [25] |
Trivedi P, Delgado-Baquerizo M, Trivedi C, et al. Keystone microbial taxa regulate the invasion of a fungal pathogen in agro-ecosystems[J]. Soil Biology and Biochemistry, 2017, 111: 10-14 (  0) 0) |
| [26] |
朱志炎, 田志宏, 李建雄. 链霉菌的功能及其在农业上的应用[J]. 热带亚热带植物学报, 2019, 27(5): 580-590 (  0) 0) |
| [27] |
van Wyk D A B, Adeleke R, Rhode O H J, et al. Ecological guild and enzyme activities of rhizosphere soil microbial communities associated with Bt-maize cultivation under field conditions in North West Province of South Africa[J]. Journal of Basic Microbiology, 2017, 57(9): 781-792 (  0) 0) |
| [28] |
Zhou Z D, Yan T T, Zhu Q, et al. Bacterial community structure shifts induced by biochar amendment to Karst calcareous soil in southwestern areas of China[J]. Journal of Soils and Sediments, 2019, 19(1): 356-365 (  0) 0) |
| [29] |
Dwibedi V, Rath S K, Jain S, et al. Key insights into secondary metabolites from various Chaetomium species[J]. Applied Microbiology and Biotechnology, 2023, 107(4): 1077-1093 (  0) 0) |
| [30] |
Liu Z, Guo Q, Feng Z Y, et al. Long-term organic fertilization improves the productivity of kiwifruit (Actinidia chinensis Planch.) through increasing rhizosphere microbial diversity and network complexity[J]. Applied Soil Ecology, 2020, 147: 103426 (  0) 0) |
| [31] |
Huang B, Jia H J, Han X B, et al. Effects of biocontrol Bacillus and fermentation bacteria additions on the microbial community, functions and antibiotic resistance genes of prickly ash seed oil meal-biochar compost[J]. Bioresource Technology, 2021, 340: 125668 (  0) 0) |
| [32] |
刘师豆, 韩耀光, 朱新萍, 等. 棉秆炭调控对碱性镉污染水稻根际土壤真菌群落结构和功能的影响[J]. 环境科学, 2020, 41(8): 3846-3854 (  0) 0) |
| [33] |
阎海涛, 殷全玉, 丁松爽, 等. 生物炭对褐土理化特性及真菌群落结构的影响[J]. 环境科学, 2018, 39(5): 2412-2419 (  0) 0) |
2. Key Laboratory of Oasis Eco-Agriculture, Xinjiang Production and Construction Corps, Shihezi, Xinjiang 832003, China
 2024, Vol. 56
2024, Vol. 56


