2. 南京农业大学动物医学院, 南京 210095
我国土壤环境污染问题多变,污染物种类复杂,除重金属、农药残留、持久性有机污染物、微塑料等污染物外,抗生素及其他药物的土壤残留随生态转运、生态富集、菌群耐药性等问题的深入研究而备受关注[1-2]。兽药及其他药物的滥用、畜禽粪便散排是致使水体、陆生环境污染的主要原因,对生态环境和人体健康造成威胁[2-4]。研究发现,磺胺类、喹诺酮类、四环素类、抗真菌类、氯霉素类和苯并咪唑类等常用兽药已在水体、粪便、土壤等环境介质中被检出[5-11]。随灌溉、粪便施肥等农业活动的持续,土壤中药物赋存状况日趋复杂。当前,以动物源性食品、血液尿液以及水体为介质的药物多残留检测方法的研究较多[12-17],土壤中药物多残留检测主要集中在磺胺类、喹诺酮类、四环素类和大环内酯类等某一类或几类药物的测定,对抗组胺类、甾体激素类、非甾抗炎类、咪唑和苯并咪唑类等多组分药物残留的检验检测方法较少。土壤基质复杂且不同种类药物的极性、物理性质和化学性质差异性较大,为多类药物残留同时提取、净化、测定带来一定困难。加强土壤中多类药物残留的检测分析方法对研究土壤中多种药物的环境赋存底数及潜在风险研究有重要意义。
常用于药物残留的检测方法主要有酶联免疫吸附法、气相色谱法、气相色谱–质谱法、液相色谱–质谱法、液相色谱法[4, 11]。液相色谱–质谱法(Liquid chromatography-tandem mass spectrometry,LC-MS/ MS)因具有高通量、高选择性和强抗干扰能力等优势,已成为复杂基质中多类药物的痕量分析的主要检测方法[18]。药物定量检测的前处理技术包括固相萃取、分散固相萃取和液–液萃取法[11],其中以分散固相萃取为代表的QuEChERS法由于快速简便、易于操作、节约成本等特点已被用于多类药物定性定量检测[5, 12, 19-22]。
本文采用QuEChERS的净化方式,优化试验方法条件,建立了同时测定土壤中11类47种药物残留的UPLC-MS/MS方法,为研究土壤药物残留赋存现状、药物溯源分析和管控监管提供关键技术支撑。
1 材料与方法 1.1 仪器、试剂与材料Agilent 1290 Infinity Ⅱ- 6460串联三重四极杆质谱仪;Zorbax Eclipse Plus C18色谱柱(100 mm×2.1 mm,3.5 μm)(美国Agilent公司);Milli-Q超纯水仪(美国Millipore公司);3-30KS冷冻离心机(美国Sigma公司);Vortex Genie2旋涡混合器(美国Scientific Industry公司);MV5氮吹仪(美国Lab Tech公司);XPE105电子天平(0.01 mg, 瑞士Mettler Toledo集团)。
甲醇、乙腈均为色谱纯,购自美国Fisher公司;甲酸为色谱纯,购自Thermo Fisher Scientific公司;乙二胺四乙酸二钠、磷酸氢二钠为分析纯,购自国药集团化学试剂有限公司;氯化钠、柠檬酸、氢氧化钠为分析纯,购自天津科密欧化学试剂有限公司;无水硫酸钠为优级纯,购自天津科密欧化学试剂有限公司;N-丙基乙二胺(Primary secondary amine,PSA)、十八烷基硅烷(C18)净化剂,购自美国Agilent公司。
磺胺噻唑(STZ)、磺胺二甲异噁唑(SFZ)、磺胺嘧啶(SDZ)、磺胺甲噁唑(SMZ)、磺胺间二甲氧嘧啶(SDM)、磺胺间甲氧嘧啶(SMM)、甲氧苄啶(TMP)、磺胺甲嘧啶(SMR)、磺胺地索辛(SDT)、磺胺氯哒嗪(SCP)、磺胺多辛(SDX)、苯并咪唑(Benzimidazole)、甲硝唑(Metronidazole)、地美硝唑(Dimetridazole)、林可霉素(Lycomycin)、克林霉素(Clindamycin)、罗红霉素(Roxithromycin)、泰乐菌素(Tylosin)、氯苯那敏(Chlorpheniramine)、四环素(Tetracycline),纯度均 > 98%,购自德国Dr.Ehrenstorfer公司;羟甲基甲硝咪唑(1-methyl-5-nitro-1H-imidazole-2-methanol)、洛硝达唑(Ronidazole), 浓度为1 000 μg/mL,购自坛墨质检科技有限公司;氯甲硝咪唑(5-chloro-1-methyl- 4-nitroimidazole)、替硝唑(Tinidazole)、红霉素(Erythromycin),浓度为1 000 μg/mL,购自上海安谱实验科技股份有限公司;左旋咪唑(Levamisole)、氯雷他定(Loratadine)、安替比林(Antipyrine)、赛康啶(Cyproheptadine),浓度为1 000 μg/mL,购自北京曼哈格生物科技有限公司;利多卡因(Lidocaine)、苯佐卡因(Benzocaine)、氟康唑(Fluconazole)、对乙酰氨基酚(Paracetamol)、阿司咪唑(Astemizole),纯度 > 99%,购自北京曼哈格生物科技有限公司;哈西奈德(halcinonide)、可的松(Cortisone)、泼尼松(Prednisone)、泼尼松龙(Prednisolone)、氟米龙(Fluorometholone)、布地奈德(Budesonide)、地夫可特(Deflazacort)、马来酸氯苯那敏(Chlorpheniramine maleate),纯度为100%,购自中国食品药品检定研究院。
1.2 标准溶液的配制分别称取适量标准物质或准确吸取1 mL标准物质溶液,用甲醇溶解,配制质量浓度为10.0 μg/mL ~ 1.0 mg/mL的各药物标准储备液。吸取适量各标准储备液于10 mL容量瓶中,用甲醇定容至刻度,配制成质量浓度为1.0 μg/mL的47种药物混合标准溶液。
采用土壤空白基质溶液逐级稀释混合标准溶液,配制成质量浓度为1.0、2.0、5.0、10.0、20.0、50.0、100.0 ng/mL的混合标准工作溶液。
1.3 仪器工作条件色谱柱:ZORBAX Eclipse Plus C18(100 mm × 2.1 mm,3.5 μm);柱温:30 ℃;进样体积:5.0 μL;流动相:0.1% 甲酸水溶液(A)和甲醇(B);流速为0.3 mL/min;梯度洗脱程序:0.0 ~ 1.0 min,97% A;1.0 ~ 5.0 min,97%A ~ 80%A;5.0 ~ 10.0 min,80%A ~ 60%A;10.0 ~ 18.0 min,60%A ~ 30%A;18.0 ~ 22.0 min,30%A ~ 0%A;22.0 ~ 25.0 min,0%A;25.0 ~ 25.1 min,0%A ~ 97%A。
质谱条件:电喷雾离子源(Electron spray ionization,ESI),正离子扫描,多反应监测模式,干燥气温度为350 ℃,干燥气流量为7 L/min,鞘气温度为350 ℃,鞘气流量为11 L/min。
1.4 试验方法土壤样品采集于银川市、青铜峡和中卫地区。采集的样品在–18 ℃冷冻保存。试验前取适量恢复至室温的样品,阴凉通风至干后过0.3 mm筛,混匀备用。
称取5 g试样至50 mL塑料离心管中,加入5 mL EDTA-Mcllvaine缓冲液,加入1颗陶瓷均质子,涡旋混匀,准确加入5 mL乙腈,涡旋2 min,加入5 g氯化钠,剧烈振荡5 min,8 000 r/min条件下离心5 min,转移上清液。用NaOH溶液调节残渣溶液pH至9,加入5 mL乙腈,涡旋2 min,8 000 r/min条件下离心5 min,合并上清液。吸取5 mL上清液于净化管(含800 mg Na2SO4、60 mg C18、20 mg PSA),涡旋混匀5 min,8 000 r/min离心5 min。收集净化液于40 ℃氮吹至近干,用10% 乙腈水溶液复溶至1 mL,过微孔滤膜,待检测。
2 结果与讨论 2.1 仪器条件的优化 2.1.1 色谱条件的优化考察了ZORBAX Eclipse Plus C18(100 mm× 2.1 mm,3.5 μm)色谱柱和InfinityLab Poroshell 120 EN-C18 (100 mm × 2.1 mm,2.7 μm)色谱柱对47种药物的分离效果。C18填料是多种兽药分析的常用柱,经验证,这两种十八烷基硅烷化键合型的色谱柱对目标组分的分离效果相当,各目标峰峰形均良好,对目标组分具有同等的洗脱顺序。除四环素、甲硝唑、羟甲基甲硝咪唑、林可霉素、多塞平以外,InfinityLab Poroshell 120 EN-C18对其他目标组分洗脱较ZORBAX Eclipse Plus C18快0.1 ~ 0.4 min,但大部分目标组分的灵敏度低于ZORBAX Eclipse Plus C18分离的目标组分。因此,采用ZORBAX Eclipse Plus C18为首选色谱柱。
考察了乙腈–0.1% 甲酸水、甲醇–0.1% 甲酸水和甲醇–(0.1%甲酸+2 mmol/L乙酸铵)水作为流动相对化合物的分离度、灵敏度及色谱峰峰形的影响。鉴于各化合物均采用正离子扫描方式,各组流动相中均添加了0.1% 的甲酸以期达到更好的电离效果。结果显示,各目标物在不同流动相组合中均有较好的峰形,峰形对称且无拖尾和基线漂移。乙腈–0.1%甲酸水作为流动相有较强的洗脱能力,大部分目标组分出峰早。采用甲醇–0.1%甲酸水为流动相的目标化合物的灵敏度普遍较高。故选甲醇–0.1%甲酸水为流动相。
2.1.2 质谱条件优化配制质量浓度为100.0 μg/L的标准溶液,在正离子扫描模式下确定各目标物母离子和子离子,并优化破碎电压、碰撞能量等质谱参数,选择信号强度较大且干扰小的特征离子为定性定量离子。优化后的定性定量离子及相应参数见表 1,各目标物色谱峰见图 1。
|
|
表 1 47种药物的保留时间和质谱条件 Table 1 Retention times and mass spectrometric conditions for 47 drugs |
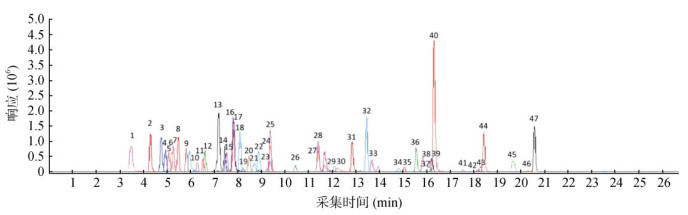
|
图 1 47种药物定量离子的提取离子色谱图(50 ng/mL) Fig. 1 Extract ion chromatograms (EIC) of quantitative ions of 47 drugs(50 ng/mL) |
多个研究表明EDTA-Mcllvaine缓冲液能够蛰合土壤等基质中的金属离子[4, 9-10],增强多种药物的提取效果。为探究EDTA-Mcllvaine缓冲液pH对各药物提取效率的影响,分别采用pH 3、7、9的EDTA-Mcllvaine缓冲液为提取液,在不加试料的情况下,按1.4步骤进行加标试验,取待净化液过滤供液相色谱–串联质谱分析。由图 2发现,羟甲基甲硝咪唑、林可霉素、苯并咪唑、左旋咪唑、红霉素、克林霉素、氯苯那敏、马来酸氯苯那敏、阿司咪唑、布地奈德、甲硝唑、利多卡因在中性或碱性条件下更易提取,其中苯并咪唑、红霉素和克林霉素在中性或碱性条件下的提取效率明显增强,较酸性条件下增幅50% 以上;磺胺类药物、四环素、地夫可特、对乙酰氨基酚、泰乐菌素在酸性条件下更易提取;其他目标物的提取效率不受pH影响。综合考虑各目标组分的提取效果,最终采用EDTA-Mcllvaine缓冲液(pH=3)与乙腈提取,调节残渣溶液pH=9后用乙腈再次提取的方式,最大程度提取样品基质中目标化合物。
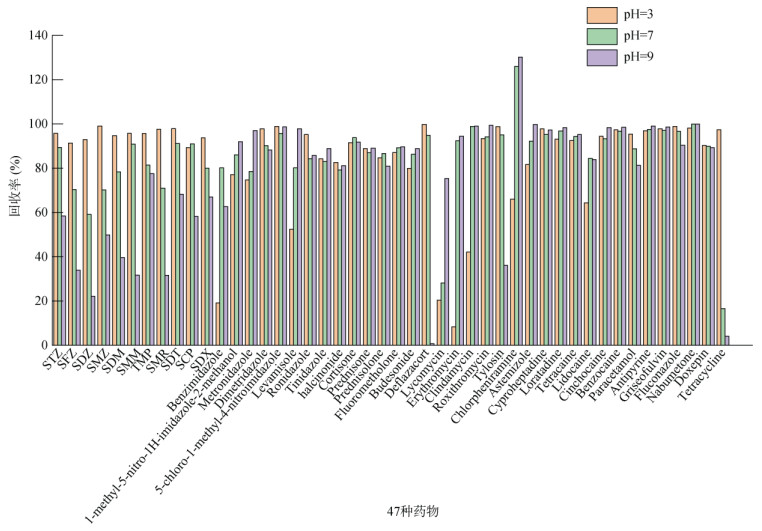
|
图 2 不同pH EDTA-Mcllvaine缓冲液对47种药物的提取效率 Fig. 2 Extraction effects of EDTA-Mcllvaine buffer solution with different pH on 47 drugs |
土壤基质复杂,含有动植物腐殖质、矿物质等多种干扰组分,因此选择合适的吸附填料与用量在净化样品的同时确保回收率至关重要。本试验考察了常用于兽药测定的d-SPE填料C18、PSA、MgSO4和Na2SO4对目标组分的吸附性和净化效果。分别在各含有100 mg MgSO4、C18、PSA和Na2SO4的净化管中加入1 mL 50.0 μg/L的标准溶液,发现MgSO4对四环素、林可霉素、苯并咪唑、克林霉素的吸附性近100%,对泰乐菌素、安替比林也有很强吸附性,故不作为本试验方法的净化填料。PSA对泰乐菌素、磺胺类药物、安替比林、对乙酰氨基酚、阿司咪唑、林可霉素、四环素具有一定吸附性,而作为吸附非极性物质的C18填料和用于除水的Na2SO4对目标物没有明显的吸附性。
为探究C18、PSA和Na2SO4对土壤基质的协同净化效果,采用Design-Expert 8.0.6设计三因素三水平的响应面分析试验,在阴性样品中添加浓度50.0 μg/L,选取受净化填料和基质效应影响较大的四环素、对乙酰氨基酚、辛可卡因、阿司咪唑、泼尼松龙、林可霉素、泰乐菌素和磺胺噻唑的平均回收率进行响应面试验,优化C18、PSA和Na2SO4用量。试验变量与响应面试验水平见表 2,响应面试验设计见表 3。
|
|
表 2 试验变量与响应面试验水平 Table 2 Experimental variables and levels of response surface analysis |
|
|
表 3 响应面试验设计方案与结果 Table 3 Experimental design scheme with experimental results for response surface analysis |
对试验数据进行二次多元回归拟合分析,得到回归拟合方程为:y(平均回收率,%)=76.50+4.54A+ 0.62B+0.99C+0.35AB–0.48AC–0.05BC–11.31A2–3.49B2–3.41C2。
由表 4分析可知,二次回归模型的F=574.39,P < 0.01,决定系数R2=0.998 6,表明该模型达到了显著水平。失拟项P值为0.875 8,即P > 0.05,表明模型拟合程度良好。模型矫正决定系数RAdj2=0.996 9,预测决定系数RPre2=0.995 1,表明该试验结果与模型预测结果保持良好的一致性。由F值的大小可知,影响目标组分平均回收率的因素主次为PSA(A) > C18(C) > Na2SO4(B)。以上结果表明,该模型可用于优化净化填料用量。
|
|
表 4 响应面二次模型的方差分析 Table 4 Analysis of variance for response surface quadratic model |
图 3反映各填料用量交互作用对8种目标物平均回收率的影响。图 3A和3B中响应面的曲面较陡峭,图 3C的弯曲幅度小,说明了PSA用量对目标组分回收率的影响明显,与方差分析结果相一致。通过软件综合分析得到最优填料用量条件为:PSA 20 mg、C18 60 mg、Na2SO4 800 mg。实验验证8种目标物的平均回收率与预测值接近。
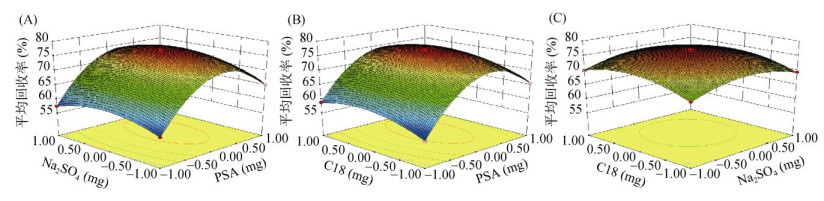
|
图 3 PSA和Na2SO4(A)、PSA和C18(B)、C18和Na2SO4(C)填料用量 Fig. 3 Disperser dosages of PSA and Na2SO4 (A), PSA and C18 (B), C18 and Na2SO4 (C) |
考察了土壤基质中各目标组分的基质效应(Matrix effect,ME)。分别采用土壤空白基质溶液和纯溶剂溶液配制标准曲线,按公式ME=(基质匹配标准曲线斜率/纯溶剂标准曲线斜率)×100%计算ME值。当ME值介于80% ~ 120%,基质效应较小;ME值小于80% 或大于120%,存在较强的基质抑制作用或增强作用。表 5表明,各目标组分皆存在强基质抑制效应。
|
|
表 5 47种药物的线性方程、相关系数(r)、检出限、定量限、基质效应、回收率和相对标准偏差 Table 5 Linear equations, correlation coefficients (r), LODs, LOQs, ME, recoveries and RSDs for 47 drugs |
鉴于土壤中药物残留处于痕量或超痕量水平,本试验选取较大称样量以期富集土壤样本中目标组分,导致各目标峰存在强基质效应。本试验采用优化样品前处理方法、调整色谱条件及质谱条件等方式尽可能降低基质效应。基于多个文献[4-5, 23]采用外标法定量且部分目标化合物存在同位素内标缺失,最终采用基质匹配标准溶液作为校准曲线,外标法定量。
2.5 方法线性关系、灵敏度、准确度、精密度按1.2步骤配制测定混合标准工作溶液,所得保留时间、线性范围、线性回归方程、相关系数、检出限和定量限见表 5。检出限(LOD)和定量限(LOQ)分别以3倍和10倍信噪比确定。结果表明,47种化合物的相关系数(r)均在0.995以上,线性关系良好。LOD为0.04 ~ 2.52 μg/kg,LOQ为0.13 ~ 8.39 μg/kg,方法灵敏度较高。
在空白土壤样品中添加4、20、32 μg/kg 3个加标水平,每个加标水平重复6次实验。由表 5所示,47种化合物的回收率为61.1% ~ 117.0%,相对标准偏差(RSD)为1.9% ~ 11.4%。结果表明该方法准确度和精密度良好,满足土壤中47种药物残留的定性定量分析要求。
取质量浓度为50.0 ng/L标准品溶液重复进样6次,各药物含量结果的相对标准偏差(RSD)(n=6)为1.04% ~ 6.87%。该方法测量再现性良好,满足分析要求。
2.6 实际样品分析采用本实验方法对240份农田土壤、45份野外池塘土壤、20份灌溉渠土壤和45份农场粪便土壤样品进行了测定,检出对乙酰氨基酚、左旋咪唑、林可霉素、甲氧苄啶、灰黄霉素、泼尼松龙和磺胺甲恶唑7种药物,实际样品测定色谱图见图 4,结果见表 6。表明本方法可满足多药物残留的检测需求。
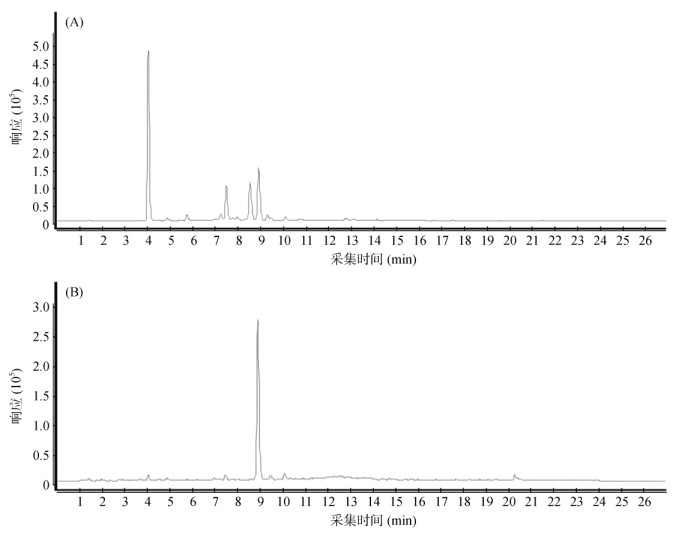
|
图 4 实际样品的总离子流图 Fig. 4 Total ion chromatograms of sample A and B |
|
|
表 6 土壤中47种药物残留检测结果 Table 6 Detection results of 47 drugs in soil |
本文建立了UPLC–MS/MS方法同时测定土壤中磺胺类、苯并咪唑类、大环内酯类、甾体激素类、抗组胺类、中枢神经类、解热镇痛类、抗真菌类、非甾抗炎类、精神类和四环素类共11类47种药物残留。该方法具有准确、灵敏度高、高通量等优点,已应用于实际样品的检测。该方法为土壤中多类别药物分析提供了方法参考,为研究土壤中多种药物的赋存底数和潜在风险研究提供技术支撑。
| [1] |
刘欣雨, 张建强, 黄雯, 等. 中国土壤中抗生素赋存特征与影响因素研究进展[J]. 土壤, 2021, 53(4): 672-681 DOI:10.13758/j.cnki.tr.2021.04.002 (  0) 0) |
| [2] |
苑学霞, 梁京芸, 范丽霞, 等. 粪肥施用土壤抗生素抗性基因来源、转移及影响因素[J]. 土壤学报, 2020, 57(1): 36-47 (  0) 0) |
| [3] |
沈聪, 张俊华, 刘吉利, 等. 宁夏养鸡场粪污和周边土壤中抗生素及抗生素抗性基因分布特征[J]. 环境科学, 2022, 43(8): 4166-4178 (  0) 0) |
| [4] |
陈晨, 李秀波, 王宏磊, 等. 土壤中抗生素多残留污染现状及前处理方法研究进展[J]. 中国兽药杂志, 2021, 55(12): 55-66 DOI:10.11751/ISSN.1002-1280.2021.12.09 (  0) 0) |
| [5] |
杨艳梅, 李晋栋, 秦曙. QuEChERS/超高效液相色谱–串联质谱法同时检测土壤中的农药及抗生素残留[J]. 分析测试学报, 2023, 42(7): 808-816 (  0) 0) |
| [6] |
乌仁图雅, 邓宇, 荣迪, 等. 超高效液相色谱法检测土壤中硝基呋喃类药物残留[J]. 化学分析计量, 2020, 29(3): 21-25 DOI:10.3969/j.issn.1008-6145.2020.03.005 (  0) 0) |
| [7] |
薛昆鹏, 俞灵钰, 任兴发, 等. 改进的固相萃取–高效液相色谱法测定土壤中15种醛酮类化合物[J]. 色谱, 2023, 41(3): 265-273 (  0) 0) |
| [8] |
薛昆鹏, 俞灵钰, 任兴发, 等. 改进的固相萃取–高效液相色谱法测定土壤中15种醛酮类化合物[J]. 色谱, 2023, 41(3): 265–273, I0003 (  0) 0) |
| [9] |
郭延萍, 刘永玲. 气相色谱质谱法测定土壤中5种苯并咪唑类的残留[J]. 中国测试, 2021, 47(9): 82-86 (  0) 0) |
| [10] |
杨晓蕾, 李杰, 李学文, 等. 土壤中10种兽用抗生素的固相萃取–高效液相色谱–紫外测定法[J]. 环境与健康杂志, 2012, 29(4): 357-360 (  0) 0) |
| [11] |
米旭蕾, 王可, 李志伟. UPLC-MS/MS法测定土壤中氯霉素类抗生素及其代谢物[J]. 河北科技大学学报, 2023, 44(2): 177-185 (  0) 0) |
| [12] |
武云龙. 养殖废水和土壤中4类78种抗菌药物残留UPLC-MS/MS检测方法的建立[D]. 太谷: 山西农业大学, 2022: 12–20.
(  0) 0) |
| [13] |
李娜, 张玉婷, 刘磊, 等. QuEChERS-超高效液相色谱–串联质谱法测定动物源食品中4类29种禁限用兽药残留[J]. 色谱, 2014, 32(12): 1313-1319 (  0) 0) |
| [14] |
夏宝林, 汪仕韬, 殷晶晶, 等. 自动上样固相萃取–超高效液相色谱–串联质谱法同时测定水中9类43种抗菌药物残留[J]. 色谱, 2023, 41(7): 591-601 (  0) 0) |
| [15] |
孙慧婧, 李佩纹, 张蓓蓓, 等. 大体积直接进样–超高效液相色谱–三重四极杆质谱法测定水中7大类42种抗生素残留[J]. 色谱, 2022, 40(4): 333-342 (  0) 0) |
| [16] |
李振环, 胡小键, 陆一夫, 等. 基于高通量全自动固相萃取的超高效液相色谱–串联质谱法测定人尿中16种抗生素和4种β-受体激动剂[J]. 色谱, 2023, 41(5): 397-408 (  0) 0) |
| [17] |
徐新, 孙文芳, 徐杰, 等. 固相萃取–超高效液相色谱–串联质谱法同时测定人尿液中40种抗生素的残留量[J]. 理化检验-化学分册, 2023, 59(5): 591-598 (  0) 0) |
| [18] |
Wang Z, Wang X Y, Tian H, et al. High through-put determination of 28 veterinary antibiotic residues in swine wastewater by one-step dispersive solid phase extraction sample cleanup coupled with ultra-performance liquid chromatography-tandem mass spectrometry[J]. Chemosphere, 2019, 230: 337-346 DOI:10.1016/j.chemosphere.2019.05.047 (  0) 0) |
| [19] |
Jongedijk E, Fifeik M, Arrizabalaga-Larrañaga A, et al. Use of high-resolution mass spectrometry for veterinary drug multi-residue analysis[J]. Food Control, 2023, 145: 109488 DOI:10.1016/j.foodcont.2022.109488 (  0) 0) |
| [20] |
Ye S B, Huang Y, Lin D Y. QuEChERS sample pre- processing with UPLC-MS/MS: A method for detecting 19 quinolone-based veterinary drugs in goat's milk[J]. Food Chemistry, 2022, 373(Pt B): 131466 (  0) 0) |
| [21] |
Chen J, He L X, Cheng Y X, et al. Trace analysis of 28 antibiotics in plant tissues (root, stem, leaf and seed) by optimized QuEChERS pretreatment with UHPLC-MS/MS detection[J]. Journal of Chromatography B, Analytical Technologies in the Biomedical and Life Sciences, 2020, 1161: 122450 DOI:10.1016/j.jchromb.2020.122450 (  0) 0) |
| [22] |
Xu J, Yang M, Wang Y H, et al. Multiresidue analysis of 15 antibiotics in honey using modified QuEChERS and high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Food Composition and Analysis, 2021, 103: 104120 DOI:10.1016/j.jfca.2021.104120 (  0) 0) |
| [23] |
Lakew A, Megersa N, Chandravanshi B S. Validation of modified QuECHERS extraction method for quantitative enrichment of seven multiclass antibiotic residues from vegetables followed by RP-LC-UV analysis[J]. Heliyon, 2023, 9(4): e15227 DOI:10.1016/j.heliyon.2023.e15227 (  0) 0) |
| [24] |
刘瑜, 王永刚, 吕红英, 等. 畜禽粪便和土壤中典型抗生素SPE-UPLC-MS/MS检测方法的建立[J]. 沈阳师范大学学报(自然科学版), 2023, 41(2): 114-119 (  0) 0) |
2. College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, China
 2024, Vol. 56
2024, Vol. 56


