2. 湖南省烟草公司张家界市公司, 湖南张家界 427099;
3. 中国科学院亚热带农业生态研究所亚热带农业生态过程重点实验室, 长沙 410125
硝化作用是稻田土壤氮循环关键过程之一,包括NH4+氧化为NO2-、NO2-转化为NO3-[1]两个步骤,均由微生物驱动。硝化作用产生的硝酸盐不仅可经淋失造成肥力损失和地下水污染[2],还可经反硝化作用产生温室气体N2O[3],加速气候变暖。因此,明确稻田土壤硝化作用机理对研究稻田氮素损失减量及N2O减排具有重要科学意义。
氨氧化反应是硝化作用的起始和限速步骤,由氨氧化古菌(Ammonia-oxidizing archaea,AOA)和氨氧化细菌(Ammonia-oxidizing bacteria,AOB)驱动[4]。氨氧化微生物的丰度和群落结构受底物浓度和多种土壤理化性质影响。研究表明,pH是决定氨氧化微生物AOA、AOB生态位分化的关键因子,由于对环境的偏好性,AOA在酸性条件下活性较强,AOB则在碱性条件下能够更好地生存,且AOA、AOB主要功能类群在pH不同的土壤中也存在较大差异[4-6];除pH外,氮的添加也会影响土壤AOB的群落结构,AOA与AOB在不同氮素水平下的生长状况不同[4]。此外,在稻田生态系统中,温度会通过改变相关酶活性进而影响AOA与AOB的功能活性、相对丰度以及群落结构[7],施肥[8]、水稻种植[9]等田间管理措施也会影响AOA与AOB的分布。
南方地区是我国水稻主产区之一,分布着由多种母质发育而来的水稻土。研究表明,土壤母质是决定土壤养分丰缺和理化分异的关键因子[10],也决定着土壤微生物丰度和结构特征[11]。目前,关于AOA和AOB在不同类型稻田土壤中的分布特征已有少量报道,然而,这些研究主要集中于不同地区不同类型的稻田土壤。由于研究之间不同地区气候条件、种植模式、施肥制度和水稻品种等方面均存在差异,因而难以系统地比较分析不同类型稻田土壤AOA和AOB群落结构的分布规律及应答特征。
基于此,本研究依托中国科学院桃源农业生态试验站原状水稻土易地置土长期定位试验,选取广东英利的砖红壤、江西鹰潭的第四纪红壤和湖南桃源古市的河流冲积物3种母质发育的稻田土壤为研究对象,利用实时荧光定量PCR和Illumina MiSeq测序等分子生物学技术,在早稻种植期间(全程淹水种植),系统监测3种水稻土关键理化因子、硝化速率及AOA和AOB丰度和群落组成的动态变化规律,以及它们之间的内在联系,系统揭示我国南方具有区域代表性的3种母质发育稻田土壤AOA和AOB的分布特征和硝化潜力及群落结构形成核心驱动因子。研究结果对提高稻田氮素利用效率和减少N2O排放具有重要的科学意义。
1 材料与方法 1.1 供试样点及样品采集中国科学院桃源农业生态试验站原状水稻土易地置土长期定位试验设置于2010年底,是将广东英利的砖红壤、浙江嘉兴和湖南桃源古市的河流冲积物、江西鹰潭和湖南桃源宝洞峪的第四纪红壤母质发育的5种水稻土置于桃源农业生态试验站的同一田块(各含3个重复)。每个微区的原状土柱长×宽×高为1.4 m×1.4 m×0.7 m。2011年至今,按照当地水稻种植模式种植双季稻。稍有调整的是,为了防止原状土柱开裂造成养分流失等问题,本长期定位试验一直淹水处理。本研究在2018年早稻种植期间选取了该长期定位试验田中广东英利的砖红壤(YL)(20°33′ N,110°04′ E)、江西鹰潭的第四纪红壤(YT)(28°12′ N,116°56′ E)和湖南桃源古市的河流冲积物(TYG)(28°55′ N,111°26′ E)3种母质发育土壤作为研究对象。2018年测得YL土壤基本理化性质为:全氮1.06 g/kg、全磷1.04 g/kg、全钾4.24 g/kg、有机质20.25 g/kg;YT土壤基本理化性质为:全氮1.21 g/kg、全磷0.71 g/kg、全钾15.4 g/kg、有机质22.15 g/kg;TYG土壤基本理化性质为:全氮2.15 g/kg、全磷0.72 g/kg、全钾22.67 g/kg、有机质18.82 g/kg。3种土壤于4月28日按每亩(1亩=667 m2)施入25 kg过磷酸钙(含P2O5 120 g/kg)、5 kg氯化钾(含K2O 600 g/kg)、11.5 kg尿素(含N 460 g/kg)后移栽早稻(品种为中早35),并于5月4日按每亩施入8 kg尿素进行追肥。分别在4月26日未施肥期、5月6日水稻返青期、5月20日分蘖期和6月4日孕穗期采集土样。每小区选取前中后三段,每段采用五点取样法采集土样(0 ~ 20 cm)后混匀,每个时期各取3个重复。去除土壤中杂草、石块等杂质,一部分立即用于理化性质和硝化速率测定,另一部分储存在–80℃冰箱用于分子生物学指标测定。
1.2 土壤理化性质的测定土壤pH采用pH计(Mettler-toledo320,上海)按水土质量比2.5︰1测定,土壤NH+ 4-N和NO3--N含量采用0.5 mol/L K2SO4溶液浸提后流动注射分析仪(AA3,德国SEAL,中国)测定;土壤可溶性有机碳(DOC)采用0.5 mol/L K2SO4浸提后可溶性有机碳分析仪(Analytik Jena,德国)测定。
1.3 土壤硝化速率的测定土壤硝化速率采用Kurola等[12]的方法测定,并稍作修改。称取5 g鲜土于50 mL离心管中培养,加入20 mL(1 mmol/L)磷酸缓冲液(内含1 mmol/L (NH4)2SO4和50 mg/L KClO3抑制亚硝酸盐氧化),在25℃黑暗处180 r/min振荡培养24 h。培养结束后加5 mL1 mol/L KCl提取NO2-后进行离心,用紫外分光光度法测定上清液中NO2–-N含量。以培养24 h中平均每小时NO2–-N浓度的净增加量作为土壤硝化速率。
1.4 土壤DNA提取及荧光定量PCR分析采用FastDNA® Spin Kit For Soil(MP Biomedicals,美国)试剂盒提取土壤DNA。称取0.5 g经冷冻干燥研磨后的土壤样品,按照试剂盒操作步骤进行土壤DNA提取。用1% 琼脂糖凝胶电泳和UV-Vis分光光度计(NanoDrop-1000,德国)检测提取的DNA质量和浓度。选取特异性引物amoA-1F/amoA-2和Arch-amoAF/Arch-amoAR[13]对AOB amoA、AOA amoA基因进行荧光定量PCR扩增。PCR反应体系为20 μL,包括10 μL SYBR-Green Ⅱ(Takara),上、下游引物(10 μmol/L)各0.5 μL,DNA模板(10倍稀释)2 μL,并用RNase-Free Water补足至20 μL。PCR程序为:95℃预变性2 min;95℃变性15 s,55℃退火30 s,72℃延伸32 s,40个循环。溶解曲线过程为95℃ 15 s,55℃ 30 s,90℃ 15 s。标准曲线采用含有AOB和AOA的amoA基因质粒,按10倍梯度稀释制作。扩增效率为95% ~ 107%,R2为0.997。
1.5 Illumina Miseq高通量测序使用PCR扩增AOB amoA、AOA amoA基因,所用反应体系和引物参考李高洋等[14]的方法,所得PCR产物采用2% 琼脂糖凝胶电泳检测,采用AxyPrep DNA kit凝胶回收试剂盒(Axygen,California,美国)切胶回收,将PCR产物送至上海美吉生物医药科技有限公司进行Illumina MiSeq测序。随后按照97% 的相似性对序列进行聚类[5],最终得到AOB amoA和AOA amoA基因的OTU(最小分类单元)代表序列。Miseq测序得到的是双端序列数据,每个样品每个功能基因至少获得3万条有效序列,原始测序数据上传至NCBI(National Center for Biotechnology Information,美国国家生物技术信息中心),数据库登录号为PRJNA673573、PRJNA673810、PRJNA674907。
1.6 数据处理与统计分析使用软件SPSS 25.0对土壤理化性质、硝化速率、AOA和AOB基因丰度进行单因素方差分析(One-way ANOVA)、独立样本t检验(Independent samples t-test)与Pearson相关性分析。使用R studio Function数据分析包对AOA和AOB群落结构进行置换多元方差分析(Permanova analysis)。使用OriginPro 2022软件绘图。使用Canoco 5软件对数据进行冗余分析(Redundancy analysis,RDA)。使用MEGA-X软件的邻接方法(Neighbor-joining)构建包含优势OTU代表性序列及其相似序列的系统发育树。
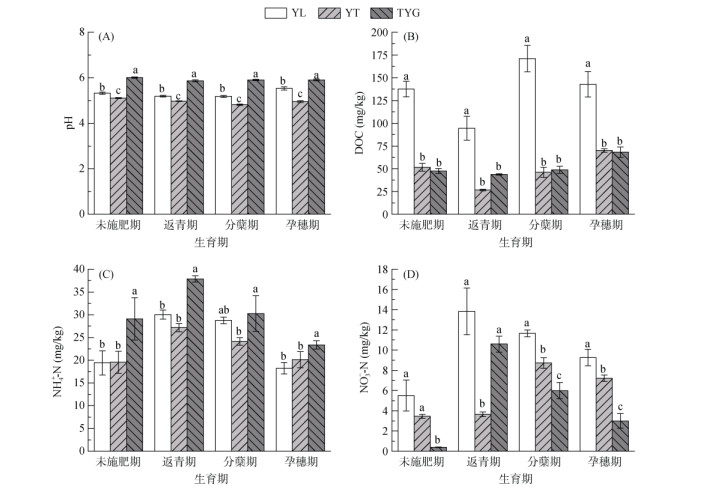
2 结果与分析 2.1 不同母质发育稻田土壤理化性质的差异早稻生育期间3种母质发育稻田土壤理化性质存在显著差异(图 1)。3种土壤的pH在4个时期一直呈酸性,均表现为:TYG > YL > YT。YL土壤DOC含量显著高于YT与TYG(P < 0.05)。TYG土壤的NH4+-N含量在各生育期显著高于YT与YL(P < 0.05)。YL土壤NO3--N含量在分蘖期和孕穗期显著高于其他处理(P < 0.05)。
|
(图中误差线为标准差;图中小写字母不同代表同一时期不同土壤样品间差异显著P < 0.05;下同) 图 1 不同母质发育稻田土壤水稻各生育期理化性质 Fig. 1 Physiochemical properties of paddy soils derived from different parent materials during different rice growth stages |
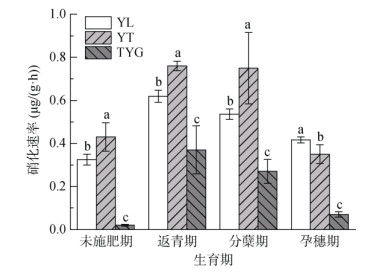
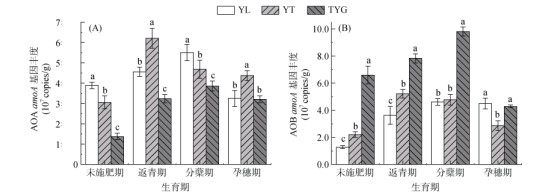
3种母质发育稻田土壤硝化速率差异显著(图 2),除孕穗期外,均表现为:YT > YL > TYG(P < 0.05)。不同母质土壤AOA和AOB丰度也具有显著差异(P < 0.05)(图 3),在水稻生长期间,YL与YT土壤中AOA数量占主导地位,其AOA丰度值分别为3.25×107 ~ 5.5×107、3.06×107 ~ 6.21×107 copies/g,AOB丰度值分别为1.27×107 ~ 4.61×107、2.2×107 ~ 5.22×107 copies/g,AOA/AOB比值分别在0.72 ~ 3.05、0.98 ~ 1.52;TYG土壤中AOB数量占主导地位,其AOA丰度值为1.37×107 ~ 3.86×107copies/g,AOB丰度值为4.28×107 ~ 9.82×107 copies/g,AOA/AOB比值在0.21 ~ 0.75。Pearson相关分析(表 1)表明,pH与AOA丰度具有极显著负相关性(P < 0.01), pH、NH4+-N含量与AOB丰度具有极显著正相关性(P < 0.01),硝化速率与AOA丰度具有极显著正相关性(P < 0.01)]。
|
图 2 不同母质发育稻田土壤水稻各生育期硝化速率 Fig. 2 Nitrification rates of paddy soils derived from different parent materials during different rice growth stages |
|
图 3 不同母质发育稻田土壤水稻各生育期AOA(A)和AOB(B)基因丰度 Fig. 3 Abundance of AOA(A) and AOB(B) of paddy soils derived from different parent materials during different rice growth stages |
|
|
表 1 不同母质发育稻田土壤AOA、AOB基因丰度、多样性指数与理化指标、硝化速率相关 Table 1 Pearson correlation of gene abundance of AOA and AOB, AOA and AOB diversity indexes, soil physiochemical properties, and nitrification rates of paddy soils derived from different parent materials |
由表 2可知,在早稻生长期间,3种土壤AOA Shannon指数表现为YT > TYG > YL,且差异达显著水平(P < 0.05),说明YT土壤AOA物种多样性最高;TYG土壤Chao指数最大,说明TYG土壤中物种丰富度较高。YT土壤AOB Shannon指数与其余两种土壤相比显著降低(P < 0.05),且除孕穗期外其Chao指数也最小,但差异未达到显著水平(P > 0.05)。从Pearson相关性分析结果可以看出(表 1),AOA和AOB的Shannon指数、AOA的Chao指数与所有土壤因子均无显著相关性(P > 0.05),仅AOB的Chao指数与NO3--N含量表现出显著正相关关系(P < 0.05)。
|
|
表 2 不同母质发育稻田土壤水稻各生育期AOA、AOB多样性指数 Table 2 Diversity indexes of AOA and AOB in paddy soils derived from different parent materials during different rice growth stages |
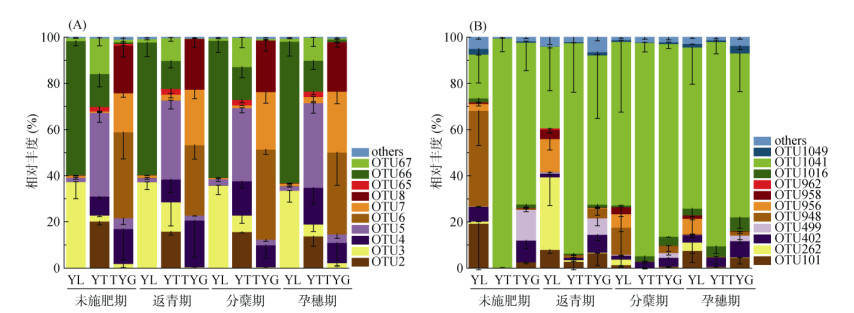
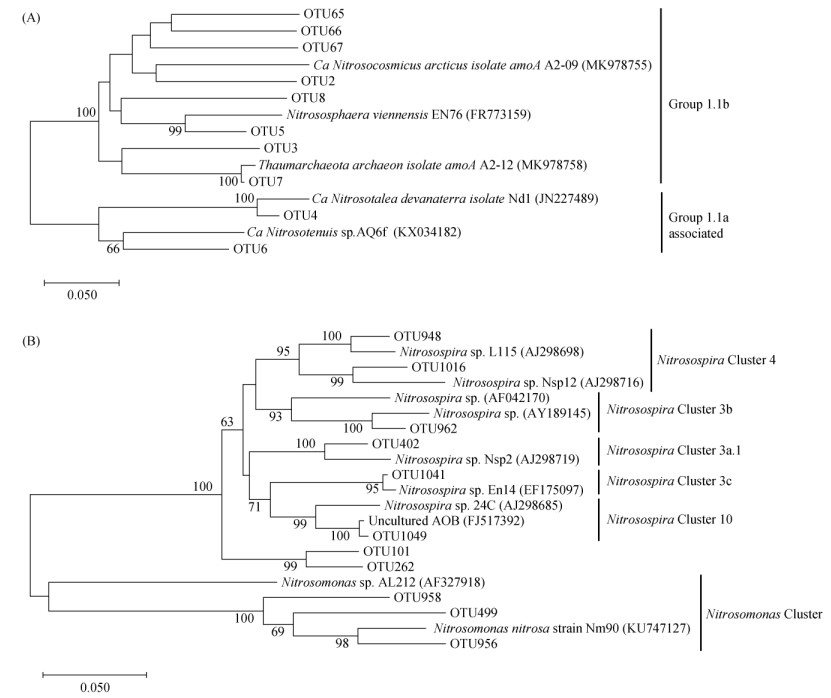
选取3种母质发育稻田土壤早稻生长时期AOA和AOB的优势OTU(> 1%)进行分析。从图 4A直方图中可以看出,不同母质发育稻田土壤AOA优势OTU各不相同。其中,YL稻田土中,OTU66与OTU3在早稻生长期间均为优势序列,通过与NCBI数据库比对发现,OTU66属于Nitrosocosmicus,OTU3属于Thaumarchaeota(奇古菌门);YT土壤优势序列为OTU5,与已知来自草地或花园土壤中的Nitrososphaera (亚硝化螺菌属)有99% 相似度;TYG土壤优势序列为OTU6,与一种来自淡水水族馆生物过滤器的Nitrosotenuis(细小亚硝化菌属)有66% 相似度。由图 4B可知,早稻生长期间OTU1041在YT和TYG两种土壤中均为优势序列,相对丰度分别达88.4% ~ 99.4%、64.6% ~ 83.5%。同时,OTU1041在YL土壤中随生育期的进行逐渐表现出主导地位。AOB系统发育树结果显示(图 5B),OTU1041与Nitrosospira(亚硝化螺旋菌属)有较高相似度(95%)。PERMANOVA分析(表 3)进一步补充说明,不同母质发育稻田土壤AOA和AOB群落结构均存在极显著差异(P < 0.01)。
|
图 4 不同母质发育稻田土壤各生育期AOA(A)和AOB(B)群落组成 Fig. 4 Community compositions of AOA (A) and AOB (B) in paddy soils derived from different parent materials during different rice growth stages |
|
图 5 AOA(A)、AOB(B)优势OTU系统发育树 Fig. 5 Phylogenetic tree of dominant OTUs of AOA(A)and AOB(B) |
|
|
表 3 不同母质发育稻田土壤AOA、AOB群落结构PERMANOVA分析 Table 3 PERMANOVA analysis of community structures of AOA and AOB |
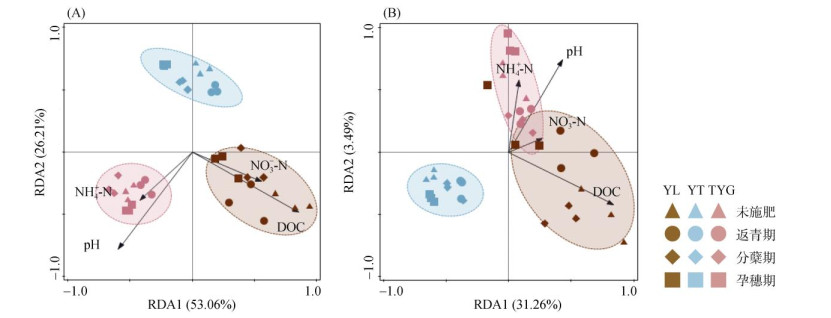
对AOA和AOB群落组成与环境变量进行RDA分析发现,两个排序轴共同解释了AOA、AOB样本79.21%、34.76% 的变异(图 6)。相同母质不同时期稻田土壤很明显聚为一类,表明不同母质土壤氨氧化微生物群落结构彼此差异较大,且采样时间对群落结构影响不明显。pH和DOC对氨氧化微生物群落结构的影响显著(P < 0.05)。
|
图 6 不同母质发育稻田土壤AOA(A)、AOB(B)群落组成和理化因子的冗余分析 Fig. 6 Redundancy analysis of AOA (A) and AOB (B) community compositions and soil properties in paddy soils derived from different parent materials |
砖红壤、第四纪红壤和河流冲积物母质发育的稻田土壤是我国南方水稻主产区代表性土壤。本研究中,在气候条件、种植模式、施肥制度和水稻品种均统一的环境背景下,YL、YT和TYG三种母质发育稻田土壤的理化性质依然存在差异(图 1),这表明母质在很大程度上影响着多种土壤理化性质。土壤形成的物质基础是母质,其天然的特性会对土壤的养分状况和理化性质有着显著的影响[10],且这种影响并没有由于种植环境背景的统一而逐渐消除。有研究表明,由母质引起的土壤理化因素之间的差异会间接影响微生物丰度[11]。YL与YT土壤中AOA数量占主导地位,TYG土壤中AOB数量占主导地位(图 2),且Pearson相关性分析结果表明,AOA与AOB丰度与pH分别存在极显著负相关和极显著正相关关系(P < 0.01)。这是由于YL与YT土壤更偏酸性,AOA为专性嗜酸菌,在偏酸性土壤中,AOA具有独特的生物化学及遗传学特征,能适应低pH的环境[15]。13CO2-DNA-SIP试验中发现,13C标记的碳源在酸性环境中对AOA而非AOB存在显著同化,也进一步有力地证明了AOA在酸性土壤氨氧化中的主导作用,加上AOA活跃的自养硝化活性,为其在酸性环境中的主导作用提供了直接证据[15]。且许多分子研究表明,在多种酸性土壤中,AOA在数量上优于AOB[16-18]。TYG土壤NH+ 4-N含量显著高于YL与YT(P < 0.05),在寡营养环境中,例如底物浓度(氨)较低的环境中,AOA对氨的亲和力约为AOB的200倍[19],因此AOA偏爱低NH+ 4-N环境,AOB则在氮素较富集土壤中较为活跃[20],这可能是AOB在TYG土壤中占比较大的原因。
Pearson相关性分析结果表明,硝化速率与AOA丰度存在显著正相关关系,与AOB丰度无显著相关性(表 1)。这与He等[16]在中国南方酸性红壤(pH 3.7~ 6.0)进行的长期施肥试验,以及Yao[17]等在苏格兰的一项全国土壤调查(共713个样本)中的结果相似。有研究发现,AOB群落较稳定,不受硝化速率显著变化的影响[21],这可能是硝化速率与AOB丰度无显著相关性的原因。但AOB中存在多个amoA基因拷贝,AOA在细胞中是否含有一个以上的amoA基因拷贝还不确定[22],此外,AOA细胞的体积通常比AOB小10 ~ 100倍,而且AOA的氨氧化速率更低[23],因此,AOA、AOB丰度与硝化速率数值上的相关性并不一定等同于二者对原位硝化的功能重要性。AOA和AOB丰度与硝化速率之间是否存在潜在相关性还需进一步深入研究。
3.2 不同母质发育稻田土壤对硝化微生物群落组成的影响本研究发现,不同母质发育稻田土壤AOA、AOB多样性指数、群落组成均存在显著差异。其中AOA优势菌属各不相同,YT土壤中,AOA优势菌属为Nitrososphaera(亚硝化螺菌属)。研究发现发现,Nitrososphaera是酸性土壤中氨氧化作用的重要驱动者[5, 24],这可能是因为其具备一种独特的代谢能力,可缓解pH较低环境对其的毒害作用。Nitrosotenuis (细小亚硝化菌属)主要在河流、河口和深水湖泊分布[25],这与本研究中同为河流冲积物母质的TYG土壤优势菌属结果一致,同时Thaumarchaeota(奇古菌门)在酸性土壤中也广泛分布[26]。在相同种植环境背景下,3种不同母质发育稻田土壤AOA优势菌属各不相同,这也充分体现了母质对AOA群落结构存在显著影响以及酸性土壤氨氧化过程的复杂性和氨氧化微生物的多样性。β变形菌门被认为在土壤AOB中占主导地位,其中两个主要类群为 Nitrosomonas(亚硝化单胞菌属)和Nitrosospira(亚硝化螺旋菌属)。Nitrosospira更偏好酸性土壤[27],是酸性土壤中的优势菌属,本研究结果与也之相符合。Nitrosomonas在酸性土壤中很少见,通常分布于中性或碱性土壤中[6, 27],这也是它在本研究3种酸性土壤中占比较少的原因。RDA分析结果表明,pH和DOC含量是驱动氨氧化微生物AOA、AOB群落结构的关键因子,其中DOC影响较大。有研究发现,土壤pH可以通过改变氨的生物有效性来影响氨氧化微生物的群落结构[28],且不同pH环境条件下,AOA、AOB主要功能类群也不同[5-8]。宋延静等[20]也认为土壤pH对稻田氨氧化菌群落结构的形成起着重要作用。Marschner[29]发现细菌群落结构受土壤有机碳含量的显著影响,这可能是由于DOC中容易分解的化合物如有机酸和碳水化合物可能主要被土壤细菌利用的结果。这说明即使在相同的种植环境背景下,由地域和成土母质因素长期影响所造成的土壤理化性质及养分的差异,仍然会导致AOA、AOB群落组成结构的不同,说明母质显著影响氨氧化微生物群落结构组成。
4 结论在气候条件、种植模式、施肥制度和水稻品种均一致的种植环境背景下,由砖红壤、第四纪红壤和河流冲积物母质发育而来的3种稻田土壤,其pH和NH+ 4-N含量的差异导致了3种土壤AOA/AOB的丰度比值不同,pH和DOC也被证明是驱动AOA、AOB群落结构形成的核心因子。
| [1] |
Wu Y X, Xu L G, Wang S, et al. Nitrate attenuation in low-permeability sediments based on isotopic and microbial analyses[J]. The Science of the Total Environment, 2018, 618: 15-25 DOI:10.1016/j.scitotenv.2017.11.039 (  0) 0) |
| [2] |
雷钊. 拟南芥硝态氮调控突变体的筛选与鉴定[D]. 泰安: 山东农业大学, 2014.
(  0) 0) |
| [3] |
Santoro A E, Buchwald C, McIlvin M R, et al. Isotopic signature of N2O produced by marine ammonia-oxidizing Archaea[J]. Science, 2011, 333(6047): 1282-1285 DOI:10.1126/science.1208239 (  0) 0) |
| [4] |
Wang F, Liang X L, Ma S H, et al. Ammonia-oxidizing Archaea are dominant over comammox in soil nitrification under long-term nitrogen fertilization[J]. Journal of Soils and Sediments, 2021, 21(4): 1800-1814 DOI:10.1007/s11368-021-02897-z (  0) 0) |
| [5] |
李文兴, 郑曼曼, 王超, 等. 亚硝化球菌属(Nitrososphaera)可能是酸性土壤硝化作用的重要驱动者[J]. 土壤, 2021, 53(1): 13-20 DOI:10.13758/j.cnki.tr.2021.01.003 (  0) 0) |
| [6] |
Li Y Y, Chapman S J, Nicol G W, et al. Nitrification and nitrifiers in acidic soils[J]. Soil Biology and Biochemistry, 2018, 116: 290-301 DOI:10.1016/j.soilbio.2017.10.023 (  0) 0) |
| [7] |
Zeng J, Zhao D Y, Yu Z B, et al. Temperature responses of ammonia-oxidizing prokaryotes in freshwater sediment microcosms[J]. PLoS One, 2014, 9(6): e100653 DOI:10.1371/journal.pone.0100653 (  0) 0) |
| [8] |
Sun R B, Myrold D D, Wang D Z, et al. AOA and AOB communities respond differently to changes of soil pH under long-term fertilization[J]. Soil Ecology Letters, 2019, 1(3): 126-135 (  0) 0) |
| [9] |
杨镇, 彭亮, 陶玲, 等. 种植水稻对池塘沉积物中养分和氨氧化古菌的影响[J]. 水生生物学报, 2023, 47(4): 564-571 (  0) 0) |
| [10] |
毛霞丽, 邱志腾, 张爽, 等. 不同母质发育土壤团聚体分布对外源输入秸秆的响应及其与有机碳矿化的关系[J]. 环境科学, 2020, 41(6): 2842-2851 (  0) 0) |
| [11] |
Ulrich A, Becker R. Soil parent material is a key determinant of the bacterial community structure in arable soils[J]. FEMS Microbiology Ecology, 2006, 56(3): 430-443 DOI:10.1111/j.1574-6941.2006.00085.x (  0) 0) |
| [12] |
Kurola J, Salkinoja-Salonen M, Aarnio T, et al. Activity, diversity and population size of ammonia-oxidising bacteria in oil-contaminated landfarming soil[J]. FEMS Microbiology Letters, 2005, 250(1): 33-38 DOI:10.1016/j.femsle.2005.06.057 (  0) 0) |
| [13] |
侯海军, 秦红灵, 陈春兰, 等. 土壤氮循环微生物过程的分子生态学研究进展[J]. 农业现代化研究, 2014, 35(5): 588-594 (  0) 0) |
| [14] |
李高洋, 黄永相, 吴伟健, 等. 海水稻根际效应对滨海盐碱地土壤氨氧化微生物的影响[J]. 土壤学报, 2023, 60(2): 587-598 (  0) 0) |
| [15] |
Zhang L M, Hu H W, Shen J P, et al. Ammonia-oxidizing Archaea have more important role than ammonia-oxidizing bacteria in ammonia oxidation of strongly acidic soils[J]. The ISME Journal, 2012, 6(5): 1032-1045 DOI:10.1038/ismej.2011.168 (  0) 0) |
| [16] |
He J Z, Shen J P, Zhang L M, et al. Quantitative analyses of the abundance and composition of ammonia-oxidizing bacteria and ammonia-oxidizing Archaea of a Chinese upland red soil under long-term fertilization practices[J]. Environmental Microbiology, 2007, 9(9): 2364-2374 DOI:10.1111/j.1462-2920.2007.01358.x (  0) 0) |
| [17] |
Yao H Y, Gao Y M, Nicol G W, et al. Links between ammonia oxidizer community structure, abundance, and nitrification potential in acidic soils[J]. Applied and Environmental Microbiology, 2011, 77(13): 4618-4625 DOI:10.1128/AEM.00136-11 (  0) 0) |
| [18] |
熊旭梅, 周雪, 郭佳, 等. 不同pH和氧气条件下土壤古菌与海洋古菌的竞争适应机制[J]. 土壤学报, 2022, 59(3): 833-843 (  0) 0) |
| [19] |
Li Z P, Liu M, Wu X C, et al. Effects of long-term chemical fertilization and organic amendments on dynamics of soil organic C and total N in paddy soil derived from barren land in subtropical China[J]. Soil and Tillage Research, 2010, 106(2): 268-274 DOI:10.1016/j.still.2009.12.008 (  0) 0) |
| [20] |
宋延静, 张晓黎, 付娆, 等. 滨海盐渍化土壤中氨氧化微生物丰度和多样性特征[J]. 土壤, 2022, 54(6): 1157-1164 DOI:10.13758/j.cnki.tr.2022.06.009 (  0) 0) |
| [21] |
Laverman A M, Speksnijder A G C L, Braster M, et al. Spatiotemporal stability of an ammonia-oxidizing community in a nitrogen-saturated forest soil[J]. Microbial Ecology, 2001, 42(1): 35-45 DOI:10.1007/s002480000038 (  0) 0) |
| [22] |
Hatzenpichler R. Diversity, physiology, and niche differentiation of ammonia-oxidizing Archaea[J]. Applied and Environmental Microbiology, 2012, 78(21): 7501-7510 DOI:10.1128/AEM.01960-12 (  0) 0) |
| [23] |
Martens-Habbena W, Berube P M, Urakawa H, et al. Ammonia oxidation kinetics determine niche separation of nitrifying Archaea and Bacteria[J]. Nature, 2009, 461(7266): 976-979 DOI:10.1038/nature08465 (  0) 0) |
| [24] |
Lin Y X, Ye G P, Luo J F, et al. Nitrosospira cluster 8a plays a predominant role in the nitrification process of a subtropical ultisol under long-term inorganic and organic fertilization[J]. Applied and Environmental Microbiology, 2018, 84(18): e01031-e01018 (  0) 0) |
| [25] |
Ren M L, Wang J J. Phylogenetic divergence and adaptation of Nitrososphaeria across lake depths and freshwater ecosystems[J]. The ISME Journal, 2022, 16(6): 1491-1501 DOI:10.1038/s41396-022-01199-7 (  0) 0) |
| [26] |
Bomberg M, Timonen S. Distribution of cren- and euryarchaeota in Scots pine mycorrhizospheres and boreal forest humus[J]. Microbial Ecology, 2007, 54(3): 406-416 DOI:10.1007/s00248-007-9232-3 (  0) 0) |
| [27] |
Song H, Che Z, Cao W C, et al. Changing roles of ammonia-oxidizing bacteria and Archaea in a continuously acidifying soil caused by over-fertilization with nitrogen[J]. Environmental Science and Pollution Research International, 2016, 23(12): 11964-11974 (  0) 0) |
| [28] |
刘晶静, 马文丹, 和松, 等. 酸性土壤氨氧化微生物及其影响因素研究进展[J]. 微生物学通报, 2023, 50(1): 413-426 (  0) 0) |
| [29] |
Marschner P. Structure and function of the soil microbial community in a long-term fertilizer experiment[J]. Soil Biology and Biochemistry, 2003, 35(3): 453-461 (  0) 0) |
2. Zhangjiajie City Company, Hunan Tobacco Company, Zhangjiajie, Hunan 427099, China;
3. Key Laboratory of Agro-ecological Processes in Subtropical Region, Institute of Subtropical Agriculture, Chinese Academy of Sciences, Changsha 410125, China
 2024, Vol. 56
2024, Vol. 56


