2. 阜蒙县农业农村局, 辽宁阜新 123100
生物质炭化还田能够提高土壤肥力,也可以实现碳封存以缓解气候变化[1],现已成为秸秆综合利用的重要途径之一。生物质炭本身含有碳素,是物理化学性质稳定的固体产物,其固有结构特征是孔隙发达、芳香化程度高等。通常生物质炭pH > 7,这与其自身碳酸盐、磷酸盐等无机矿物质成分有关[2]。研究表明,不同生物质炭原材料显著影响其理化性质,如灰分、比表面积、孔隙度、芳香化结构以及炭化产率等[3]。生物质炭热解速度与热解温度有关,热解时间由几小时到几天不等,在低温短时间下生产的生物质炭,保留了碳水化合物和酚类物质[2],而在≥550 ℃裂解温度下生产的慢热解生物质炭,其阳离子交换量和比表面积更大,pH也更高[4-5]。
土壤微生物是生态系统中重要的组成部分,在土壤有机质矿化、腐殖质化、养分转化等方面有重要作用[6-7]。生物质炭可以加快生物地球化学进程、增强微生物的生态位,有巨大的潜力重塑土壤微生物的多样性[8]。相关研究指出,土壤微生物可以通过降解利用生物质炭中的营养物质,而生物质炭的孔隙特征可以通过影响微生物所需水分、营养物质和所处的栖息地环境改变微生物群落结构[9]。不同裂解温度制成的生物质炭,其特性差异大,从而可对土壤微生物产生不同的影响。有Meta分析表明,低裂解温度生物质炭的施用,对土壤微生物的多样性有更好的提高作用[10]。300 ~ 600 ℃炭化条件下,生物质炭的主体结构得到了完整的保留,而 > 700 ℃会对结构有一定程度的破坏[9]。但也有研究指出,与低裂解温度相比,土壤中某些类群的相对丰度及总体微生物多样性在650 ℃裂解温度制成的生物质炭添加后有明显增加[11]。生物质炭添加初期,其表面有容易被分解的碳源和氮源,益于微生物的利用,随着添加的时间延长,其对碳固定的能力有所增加,但微生物性质受生物质炭的影响逐渐变小[5]。
水稻(C3作物)和玉米(C4作物)秸秆其碳源不同。不同种类生物质炭诱导形成的微生物群落不同及其诱导效果和程度有所差异[12],因为不同的生物质炭能够被不同的微生物群落利用,从而使群落结构的变化产生差异[13]
基于以上,本研究采用水稻和玉米秸秆为原材料制备生物质炭,在北方典型稻田土壤中进行试验,研究了不同种类和裂解温度生物质炭添加对稻田土壤微生物多样性和群落结构的影响,以期为改善稻田土壤结构、提高土壤肥力、固碳减排提供一定的参考。
1 材料与方法 1.1 研究区概况本试验于沈阳农业大学科研试验基地(41.82°N, 123.57°E)进行。该基地地处北温带,位于松辽平原南部的中心地带,属温带湿润‒半湿润季风性气候,降雨多集中在7—8月,夏秋多雨,冬春干燥,年平均气温约7.9 ℃,年降水量574 ~ 684 mm,全年无霜期147 ~ 164 d,10 ℃以上积温3 300 ~ 3 400 ℃。作物全生育期130 ~ 150 d,作物生育期平均温度约20.7 ℃,生长季降水量平均547 mm,适宜作物生长。供试土壤为辽宁省沈阳市连续种植多年的稻田土壤(42.08°N,123.30°E),由原始棕壤经人工改水田发育而成,成土母质为黄土状堆积物,基本理化性质如表 1所示。
|
|
表 1 供试土壤基本理化性质 Table 1 Basic physiochemical properties of tested soil |
本研究采用露天盆栽培养试验,选用具有不同固碳方式的C3、C4两种作物的秸秆作为原材料制成的生物质炭:玉米秸秆生物质炭(M)、水稻秸秆生物质炭(R)。两种生物质炭均在裂解温度分别为T1(350 ℃)、T2(550 ℃)、T3(750 ℃)的厌氧条件下烧制而成(生物质炭购买于金丰环保科技有限公司),生物质炭C、N含量如表 2所示。按照试验设定的添加比例(质量分数为1%),将准备好的不同生物质炭均匀地混合到水稻土中,并以不添加生物质炭为对照(CK)。每盆装土10 kg,栽种3穴水稻苗,每穴种3棵。在培养过程中保持浅水层为3 cm,以保持土壤含水量恒定。于2021年4月28日将生物质炭均匀混入稻田土中,并于当日进行灌水泡田,之后移栽水稻,分别在培养60 d(F,拔节期)和360 d(S,第二年春季)后进行土壤样品采集。土壤样品采自0 ~ 20 cm土层,采样后挑拣出根系等杂质,将样品混合均匀装入自封袋,并放入有干冰的保温箱内带回实验室,于–80 ℃冰箱保存,待用。不同处理及样品对应的代号如表 3所示。
|
|
表 2 供试生物质炭C、N含量(g/kg) Table 2 C and N contents in tested biochar |
|
|
表 3 不同处理的代号 Table 3 Letter representation for different treatments |
DNA提取:使用OMEGA土壤DNA试剂盒(M5635-02) (OMEGA Bio-Tek,Norcross,GA,USA)提取总基因组DNA样本。分别使用NanoDrop NC2000分光光度计(Thermo Fisher Scientific, Waltham, MA, USA)和琼脂糖凝胶电泳检测提取DNA的数量和质量。
PCR扩增:本研究选择细菌标准16S rDNA (V3 ~ V4)可变区,引物:338F(5′-ACTCCTACGGGAGG CAGCA-3′),806R(5′-GGACTACHVGGGTWTCTA AT-3′);真菌标准ITS1,引物:ITS5F(5′-GGAAGT AAAAGTCGTAACAAGG-3′),ITS1R(5′-GCTGCGTT CTTCATCGATGC-3′)。PCR体系如下:NEB Q5 DNA高保真聚合酶0.25 μL,5×Reaction Buffer 5 μL,5×High GC Buffer 5 μL,dNTP(10 mmol/L)2 μL,模板DNA 2 μL,正向引物(10 μmol/L)1 μL,反向引物(10 μmol/L)1 μL,水8.75 μL。PCR反应程序:98 ℃预变性30 s;98 ℃变性15 s,50 ℃退火30 s,72 ℃延伸30 s),循环25 ~ 27次;72 ℃保持5 min。扩增产物于4 ℃保存。扩增结果进行2% 琼脂糖凝胶电泳,切取目的片段后用Axygen凝胶回收试剂盒回收目的片段。
利用Illumina公司的TruSeq Nano DNA LT Library Prep Kit进行建库,后进行文库质检与定量:取1 μL文库,在Agilent Bioanalyzer机器上用Agilent High Sensitivity DNA Kit对文库做2100质检,筛选出有单一峰、无接头的合格文库。利用Quant-iT PicoGreen dsDNA Assay Kit在Promega QuantiFluor上对文库进行定量,保证文库计算后浓度2 nmol/L以上。质检合格的文库使用PE250 Illumina NovaSeq平台对样品进行测序。
上述微生物DNA提取及测序操作均由派森诺基因科技有限公司(南京)完成。
1.3.2 序列处理与分析原始序列去引物、质量过滤、去噪、拼接和去嵌合体等步骤通过DADA2方法[14]进行。该方法只进行去重,聚类相似度为100%,之后得到的序列量称为ASV (Amplicon sequence variants)。对于不同类别的序列,分别采用各自特定的数据库作为ASV分类鉴定的模板序列,采取特定数据库注释:细菌项目基于silva_132数据库(Release 132, http://www.Arb-silva.de),真菌项目基于unite_8数据库(Release 8.0, https://unite.ut.ee/)。
1.4 数据处理采用SPSS 25.0进行数据的统计分析,采用单因素和多因素方差分析和Duncan法多重比较进行处理间差异显著性检验。采用派森诺基因云平台(https://www.genescloud.cn/)进行分类学组成分析、多样性分析等,具体如下:使用QIIME2 (2019.4),通过https://view.qiime2.org/,实现稀疏曲线的可视化;自编perl脚本等,调用“qiime taxa barplot”命令,进行物种组成堆叠柱状图的绘制。使用R语言ggplot2包进行α多样性指数分析;vegan包等对Bray-curtis距离矩阵(默认)进行非度量多维尺度分析(Non-metric multidimensional scaling analysis, NMDS)分析;物种组成热图使用R脚本计算各样本以及各分类单元的聚类结果,pheatmap包绘制热图。
2 结果与分析 2.1 生物质炭添加对稻田土壤微生物物种数量的影响研究发现,随培养时间的延长,细菌样本检测到的平均序列条数增加,真菌样本的平均序列条数减小。培养60 d和360 d的细菌样本平均序列数分别为78 802条和89 125条,其中高质量平均序列为68 836条和80 460条;培养60 d和360 d真菌样本的平均序列数分别为131 695条和822 903条,其中高质量平均序列为109 228条和72 979条(图 1)。
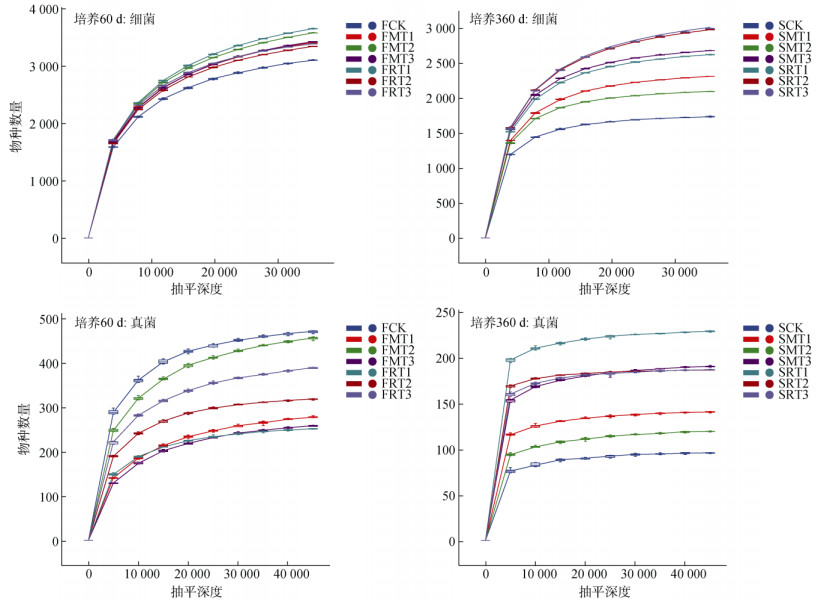
|
(横坐标为抽平深度,纵坐标为计算10次的α多样性指数的中位值与箱线图) 图 1 土壤微生物(细菌、真菌)的物种稀疏曲线 Fig. 1 Species sparse curves of soil microorganisms (Bacteria, Fungi) |
由图 1可知,各处理细菌测序深度达30 000条、真菌达40 000条时,稀疏曲线均基本趋于平缓,说明测序深度已经基本覆盖细菌和真菌样品中所有的物种,取样基本合理,真实环境样本中细菌和真菌群落结构的置信度较高,能够较真实地反映稻田土壤样本的微生物群落。稀疏曲线中,与CK处理相比,除培养60 d时的真菌外,各处理的物种数量均高于CK处理,各处理随抽平深度的增加,SR各处理的微生物物种数量增加量比SM各处理高。SRT2和SRT3处理的物种数量变化最为接近;但对于真菌,SRT1处理的数量大于SRT2和SRT3处理;对于细菌,SRT1处理的指数小于SRT2和SRT3处理。
2.2 生物质炭添加对稻田土壤微生物群落结构的影响 2.2.1 细菌群落结构图 2为不同生物质炭添加处理土壤细菌在门和科水平的物种分布堆叠图。图中展示的为丰度前10位的物种,其余物种统一归类到other类别。两个时期(60 d和360 d)各处理细菌门类数量平均分别为37种和35种。其中,与FCK(33种)、SCK(30种)处理相比,玉米和水稻秸秆生物质炭处理60 d时分别增加了1种和2种,360 d时分别增加了3种和6种。如图 2所示,各处理优势菌门均为浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria),这3种优势菌门在培养60 d时的各处理中相对丰度范围分别为:29.33 ~ 32.60%、23.21% ~ 28.99%、11.25% ~ 12.73%,而在培养360 d时的各处理下范围分别为:25.34% ~ 33.24%、21.64% ~ 32.30%、17.72% ~ 22.53%,其中,培养360 d后土壤放线菌门比培养60 d时增加了64.37%,而酸杆菌门则降低了44.51%。另外,550 ℃裂解温度的生物质炭处理有利于提高优势菌门的相对丰度,3个优势菌门相对丰度最大值分别出现SMT2、SRT2、SRT2处理。(图 2)。
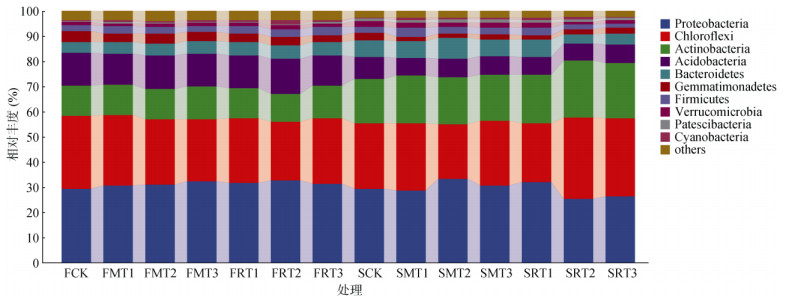
|
图 2 不同种类及不同裂解温度生物质炭处理下细菌门水平的相对丰度 Fig. 2 Relative abundance of bacteria at phylum level under different types and pyrolysis temperatures of biochar |
两个培养时期各处理细菌科水平数量平均分别为307科和275科,与FCK(292科)、SCK(232科)处理相比,玉米和水稻秸秆生物质炭处理60 d时分别增加了14科和17科,360 d时分别增加了37科和53科。如图 3所示,各处理细菌科水平的种类多且相对丰度均较小,但厌氧绳菌科(Anaerolineaceae)的相对丰度达7.67% ~ 11.41%,培养60 d时FCK处理的相对丰度高于其他处理,培养360 d时相对丰度最高的是SMT2处理,SCK处理次之(图 3)。除厌氧绳菌科外,相对丰度最大的为FRT2处理中的Subgroup_6,其相对丰度为7.30%。两个培养时期相对丰度前10位的菌科之和分别占所有细菌科相对丰度的37.61% 和41.41%。对比两个培养时期,相对丰度差异较大的为Subgroup_6、伯克氏菌科(Burkholderiaceae)和间孢囊菌科(Intrasporangiaceae),其中,Subgroup_6的相对丰度相较前一个时期减少了48.37%,伯克氏菌科增加了54.86%,间孢囊菌科的增加量达到了187.41%。(图 3)。
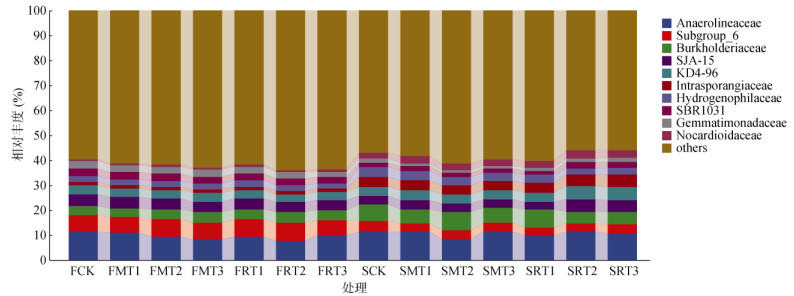
|
图 3 不同种类和不同裂解温度生物质炭处理下细菌科水平的相对丰度 Fig. 3 Relative abundance of bacteria at family level under different types and pyrolysis temperatures of biochar |
无论是水稻秸秆生物质炭还是玉米秸秆生物质炭处理,所有样品中检测到除未分类的真菌和未知的真菌外,共检测到12个真菌门类,各处理3 ~ 8个不等,且每个处理中均有子囊菌门(Ascomycota)和担子菌门(Basidiomycota)(图 4)。另外,培养360 d时,每个处理中均含有壶菌门(Chytridiomycota)和毛霉门(Mucoromycota)。两个培养时期中子囊菌门在各处理中的相对丰度均小于CK处理。子囊菌门在培养60 d时的水稻秸秆生物质炭处理和培养360 d的两种生物质炭处理中均呈现以下规律:FRT2 > FRT1 > FRT3;SMT2 > SMT1 > SMT3;SRT2 > SRT1 > SRT3,总体的相对丰度大小为:FR > SR > SM。
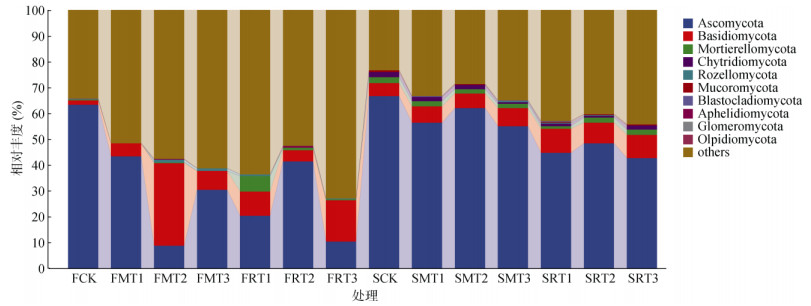
|
图 4 不同种类和裂解温度生物质炭处理下真菌门水平的相对丰度 Fig. 4 Relative abundance of fungi at phylum level under different types and pyrolysis temperatures of biochar |
除未在科水平上分类及未知的真菌之外,共检测出225个真菌科,每个处理9 ~ 52个不等。图 5为相对丰度前20位的科水平真菌物种分布堆叠图。由图 5可知,发菌科(Trichocomaceae)在培养60 d时在FCK(61.07%)、FMT1(22.68%)、FMT3(27.29%)3个处理中相对丰度占比较大;而酵母科(Saccharomycetaceae)在FRT2处理中处于极大的优势,相对丰度为25.64%;枝孢霉科(Cladosporiaceae)出现在SCK、SRT2、SRT3处理中,相对丰度分别为11.19%、1.41%、0.24%。总体上,培养360时(各处理真菌平均科数量为27个)相对丰度前20位的真菌科数量较多且较培养60 d时(平均科数量为17)更为均匀。
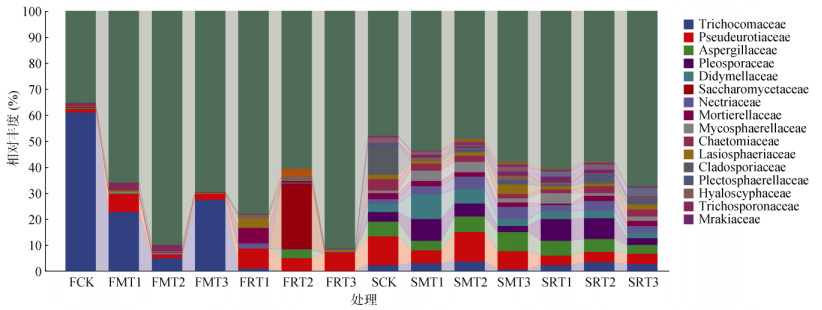
|
图 5 不同种类和裂解温度生物质炭处理下真菌科水平的相对丰度 Fig. 5 Relative abundance of fungi at family level under different species and pyrolysis temperatures of biochar |
如表 4所示,培养60 d时,在玉米秸秆生物质炭处理中,细菌的5个指标均在FMT2处理下最大。整体上,除Simpson指数外,各指标均随着生物质炭裂解温度的升高表现为增加趋势。培养360 d后,细菌在玉米秸秆生物质炭处理中,SMT3处理各指数均高于SMT1和SMT2处理,其中Simpson指数差异显著(P < 0.05);在水稻秸秆生物质炭处理中,SRT1处理只有序列数最大,其他各指标均为最低。对比两个培养时期不同原材料生物质炭,发现细菌的序列数FCK、FR处理显著小于SR处理;丰富度和多样性4个指数在各处理间变化趋势一致:生物质炭处理均高于CK处理,其中FCK > SCK,FM > SM,且均有显著差异(P < 0.05)(表 4)。多因素方差分析表明,各多样性和丰富度指数的主效应在培养时间上均极显著,生物质炭种类和培养时间的交互效应也显著。
|
|
表 4 细菌16S rDNA Illumina Novaseq高通量测序数据及α多样性指数 Table 4 Illumina Novaseq sequencing bacterial data and bacterial community α diversity indices based on 16S rDNA |
培养60 d时,在玉米秸秆生物质炭处理中,真菌各指标均在FMT2处理下值最高(表 5);在水稻秸秆生物质炭处理中,FRT3处理除Simpson指数外,其他指数均为最大值。培养360 d时,各处理真菌的多样性指数均高于SCK处理。在玉米秸秆生物质炭处理中,SMT3处理各指标均为最大值,其中Shannon和Simpson指数显著高于SCK处理。对比两时期不同的原材料生物质炭,FCK、FM处理序列数大于其他处理且有显著差异(P < 0.05);Chao1、Observed_ species指数FCK > SCK,FM > SM,FR < SR;而Shannon和Simpson指数则相反,FCK < SCK、FM < SM、FR < SR,且存在显著差异。多因素方差分析显示,培养时间的主效应在所有指标中依然极显著,真菌的序列数在生物质炭种类、时间的主效应上及生物质炭种类×裂解温度、生物质炭种类×培养时间的交互效应上为极显著。
|
|
表 5 真菌ITS基因Illumina Novaseq高通量测序数据及α多样性指数 Table 5 Illumina Novaseq sequencing fungal data and fungal community α diversity indices based on ITS gene |
β多样性表征不同样本微生物群落之间物种组成的相异性,也被称之为生境间多样性。图 6是不同处理土壤细菌、真菌群落组成的NMDS分析。该分析基于Bray-curtis距离矩阵,采用加权的计算方法,计算两样本间各物种丰度差值的绝对值与总丰度的比值,既考虑物种有无,也考虑丰度差异。本研究中,细菌、真菌应力值(Stress)分别为0.124和0.170,Stress < 0.2,排序效果良好,分析结果可靠。
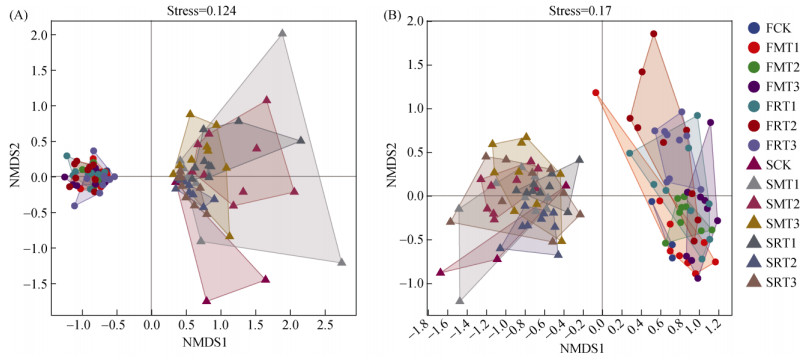
|
(A:细菌,B:真菌;图中每一个点为一个样本,不同颜色为不同的处理组,且按组进行连线,图中两点之间的距离反映样本间数据秩次信息的远近,可近似看成两个样本之间微生物群落的差异大小;横纵坐标轴无权重意义) 图 6 不同处理下细菌(A)、真菌(B)基于Bray-curtis距离的NMDS分析 Fig. 6 NMDS analysis of bacteria(A) and fungi(B) based on bray-curtis distance under different treatments |
各处理细菌和真菌在两个培养时间均沿第一坐标轴完全分离,说明细菌和真菌群落均在两培养时间之间有差异(图 6)。从图 6A可知,培养60 d时,对于细菌各个样本点之间的距离较小,表明细菌多样性差异小;培养360 d时,部分样本间的差异变大,如SCK、SMT1、SMT2处理。对于真菌(图 6B),每个样本点的离散程度较大,且培养60 d时各样本点主要在第二坐标轴方向上距离较远,表明培养60 d时部分样本之间的群落差异较大,且主要体现在第二个维度(NMDS2)。
2.4 生物质炭添加对微生物种间差异的影响 2.4.1 生物质炭对细菌组成差异的影响微生物物种组成无论是在门水平上还是在科水平上,两个培养时期之间物种存在明显差异。图 7A门水平物种组成热图中,图上面部分的树图显示各个生物质炭处理均与FCK和SCK处理有较远距离,表明生物质炭的添加改变了土壤细菌群落的物种组成。黏胶球形菌门(Latescibacteria)、芽单胞菌门(Gemmatimonadetes)、棒状杆菌门(Rokubacteria)、酸杆菌门(Acidobacteria)、硝化螺旋菌门(Nitrospirae)、装甲菌门(Armatimonadetes)、BRC1等细菌门类在培养60 d时丰度较高;FMT1和FMT2、SMT1和SMT2处理均与其他处理聚类距离较远,其中SRT2和SRT3两处理中绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria)丰度最高,而变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)丰度最小。酸杆菌门(Acidobacteria)和硝化螺旋菌门(Nitrospirae)是在全部培养时期内变动最小的细菌门,且二者丰度水平较相近。图 7B科水平物种组成热图中,SRT2和SRT3处理之间差异较小且区别于另外的处理,这与门水平一致。丰度前20位的物种中,无论是门水平还是科水平,大约一半物种的丰度在培养60 d时较大,另一半物种在培养360 d时丰度较大。
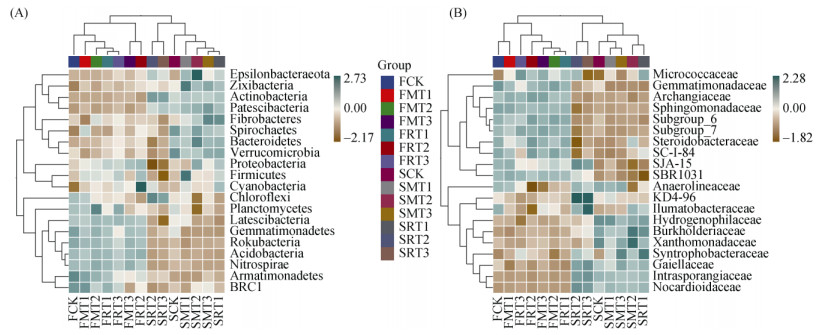
|
(A:门水平;B:科水平;图中样本按照物种组成数据的欧式距离(euclidean distance)进行UPGMA聚类,并根据聚类结果排列;基于物种组成数据的Pearson相关性系数矩阵,再次使用UPGMA聚类法对物种进行聚类,并根据聚类结果对物种进行可视化排列;下同) 图 7 不同种类和裂解温度生物质炭添加下细菌门水平(A)和科水平(B)丰度前20位物种组成热图 Fig. 7 Heat map of top 20 species composition at bacterial phylum (A) and family (B) levels with biochar addition at different pyrolysis temperatures |
图 8A显示,在门水平共计检测到的12个门类真菌中,FCK和FMT1处理间、SMT1和SMT2处理间的差异较小,具体表现为其Pearson相关系数大多为负值,且正值部分数值较小;从其余各处理均只有1 ~ 2个相对丰度较大的门水平物种,且各不相同。图 8B显示,培养60 d时,科水平的物种相对丰度普遍较低,尤其是FCK、FMT1、FMT2和FMT3处理中仅毛孢子虫科(Trichosporonaceae)和毛发菌科(Trichocomaceae)丰度较高;而经过360 d的培养,丰度前20位的真菌科水平的丰度比培养60 d时明显增加,其中各处理Pearson相关系数大于0的物种为11种,比前一时期多8种。
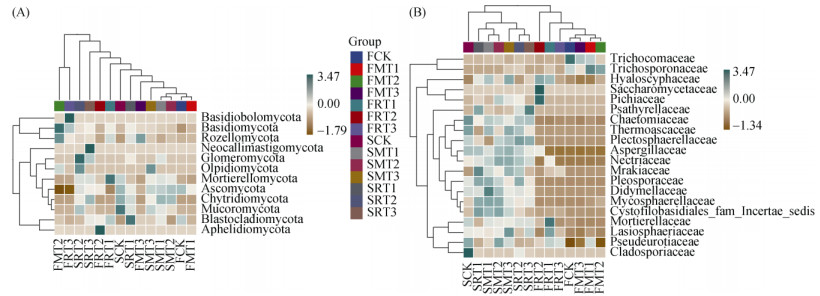
|
图 8 不同种类和裂解温度生物质炭添加下真菌门水平(A)和科水平(B)物种组成热图 Fig. 8 Heat map of species composition at fungal phylum (A) and family (B) levels with biochar addition at different pyrolysis temperatures |
生物质炭的性质相对稳定,微生物不可能迅速利用其中的基质,但生物质炭的添加仍显著影响土壤微生物群落[15],如生物质炭的多孔特征和较大比表面积为微生物提供栖息环境[16],给土壤提供碳源物质等,为相关微生物的生长创造了条件[17]。本研究中,生物质炭经过360 d培养后,提高了细菌群落的物种丰富度和多样性,细菌和真菌的多样性指数中,SR处理的指数值普遍高于SM处理,与周玉祥等[18]以及李明等[15]研究结果一致。究其原因可能是水稻秸秆生物质炭的阳离子交换量(CEC)高于玉米秸秆生物质炭[19],更高的CEC使水稻秸秆生物质炭处理下的土壤有更好的土壤水肥保有量,促进土壤微生物的繁殖。
不同种类生物质炭的添加会被不同的土壤微生物利用,从而使微生物群落结构产生差异[15]。本研究中,生物质炭的输入增加了细菌门水平和科水平数量,其中水稻秸秆生物质炭比玉米秸秆生物质炭在培养60 d时多增加了1门3科,在培养360 d时多增加了3门、16科。两个培养时间下土壤中细菌的主要门类均是浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria),其相对丰度之和达到了总群落丰度的65% 以上,其中浮霉菌门、绿弯菌门在各处理中的变化幅度不大,两者却占据总丰度的50% 以上。随着培养时间的延长,放线菌门丰度增加,酸杆菌门丰度降低。有研究表明,酸杆菌门是嗜酸细菌,且一般出现在酸性较强的土壤中[20-21],生物质炭的添加提高了土壤pH[22],这可能是本试验中酸杆菌门丰度降低的主要原因之一,而放线菌门丰度的增加更利于降解和利用外源有机物[18]。本研究中,在科水平上,所有已知菌科仅占40% 左右,未知菌科较多,说明该稻田土壤中有大部分未被挖掘的菌科,对比培养60 d时,培养360 d时的放线菌门中Subgroup_6科有所减小,变形菌门中伯克氏菌科(Burkholderiaceae)和放线菌门中间孢囊菌科(Intrasporangiaceae)都有增加。
生物质炭的添加能够改变土壤真菌的多样性和群落结构[19]。本研究中,生物质炭添加培养60 d时,两种生物质炭均使真菌的丰富度下降,这与Li等[23]在实验室将玉米秸秆生物质炭加入紫色土进行30 d培养的研究结果一致。但随着时间的推移,培养360 d时,生物质炭添加处理真菌物种丰富度和多样性均提高。其原因可能是生物质炭作为富碳固体,结构稳定,短期的添加对真菌的作用效果较为缓慢[16]。而前期导致真菌丰富度下降的另一原因可能是大量碳的输入,导致碳氮比发生变化,“争氮”现象在农作物与真菌之间发生,从而对真菌的生长有所限制[24]。
真菌对糖类、纤维素等有较好的分解能力,也能对作物根际环境有所改善,从而增加作物抗病性[22]。子囊菌门(Ascomycota)主要为腐生菌,营养方式有腐生、寄生和共生,能够将土壤中的有机物质分解后供作物吸收[25],其丰度随土壤pH的上升而降低[26]。本试验中,添加两种生物质炭均降低了土壤中子囊菌门的相对丰度。壶菌门(Chytridiomycota)多水生,普遍腐生于动植物残体上或寄生于水生植物、藻类、小动物和其他真菌上,其数量与高碳含量有很大的关系,可以分解植物残体,利于土壤养分循环[27]。毛霉门(Mucoromycota)多腐生于土壤、粪堆中。本研究中,培养360 d时,壶菌门和毛霉门出现,随着灌水泡田时间的推移,植物的腐烂组织增加,有利于这两种真菌的生存。从科水平上看,在培养60天时,发菌科随着生物质炭的添加相对丰度快速降低,真菌科水平数量明显在培养360 d时增加,且科水平的均匀度更高,这是由于最初生物质炭的添加引入了多环芳烃等化合物,残余热解油和极性热解冷凝物等可能对微生物产生毒害或阻碍微生物活性[22],随着时间的推移,这种效果逐渐减弱。本试验结果表明,相较于培养60 d,当培养时间到达360 d时,生物质炭的添加更能使细菌和真菌的多样性提高,群落结构更丰富。说明在水稻土淹水条件下,生物质炭添加初期,土壤微生物受生物质炭表面易分解的碳源、氮源的影响作用不明显,而随时间增加,生物质炭对微生物的影响效果增加。
3.2 生物质炭裂解温度对土壤微生物多样性和群落结构的影响研究发现,在较低的裂解温度下产出的生物质炭所含植物有效养分较高,而在≥550 ℃的裂解温度下生产的慢热解生物质炭,其CEC和比表面积更大,pH也更高[5]。本研究中,玉米秸秆生物质炭添加处理在培养60 d时,细菌和真菌的丰富度和多样性指数均在550 ℃裂解温度生物质炭处理下为最大,在培养360 d时则在750 ℃裂解温度生物质炭处理下为最大,这表明随着生物质炭在土壤中存在时间的延长,生物质炭裂解温度越高影响土壤微生物的活性越显著。李青芳[28]研究发现,350 ℃裂解温度玉米秸秆生物质炭添加提高了石灰土中微生物数量,而600 ℃裂解温度制成的生物质炭添加抑制了土壤微生物的生长。在水稻秸秆生物质炭各处理中,培养60 d时裂解温度为750 ℃的生物质炭处理真菌的物种丰富度和多样性最大,而在360 d时,350 ℃裂解温度生物质炭对真菌丰富度和多样性指数提高最多。两种秸秆生物质炭添加对真菌的影响可能与生物质炭本身的碳氮含量相关(表 1),均表现为随着培养时间的推移,微生物的丰富度和多样性均随生物质炭自身碳氮含量的减少而提高。
本研究中,培养结束时(360 d),3种优势细菌菌门相对丰度的最大值均存在于550 ℃裂解温度制成的生物质炭处理中,而对于真菌,培养60 d时,550 ℃裂解温度玉米秸秆生物质炭添加明显增加了担子菌门的相对丰度。在本研究的3个裂解温度中,优势菌所处的最适宜栖息环境可能恰好是低温裂解带来较多不稳定碳和提供较多碳水化合物[29]与高裂解温度带来的大比表面积和强吸附性能[30]之间的一个平衡。两个培养时间,350 ℃和550 ℃制成的玉米秸秆生物质炭添加处理均与相同时期其他处理的细菌群落物种组成有所差异。在添加水稻秸秆生物质炭后,真菌群落中的优势门类因为裂解温度的不同而有所差异(图 8A),说明不同裂解温度的水稻秸秆生物质炭添加改变了真菌的生存环境,从而对真菌群落分布产生了影响[20]。表明水稻秸秆生物质炭裂解温度对土壤真菌群落结构产生影响较大,而这可能与生物质炭的自身性质有关。
4 结论1) 两种生物质炭处理培养360 d后均使稻田土壤细菌丰富度、多样性提高,其中水稻秸秆生物质炭提高的效果更为明显。土壤中细菌优势类群为浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria)。
2) 土壤中真菌群落随着生物质炭处理培养时间的延长,其丰富度和多样性表现为先降低后升高的趋势。土壤优势真菌类群为子囊菌门(Ascomycota)和担子菌门(Basidiomycota)。生物质炭处理培养360 d时,检测出现壶菌门和毛霉门两个门类,且真菌的各科水平物种丰度更加均匀。
3) 不同裂解温度制成的生物质炭对微生物多样性和群落结构影响不同,且能够改变微生物的群落物种组成。玉米秸秆生物质炭添加培养60 d时,细菌和真菌的丰富度和多样性指数均在550 ℃裂解温度生物质炭下为最大。水稻秸秆生物质炭的添加,真菌群落中的优势门类会因生物质炭裂解温度的不同有所差异。
| [1] |
Gul S, Whalen J K, Thomas B W, et al. Physico-chemical properties and microbial responses in biochar-amended soils: Mechanisms and future directions[J]. Agriculture, Ecosystems & Environment, 2015, 206: 46-59 (  0) 0) |
| [2] |
陈志良, 袁志辉, 黄玲, 等. 生物炭来源、性质及其在重金属污染土壤修复中的研究进展[J]. 生态环境学报, 2016, 25(11): 1879-1884 (  0) 0) |
| [3] |
Gul S, Whalen J K. Biochemical cycling of nitrogen and phosphorus in biochar-amended soils[J]. Soil Biology and Biochemistry, 2016, 103: 1-15 DOI:10.1016/j.soilbio.2016.08.001 (  0) 0) |
| [4] |
徐东昱, 周怀东, 高博. 生物炭吸附重金属污染物的研究进展[J]. 中国水利水电科学研究院学报, 2016, 14(1): 7-15 (  0) 0) |
| [5] |
Pérez-Cruzado C, Merino A, Rodríguez-Soalleiro R. A management tool for estimating bioenergy production and carbon sequestration in Eucalyptus globulus and Eucalyptus nitens grown as short rotation woody crops in north-west Spain[J]. Biomass and Bioenergy, 2011, 35(7): 2839-2851 DOI:10.1016/j.biombioe.2011.03.020 (  0) 0) |
| [6] |
Chimento C, Almagro M, Amaducci S. Carbon sequestration potential in perennial bioenergy crops: The importance of organic matter inputs and its physical protection[J]. GCB Bioenergy, 2016, 8(1): 111-121 DOI:10.1111/gcbb.12232 (  0) 0) |
| [7] |
Bhaduri D, Saha A, Desai D, et al. Restoration of carbon and microbial activity in salt-induced soil by application of peanut shell biochar during short-term incubation study[J]. Chemosphere, 2016, 148: 86-98 DOI:10.1016/j.chemosphere.2015.12.130 (  0) 0) |
| [8] |
钟佳旺, 张丽, 詹祥生, 等. 热解温度和氮肥用量影响生物炭的减排和增产效应[J]. 植物营养与肥料学报, 2023, 29(4): 664-676 (  0) 0) |
| [9] |
侯建伟, 索全义, 梁桓, 等. 炭化温度对沙蒿生物炭形貌特征和化学性质的影响[J]. 土壤, 2014, 46(5): 814-818 (  0) 0) |
| [10] |
Li X N, Wang T, Chang S X, et al. Biochar increases soil microbial biomass but has variable effects on microbial diversity: A meta-analysis[J]. The Science of the Total Environment, 2020, 749: 141593 DOI:10.1016/j.scitotenv.2020.141593 (  0) 0) |
| [11] |
Khodadad C L M, Zimmerman A R, Green S J, et al. Taxa-specific changes in soil microbial community composition induced by pyrogenic carbon amendments[J]. Soil Biology and Biochemistry, 2011, 43(2): 385-392 DOI:10.1016/j.soilbio.2010.11.005 (  0) 0) |
| [12] |
Andert J, Mumme J. Impact of pyrolysis and hydrothermal biochar on gas-emitting activity of soil microorganisms and bacterial and archaeal community composition[J]. Applied Soil Ecology, 2015, 96: 225-239 DOI:10.1016/j.apsoil.2015.08.019 (  0) 0) |
| [13] |
王丽, 赵惠丽, 赵英. 生物质炭配施木灰对石灰性土壤固碳和微生物群落的影响[J]. 土壤, 2022, 54(2): 320-328 (  0) 0) |
| [14] |
Callahan B J, McMurdie P J, Rosen M J, et al. DADA2: High-resolution sample inference from Illumina amplicon data[J]. Nature Methods, 2016, 13(7): 581-583 DOI:10.1038/nmeth.3869 (  0) 0) |
| [15] |
李明, 李忠佩, 刘明, 等. 不同秸秆生物炭对红壤性水稻土养分及微生物群落结构的影响[J]. 中国农业科学, 2015, 48(7): 1361-1369 (  0) 0) |
| [16] |
李昌骏, 李婷, 李露露, 等. 生物质炭负载解钾菌对土壤酶活性与微生物群落结构的影响[J]. 土壤学报, 2023, 60(5): 1531-1542 (  0) 0) |
| [17] |
姚玲丹, 程广焕, 王丽晓, 等. 施用生物炭对土壤微生物的影响[J]. 环境化学, 2015, 34(4): 697-704 (  0) 0) |
| [18] |
周玉祥, 宋子岭, 孔涛, 等. 不同秸秆生物炭对露天煤矿排土场土壤微生物数量和酶活性的影响[J]. 环境化学, 2017, 36(1): 106-113 (  0) 0) |
| [19] |
阎海涛, 殷全玉, 丁松爽, 等. 生物炭对褐土理化特性及真菌群落结构的影响[J]. 环境科学, 2018, 39(5): 2412-2419 (  0) 0) |
| [20] |
纪程, 孙玉香, 孟圆, 等. 稻麦轮作体系长期秸秆还田对土壤真菌群落结构及秸秆降解潜力的影响[J]. 农业环境科学学报, 2022, 41(4): 819-825 (  0) 0) |
| [21] |
Hammes K, Smernik R J, Skjemstad J O, et al. Characterisation and evaluation of reference materials for black carbon analysis using elemental composition, colour, BET surface area and 13C NMR spectroscopy[J]. Applied Geochemistry, 2008, 23(8): 2113-2122 DOI:10.1016/j.apgeochem.2008.04.023 (  0) 0) |
| [22] |
张英, 武淑霞, 雷秋良, 等. 不同类型粪肥还田对土壤酶活性及微生物群落的影响[J]. 土壤, 2022, 54(6): 1175-1184 (  0) 0) |
| [23] |
Li Y, Yang Y Q, Shen F, et al. Partitioning biochar properties to elucidate their contributions to bacterial and fungal community composition of purple soil[J]. The Science of the Total Environment, 2019, 648: 1333-1341 (  0) 0) |
| [24] |
张婷婷, 王丽芳, 张德健, 等. 不同小麦秸秆还田覆盖度对旱作农田土壤微生物群落多样性的影响[J]. 北方农业学报, 2021, 49(1): 77-87 (  0) 0) |
| [25] |
Xu L H, Ravnskov S, Larsen J, et al. Soil fungal community structure along a soil health gradient in pea fields examined using deep amplicon sequencing[J]. Soil Biology and Biochemistry, 2012, 46: 26-32 (  0) 0) |
| [26] |
杨虎, 马巧蓉, 杨君珑, 等. 宁夏南部生态移民迁出区不同恢复模式土壤微生物群落特征[J]. 应用生态学报, 2022, 33(1): 219-228 (  0) 0) |
| [27] |
周阳, 黄旭, 赵海燕, 等. 麦秸秆和沼液配施对水稻苗期生长和土壤微生物的调控[J]. 土壤学报, 2020, 57(2): 479-489 (  0) 0) |
| [28] |
李青芳. 玉米秸秆及其生物炭对岩溶区石灰土碳效应的影响[D]. 桂林: 广西师范大学, 2015.
(  0) 0) |
| [29] |
Luo L, Xu C, Chen Z E, et al. Properties of biomass-derived biochars: Combined effects of operating conditions and biomass types[J]. Bioresource Technology, 2015, 192: 83-89 (  0) 0) |
| [30] |
胡旺, 赵杭, 周旋, 等. 施用南荻生物炭对不同类型土壤氨挥发的影响[J]. 应用生态学报, 2022, 33(7): 1919-1926 (  0) 0) |
2. Agriculture and Rural Bureau of Fumeng County, Fuxin, Liaoning 123100, China
 2024, Vol. 56
2024, Vol. 56


