盐碱土特殊的理化特性使土壤的盐碱化成为农业生产的主要威胁之一。治理土壤盐碱化和改良盐碱土的核心是改变土壤上、下边界条件和土壤内固-液-气-生状态,定向调节土壤水盐的运动与分布[1]。土壤微生物是土壤生态系统中重要的组成部分,其数量大、种类丰富、分布广泛,在土壤碳、氮、磷等元素的循环中起着至关重要的作用,因此微生物的生理生化活动深刻影响着土壤结构的形成及其稳定性[2]。胞外多糖是一种特殊微生物在生理活动过程中分泌到细胞外、能起到对自我进行保护、类聚、提供营养的一类生物高聚物[3]。上官王丽[4]研究了不同土地利用土壤中细菌与细菌胞外多糖对土壤团聚体形成与水稳定性的影响,结果表明,林地中细菌能促进土壤水稳定性团聚体的形成,而草地中细菌胞外多糖作用更显著;杜宇佳等[5]的研究结果显示,由芽孢杆菌形成的生物膜能够降低土壤容重、提升土壤孔隙度、增强土壤保水能力。
土壤中盐分的移动遵循“盐随水来,盐随水动”的基本规律。前人的研究结果已经证明微生物能够在土壤修复中起到重要的作用,但是微生物对于盐碱土中水盐运动特性的影响却鲜有研究。因此,本试验以从盐碱土中分离的高产胞外多糖菌株枯草芽孢杆菌(Bacillus subtilis)hs032为试验材料,研究了室内培养条件下不同菌种接种量对土壤理化特性及土壤溶质穿透曲线和弥散系数的影响,以为盐碱地生物治理技
术的开发提供参考数据和理论依据。
1 材料与方法 1.1 试验材料供试菌种为本实验室从盐碱土壤中分离得到的高产胞外多糖菌株枯草芽孢杆菌hs032(NCBI登录号:OM339850)[6]。供试土壤采自陕西省榆林市横山区塔湾镇(37°46′ N,109°11′ E,海拔1 088 m),取样深度0 ~ 50 cm,为5个位点取样制成的混合样,挑出土样中的砾石和植物残体后置于自然阴凉通风处风干,过2 mm筛备用。土理基本化性质如表 1所示。
|
|
表 1 供试土壤基本理化性质 Table 1 Basic physiochemical properties of tested soil |
将枯草芽孢杆菌hs032活化后接种至BPM[7]摇瓶中,于恒温摇床中30℃、180 r/min振荡培养24 h[8]。将菌液在8 000 r/min的条件下离心10 min,利用无菌水将菌体冲散,再在8 000 r/min的条件下离心5 min,重复2次。利用无菌水将菌体调配成OD600 = 1的标准菌悬液。设置5个微生物施用水平,分别为每公斤土壤5、7、9、15和20 mL标准菌悬液,并设置1个对照组添加无菌水,将土壤样品与菌种发酵液按照相应的施用水平混合均匀。利用无菌水调节土壤含水率至相同。按相同体积填入培养盆中,每组设置3个重复。将各组放置于室温27℃ ± 1℃、湿度48% ± 5% 的室内,培养30 d,分别在培养的0、3、7、11、15、20、25、30 d采样检测土壤特性。
土壤理化性质检测水稳性团聚体含量采用湿筛法测定[9];土壤容重[10]采用环刀法测定;土壤孔隙度采用比重瓶法测定[10];土壤pH采用去离子水按照土液质量比为1∶2.5配制土壤悬浊液,雷磁PHS-3C酸度计检测;土壤可溶性盐含量参考重量法测定[11]。土壤微生物含量检测:利用ATP与荧光素在荧光素酶催化下产生荧光的原理进行分析[12],使用Luminultra Technologies公司的QuenchGone21 Wastewater(QG21WTM)试剂包和PhotonMasterTM荧光光度计测定;土壤多糖含量检测[4]:称取土壤样品5.0 g置于100 mL三角瓶中,于50 mL 2.0 mol/L硫酸沸水浴6 h,水解完毕后趁热过滤,向滤液中加入5.0 g CaCO3使溶液完全中和,过滤并定容至100 mL,取水解液1.0 mL于试管中按照蒽酮–硫酸法处理于620 nm下测定吸光值。
1.2.2 hs032添加对土壤溶质弥散能力的影响1) 土壤溶质穿透曲线。土壤中存在过量的Na+将会造成土壤水稳性团聚体解体、产生离子毒性,造成土壤结构、理化性质、生物活性的退化[13],因此此次试验主要监测土壤对Na+的弥散能力。试验采用室内恒定水头一维有机玻璃土柱进行,有机玻璃柱高50 cm,内径10 cm,装土40 cm。将1.2.1中培养30 d后的土壤按照每组最后测得的容重进行土柱装填,层间刮毛。采用马氏瓶供水,饱和土壤用蒸馏水,示踪剂选用3 g/L的NaCl溶液。采用雷磁DWS-51型钠离子计测量溶液中Na+浓度。试验装置如图 1所示。
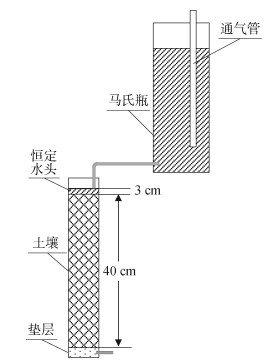
|
图 1 一维土柱试验装置示意图 Fig. 1 Schematic diagram of one-dimensional soil column experiment |
由马氏瓶中注入蒸馏水,自下而上饱和土柱土壤,排空土壤孔隙中的空气;再自上而下,利用马氏瓶保持水面高于土壤表面3 cm,使土壤形成饱和稳定水流,测定水流流速。利用钠离子计测量土柱出口溶液中Na+浓度,连续3次测量值变化率小于5% 时,将马氏瓶中的溶液更换为3 g/L的NaCl溶液。自从出口检测到Na+开始计时,间隔一定的时间测定出口溶液中Na+浓度,直至出口溶液Na+浓度与入口浓度相同,穿透试验结束。溶液流出体积(V)用量筒测量,根据上文已测得的土壤孔隙体积(V0),计算孔隙体积倍数PV=V/V0。利用Origin 2021软件绘制相对浓度(C/C0)与孔隙体积倍数(PV )的关系曲线,即得土壤溶质穿透曲线。
由于土壤穿透曲线为S型曲线,数学模型logistic 5[14]可以描述S型曲线,其中参数h与S型曲线坡度的斜率有关,值越大表示坡度越小,即y随x的增大而增大的幅度越小。为了体现各微生物添加量对土壤溶质穿透曲线的影响,利用Origin 2021软件拟合曲线,得到相应的参数值。logistic 5数学模型为:
| $ y=A_{\min }+\frac{A_{\max }-A_{\min }}{\left(1+\left(\frac{x}{x_0}\right)^{-h}\right)^s} $ | (1) |
式中:Amin为下边界值;Amax为上边界值;x0为y半值时的x值;h为斜率;s为控制参数。
2) 土壤溶质弥散系数。本试验中,因为土壤孔隙水流速较大,所以只考虑机械弥散作用。在上述土柱试验装置中,土壤均匀,孔隙水流速均匀,土壤中示踪剂可以视为一维水分和溶质流动问题,其可以表示为:
| $ \frac{{\partial C}}{{\partial t}} = {D_L}\frac{{{\partial ^2}C}}{{\partial {x^2}}} - v\frac{{\partial C}}{{\partial x}} $ | (2) |
其中,
| $ C\left(0, t\right)={C}_{0}, \text{ }t > 0 $ |
| $ C\left(\infty , t\right)=0\text{ }, \text{ }t > 0 $ |
一维饱和溶质运移过程,对流弥散方程的解析解为:
| $ C\left( {x, t} \right) = \frac{{{C_0}}}{2}\left[ {{\text{erfc}}\left( {\frac{{x - vt}}{{2\sqrt {{D_L}t} }}} \right) + {\text{exp}}\left( {\frac{{vx}}{{{D_L}}}} \right){\text{erfc}}\left( {\frac{{x + vt}}{{2\sqrt {{D_L}t} }}} \right)} \right] $ | (3) |
公式(3)中,等号右边中括号中第1项远大于第2项,可忽略第2项,简化为:
| $ \frac{{C\left( {x, t} \right)}}{{{C_0}}} = \frac{1}{2}{\text{erfc}}\left( {\frac{{x - vt}}{{2\sqrt {{D_L}t} }}} \right) $ | (4) |
再变形为:
| $ \frac{{C\left( {x, t} \right)}}{{{C_0}}} = 1 - N\left( {\frac{{x - vt}}{{2\sqrt {{D_L}t} }}} \right) $ | (5) |
式中:N为正态分布函数,期望m=vt,标准差
| $ {D_L} = \frac{1}{8}{\left( {\frac{{x - v{t_{0.159}}}}{{\sqrt {{t_{0.159}}} }} - \frac{{x - v{t_{0.841}}}}{{\sqrt {{t_{0.841}}} }}} \right)^2} $ | (6) |
式中:DL为水动力弥散系数(cm²/min);t0.841及t0.159分别为出流液的相对浓度C/C0分别达到0.841和0.159对应的时间(min);v为出流液实际流速(cm/min)。
1.3 数据统计分析利用SPSS 21软件对不同施菌量土壤理化性质进行单因素方差分析(One-way ANOVA),并采用Duncan法进行处理间显著性检验。利用Origin 2021中Redundancy Analysis(RDA)插件分析微生物总量与多糖含量对土壤特性的影响,并用Origin 2021绘制土壤生物特征与理化特征变化图以及土壤溶质穿透曲线。
2 结果与分析 2.1 添加hs032对土壤生物特性的影响 2.1.1 对土壤微生物含量的影响试验各处理组微生物含量均显著高于对照组(P < 0.05)(图 2A)。在培养期间,不同菌液施加量的土壤中,微生物含量呈现出不同的变化趋势。菌液添加量为15和20 mL/kg的土样中微生物含量呈现先快速增加后缓慢下降的趋势,并且分别在培养7 d和9 d时达到微生物含量最高峰,数量级均达到109。菌液添加量为5、7和9 mL/kg的3个处理组微生物含量呈现先迅速增加后保持相对稳定的趋势。
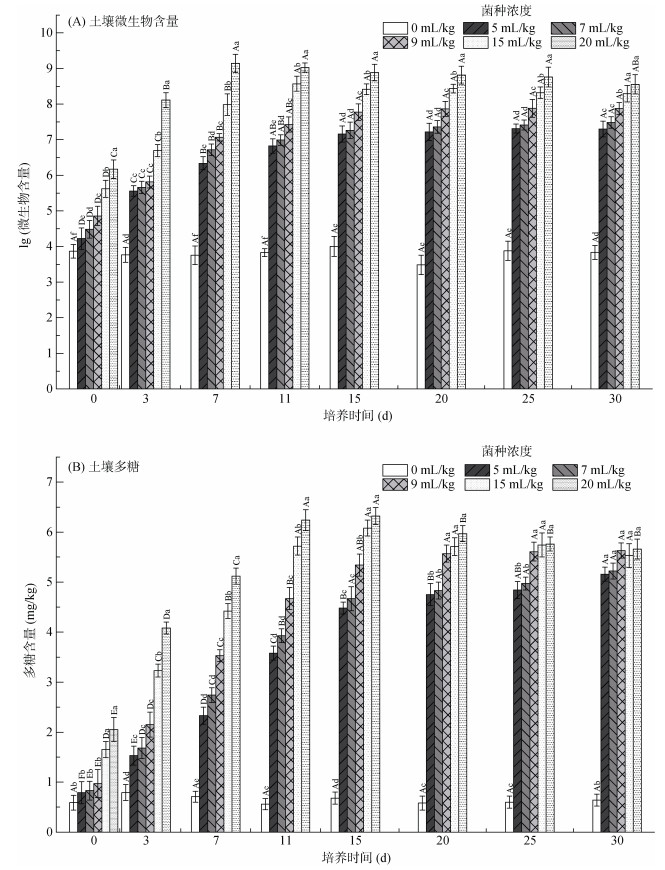
|
(图中不同大写字母表示同一菌液添加量下不同培养时间间的差异显著(P < 0.05);不同小写字母表示同一培养时间下不同菌液添加量间差异显著(P < 0.05),下同) 图 2 不同hs032添加量对土壤生物特征的影响 Fig. 2 Soil biological characteristics under different hs032 additions |
15和20 mL/kg两个处理组由于菌液添加量较大,能够在短时间内达到微生物含量最高值,并且可以达到较高的微生物含量上限;试验后期微生物含量出现下降的情况,这可能是由于营养物质的耗尽,微生物开始出现死亡溶解所导致的。5、7和9 mL/kg三个处理组菌液添加量小,初始含菌量较小,导致这3个处理组中的微生物有足够的营养物质,在实验结束时仍处在生长稳定期。
2.1.2 对土壤多糖含量的影响土壤多糖含量的变化趋势与土壤微生物含量的变化趋势相似(图 2B)。对照组多糖含量相对稳定,而各处理组显著升高(P < 0.05),并在培养11 d后先后达到最高水平。不同的是,菌液添加量为15和20 mL/kg两个处理组的多糖含量在达到最高水平之后开始缓慢下降,而其余各处理组15 d之前多糖含量快速增加,之后缓慢增加。至试验结束时(30 d)各处理组多糖含量已无显著差异(P > 0.05)。
2.2 添加hs032对土壤理化特性的影响 2.2.1 对土壤容重和孔隙度的影响在为期30 d的试验期内,对照组的容重(图 3 A)和孔隙度(图 3 B)随时间的变化不显著(P > 0.05),而各处理组的土壤容重和孔隙度随时间变化显著(P < 0.05)。各处理组的土壤容重均呈波动下降趋势,较对照组的容重下降26.4% ~ 35.6%。菌液添加量为20 mL/kg处理组土壤容重降低最多,试验结束时为1.01 g/cm3。试验结束时菌液添加量为9、15和20 mL/kg 3个处理组土壤容重无明显差异(P > 0.05),但显著低于菌液添加量为5和7 mL/kg两个处理组(P < 0.05)。土壤孔隙度在混入菌液之后(0 d)就有了显著差别(P < 0.05),并且上升程度随着菌液添加量的增加而增加。菌液添加量较多时(15和20 mL/kg),土壤孔隙度变化趋势可分为2段:迅速增加和缓慢增加;而添加量较小时(5、7和9 mL/kg)孔隙度变化趋势可分为3段:缓慢增加、快速增加和缓慢增加,这可能与发酵液内含有不同量的胞外多糖有关。
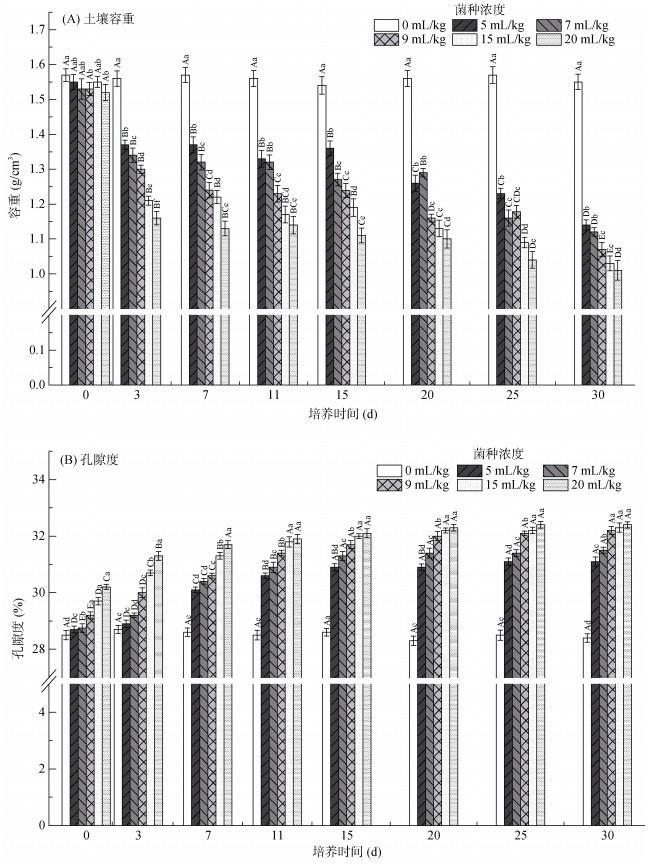
|
图 3 不同hs032添加量对土壤容重和孔隙率的影响 Fig. 3 Soil bulk densities and porosities under different hs032 additions |
添加菌液使处理组土壤可溶性盐含量相对于对照组显著下降(P < 0.05,图 4)。各处理组在试验7 d之前均呈下降趋势,在7 d之后菌液添加量为15和20 mL/kg的处理组土壤可溶性盐含量开始缓慢上升,而其他处理组仍处在下降阶段,并且趋向于保持动态平衡。菌液添加量最多(20 mL/kg)的处理组在试验7 d时到达胞外可溶性盐含量的最低值(4.5 g/kg),在试验结束时为5.2 g/kg,相较试验初,下降41.5%。试验结束时各处理组土壤胞外可溶性盐含量无显著差别(P > 0.05)。
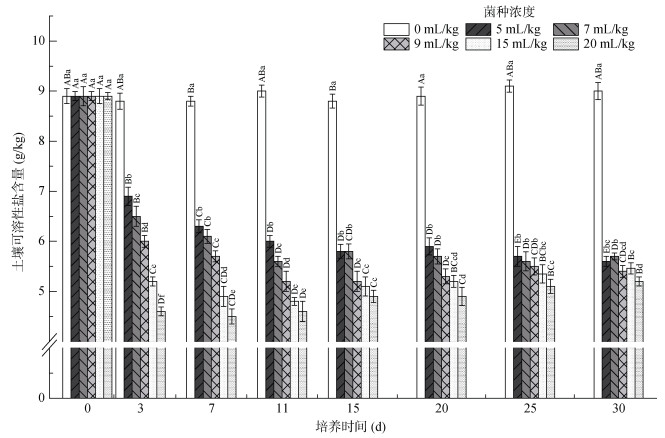
|
图 4 不同hs032添加量对土壤可溶性盐含量的影响 Fig. 4 Soil soluble salt contents under different hs032 additions |
添加菌液的各处理组土壤pH整体呈先下降后平稳的变化趋势(图 5),在试验3 d之后相对于对照组显著下降(P < 0.05),下降幅度10.83% ~ 13.84%,且各组的下降趋势相似,均以试验20 d时为时间分界点,前20 d快速下降,下降幅度占总下降幅度的90% 以上,20 ~ 30 d下降速度减缓。其中下降幅度最大的是9 mL/kg菌液添加量处理组,pH范围8.61 ~ 7.16。试验结束时,9和20 mL/kg菌液添加量处理组之间,5和7 mL/kg菌液添加量处理组之间土壤pH无显著差异(P > 0.05),15 mL/kg菌液添加量处理组pH介于它们之间。
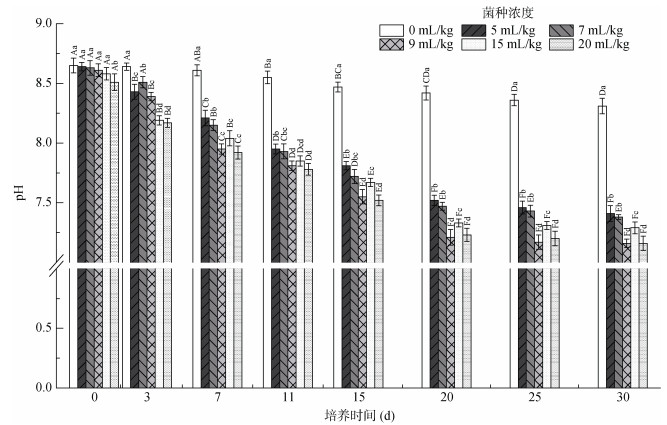
|
图 5 不同hs032添加量对土壤pH的影响 Fig. 5 Soil pH under different hs032 additions |
图 6中显示的是土壤水稳性团聚体(0.25 ~ 0.5mm粒级)含量变化趋势,可见,对照组在试验期间随时间变化不显著(P > 0.05)。菌液添加量为7、15和20 mL/kg的处理组在试验的11 d之前随时间的变化显著(P < 0.05),11 d之后变化不显著(P > 0.05);菌液添加量5和9 mL/kg两处理组在试验15 d之后变化不显著(P > 0.05)。在试验结束时,菌液添加量20 mL/kg处理组水稳性团聚体含量较对照组增加了110%,但是较本处理组初始含量仅增加了16.1%。与初始水稳性团聚体含量相比,增加最多的是菌液添加量5 mL/kg处理组,其增加了78.8%。在试验结束时(30 d),除菌液添加量15和20 mL/kg两处理组无显著差异(P > 0.05)外,其他处理组土壤团聚体含量随菌液添加量的增加而显著增加(P < 0.05)。
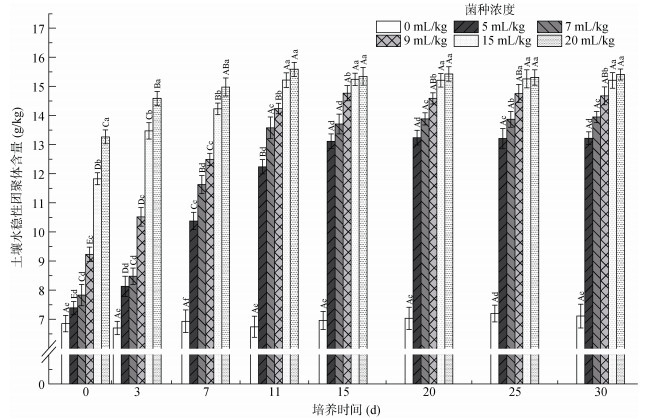
|
图 6 不同hs032添加量对土壤水稳性团聚体含量的影响 Fig. 6 Soil agglomerate masses under different hs032 additions |
以土壤微生物含量和多糖含量为解释变量,土壤容重、孔隙度、可溶性盐、pH、水稳性团聚体含量为响应变量进行冗余分析(图 7),结果表明,冗余分析的第1和第2排序轴累计解释微生物特性对土壤理化性质影响的97.3%,表明这两轴可以解释微生物含量和胞外多糖对土壤理化性质影响的绝大部分信息。多糖含量和微生物含量与土壤水稳性团聚体含量、孔隙度呈正相关,与可溶性盐、容重和pH呈负相关。
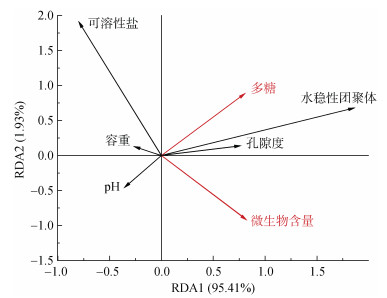
|
图 7 土壤微生物含量和多糖含量与土壤理化特性的冗余度分析 Fig. 7 Redundancy analysis of soil microorganism content and polysaccharide content with soil physicochemical properties |
土壤溶质穿透曲线随菌液添加量的增加而右移(图 8),表示溶质穿透时间后移,添加菌液能够对溶质在土壤中的移动起阻碍作用。通过拟合S型曲线数学模型logistic 5,得到的参数如表 2所示,其中h与曲线斜率有关,h值越大表示曲线斜率越小。由拟合得到的参数h值得出,穿透曲线的斜率随菌液添加量的增加而减小,表明添加菌液可以使溶质穿透土柱所需时间延长。菌液添加量20 mL/kg处理组相较对照组穿透时间推后50%,完全穿透所需时间增加27.8%。并且,经试验测量处理组土壤孔隙水流速相较对照组增加4.5% ~ 39.6%,且随菌液添加量的增加而增加。经计算土壤穿透系数大小按菌液添加量依次为5 mL/kg > 0 mL/kg > 7 mL/kg > 9 mL/kg > 20 mL/kg > 15 mL/kg。
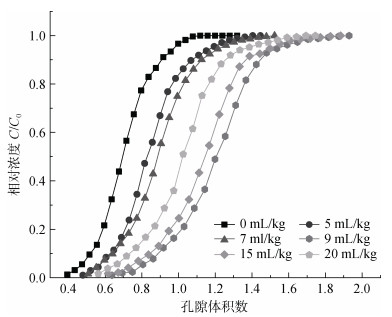
|
图 8 各组土壤穿透曲线 Fig. 8 Soil penetration curves under different hs032 additions |
|
|
表 2 各组土壤穿透曲线拟合参数h、孔隙水流速以及弥散系数 Table 2 Parameters h, pore water flow rates and dispersion coefficients for fitting soil penetration curves under different hs032 additions |
本试验研究了一株高产胞外多糖枯草芽孢杆菌hs032对盐碱土物理、化学和生物特性以及溶质扩散参数的影响。试验中采用了ATP荧光法检测土壤微生物含量,该方法可以在采样现场进行操作,解决了由于运输、保存不当等造成土壤生物特性发生变化的问题,也可检测出不可培养微生物数量,提高了检测数据的准确度。添加了hs032的盐碱土在试验结束时,微生物含量显著提高(P < 0.05)。从试验结果可以得出,添加具有耐盐特性的外源菌剂可以显著增加盐碱土中微生物的含量,这与在较贫瘠的风沙土中添加菌剂有所不同[16]。其原因可能是风沙土中有机质含量较低,不足以支撑较大的微生物增长量,遂呈现出先升后降的趋势。本试验中,供试土壤有机质含量为3.62 g/kg,有机质含量充足,因此土壤含盐量过高是微生物生长的限制性因素。不同剂量的hs032加入后,盐碱土壤的微生物含量迅速升高,最终保持在较高水平,但过高的剂量可能会造成菌种浪费。菌液添加量为15和20 mL/kg时,土壤微生物含量会迅速增加,达到最高峰后缓慢下降;而在其他添加量的条件下,土壤微生物含量会先上升达到一定数量后处于相对稳定的状态。
拥有大量的、健康的微生物细胞是微生物改良盐碱土的基础。从RDA排序图(图 7)中可以看出,微生物含量与多糖含量、水稳性团聚体含量、土壤孔隙度呈正相关,与可溶性盐含量、容重、pH呈负相关,这与其他研究得出的结果一致[17-18]。活的微生物细胞自身带负电荷,会通过静电引力吸附在土壤颗粒表面,成为“复合结构单元”,也可以成为团聚体的核[19]。而作为微生物次级代谢产物的胞外多糖则在形成土壤团聚体和维持土壤团聚体稳定性上起着重要的作用[20-22]。胞外多糖具有丰富的羧基、酰胺基和磷酰基等极性官能团,可以与土壤颗粒形成氢键;其还含有大量的酸性基团,可以与土壤颗粒形成离子键,这两种力是土壤团聚体内部主要的结合力[23]。通常认为土壤的团聚结构是土壤最好的结构形式,最根本的是团聚结构具有良好的孔径分布,能够良好地调节土壤的水、肥、气、热等因素[19]。因此,微生物对良好土壤结构的形成和稳定至关重要。
无机盐在微生物的生长繁殖过程中也是必需的,如铜、铁、锰等元素能够保证细胞内酶的最大活性;钙、镁二价离子能够维持细胞结构的稳定性;钾、钠离子被用来维持细胞的渗透压平衡或有利于营养物质的运输[24]。微生物细胞对土壤中无机盐的吸收会减少土壤溶液中游离的可溶性盐含量,从而减轻土壤盐渍化对土壤生态系统的损害。在以往发布的研究中很少关注微生物细胞对土壤无机盐的吸收和利用。但土壤中细菌的含量巨大,有时可达109 cfu/g以上,其细胞内无机盐含量不可忽略。Xie等[25]和李小雨等[26]采用的是重量或电导率法测量土壤含盐量,但对于利用微生物改良盐碱土的研究中,未经去除微生物细胞的土壤浸出液可能会由于在检测过程中细胞破裂,细胞内的无机盐成分外泄或细胞表面带电,导致检测结果偏高。因此,本试验中土壤浸出液先通过注射式过滤器去除微生物细胞,再按照重量法测定可溶性盐含量,更能反映微生物对土壤含盐量的影响。
3.2 枯草芽孢杆菌hs032对盐碱土穿透曲线和弥散系数的影响土壤结构和理、化、生特性的改变会引起土壤水盐运移参数的改变。土柱试验结果显示,土壤穿透曲线会随着菌液添加量的增加而右移,斜率变小,菌液添加量的增加使土壤对溶质穿透的阻碍越来越强,这与丛伟[27]的研究结果相似。细菌的胞外多糖具有转运和储存营养物质的作用[28],胞外多糖通常含有糖醛酸,可从环境中提取用于交换的有机离子或无机离子,从而在细胞附近保持适宜浓度的矿物质和其他营养物。并且胞外多糖具有巨大的比表面积和亲水性基团,同时存在着大量的阴离子基团(羧基、羟基、硫酸根),对于土壤中的无机盐离子有着明显的吸附作用[29]。本试验中,孔隙水流速随着菌剂添加量的增加而升高,原因可能是土壤中大孔隙数量随着菌剂添加量增加而增多,孔隙连通性增强,导致孔隙水流速升高,这与郭梦[30]的研究结果一致。土壤大孔隙的增加有利于土壤形成水分向上移动的阻隔层,有效地减少水分的蒸发和盐分的积累,这有利于减缓土壤盐分向表面积聚。
土壤溶质弥散系数是研究土壤中溶质运移特征的一个重要参数,它表征在一定土壤水流速下,土壤对于某种溶质的弥散能力。在本试实验中,弥散系数并没有严格地随着菌液的添加量增加而减小,这与吴军虎和任敏[31]利用羟丙基甲基纤维素作为改良剂的效果不同,原因可能是由于微生物数量和多糖的增加,提高了土壤团聚体的数量和土壤大孔隙体积,增加了土壤孔隙水流速。同时微生物细胞和胞外多糖对Na+的吸附或离子交换作用,使Na+的穿透受阻。然而多糖会造成土壤毛细孔隙的堵塞,所以过多的菌种添加量可能会导致土壤水流的不畅。因此,并不是添加的菌液量越多效果越好,在本次试验条件下菌剂添加量15 mL/kg为最佳。
3.3 土壤改良添加菌剂策略添加不同浓度菌液后土壤结构和理、化、生特性的变化规律,为盐碱土微生物改良提供了两种菌种施加策略:第一,大剂量添加。对于需要在短时间内达到高微生物含量、快速提高土壤生物活性要求的土壤,或者是土壤盐碱化程度高、土壤质量较低的土壤,可以采用此类施加方式。然而,过高的菌种添加量可能会增加菌种间或个体间对于生存空间、营养物质的竞争,从而导致后期微生物含量的减少或是微生物多样性的降低。第二,较小剂量添加。对于处于盐碱化初期或土壤质量退化程度较低的土壤,小添加量应是较好的选择,降低治理成本的同时可以使菌种在初期通过适应期筛选出更适应外界条件的菌株,从而在后期达到更好的治理效果,提高盐碱土本就含量较少的有机质的利用率。但是,盐碱土的治理通常情况下是在野外条件下进行的,外界条件的变化对于治理效果有着较大的影响,较小的菌种施加量可能会在外界条件的突然改变后,例如强降雨或降温等,使治理效果下降或者彻底失败。因此,针对处于不同地区、不同自然环境下的盐碱土改良最适菌种施加量仍需进一步的研究。
4 结论枯草芽孢杆菌hs032能够增加盐碱土壤中的微生物含量和多糖含量,土壤水稳性团聚体含量、土壤孔隙度也显著增加,而土壤可溶性盐含量、容重和pH显著降低。在合理的添加量范围内,菌剂添加可以降低盐碱土对无机盐离子的弥散能力,在本次试验中最佳的菌种施用量为15 mL/kg。
| [1] |
杨劲松, 姚荣江, 王相平, 等. 中国盐渍土研究: 历程、现状与展望[J]. 土壤学报, 2022, 59(1): 10-27 (  0) 0) |
| [2] |
Rillig M C, Muller L A, Lehmann A. Soil aggregates as massively concurrent evolutionary incubators[J]. The ISME Journal, 2017, 11(9): 1943-1948 DOI:10.1038/ismej.2017.56 (  0) 0) |
| [3] |
Koo H, Allan R N, Howlin R P, et al. Targeting microbial biofilms: Current and prospective therapeutic strategies[J]. Nature Reviews Microbiology, 2017, 15(12): 740-755 DOI:10.1038/nrmicro.2017.99 (  0) 0) |
| [4] |
上官王丽. 产胞外多糖细菌多样性及其对土壤团聚体形成作用的研究[D]. 南京: 南京农业大学, 2013.
(  0) 0) |
| [5] |
杜宇佳, 高广磊, 陈丽华, 等. 土壤微生物膜对风沙土固沙保水特性的影响[J]. 农业工程学报, 2020, 36(17): 98-105 (  0) 0) |
| [6] |
郭彦钊, 杜春辉, 于烽, 等. 旱区盐生植物根际促生菌的分离鉴定及其干旱、盐胁迫下促生特性[J]. 微生物学报, 2023, 63(2): 610-622 (  0) 0) |
| [7] |
魏蔚, 宋时丽, 吴昊, 等. 复合菌剂对玉米秸秆的降解及土壤生态特性的影响[J]. 土壤通报, 2019, 50(2): 323-332 (  0) 0) |
| [8] |
蔡国林. 解淀粉芽孢杆菌胞外多糖的结构及其益生作用机制[D]. 无锡: 江南大学, 2020.
(  0) 0) |
| [9] |
Limon O A, Govaerts B, Deckers J, et al. Soil aggregate and microbial biomass in a permanent bed wheat-maize planting system after 12 years[J]. Field Crops Research, 2006, 97(2/3): 302-309 (  0) 0) |
| [10] |
李燕培, 王静, 林佳琦, 等. 香蕉园间种甘薯对土壤物理性状和结构的影响[J]. 江苏农业科学, 2022, 50(5): 205-211 (  0) 0) |
| [11] |
查同刚. 土壤理化分析[M].
中国林业出版社, 北京, 2017
(  0) 0) |
| [12] |
朱羽廷, 冯炜, 吴宜全, 等. 三磷酸腺苷及生物威胁指数与活性污泥法常规指标的相关性分析: 以某精细化工废水处理设施为例[J]. 环境工程, 2021, 39(6): 49-54 (  0) 0) |
| [13] |
Wang S Q, Huang M, Shao X Mi, et al. Vertical distribution of soil organic carbon in China[J]. Environmental Management, 2004, 33(Suppl 1): S200-S209 (  0) 0) |
| [14] |
Gottschalk P G, Dunn J R. The five-parameter logistic: A characterization and comparison with the four-parameter logistic[J]. Analytical Biochemistry, 2005, 343(1): 54-65 DOI:10.1016/j.ab.2005.04.035 (  0) 0) |
| [15] |
薛禹群, 吴吉春. 地下水动力学(3版)[M].
地质出版社, 北京, 2010
(  0) 0) |
| [16] |
蒋辉. 弥散参数计算方法分析[J]. 勘察科学技术, 2013(3): 9–12, 28 (  0) 0) |
| [17] |
张咪, 赵文静, 赵亚男, 等. 盐碱土壤修复菌剂的微生物筛选[J]. 农业环境科学学报, 2022, 41(12): 2622-2628 DOI:10.11654/jaes.2022-1158 (  0) 0) |
| [18] |
张晓丽, 王国丽, 常芳弟, 等. 生物菌剂对根际盐碱土壤理化性质和微生物区系的影响[J]. 生态环境学报, 2022, 31(10): 1984-1992 (  0) 0) |
| [19] |
王悦, 陈爽, 曹锐, 等. 耐盐菌联合化学复合改良剂协同改良黄河三角洲盐碱土壤的效果[J]. 水土保持学报, 2023, 37(1): 354-360 (  0) 0) |
| [20] |
刘亚龙, 王萍, 汪景宽. 土壤团聚体的形成和稳定机制: 研究进展与展望[J]. 土壤学报, 2023, 60(3): 627-643 (  0) 0) |
| [21] |
文倩, 赵小蓉, 陈焕伟, 等. 半干旱地区不同土壤团聚体中微生物量碳的分布特征[J]. 中国农业科学, 2004, 37(10): 1504-1509 (  0) 0) |
| [22] |
Six J, Bossuyt H, Degryze S, et al. A history of research on the link between (micro)aggregates, soil biota, and soil organic matter dynamics[J]. Soil and Tillage Research, 2004, 79(1): 7-31 (  0) 0) |
| [23] |
Christensen B T. Physical fractionation of soil and structural and functional complexity in organic matter turnover[J]. European Journal of Soil Science, 2001, 52(3): 345-353 (  0) 0) |
| [24] |
苗芳芳, 勉有明, 普雪可, 等. 耕作覆盖对宁南旱区土壤团粒结构及马铃薯水分利用效率的影响[J]. 中国农业科学, 2021, 54(11): 2366-2376 (  0) 0) |
| [25] |
Xie Yan, Bu Heshen, Feng Qijia et al. Identification of Cd-resistant microorganisms from heavy metal-contaminated soil and its potential in promoting the growth and Cd accumulation of bermudagrass.[J]. Environmental research, 2021(2001): 11730-111730 (  0) 0) |
| [26] |
李小雨, 贾科利, 魏慧敏, 等. 基于随机森林算法的土壤含盐量预测[J]. 干旱区研究, 2023, 40(8): 1258-1267 (  0) 0) |
| [27] |
丛伟. 丛枝菌根真菌和盐胁迫对硒在土壤—植物系统中迁移的影响[D]. 杨陵: 西北农林科技大学, 2012.
(  0) 0) |
| [28] |
Zhang M, Zeng S Y, Hao L Y, et al. Structural characterization and bioactivity of novel exopolysaccharides produced by Tetragenococcus halophilus[J]. Food Research International, 2022, 155: 111083 (  0) 0) |
| [29] |
李静. 一株多糖高产菌株的研究与应用[D]. 贵阳: 贵州大学, 2006.
(  0) 0) |
| [30] |
郭梦. 不同含砂量土壤蒸发机理及水盐运移数值模拟[D]. 西安: 长安大学, 2020.
(  0) 0) |
| [31] |
吴军虎, 任敏. 羟丙基甲基纤维素作土壤改良剂对土壤溶质运移的影响[J]. 农业工程学报, 2019, 35(5): 141-147 (  0) 0) |
 2024, Vol. 56
2024, Vol. 56

