2. 土壤与农业可持续发展重点实验室(中国科学院), 南京 211135
重金属污染土壤的修复是土壤修复领域的研究重点之一[1-2]。随着环境保护的需要和环保法规的日益严格,降低土壤重金属的总量成为修复技术研究中的一个重要目标。传统的固化/稳定化技术、异位填埋技术、水泥窑技术等并未降低土壤重金属总量[2-4],仅涉及土壤的异位处置,已无法适应新的需求。现有的土壤重金属总量去除技术主要有植物修复、淋洗修复、电动修复等[1, 5]。由于重金属在土壤中的形态多样,不同重金属以及同一种重金属不同形态的活性、移动性等均不相同,且历史污染土壤的重金属活性和移动性均较低[6-7]。为了提高总量去除技术对土壤重金属的去除效率,通常需加入活化剂来提高土壤中重金属的可溶性和移动性,因此活化剂的应用成为重金属总量去除技术应用的关键之一。
目前研究较多的活化试剂主要包括三大类,即小分子有机酸(柠檬酸、草酸、乳酸等)、大分子的络合剂(乙二胺四乙酸(EDTA)、二亚乙基三胺五乙酸(DTPA)、甲基甘氨酸二乙酸(MGDA)、亚氨基二琥珀酸(IDS)、谷氨酸二乙酸四钠(GLDA)等)和生物表面活性剂(鼠李糖脂)等[8]。由于在原位修复时防止二次污染的需要,生物难降解的络合剂EDTA、DTPA等难以在原位修复时应用,因此生物可降解络合剂逐步成为研究和应用的主流[9-11]。在这些生物可降解络合剂中,GLDA是一种新型绿色的生物可降解络合剂,其对重金属具有较好的络合能力,目前已有研究将其应用于土壤淋洗、植物修复和电动修复中[11-13]。此外,与MGDA、IDS等化学合成的生物可降解络合剂相比,GLDA主要通过生物发酵形成,碳足迹低,48% 的碳来自天然植物,更适合在当前碳中和背景下土壤修复的需要,是一种具有较好应用前景的生物可降解络合剂[14]。但GLDA对重金属的络合能力要低于EDTA,因此如何通过生物可降解络合剂的组合来获得与EDTA相近的重金属提取能力,同时实现低成本和减少二次污染是有待解决的技术难题。
对于重金属复合污染土壤,单一试剂对多种重金属也难以达到令人满意的提取效果,因此也需要不同试剂的组合来解决这一问题。Guo等[15]将EDTA、GLDA和柠檬酸三者结合形成混合试剂,获得了与单独使用EDTA相似的重金属提取能力,但该研究中将EDTA作为组合试剂的成分之一,仍存在一定的环境风险。Yan等[16]将GLDA与抗坏血酸相结合,利用抗坏血酸的强还原性来提高对As的提取能力,实现了As、Cd和Pb的同步去除。Xu等[8]针对As、Cd和Pb复合污染土壤,提出将1-羟基亚乙基-1, 1-二磷酸(HEDP)、乳酸和FeCl3相结合,其重金属提取率达到了79.93%(Cd)、69.84%(Pb)和61.55%(As)。上述研究虽然也提出了不同的试剂组合,但并未与EDTA进行对比,缺乏对组合试剂成本效益的评估。
基于以上,本研究将GLDA和其他生物可降解络合剂进行组合,通过控制浸提剂的pH和组合配比,以筛选获得最优的组合试剂,并且在探究重金属提取效率和机制的同时,对试验成本和效益进行综合评估,以期为重金属总量去除技术修复污染土壤提供技术支持。
1 材料与方法 1.1 供试材料试验土壤为浙江湖州某场地土壤,采自表层0 ~ 20 cm。采集的土壤经风干,拣除石子、草根等,磨细过0.25 mm孔径筛,混匀备用。土壤pH为8.13,电导率为0.306 mS/cm,有机质含量为17.5 g/kg,土壤重金属形态分级见表 1。对照GB36600—2018《土壤环境质量建设用地土壤污染风险管控标准(试行)》[17],土壤中As、Cd和Pb含量均超过了第二类用地管制值,污染较重。从重金属的化学形态来看,As以无定形铁铝水合氧化态为主,占比82.3%;Cd以弱酸可提态为主,占比为41.4%;Cu以可还原态为主,占比为40.1%,Pb以弱酸可提态为主,占比为35.6%。
|
|
表 1 供试土壤重金属形态分级(mg/kg) Table 1 Chemical fractions of heavy metals |
本研究选用了市场上主流的生物可降解络合剂进行试验,包括6种大分子螯合剂和2种小分子有机酸。NTA(次氮基三乙酸)因具有较高的生物毒性和致癌性[20],因此未被选为研究材料。表 2列出了所用试剂的性质和价格等。所有试剂均采用分析纯,现配现用。
|
|
表 2 供试试剂性质及价格 Table 2 Specifics and prices of different chelates tested |
选用表 2中的8种络合剂,配制不同浓度的溶液进行单一试剂的浸提试验。溶液配制浓度根据土壤中目标重金属的浓度来确定。由于污染土壤中还存在非目标金属元素(如钙、镁、铝等)也能与络合剂形成络合物,因此为了尽可能解吸土壤中的目标重金属,一般活化试剂和目标金属之间的摩尔比会大于等于1。根据Wu等[12]和Liu等[21]的研究结果,本研究中浸提试剂的摩尔数与土壤中重金属的摩尔数之比定为1∶1、2.5∶1、5∶1和10∶1。根据表 1供试土壤的重金属含量,计算得每克土壤中的重金属的摩尔数为2 mmol。浸提剂固液比、浸提时间等参数参考Guo等[22]和Liu等[21]的研究结果,同时考虑到试剂的生物可降解性,浸提时间设定为2 h,固液比为1∶10(m/V)。浸提试验步骤为:称取1.000 g污染土壤于50 mL离心管中,分别加入10 mL提取剂溶液(浓度分别为0.02、0.05、0.10和0.20 mol/L),在25℃、200 r/min往复振荡箱中振荡2 h,然后在8 000 r/min离心5 min。取上清液,用0.45 μm的水相微孔滤膜过滤,测定溶液中的重金属浓度。每个处理为3个重复,平行测定2次。
1.2.2 不同pH下GLDA的浸提试验根据1.2.1节的试验结果,确定最优的GLDA浸提浓度。在此浓度下,用0.5 mol/L NaOH和0.5 mol/L HCl调节GLDA溶液的pH,配制pH 1 ~ 11的GLDA溶液,并用此溶液开展浸提试验。具体浸提试验步骤与1.2.1节相同。
1.2.3 复合试剂浸提试验以GLDA为主,将其他试剂(以X代替)与其进行两两组合,配制的溶液中GLDA与X的摩尔比分别为5∶1、3∶1、1∶1、1∶3、1∶5,浸提剂总浓度以1.2.1中获得的最优浓度为准。同时调节组合试剂的pH为4[15],研究不同组合试剂对土壤重金属的提取效果。具体浸提试验步骤与1.2.1节相同。
1.3 测试方法参考《土壤农业化学分析方法》[23],土壤pH和EC在土水比为1∶2.5(m/V)下,涡旋1 min,静置30 min后,分别采用pH计(S210-K,梅特勒托利多仪器有限公司,瑞士)和电导率仪(FE38,梅特勒托利多仪器有限公司)测定;土壤有机质采用重铬酸钾氧化法测定。
土壤As的形态分级采用Wenzel法[18]进行分级,共分为非专性吸附态、专性吸附态、无定形铁铝水合氧化态、结晶态铁铝水合氧化态和残渣态5个形态。其中非专性吸附态用0.05 mol/L硫酸铵溶液浸提,专性吸附态采用0.05 mol/L磷酸二氢铵浸提,无定形铁铝氧化结合态用0.2 mol/L草酸铵缓冲液(pH 3.25)浸提,晶质铁铝氧化物结合态采用0.2 mol/L草酸铵缓冲液(pH 3.25)和0.1 mol/L抗坏血酸水浴(90℃)提取,残渣态用盐酸–硝酸(3∶1,V/V)消化。土壤Cd、Cu和Pb形态采用BCR法[19]进行分级,共分为弱酸可提态、可还原态、可氧化态和残渣态4个形态,其中弱酸可提态用0.11 mol/L乙酸溶液浸提,可还原态采用0.1 mol/L盐酸羟胺(pH 2)浸提,可氧化态用30% H2O2水浴(85℃)氧化后用1 mol/L乙酸铵浸提,残渣态用硝酸–氢氟酸–高氯酸(1∶2∶1,V/V)消化。浸提液中的重金属浓度采用ICP-OES(Optima 8000,珀金埃尔默仪器有限公司,美国)测定。土壤重金属总量采用三酸法(硝酸–氢氟酸–高氯酸)消化,消化液用ICP-OES测定。
1.4 数据处理与分析本研究重金属提取率按如下公式进行计算:
| $ 重金属提取率=\frac{{{C_1} \cdot {V_1}}}{{{C_2} \cdot m}} \times {{100\% }} $ |
式中:C2(mg/kg)和m(g)分别表示土壤中重金属含量和土壤样品质量;C1(mg/L)和V1(mL)表示浸提液中重金属的浓度和体积。
使用Excel 2010对数据进行整理和分析,使用Origin 2023绘制图形,数据以2个平行的平均值表示。采用SPSS 26中的单因素方差分析检验处理间的显著性差异。
2 结果与讨论 2.1 不同浓度生物可降解络合剂对重金属的浸提效果图 1为不同浓度络合剂对土壤中As、Cd、Cu和Pb的浸提效率。总体上,随着络合剂与重金属摩尔比的增加,重金属的提取率逐渐增加,这与以往研究结果一致[24],但不同金属元素和不同络合剂间存在一定的差异[21]。对于As,在较低摩尔比时(1∶1和2.5∶1),大分子络合剂对As的提取能力明显高于小分子有机酸,但在较高摩尔比时(5∶1和10∶1),OA对As的提取率反而高于大分子络合剂,达到了67.7% ~ 84.2%。土壤中的As主要与土壤中的铁/锰/铝氧化物、有机质、硅铝酸盐等不同组分结合[25],OA的酸性较强(0.2 mol/L时pH为1.23),对土壤铁锰氧化物有较强的提取能力,此外较高的摩尔比也有利于减少非目标成分对提取的竞争,上述的共同作用使OA在较高浓度时具备了超过大分子络合剂对As的提取能力[26-27]。以最高提取率排序,不同络合剂对As的提取率顺序为:OA > EDTA > HEDP≈MGDA > EDDS > GLDA > IDS > CA。
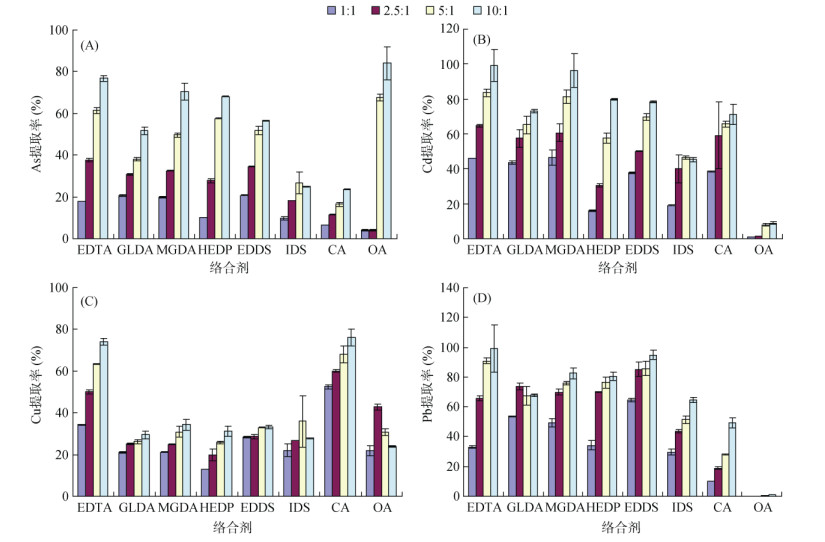
|
图 1 不同络合剂与重金属摩尔比对土壤中重金属提取率的影响 Fig. 1 Effects of different molar ratios of complexing agents to heavy metals on removal rates of heavy metals in soils |
对于Cd,EDTA无论在低摩尔比还是在高摩尔比时,相较其他络合剂,对Cd的提取能力均最强,这和其与Cd的络合能力最强有关(EDTA与Cd的络合常数达16.5)[24]。GLDA对Cd的提取能力居中,且其在较低浓度时也能获得较高的Cd提取率,受试剂浓度影响较小。OA对Cd提取能力偏低,仅为1.00% ~ 8.90%,可能是因为OA与重金属形成的络合物容易在土壤上吸附,从而降低了提取液中的重金属浓度[27]。以最高提取率排序,不同络合剂对Cd的提取率顺序为EDTA > MGDA > HEDP > EDDS > GLDA≈ CA > IDS > OA。不同试剂对Pb的提取能力与Cd相似,均为EDTA的提取能力最高,而OA最低。以最高提取率排序,不同络合剂对Pb的提取率顺序为EDTA > EDDS > MGDA≈HEDP > GLDA > IDS > CA > OA。
对于Cu,CA的提取能力超过了EDTA,尽管从络合常数来看,EDTA与Cu的络合常数(18.8)高于CA与Cu的络合常数(5.9)[28],但由于CA有较低的pH,有利于Cu的提取。此外,从土壤中Cu的形态分级来看,弱酸可提态的占比为32.6%,也有利于酸性试剂对Cu的提取。其他试剂对Cu的提取能力相似,且不同摩尔比之间的差异也不明显。以最高提取率排序,不同络合剂对Cu的提取率顺序为CA > EDTA > MGDA≈EDDS > HEDP > GLDA > IDS > OA。
综合考虑浸提效果,当络合剂与重金属摩尔比从5∶1增加到10∶1时对重金属的提取率增加不大,因此选择5∶1(即络合剂浓度为0.1 mol/L)作为后续试验的试剂浓度。
2.2 不同pH条件下GLDA对重金属的浸提效果不同pH条件下GLDA浸提重金属的效果如图 2所示,不同重金属的提取率存在较大差异。总体上,As的提取率低于其他几种重金属。随浸提剂pH的增加,As提取率呈现先下降后上升的趋势,在酸性区(3.98 ~ 5.16)和碱性区(9.41 ~ 10.6)出现峰值,且pH为10.6左右的As提取率(38.7%)略大于pH为3.98时的提取率(34.9%)。这可能是由于当pH < 7时,随着pH的升高,溶液酸度降低,不利于氧化铁的溶解,从而抑制了As的去除,相反,当pH大于7时,随着pH的增加,氧化铁与As化合物的稳定性下降,As与OH–交换[16],有利于As提取率的提高。
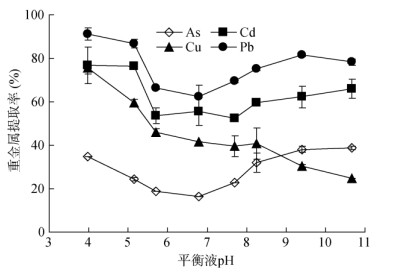
|
图 2 不同pH对GLDA提取重金属的影响 Fig. 2 Effects of different pH values on removal rates of heavy metals by GLDA |
GLDA对Cd和Pb的提取率随pH的变化规律与As相似,在pH 3 ~ 11范围内,也呈现先下降后上升的趋势。GLDA与Cd和Pb的络合常数相近(前者为10.3,后者为11.6),Pb略高[11],两者总体提取率在50%以上,其中Cd的提取率为52.0% ~ 77.0%,Pb提取率为62.5% ~ 91.0%。Yan等 [16]开展了不同pH条件下GLDA对土壤中Cd和Pb的浸提试验研究,结果表明,随着pH的升高,Cd和Pb的提取率逐步降低,这一结果与本研究结果不同,可能与土壤性质以及重金属的形态存在差异有关[22, 24]。GLDA对Cu的提取率随pH的升高而降低,提取率从最高的76.0%(pH 3.98)降低至25.0%(pH 10.6),表明酸性条件下更有利于GLDA对Cu的提取[29]。
2.3 络合剂两两组合对重金属的浸提效果根据图 1中单一络合剂对重金属的提取效果,由于IDS对不同重金属的提取能力均排在较后的位置,因此,在两两组合研究中将IDS排除,将GLDA和其他5种生物可降解络合剂进行组合,研究不同组合试剂对土壤重金属的提取能力,结果如图 3所示。
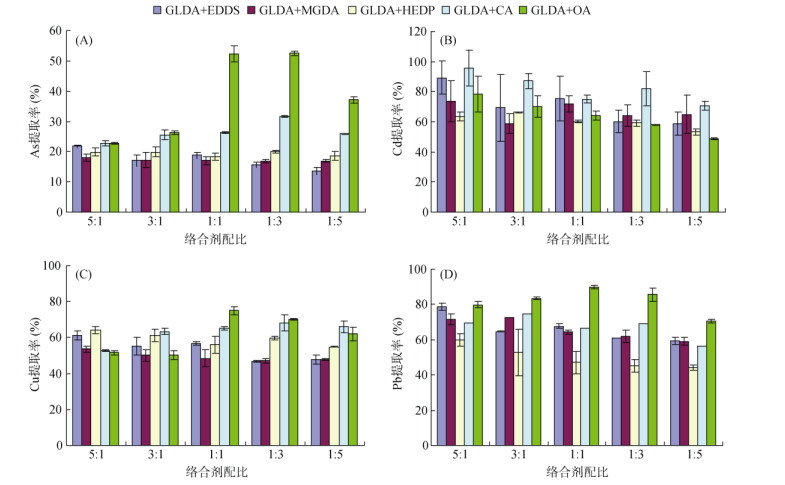
|
图 3 pH4条件下不同络合剂配比对土壤中重金属浸提效果的影响 Fig. 3 Effects of different complexing agents ratios on removal rates of heavy metals in soils at pH 4 |
由图 3可知,不同组合试剂和配比对不同重金属的提取效率存在明显差异。对于As,不同配比的GLDA+EDDS、GLDA+MGDA和GLDA+HEDP组合对As的提取能力差异不大(图 3A),这可能是因为GLDA与EDDS、MGDA和HEDP均属于大分子络合剂,其对As的提取机理相似,因此不同配比对As的提取影响较小。当GLDA与小分子有机酸CA和OA组合使用时,随着CA和OA配比的增加,组合试剂对As的提取能力明显增加,特别是在1∶1和1∶3时提取能力最大。GLDA+CA组合和GLDA+OA组合相比,GLDA+OA对As的提取能力明显高于GLDA+CA(配比在1∶1 ~ 1∶5时),这主要是因为OA对As的提取能力强于其他试剂(图 1A)[26-27]。配比为1∶1和1∶3的GLDA+OA组合试剂对As的提取率最高,分别为52.5% 和52.4%。
不同组合试剂对Cd的提取规律与As不同。总体上,5∶1配比的组合试剂对Cd的提取效率均大于其他配比,且随着配比的减少提取率逐步降低。这一结果表明,组合试剂中对Cd提取起到主要作用的仍是GLDA,其他试剂对于提高Cd提取效率的帮助不大。不同组合试剂之间比较,GLDA+EDDS和GLDA+CA的组合要略高于其他组合,而GLDA+ HEDP组合则低于其他组合。配比为5∶1的GLDA+ CA组合试剂对Cd的提取率最高,为95.7%。
不同组合试剂对Cu和Pb的提取规律与As相似,即GLDA与大分子络合剂的组合随不同配比的变化不明显,而GLDA与CA和OA组合时,随着CA和OA配比的增加,Cu和Pb的提取率明显提高,在1∶1时最高,且GLDA+OA组合高于GLDA+CA组合,对Cu和Pb的提取率分别达到75.0% 和89.8%。
综合上述结果,GLDA和OA组合表现出较好的提取效果,出于本研究筛选以GLDA为主体的组合试剂的目的以及GLDA+OA(1∶1)对4种重金属的提取率均高于GLDA+OA (1∶3),因此,后续以GLDA+OA 1∶1为主要研究考察对象。GLDA和OA在配比为1∶1时对土壤中As、Cu和Pb的提取能力最强,分别为52.5%、75.0% 和89.8%,对Cd的提取率为64.2%,低于GLDA+CA对Cd的提取能力(GLDA+CA摩尔比5∶1时95.7%)。与单一EDTA对不同重金属的提取率相比(As:61.5%,Cd:83.6%,Cu:63.5%,Pb:90.9%)(图 1),现有组合试剂对Cu的提取能力高于EDTA,而对As和Cd的提取能力低于EDTA;与Xu等[8]提出的HEDP+乳酸+FeCl3的组合试剂结果相比,Cd和As的提取率略低,而Pb的提取率则较高。
对上述研究中较优的几种络合剂的提取率和成本进行了评估,结果见表 3。在相同提取剂浓度下,EDTA对As、Cd的提取率高于GLDA+OA(1∶1)组合试剂,Cu的提取率较低,Pb持平。从试剂成本来看,EDTA的单位用量价格为6.69元/mol,这一价格要比GLDA的11.95元/mol低,但高于GLDA+ OA(1∶1)的6.09元/mol。GLDA+OA(1∶1)对As的提取率明显高于GLDA,而Cu和Pb的提取率较为接近。因此,综合对4种重金属的提取能力和成本的比较,GLDA+OA(1∶1)组合试剂是较优的可替代EDTA的试剂组合。由于提取试剂在不同土壤中的提取能力受土壤pH、重金属形态等影响而表现不同,因此后续仍需在不同类型的重金属污染土壤中开展试验,以科学评估GLDA+OA组合试剂对不同土壤中重金属的提取能力和应用成本。
|
|
表 3 不同络合剂的重金属提取率及成本 Table 3 Extraction efficiency and costs of different chelates |
土壤重金属形态是关系到重金属活化和迁移的重要因素。通过比较提取前后土壤重金属形态的变化,可以探究络合剂对土壤重金属的提取机制。以上述研究获得的最佳提取剂组合GLDA+OA(1∶1)为研究对象,对提取后的土壤重金属形态进行分析,并与提取前的原土进行对比,结果见图 4。总体上,经GLDA+OA组合浸提剂提取后,土壤重金属的大多数形态含量均明显下降。对于As,除残渣态(F5)含量没有变化外,专性吸附态(F2)、无定形(F3)和结晶态(F4)的铁铝氧化物结合态含量均减少,尤其是F3的变化幅度最大,从原土的179.6 mg/kg下降到提取后的752.4 mg/kg,但F3仍为土壤中As的主要形态,占比达70%。这主要是因为土壤中的铁铝氧化物能够强烈吸附As[30-31]。提取后非专性吸附态(F1)含量有所增加,表明其他形态的As(F2、F3和F4)在被组合试剂提取的过程中一部分转化为了稳定性较低的形态。
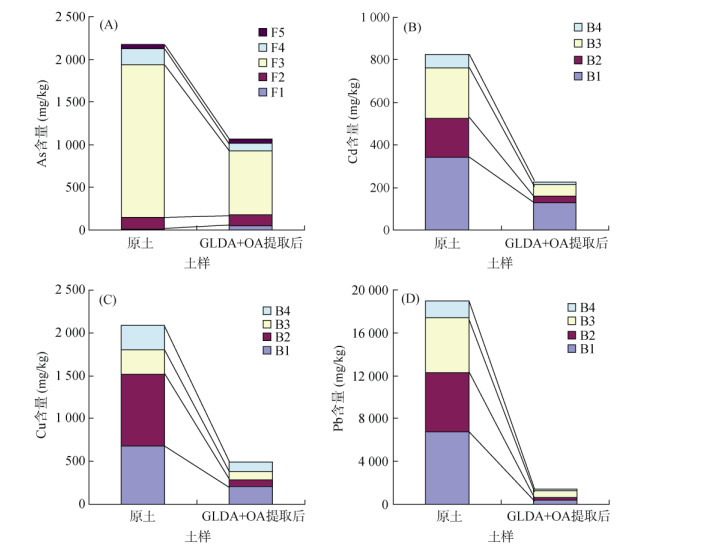
|
图 4 GLDA+OA(1∶1)提取前后土壤中重金属的形态变化 Fig. 4 Chemical fractions changes of heavy metals in soils before and after extraction of GLDA+OA (1∶1 ratio) |
土壤中Cd、Cu和Pb的各形态含量均明显下降。对于Cd,尽管提取后Cd仍然以弱酸可提态(B1)为主要形态,且占比由原土的41.4% 升高到56.5%,但可还原态(B2)和可氧化态(B3)含量的下降幅度更大,表明GLDA+OA组合试剂更有利于土壤中可还原态和可氧化态Cd的去除。Cu在提取前后的形态变化与Cd相似,也是可还原态(B2)含量的下降幅度最大。通常可还原态的重金属主要指土壤中与铁锰氧化物结合的重金属形态[19],OA具有较强的还原溶解能力[32],同时结合GLDA对土壤重金属较强的络合提取能力[33],因此表现为B2形态更容易被组合试剂提取和去除。Pb在原土中各形态占比为B1 > B2 > B3 > B4,经浸提后,可氧化态(B3)为主要形态,B1和B2形态大幅减少。这些形态的变化在一定程度上解释了不同重金属提取率的差异。
通过比较提取前后土壤中重金属形态的变化,可以发现GLDA+OA浸提组合可以大幅度降低土壤重金属总量,同时有助于减少易被生物吸收和易迁移的重金属形态,降低土壤中不同形态重金属的含量和释放风险。
3 结论1) 随着络合剂与重金属摩尔比的增加,重金属的提取率逐渐增加,最优摩尔比为5∶1;OA对As、CA对Cu的提取能力接近EDTA对As和Cu的提取能力。
2) GLDA在较酸的条件下对各种重金属的提取能力均较高。
3) 通过不同试剂的组合,GLDA+OA在配比为1∶1时对土壤中As、Cu和Pb的提取能力最强,分别为52.5%、75.0% 和89.8%,对Cd的提取率为64.2%。从试剂成本来看,GLDA+OA(1∶1)要低于EDTA和GLDA,有望成为替代EDTA用于土壤重金属络合剂辅助总量去除技术的选择之一。
4) GLDA+OA(1∶1)浸提土壤后,土壤重金属的大多数形态含量均有所下降,特别是易被生物吸收和容易迁移的弱结合态重金属形态明显减少,降了土壤中残留重金属的释放风险。
| [1] |
Song P P, Xu D, Yue J Y, et al. Recent advances in soil remediation technology for heavy metal contaminated sites: A critical review[J]. The Science of the Total Environment, 2022, 838(Pt 3): 156417 (  0) 0) |
| [2] |
骆永明, 滕应. 中国土壤污染与修复科技研究进展和展望[J]. 土壤学报, 2020, 57(5): 1137-1142 (  0) 0) |
| [3] |
严康, 楼骏, 汪海珍, 等. 污染场地研究现状与发展趋势: 基于知识图谱的分析[J]. 土壤学报, 2021, 58(5): 1234-1245 (  0) 0) |
| [4] |
常春英, 曹浩轩, 陶亮, 等. 固化/稳定化修复后土壤重金属稳定性及再活化研究进展[J]. 土壤, 2021, 53(4): 682-691 (  0) 0) |
| [5] |
Azhar U, Ahmad H, Shafqat H, et al. Remediation techniques for elimination of heavy metal pollutants from soil: A review[J]. Environmental Research, 2022, 214(Pt 4): 113918 (  0) 0) |
| [6] |
Zong Y T, Xiao Q, Lu S G. Chemical fraction, leachability, and bioaccessibility of heavy metals in contaminated soils, Northeast China[J]. Environmental Science and Pollution Research International, 2016, 23(23): 24107-24114 DOI:10.1007/s11356-016-7598-9 (  0) 0) |
| [7] |
Kierczak J, Neel C, Aleksander-Kwaterczak U, et al. Solid speciation and mobility of potentially toxic elements from natural and contaminated soils: A combined approach[J]. Chemosphere, 2008, 73(5): 776-784 DOI:10.1016/j.chemosphere.2008.06.015 (  0) 0) |
| [8] |
Xu L, Dai H P, Skuza L, et al. Co-high-efficiency washing agents for simultaneous removal of Cd, Pb and As from smelting soil with risk assessment[J]. Chemosphere, 2022, 300: 134581 DOI:10.1016/j.chemosphere.2022.134581 (  0) 0) |
| [9] |
Tandy S, Bossart K, Mueller R, et al. Extraction of heavy metals from soils using biodegradable chelating agents[J]. Environmental Science & Technology, 2004, 38(3): 937-944 (  0) 0) |
| [10] |
孙小峰, 吴龙华, 骆永明. EDDS对海州香薷修复重金属复合污染土壤的田间效应[J]. 土壤, 2006, 38(5): 609-613 (  0) 0) |
| [11] |
Pinto I S S, Neto I F F, Soares H M V M. Biodegradable chelating agents for industrial, domestic, and agricultural applications—a review[J]. Environmental Science and Pollution Research International, 2014, 21(20): 11893-11906 DOI:10.1007/s11356-014-2592-6 (  0) 0) |
| [12] |
Wu Q, Cui Y R, Li Q L, et al. Effective removal of heavy metals from industrial sludge with the aid of a biodegradable chelating ligand GLDA[J]. Journal of Hazardous Materials, 2015, 283: 748-754 DOI:10.1016/j.jhazmat.2014.10.027 (  0) 0) |
| [13] |
卫泽斌, 陈晓红, 吴启堂, 等. 可生物降解螯合剂GLDA诱导东南景天修复重金属污染土壤的研究[J]. 环境科学, 2015, 36(5): 1864-1869 (  0) 0) |
| [14] |
陈叶享. 更绿色和持续性螯合剂GLDA及其应用之道[J]. 中国洗涤用品工业, 2011(3): 65-67 (  0) 0) |
| [15] |
Guo X F, Zhang G X, Wei Z B, et al. Mixed chelators of EDTA, GLDA, and citric acid as washing agent effectively remove Cd, Zn, Pb, and Cu from soils[J]. Journal of Soils and Sediments, 2018, 18(3): 835-844 DOI:10.1007/s11368-017-1781-6 (  0) 0) |
| [16] |
Yan D M, Guo Z H, Xiao X Y, et al. Cleanup of arsenic, cadmium, and lead in the soil from a smelting site using N, N-bis(carboxymethyl)-L-glutamic acid combined with ascorbic acid: A lab-scale experiment[J]. Journal of Environmental Management, 2021, 296: 113174 DOI:10.1016/j.jenvman.2021.113174 (  0) 0) |
| [17] |
生态环境部, 国家市场监督管理总局. 土壤环境质量建设用地土壤污染风险管控标准(试行): GB 36600—2018[S]. 北京: 中国标准出版社, 2018.
(  0) 0) |
| [18] |
Wenzel W W, Kirchbaumer N, Prohaska T, et al. Arsenic fractionation in soils using an improved sequential extraction procedure[J]. Analytica Chimica Acta, 2001, 436(2): 309-323 DOI:10.1016/S0003-2670(01)00924-2 (  0) 0) |
| [19] |
Davidson C M, Duncan A L, Littlejohn D, et al. A critical evaluation of the three-stage BCR sequential extraction procedure to assess the potential mobility and toxicity of heavy metals in industrially-contaminated land[J]. Analytica Chimica Acta, 1998, 363(1): 45-55 DOI:10.1016/S0003-2670(98)00057-9 (  0) 0) |
| [20] |
Ebina Y, Okada S, Hamazaki S, et al. Nephrotoxicity and renal cell carcinoma after use of iron- and aluminum- nitrilotriacetate complexes in rats[J]. Journal of the National Cancer Institute, 1986, 76(1): 107-113 (  0) 0) |
| [21] |
Liu L R, Luo D G, Yao G C, et al. Comparative activation process of Pb, Cd and Tl using chelating agents from contaminated red soils[J]. International Journal of Environmental Research and Public Health, 2020, 17(2): 497 DOI:10.3390/ijerph17020497 (  0) 0) |
| [22] |
Guo J Y, Yuan C R, Zhao Z Y, et al. Soil washing by biodegradable GLDA and PASP: Effects on metals removal efficiency, distribution, leachability, bioaccessibility, environmental risk and soil properties[J]. Process Safety and Environmental Protection, 2022, 158: 172-180 DOI:10.1016/j.psep.2021.12.004 (  0) 0) |
| [23] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000
(  0) 0) |
| [24] |
Begum Z A, Rahman I M M, Sawai H, et al. Effect of extraction variables on the biodegradable chelant-assisted removal of toxic metals from artificially contaminated European reference soils[J]. Water, Air, & Soil Pollution, 2013, 224(3): 1381 (  0) 0) |
| [25] |
Kim E J, Yoo J C, Baek K. Arsenic speciation and bioaccessibility in arsenic-contaminated soils: Sequential extraction and mineralogical investigation[J]. Environmental Pollution, 2014, 186: 29-35 (  0) 0) |
| [26] |
Shi J Y, Pang J L, Liu Q L, et al. Simultaneous removal of multiple heavy metals from soil by washing with citric acid and ferric chloride[J]. RSC Advances, 2020, 10(13): 7432-7442 (  0) 0) |
| [27] |
Zhang Z, Guo G L, Wang M, et al. Enhanced stabilization of Pb, Zn, and Cd in contaminated soils using oxalic acid-activated phosphate rocks[J]. Environmental Science and Pollution Research International, 2018, 25(3): 2861-2868 (  0) 0) |
| [28] |
Neilson J W, Artiola J F, Maier R M. Characterization of lead removal from contaminated soils by nontoxic soil-washing agents[J]. Journal of Environmental Quality, 2003, 32(3): 899-908 (  0) 0) |
| [29] |
Thinh N V, Osanai Y, Adachi T, et al. Removal of lead and other toxic metals in heavily contaminated soil using biodegradable chelators: GLDA, citric acid and ascorbic acid[J]. Chemosphere, 2021, 263: 127912 (  0) 0) |
| [30] |
Ritchie V J, Ilgen A G, Mueller S H, et al. Mobility and chemical fate of antimony and arsenic in historic mining environments of the Kantishna Hills district, Denali National Park and Preserve, Alaska[J]. Chemical Geology, 2013, 335: 172-188 (  0) 0) |
| [31] |
Kappen P, Webb J. An EXAFS study of arsenic bonding on amorphous aluminium hydroxide[J]. Applied Geochemistry, 2013, 31: 79-83 (  0) 0) |
| [32] |
Oustan S, Heidari S, Neyshabouri M R, et al. Removal of heavy metals from a contaminated calcareous soil using oxalic and acetic acids as chelating agents[J]. Environment Science and Engineering, 2011, 8: 152-155 (  0) 0) |
| [33] |
Wang G Y, Zhang S R, Xu X X, et al. Heavy metal removal by GLDA washing: Optimization, redistribution, recycling, and changes in soil fertility[J]. The Science of the Total Environment, 2016, 569/570: 557-568 (  0) 0) |
2. Key Laboratory of Soil and Sustainable Agriculture, Chinese Academy of Sciences, Nanjing 211135, China
 2024, Vol. 56
2024, Vol. 56


