随着工业化和城市化进程的加快,我国农田土壤重金属污染日益严重,尤其是Cd、As污染,这严重影响了粮食安全和人类健康[1-2]。根据2014年《全国土壤污染状况调查公报》[3],我国农业污染土壤中Cd、As两种污染物点位超标率分别为7.0%和2.7%。土壤Cd、As污染不仅破坏农田生态系统,还会随食物链危害人类健康。Cd和As已被国际癌症机构认定为对人类具有致癌性[4]。Cd可造成大脑、肾脏和骨骼等重要器官受到严重损害[5],而As则会导致人体患上心血管疾病、神经系统疾病[6]。目前,我国有60%的人口以大米为主食[7],而水稻是Cd、As进入人体的主要途径之一[8]。因此,对Cd、As污染土壤的修复至关重要,特别是针对水稻土,这对保障粮食安全和促进农业发展具有重要意义。
微生物诱导碳酸盐沉淀(Microbially induced carbonate precipitation, MICP)被广泛认为是一种新兴的环境重金属污染生物修复技术[9-10]。MICP过程通过产脲酶细菌必要的代谢活动进行。在MICP过程中,尿素被产脲酶细菌分泌的脲酶水解成NH4+和CO32–,释放的CO32–可以结合环境中的Ca2+,并以CaCO3的形式沉淀[11]。在生成CaCO3沉淀的过程中,重金属离子以类质同象置换或共结晶的方式,进一步转化为重金属沉淀物或重金属共沉淀[12],从而固定重金属。
近年来,MICP技术已被成功应用于Cd、As、Pb和Zn等多种重金属修复[9, 13-14]。前人研究表明,巴氏八叠球菌和蜡样芽孢杆菌对重金属具有良好的固定效果[15-16]。但在自然条件下,土壤中的重金属在一定程度上会抑制菌株生长,导致菌株难以高效地产生脲酶,从而影响重金属的修复效率。然而,可通过添加外源物质的方式,为产脲酶细菌补充必要的物质,从而促进其生长,促进MICP过程,提高修复效果。当前关于利用MICP技术修复重金属的研究大多关注于通过微生物自身修复方面,修复效率低,忽视了添加外源物质提高修复效率的可能性。有研究表明,Ca2+添加可以缓解重金属对微生物的毒性,进而强化MICP过程[17]。由此可见,Ca2+在MICP过程中起着重要作用。氯化钙(CaCl2)具有易溶于水、廉价易
得等特点,是MICP技术的首选钙源。目前,已有较多研究将CaCl2作为钙源应用于水溶液试验条件下,诱导微生物形成碳酸钙沉淀,并证实了CaCl2能有效促进MICP过程,从而提高对重金属的固定效果[14, 18]。但MICP技术中以CaCl2为钙源,在农田土壤中探究重金属固定效果的研究还较少。对于农田土壤重金属污染,不仅要关注重金属的固定效果,还需对土壤肥力以及生态功能进行评估,这对后续生产极为重要[19]。此外,大部分基于MICP技术修复重金属污染土壤的研究多针对于一种重金属,对于复合污染土壤的研究相对较少。因此,进一步探究外源Ca2+对MICP技术修复Cd-As复合污染农田土壤的效果及其对土壤生态功能的影响,对农田生产及食品安全具有重要意义。
基于此,本研究以Cd-As复合污染水稻土为研究对象,分别添加巴氏八叠球菌和蜡样芽孢杆菌,对比分析CaCl2添加对两种产脲酶细菌固定土壤中Cd、As效果的影响,同时探讨对土壤性质、土壤酶活性和微生物多样性的影响,以期为更有效地修复土壤重金属Cd-As复合污染提供理论依据和参考。
1 材料与方法 1.1 供试材料本研究采用的产脲酶细菌为巴氏八叠球菌(Octococcus pasteurii)和蜡样芽孢杆菌(Bacillus cereus),均为非致病菌。将巴氏八叠球菌和蜡样芽孢杆菌的菌液分别在YE-NH4培养基(酵母提取物20 g/L、硫酸铵10 g/L、Tris 15.75 g/L、尿素0.025 g/mL)、LB培养基(肽10 g/L、酵母提取物5 g/L、氯化钠10 g/L)中进行恒温培养,随后以6 000 r/min离心5 min,获得菌体细胞,用无菌水冲洗2 ~ 3次,使菌体悬浮于无菌水,获得菌悬液。采用OD600测得细胞浓度分别为3×109、0.3×109 cfu/mL,用于后续试验。所有培养基使用前均进行121℃高压灭菌20 min。
供试土壤采自于四川省绵竹市某农田(31°41′86″ N,104°25′42″ E)0 ~ 20 cm表层,为Cd-As复合污染土壤,土壤类型为水稻土,其基本性质见表 1。
|
|
表 1 供试土壤基本性质 Table 1 Properties of tested soil |
设置4个处理组:BCK(添加巴氏八叠球菌10%,V/m)、BCa(添加巴氏八叠球菌10%,V/m)和CaCl2 0.00125%,m/m)、LCK(添加蜡样芽孢杆菌10%,V/m)、LCa(添加蜡样芽孢杆菌10%,V/m)和CaCl2 0.00125%,m/m)[17]。每个处理重复3次。试验中,称取土壤100 g,加入尿素0.694 mg,按照处理组设置,添加菌悬液10 mL或CaCl2 1.25 mg,搅拌均匀后加入蒸馏水,保持水土质量比为1∶5。将所有土壤样品放入25 ℃的培养箱恒温培养,期间采用重量法补充流失水分。培养20 d后,采集样品。土壤样品进行风干,研磨,过2 mm尼龙筛,装袋备用。
1.3 样品测定采用CaCl2浸提法测定有效态Cd、As含量[20];采用BCR顺序提取法对Cd和As的不同形态进行提取,土壤中的Cd和As形态分为可交换态、可还原态、可氧化态和残渣态4种形态[21]。采用电感耦合等离子体质谱仪(ICP-MS, NexION300X, PerkinElmer, USA)测定提取液中的重金属[22]。
土壤理化性质参照《土壤农化分析》[23]进行测定。采用外加热–重铬酸钾氧化法测定土壤有机质含量(OM);采用六胺三氯化钴萃取分光光度法测定土壤阳离子交换量(CEC);采用凯氏定氮蒸馏法测定碱解氮含量(AN);采用NaHCO3浸提–钼锑抗比色法测定土壤有效磷含量(AP);采用乙酸铵浸提–火焰光度法测定速效钾含量(AK)。
采用苯酚钠–次氯酸钠比色法测定脲酶活性[24];采用3.5-二硝基水杨酸比色法测定蔗糖酶活性[25];采用磷酸苯二钠比色法测定磷酸酶活性[26]。
通过高通量测序技术对土壤微生物群落进行分析[27]。土壤样品DNA提取采用PowerSoil试剂盒。使用引物27F(5'-AGTTTGATCMTGGCTAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')进行16S rRNA基因扩增。扩增产物送往北京青科生物技术有限公司(成都)测序。测序完成,统计各样本的群落组成。
1.4 数据处理采用Excel 2021及SPSS 26.0软件对数据进行处理及统计分析,并采用单因素方差分析(one-way ANOVA)及Duncan法多重比较进行处理间差异性检验,显著性水平为P < 0.05。使用Origin 2022软件进行绘图。
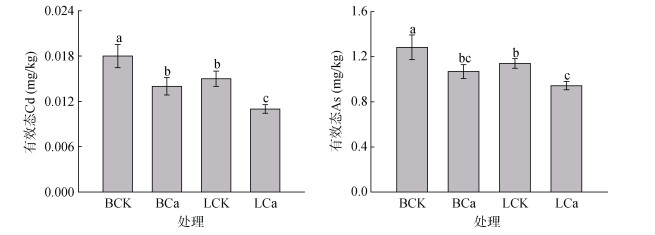
2 结果与分析 2.1 不同处理对土壤中Cd、As有效性及其形态的影响不同处理下土壤中Cd、As有效性的变化如图 1所示。整体上,与BCK处理相比,所有处理均能显著降低Cd、As的有效性(P < 0.05)。与BCK处理相比,BCa处理的有效态Cd、As含量分别降低了22.2%、16.8%(P < 0.05);与LCK处理相比,LCa处理的有效态Cd、As含量分别降低了17.3%、26.7%(P < 0.05);与BCK处理相比,LCK处理的有效态Cd、As含量分别降低了16.7%、11.1%(P < 0.05)。
|
(图中不同小写字母表示处理间差异在P < 0.05水平上显著;下同) 图 1 不同处理下土壤有效态Cd和As的含量 Fig. 1 Available Cd and As concentrations in soils under different treatments |
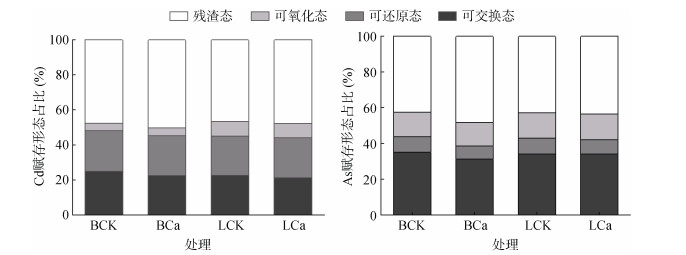
不同处理下Cd、As在土壤中的赋存形态如图 2所示。整体上,土壤中Cd、As的残渣态占比均最大。
|
图 2 不同处理下土壤Cd、As的赋存形态 Fig. 2 Fractions of Cd and As in soils under different treatments |
与BCK处理相比,BCa处理下土壤可交换态Cd、As含量分别降低4.50%、3.51%,残渣态Cd、As含量分别增加11.67%、14.9%;与LCK处理相比,LCa处理下土壤可交换态Cd、As含量分别降低6.57%、0.17%,残渣态Cd、As含量分别增加1.77%、0.37%。与BCK处理相比,LCK处理下可交换态Cd含量降低了2.84%,而残渣态Cd含量增加了5.34%。
2.2 不同处理对土壤理化性质的影响不同处理下土壤理化性质如表 2所示。与LCK处理相比,LCa处理显著提高了土壤pH。与BCK处理相比,BCa处理下土壤碱解氮含量提高了25.5% (P < 0.05),有效磷含量降低了21.2%(P < 0.05)。与LCK处理相比,LCa处理下土壤速效钾含量提高了34.1%(P < 0.05);与BCK相比,LCK处理下土壤速效钾含量提高了49.8%(P < 0.05)。不同处理下土壤有机质含量、阳离子交换量无明显差异(P > 0.05)。
|
|
表 2 不同处理对土壤理化性质的影响 Table 2 Effects of different treatments on soil properties |
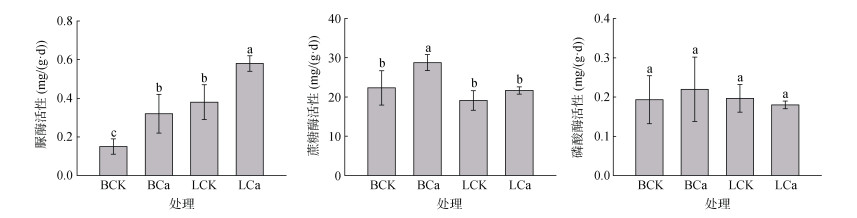
不同处理下土壤脲酶、蔗糖酶、磷酸酶活性变化如图 3所示。与BCK处理相比,BCa、LCK处理下土壤脲酶活性分别提高了113.3%、153.3%(P < 0.05),且LCa处理下的脲酶活性最高,与LCK处理相比,LCa处理的脲酶活性提高了52.6%(P < 0.05)。与BCK处理相比,BCa处理可显著提高土壤蔗糖酶活性,提高了28.9%(P < 0.05)。土壤磷酸酶活性在不同处理下无显著性差异(P > 0.05)。
|
图 3 不同处理下土壤酶活性差异 Fig. 3 Soil enzyme activities under different treatments |
采用操作分类单元(OTU)水平方法计算不同处理的微生物群落多样性,结果如表 3所示。与BCK处理相比,BCa处理的Chao1指数显著上升;且LCa处理下土壤微生物Chao1、Faith_pd指数显著高于LCK处理;与BCK、BCa处理相比,LCK、LCa处理下Chao1、Faith_pd均显著增加。其中,LCa处理下土壤微生物多样性及丰度指数均最高。
|
|
表 3 不同处理对微生物多样性及丰度的影响 Table 3 Effects of different treatments on microbial diversities and richness |
在MICP过程中,产脲酶细菌代谢产生脲酶,促进尿素水解产生NH4+、OH–和CO32–,产生的CO32–可以与Ca2+反应形成CaCO3沉淀[28]。在这个过程中重金属离子以同晶置换或共结晶的方式与CaCO3结合,从而被固定在沉淀中,降低其有效性[8, 12]。而CaCO3沉淀的形成受底物Ca2+含量的影响,进而影响土壤重金属的修复效果。本研究以不添加Ca2+作为对照,通过外源添加Ca2+,比较巴氏八叠球菌和蜡样芽孢杆菌两种产脲酶细菌对土壤Cd、As的固定效果,结果表明,在引入Ca2+后,两种菌株处理下土壤有效态Cd和As含量均显著降低,Ca2+的添加可显著提升Cd、As的固定效率。王晖等[29]研究表明,添加20 mmol/L的Ca2+后,芽孢杆菌对Cd2+的去除率上升,本研究结果与其一致。外源Ca2+的添加显著影响MICP技术固定Cd、As的效率,这可能是因为:一方面Ca2+的添加增强了细菌对重金属胁迫的耐受性,提高细菌的活性,促进脲酶产生,促进MICP过程,从而提高对Cd、As的固定效果[30]。与不添加Ca2+相比,添加Ca2+后,巴氏八叠球菌、蜡样芽孢杆菌处理的脲酶活性分别提高了113.3%、46.9%(图 3)。另一方面,在MICP过程中,产生的CaCO3具有较为致密的空隙结构,可为Cd、As的固定提供位点。而Ca2+添加可以为CaCO3产生提供充足的底物,使得更多的具有特殊网状晶格体的CaCO3晶体生成,为Cd、As的固定提供更多结合位点,从而提升Cd、As的固定效率[31-32]。另外,与巴氏八叠球菌对Cd、As的固定效果相比,蜡样芽孢杆菌对Cd、As的修复更具优势。综上,Ca2+的添加能促进MICP过程,提高脲酶活性,同时促进更多碳酸盐生成,从而提高产脲酶细菌对土壤中Cd、As的固定效率。
重金属的不同赋存形态决定其在土壤中的迁移能力,其中可交换态的活性较大,在土壤中的迁移性更强,而残渣态属于难溶态,迁移能力较弱[15]。4种处理下,土壤中大部分Cd和As均以残渣态的形态存在。添加Ca2+后,土壤有效态Cd、As含量显著降低,残渣态Cd、As含量显著升高,表明Cd、As的形态由活跃的有效态向稳定的残渣态转化,从而降低其在土壤中的迁移能力,这主要与土壤脲酶的活性显著提高有关。添加Ca2+后,提高了产脲酶细菌的活性,增加了CaCO3沉淀,从而提高了Cd、As固定率。此外,重金属Cd、As还可与CaCO3形成共沉淀[33],降低其在土壤中的有效性。因此,添加Ca2+可有效促进重金属的固定过程,将更多活性较高的可交换态Cd、As转变为稳定的残渣态Cd、As,且蜡样芽孢杆菌较巴氏八叠球菌对Cd、As的固定效果更佳。
3.2 不同处理对土壤性质的影响在农田土壤重金属污染修复过程中,土壤理化性质变化对农田土壤的后续生产尤为重要。因此,关注土壤性质的变化是农田土壤重金属修复效果的重要内容。Ca2+添加后,土壤pH上升了0.23 ~ 0.88个单位,其中LCa处理下土壤pH最高,这可能是因为Ca2+添加后,促进了MICP过程,刺激了尿素的分解和CO32–的产生,从而提高土壤pH[34]。pH提高的过程中,可为土壤形成局部碱性环境,为CaCO3的结晶提供成核位点,从而利于金属及CaCO3沉淀或其复合物形成。因此,与BCK处理相比,BCa处理下有效态Cd及As的含量均显著降低(图 1)。与BCK处理相比,BCa处理下土壤碱解氮含量显著提高,这可能是巴氏八叠球菌在Ca2+刺激下可更有利于促进尿素降解分解,其反应过程为:(NH2)2CO + H2O → 2NH3 + CO2;2NH3 + 2H2O → 2NH4+ + 2OH−[12]。然而,与LCa处理相比,BCa处理下碱解氮含量更高,这可能是因为LCa处理下蜡样芽孢杆菌进行MICP过程时,会消耗更多的氮素。在Ca2+刺激下,蜡样芽孢杆菌处理下MICP过程更加强烈可证明此观点。与BCK处理相比,LCK处理的速效钾含量显著增加,表明与巴氏八叠球菌相比,蜡样芽孢杆菌更有利于提高土壤钾素。与LCK处理相比,LCa处理下土壤速效钾含量显著提高,表明蜡样芽孢杆菌处理下Ca2+的介入有利于其对土壤钾素的矿化作用。此外,与BCK处理相比,BCa处理下土壤有效磷含量降低了21.2%,这可能是因为在巴氏八叠球菌处理下Ca2+的添加导致磷素与钙结合生成沉淀所致,这也可能是巴氏八叠球菌处理下重金属固定效果不如蜡样芽孢杆菌的原因之一。综上,对比菌株添加和不加Ca2+的处理结果,可以得出,补充外源Ca2+后,能够促进MICP过程,提高土壤碱解氮、速效钾含量,这在一定程度上能起到改善土壤肥力的效果。
3.3 不同处理对土壤酶活性的影响土壤酶在农田土壤及生态系统中发挥着重要作用[35]。脲酶是MICP过程中的关键酶[34],重金属的去除率与脲酶活性水平有关[36]。本研究中,巴氏八叠球菌和蜡样芽孢杆菌均能产生脲酶,且蜡样芽孢杆菌处理下脲酶活性更高。在两种菌株处理下,添加Ca2+后产生的脲酶活性均得到提高,再次表明Ca2+可促进MICP过程。Fang等[17]利用巴氏孢子球菌固定Cd2+,发现添加Ca2+后,脲酶活性增加了约3倍,与本研究结果一致。此外,蔗糖酶活性在Ca2+添加后也有所增加,这可能是Ca2+的添加为微生物提供了营养物质和能量,促进了微生物的生长代谢,从而提高了蔗糖酶活性。此外,Ca2+添加能缓解重金属对微生物的胁迫,良好的生存环境可以刺激微生物活动,促进蔗糖酶的分泌[17]。综上,外源Ca2+添加不仅能促进脲酶活性提高,还可以提高土壤蔗糖酶活性,有效改善土壤生态功能。
3.4 不同处理对土壤微生物多样性的影响土壤微生物对环境条件的变化极其敏感,对环境变化能迅速做出响应。土壤微生物的丰度和多样性一定程度上可以反映土壤质量。对于农田土壤,土壤质量的提升可以为提高农田生产提供重要的保障。因此,关注修复后土壤微生物的丰度及多样性,对农田土壤的修复评价更为重要。在本研究中,不同处理下土壤微生物多样性差异显著。与巴氏八叠球菌处理相比,蜡样芽孢杆菌处理下微生物的丰度更高,表明蜡样芽孢杆菌在Cd-As复合污染土壤条件下更具有耐受性,利于维护土壤微生态。添加Ca2+后,Chao1和Faith_pd指数均显著上升,表明土壤微生物的多样性增加,这可能是因为添加Ca2+后有效降低了重金属的有效性,抑制了重金属对微生物的胁迫。此外,Ca2+的添加可以缓解微生物对重金属的生物吸附和生物积累,从而降低细菌在重金属胁迫下的伤害[37],促进微生物的生长[17, 38]。综上所述,外源Ca2+的添加,不仅能促进MICP过程降低土壤重金属Cd、As的有效性,还能有效缓解重金属对微生物的胁迫,提高微生物的丰度及多样性,维持土壤生态功能。
4 结论1) 在MICP技术固定重金属过程中,蜡样芽孢杆菌相比于巴氏八叠球菌产脲酶的活性更强,对土壤中Cd、As的固定效果更佳。
2) Ca2+的添加可有效促进重金属的固定过程,促进可交换态Cd、As转变为残渣态Cd、As,有效降低土壤中Cd、As的有效性。
3) Ca2+的添加能提高土壤脲酶和蔗糖酶活性,增加土壤碱解氮、有效磷的含量,有效改善土壤养分。
4) Ca2+的添加可缓解重金属对土壤微生物的胁迫,提高土壤微生物多样性,维持土壤生态功能。
| [1] |
Yuan X H, Xue N D, Han Z G. A meta-analysis of heavy metals pollution in farmland and urban soils in China over the past 20 years[J]. Journal of Environmental Sciences (China), 2021, 101: 217-226 DOI:10.1016/j.jes.2020.08.013 (  0) 0) |
| [2] |
Qin G W, Niu Z D, Yu J D, et al. Soil heavy metal pollution and food safety in China: Effects, sources and removing technology[J]. Chemosphere, 2021, 267: 129205 DOI:10.1016/j.chemosphere.2020.129205 (  0) 0) |
| [3] |
彭瑜, 王海娟, 王宏镔. 农田土壤砷、镉协同钝化修复的研究进展[J]. 土壤, 2021, 53(4): 692-699 (  0) 0) |
| [4] |
Giordano D, Blandino M. Arsenic, lead and cadmium distribution in the pearled fractions of different winter wheat cultivars (Triticum aestivum L.)[J]. Journal of Cereal Science, 2018, 80: 94-101 DOI:10.1016/j.jcs.2018.02.002 (  0) 0) |
| [5] |
Wu J Z, Li Z T, Huang D, et al. A novel calcium-based magnetic biochar is effective in stabilization of arsenic and cadmium co-contamination in aerobic soils[J]. Journal of Hazardous Materials, 2020, 387: 122010 DOI:10.1016/j.jhazmat.2019.122010 (  0) 0) |
| [6] |
Kumar S, Choudhary A K, Suyal D C, et al. Leveraging arsenic resistant plant growth-promoting rhizobacteria for arsenic abatement in crops[J]. Journal of Hazardous Materials, 2022, 425: 127965 DOI:10.1016/j.jhazmat.2021.127965 (  0) 0) |
| [7] |
胡贤巧, 张卫星, 邵雅芳, 等. 我国近20年稻米品质优质率状况分析[J]. 中国稻米, 2021, 27(4): 84-87 (  0) 0) |
| [8] |
Chen X Y, Achal V. Biostimulation of carbonate precipitation process in soil for copper immobilization[J]. Journal of Hazardous Materials, 2019, 368: 705-713 DOI:10.1016/j.jhazmat.2019.01.108 (  0) 0) |
| [9] |
Peng D H, Qiao S Y, Luo Y, et al. Performance of microbial induced carbonate precipitation for immobilizing Cd in water and soil[J]. Journal of Hazardous Materials, 2020, 400: 123116 DOI:10.1016/j.jhazmat.2020.123116 (  0) 0) |
| [10] |
王新花, 赵晨曦, 潘响亮. 基于微生物诱导碳酸钙沉淀(MICP)的铅污染生物修复[J]. 地球与环境, 2015, 43(1): 80-85 (  0) 0) |
| [11] |
Song H W, Kumar A, Zhang Y L. Microbial-induced carbonate precipitation prevents Cd2+ migration through the soil profile[J]. The Science of the Total Environment, 2022, 844: 157167 DOI:10.1016/j.scitotenv.2022.157167 (  0) 0) |
| [12] |
Liu P, Zhang Y, Tang Q, et al. Bioremediation of metal-contaminated soils by microbially-induced carbonate precipitation and its effects on ecotoxicity and long-term stability[J]. Biochemical Engineering Journal, 2021, 166: 107856 DOI:10.1016/j.bej.2020.107856 (  0) 0) |
| [13] |
Lyu C H, Qin Y J, Chen T, et al. Microbial induced carbonate precipitation contributes to the fates of Cd and Se in Cd-contaminated seleniferous soils[J]. Journal of Hazardous Materials, 2022, 423(Pt A): 126977 (  0) 0) |
| [14] |
Song M Z, Ju T Y, Meng Y, et al. A review on the applications of microbially induced calcium carbonate precipitation in solid waste treatment and soil remediation[J]. Chemosphere, 2022, 290: 133229 DOI:10.1016/j.chemosphere.2021.133229 (  0) 0) |
| [15] |
Ma H, Wei M Y, Wang Z R, et al. Bioremediation of cadmium polluted soil using a novel cadmium immobilizing plant growth promotion strain Bacillus sp. TZ5 loaded on biochar[J]. Journal of Hazardous Materials, 2020, 388: 122065 DOI:10.1016/j.jhazmat.2020.122065 (  0) 0) |
| [16] |
李倩, 张平, 廖柏寒, 等. 一株耐Cd菌株的分离、鉴定及基本特性[J]. 微生物学报, 2019, 59(1): 11-24 (  0) 0) |
| [17] |
Fang L Y, Niu Q J, Cheng L, et al. Ca-mediated alleviation of Cd2+ induced toxicity and improved Cd2+ biomineralization by Sporosarcina pasteurii[J]. Science of the Total Environment, 2021, 787: 147627 DOI:10.1016/j.scitotenv.2021.147627 (  0) 0) |
| [18] |
Achal V, Pan X L. Influence of calcium sources on microbially induced calcium carbonate precipitation by Bacillus sp. CR2[J]. Applied Biochemistry and Biotechnology, 2014, 173(1): 307-317 DOI:10.1007/s12010-014-0842-1 (  0) 0) |
| [19] |
刘娟, 张乃明, 于泓, 等. 重金属污染对水稻土微生物及酶活性影响研究进展[J]. 土壤, 2021, 53(6): 1152-1159 (  0) 0) |
| [20] |
Pueyo M, López-Sánchez J F, Rauret G. Assessment of CaCl2, NaNO3 and NH4NO3 extraction procedures for the study of Cd, Cu, Pb and Zn extractability in contaminated soils[J]. Analytica Chimica Acta, 2004, 504(2): 217-226 DOI:10.1016/j.aca.2003.10.047 (  0) 0) |
| [21] |
Ghorbanzadeh N, Abduolrahimi S, Forghani A, et al. Bioremediation of cadmium in a sandy and a clay soil by microbially induced calcium carbonate precipitation after one week incubation[J]. Arid Land Research and Management, 2020, 34(3): 319-335 DOI:10.1080/15324982.2020.1720866 (  0) 0) |
| [22] |
Li X D, Ma H, Li L L, et al. Subcellular distribution, chemical forms and physiological responses involved in cadmium tolerance and detoxification in Agrocybe Aegerita[J]. Ecotoxicology and Environmental Safety, 2019, 171: 66-74 DOI:10.1016/j.ecoenv.2018.12.063 (  0) 0) |
| [23] |
鲍士旦. 土壤农化分析(3版)[M].
中国农业出版社, 北京, 2000
(  0) 0) |
| [24] |
Achal V, Pan X L. Characterization of urease and carbonic anhydrase producing bacteria and their role in calcite precipitation[J]. Current Microbiology, 2011, 62(3): 894-902 DOI:10.1007/s00284-010-9801-4 (  0) 0) |
| [25] |
姚志鹏, 李兆君, 梁永超, 等. 土壤酶活性对土壤中土霉素的动态响应[J]. 植物营养与肥料学报, 2009, 15(3): 696-700 (  0) 0) |
| [26] |
Yu P J, Tang X G, Zhang A C, et al. Responses of soil specific enzyme activities to short-term land use conversions in a salt-affected region, northeastern China[J]. The Science of the Total Environment, 2019, 687: 939-945 DOI:10.1016/j.scitotenv.2019.06.171 (  0) 0) |
| [27] |
Konstantinou C, Wang Y Z, Biscontin G, et al. The role of bacterial urease activity on the uniformity of carbonate precipitation profiles of bio-treated coarse sand specimens[J]. Scientific Reports, 2021, 11(1): 6161 (  0) 0) |
| [28] |
叶文玲, 周于杰, 晏士玮, 等. 微生物成矿技术在环境砷污染治理中的应用研究进展[J]. 土壤学报, 2021, 58(4): 862-875 (  0) 0) |
| [29] |
王晖, 王敏, 汤鼎, 等. Ca2+添加对微生物矿化固结Cd2+的影响[J]. 环境化学, 2021, 40(3): 859-867 (  0) 0) |
| [30] |
Yi H H, Zheng T W, Jia Z R, et al. Study on the influencing factors and mechanism of calcium carbonate precipitation induced by urease bacteria[J]. Journal of Crystal Growth, 2021, 564: 126113 (  0) 0) |
| [31] |
龚伟, 王伯初. 钙离子在植物抵抗非生物胁迫中的作用[J]. 生命的化学, 2011, 31(1): 107-111 (  0) 0) |
| [32] |
李成杰, 魏桃员, 季斌, 等. 不同钙源及Ca2+浓度对MICP的影响[J]. 环境科学与技术, 2018, 41(3): 30-34 (  0) 0) |
| [33] |
Xu X C, Guo H X, Li M, et al. Bio-cementation improvement via CaCO3 cementation pattern and crystal polymorph: A review[J]. Construction and Building Materials, 2021, 297: 123478 (  0) 0) |
| [34] |
Kang C H, Shin Y, Anbu P, et al. Biosequestration of copper by bacteria isolated from an abandoned mine by using microbially induced calcite precipitation[J]. The Journal of General and Applied Microbiology, 2016, 62(4): 206-212 (  0) 0) |
| [35] |
谭向平, 何金红, 郭志明, 等. 土壤酶对重金属污染的响应及指示研究进展[J]. 土壤学报, 2023, 60(1): 50-62 (  0) 0) |
| [36] |
Bhattacharya A, Naik S N, Khare S K. Harnessing the bio-mineralization ability of urease producing Serratia marcescens and Enterobacter cloacae EMB19 for remediation of heavy metal cadmium (II)[J]. Journal of Environmental Management, 2018, 215: 143-152 (  0) 0) |
| [37] |
Zhao Y, Yao J, Yuan Z M, et al. Bioremediation of Cd by strain GZ-22 isolated from mine soil based on biosorption and microbially induced carbonate precipitation[J]. Environmental Science and Pollution Research International, 2017, 24(1): 372-380 (  0) 0) |
| [38] |
Carafoli E, Krebs J. Why calcium? how calcium became the best communicator[J]. The Journal of Biological Chemistry, 2016, 291(40): 20849-20857 (  0) 0) |
 2024, Vol. 56
2024, Vol. 56


