生物质炭由生物质在高温无氧条件下热解而成,由于其原始生物质来源广泛、成本低,且生物质炭自身具有较大孔隙率、比表面积和丰富的官能团等特性,已被广泛用于农业和水土修复[1],包括去除废水中的污染物、碳封存和土壤修复[2]。然而生物质炭在土壤环境应用过程中,会通过风化和老化导致基体断裂和孔隙崩解形成纳米生物质炭[3-4],纳米生物质炭也因其潜在的环境风险受到了越来越多的关注。
纳米生物质炭在水生环境中具有较高的胶体稳定性和流动性,可以通过降雨、排水、灌溉、径流、渗透进入湖泊、海洋等地表水中,并垂直输送至深层土壤甚至地下水中。Leifeld等[5]的研究发现生物质炭在田间的迁移距离最深可达140 cm。此外,纳米生物质炭对有机无机污染物、重金属和病原微生物等环境污染物表现出较高的吸附亲和性,很有可能通过“胶体促进”污染物向地下水系统迁移或共迁移[6]。因此,全面了解纳米生物质炭在环境中的归趋与滞留行为,对于优化生物质炭的利用、评估其在农业和环境修复应用中的潜在风险具有重要意义。
纳米生物质炭的迁移受到自身特性和环境因素的影响。目前一些研究揭示了生物质炭颗粒在饱和多孔介质中的迁移行为,如杨雯等[7]研究发现不同热解温度和生物质材料制备的生物质炭其Zeta电位差异较大,较低热解温度制备的微米级生物质炭具更大的Zeta电位,与多孔介质之间具有更大的排斥势垒,从而在饱和多孔介质中的迁移能力更强。Cao等[8]研究发现腐殖酸会通过其表面负电荷和空间位阻效应增强球磨生物质炭的迁移率。但是目前对于生物质炭的研究主要集中于微米级生物质炭,纳米级生物质炭的迁移规律及机制还需要进一步开展系统研究。由于地域、气候的不同,实际土壤溶液的含盐量和酸碱度会存在差异,降雨、灌溉也会导致土壤孔隙水流速差异[9],这些环境因素都会对生物质炭纳米颗粒的迁移和归趋产生影响。
因此,本研究采取球磨法制备纳米生物质炭,通过饱和石英砂柱试验研究不同背景溶液离子强度(1、10、50 mmol/L)、pH(4、7、10),以及流速(0.5、1、2 mL/min)条件下,球磨纳米生物质炭在饱和多孔介质中的迁移和滞留规律,并且利用两点动力学吸附模型拟合球磨纳米生物质炭的穿透与滞留曲线,结合DLVO理论,阐明球磨纳米生物质炭在饱和多孔介质中的迁移和滞留机制。
1 材料与方法 1.1 球磨纳米生物质炭的制备本研究选用花生壳生物质炭,其热解温度为500℃。采用球磨法制备纳米生物质炭[10],研磨生物质炭使用3、5、8 mm的玛瑙球,其质量比为70∶20∶10。将制备好的花生壳生物质炭与球粉按20∶1的质量比放入行星式球磨机(QM-3SP4,南京南大仪器有限公司)中研磨6 h,在球磨过程中仪器每运行30 min休息10 min,以防止球磨过程中温度过高导致纳米生物质炭的团聚。
1.2 球磨纳米生物质炭的表征球磨纳米生物质炭溶液浓度使用紫外分光光度计(UV-3150,日本岛津)在435 nm波长处测定[11]:准确称量0.2 mg烘干后的纳米生物质炭配制200 mg/L的标准分散液,建立标准曲线。使用扫描电子显微镜(德国ZEISS Sigma 300)对生物质炭进行形貌表征。使用全自动比表面面积分析仪(Micromeritics APSP 460,美国)对样品进行氮气吸脱附测试,待仪器分析完毕得到等温吸脱附曲线,通过BET法得到生物质炭的总比表面积。利用透射电子显微镜(TEM,JEOL JEM-F200,日本)对生物质炭的粒径和形貌进行表征。生物质炭的C、H和N含量使用元素分析仪(Vario ELIII Elementar,Germany)测试[12]。不同背景溶液IS、pH条件下的球磨纳米生物质炭的水力学直径和Zeta电位使用纳米粒度电位仪(ZetaSizer Nano-ZS analyzer, Malvern Instrument Inc., UK)测试。
1.3 多孔介质的处理及表征选用的石英砂(26 ~ 40目,购自铭海环保科技有限公司)用自来水揉搓冲洗若干次至石英砂上清液清澈,以去除可溶性物质及石英砂表面粉末;再将其依次浸泡在500 mmol/L的NaOH、HCl溶液中24 h,然后用超纯水洗至上清液为中性,以去除石英砂中含有的一些杂质离子;最后将洗净的石英砂放入烘箱于105 ℃烘干。烘干后的石英砂放入密封袋中备用[13]。测试不同背景溶液IS、pH条件下石英砂Zeta电位时[14],先使用研钵研磨石英砂过200目筛,然后取一定量的石英砂粉末分散在不同试验条件的NaCl背景溶液中,于数控超声机中超声15 min后使用纳米粒度仪测定。
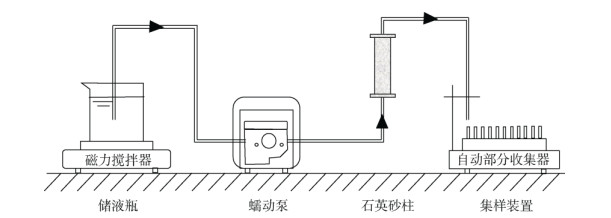
1.4 柱迁移试验采用湿法填装石英砂至内径为1.6 cm、高为10 cm的有机玻璃柱中。装填过程中记录使用的超纯水体积和石英砂质量,以计算所装填砂柱的孔隙体积(PV)。迁移试验过程中使用恒流蠕动泵(BT100-2J,保定融柏恒流泵制造有限公司)控制入流液流速,水流方向自下而上(图 1)。迁移试验以NaCl作为背景溶液,具体条件如表 1所示。首先持续通入10 PV背景溶液(不含球磨纳米生物炭)使石英砂柱达到稳定饱和流状态,然后注入1 mmol/L Br–(NaBr)的非反应性离子作为保守示踪剂,通过Hydrus-1D拟合Br–的穿透曲线,得到石英砂柱的对流–弥散系数D[15]。示踪剂迁移试验结束后,通入5 PV 200 mg/L球磨纳米生物质炭悬浮液,最后通入10 PV背景溶液淋洗柱子,具体背景溶液的条件设置见表 1。在此期间,球磨纳米生物质炭悬浮液需一直使用磁力搅拌器(雷磁JB-1A,上海仪电科学仪器股份有限公司)进行搅拌以防止其团聚。自开始通入球磨纳米生物质炭悬浮液起,使用自动部分收集器(BSZ-100,上海嘉鹏科技有限公司)采集出流液。出流液中的球磨纳米生物质炭浓度使用紫外分光光度计于435 nm波长处测定。所有试验均在室温(25℃)下进行,3次重复。
|
图 1 柱迁移试验装置示意图 Fig. 1 Schematic diagram of column transport experimental setup |
|
|
表 1 柱试验中球磨纳米生物质炭的试验条件及两点动力学吸附模型拟合参数 Table 1 Experimental conditions and fitted parameters of two-site kinetic retention models of ball-milled nano-biochars in column test |
迁移试验结束后,测定球磨纳米生物质炭滞留在石英砂柱中的浓度,并结合相应的穿透曲线进行质量平衡计算。该过程中,先将石英砂柱纵向等分为10份,分装在10个离心管中并加入10 mL超纯水,然后水浴超声30 min解吸吸附在石英砂上的纳米生物质炭,最后悬浮液中球磨纳米生物质炭的浓度使用紫外分光光度计在波长435 nm处测定,计算每克石英砂上滞留的球磨纳米生物质炭量并绘制滞留曲线。
1.5 模型模拟 1.5.1 对流弥散方程本研究采用一维形式的对流弥散方程[16-17],考虑了两种类型位点的动力学保留,模拟球磨纳米生物质炭的迁移与滞留,并采用Hydrus-1D软件计算了纳米生物质炭在石英砂柱中的运移参数。
| $ \frac{{\partial \theta C}}{{\partial t}} + {\rho _{\text{b}}}\frac{{\partial \left( {{S_1}} \right)}}{{\partial t}} + {\rho _{\text{b}}}\frac{{\partial \left( {{S_2}} \right)}}{{\partial t}} = \frac{\partial }{{\partial x}}\left( {\theta D\frac{{\partial C}}{{\partial x}}} \right) - \frac{{\partial qC}}{{\partial x}} $ | (1) |
式中:θ为体积含水量;C是溶液中纳米生物质炭的浓度(mg/L);ρb是石英砂的容重(kg/m3);x是水流方向上的距离(cm);D是水动力弥散系数(cm2/min);q是达西流速(cm/min);S1、S2为滞留固相位点的浓度(mg/g)。
| $ {\rho _{\text{b}}}\frac{{\partial \left( {{S_1}} \right)}}{{\partial t}} = \theta {k_{{\text{att}}}}{\psi _{{\text{att}}}}C - \rho {k_{{\text{det}}}}S $ | (2) |
| $\boldsymbol \psi=\frac{\boldsymbol S_{\mathbf{max} }-\boldsymbol S}{\boldsymbol S_{\mathbf{max}}}=1-\frac{\boldsymbol S}{\boldsymbol S_{\mathbf{max} }} $ | (3) |
式中:
| $ {\rho _{\text{b}}}\frac{{\partial \left( {{S_2}} \right)}}{{\partial t}} = \theta {k_{{\text{str}}}}{\psi _{{\text{str}}}}C $ | (4) |
| $ \psi = {\left( {\frac{{{d_{\text{c}}} + x}}{{{d_{\text{c}}}}}} \right)^{ - \beta }} $ | (5) |
式中:
应用DLVO理论计算溶液中纳米生物质炭和石英砂之间的相互作用力,即范德华吸引力和静电层排斥力[18-19]:
| $ {\varPhi _{{\text{DLVO}}}} = {\varPhi _{{\text{LW}}}} + {\varPhi _{{\text{EDL}}}} $ | (6) |
| $ {\varPhi _{{\text{LW}}}} = - \frac{{Ar}}{{{\text{6}}h\left( {1 + \frac{{14h}}{\lambda }} \right)}} $ | (7) |
| $ {\varPhi _{{\text{EDL}}}} = \pi {\varepsilon _0}{\varepsilon _{\text{r}}}r\left\{ {2{\xi _1}{\xi _2}{\text{ln}}\left[ {\frac{{{\text{1 + exp}}\left( { - kh} \right)}}{{{\text{1}} - {\text{exp}}\left( { - kh} \right)}}} \right] + \left( {\xi _1^2 + \xi _2^2} \right){\text{ln}}\left[ {{\text{1 + exp}}\left( { - {\text{2}}kh} \right)} \right]} \right\} $ | (8) |
| $ k = \sqrt {\frac{{2{N_{\text{A}}}{e^2}I}}{{{\varepsilon _0}{\varepsilon _{\text{r}}}{K_{\text{B}}}T}}} $ | (9) |
式中:A为Hamaker常数(4.42×10–21J);r为生物质炭纳米颗粒的水力学直径(nm);h为生物质炭纳米颗粒和石英砂表面的平均距离(nm);
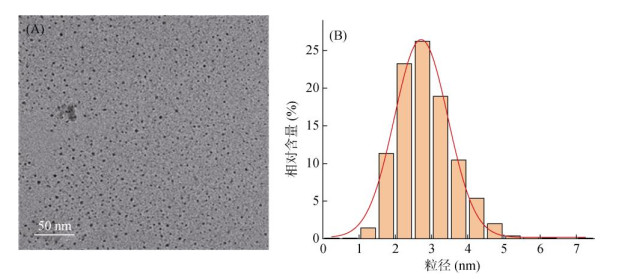
球磨纳米生物质炭的物理化学性质见表 2。球磨纳米生物质炭的C、H、N含量分别为66.56%、2.27%、1.15%,且具有较大的比表面积257.68 m2/g。球磨纳米生物质炭的TEM图和粒径分布图(图 2)表明,球磨纳米生物质炭基本呈圆球状,平均粒径在3 nm左右。球磨纳米生物质炭和石英砂在不同背景溶液IS、pH条件下的Zeta电位以及球磨纳米生物质炭的水力直径结果见表 3。在本试验所设置背景溶液中,球磨纳米生物质炭的水力直径范围为301 ~ 460 nm,较TEM粒径大两个数量级,表明球磨纳米生物质炭在背景溶液中发生了团聚;球磨纳米生物质炭和石英砂的表面均带负电,且其Zeta电位绝对值随背景溶液IS的增加和pH的降低而下降。当背景溶液IS从1 mmol/L增加到50 mmol/L时,球磨纳米生物炭Zeta电位从–33.0 mV降低到–20.8 mV(本文涉及Zeta电位增大或减小的表述均指其绝对值的变化),此时纳米颗粒表面双电层因为离子强度的增加被压缩,从而使其Zeta电位降低[20];当背景溶液pH从10减小到4时,Zeta电位从–36.3 mV降低到–28.7 mV,这主要是酸性环境引起颗粒表面H+含量的增加,导致球磨纳米生物质炭的电负性降低[21-22]。此外,球磨纳米生物质炭与石英砂之间的最大势垒随着背景溶液IS的增大和pH的减小而降低,这更利于球磨纳米生物质炭克服最大势能吸附在石英砂表面,因此球磨纳米生物质炭的迁移可能会因为背景溶液IS的增大和pH减小而受到阻碍。
|
|
表 2 球磨纳米生物质炭的物理化学性质 Table 2 Physicochemical properties of ball-milled nano-biochars |
|
图 2 球磨纳米生物质炭的TEM(A)和粒径分布图(B) Fig. 2 TEM image (A) and particle size distribution (B) of ball-milled nano-biochar |
|
|
表 3 不同背景溶液下球磨纳米生物质炭和石英砂的Zeta电位及DLVO势能 Table 3 Zeta potentials of ball-milled nano-biochars and quartz sands and DLVO parameters under different background solutions |
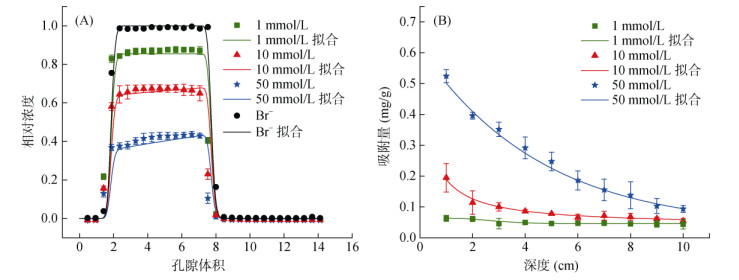
球磨纳米生物质炭在不同背景溶液IS下的穿透与滞留曲线如图 3所示。与保守示踪剂Br–的迁移相比,球磨纳米生物质炭的迁移受到了石英砂的阻滞。随着背景溶液IS由1 mmol/L逐渐增加到10、50 mmol/L,球磨纳米生物质炭的迁移率有显著的降低。球磨纳米生物质炭的最大出流浓度/入流浓度(相对浓度)由1 mmol/L时的0.88降至50 mmol/L时的0.43;出流液中的球磨纳米生物质炭的质量回收率由1 mmol/L时的88.3 % 降至50 mmol/L时的41.53 % (表 1)。这一结果可以用DLVO相互作用理论解释,随着背景溶液IS的增加,球磨纳米生物质炭与石英砂颗粒间的表面扩散双电层被压缩,二者的的Zeta电位绝对值减小,球磨纳米生物质炭和石英砂之间的静电斥力减弱[23],这促进了球磨纳米生物质炭在石英砂表面的沉积,从而导致球磨纳米生物质炭的迁移受到阻滞。如表 3中所示,计算的最大势垒(Φmax)在1 mmol/L时高达587.376 KBT,但在50 mmol/L时降低到了257.433 KBT。相反,次级势阱(Φmin2)从1 mmol/L处的–0.0231 KBT下降到50 mmol/L处的–2.855 KBT,这可能促进了次级势阱处球磨纳米生物质炭的沉积。此外,在高IS下,球磨纳米生物质炭更容易发生团聚形成大的团聚体,背景溶液IS 1 mmol/L时球磨纳米生物质炭的水力直径为325.7 nm,当IS增加到50 mmol/L时水力直径增大到460.2 nm,因此在迁移过程中更容易滞留在石英砂柱中。两点动力学吸附模型较好地拟合了生物质炭的穿透曲线和滞留曲线(表 1)。模型拟合的K1a随着背景溶液IS从1 mmol/L增加到50 mmol/L时,由0.001 2 min–1增大到0.058 8 min–1,而K1d逐渐减小,这表明随着IS的增加,吸附过程变得越来越快,而分离过程逐渐减慢。同时,Smax1也随着提供更多的吸附位点而增加,由IS 1 mmol/L时的0.077 3 mg/g增大到IS 50 mmol/L时的0.498 9 mg/g。因此,降雨或灌溉引起的IS下降有利于球磨纳米生物质炭的迁移,并可能对地下环境构成潜在风险[24]。
|
图 3 不同IS条件下球磨纳米生物质炭的穿透曲线(A)和滞留曲线(B) Fig. 3 Observed and fitted breakthrough curves(A)and retention profiles(B)for ball-milled nano-biochars at varying IS conditions |
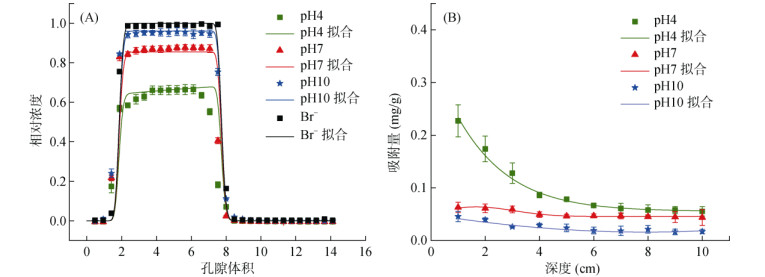
球磨纳米生物质炭在不同背景溶液pH下的的穿透曲线和拟合曲线(图 4)表明,球磨纳米生物质炭的迁移率随pH的增加而增加。球磨纳米生物质炭的最大相对浓度由pH 4时的0.66增加到pH 10时的0.95;出流液中的球磨纳米生物质炭的质量回收率由pH 4时的63.89% 增加到pH 10时的99.69%(表 1)。当pH从4增加到10时,球磨纳米生物质炭的Zeta电位从–28.7 mV增大到–36.3 mV,电负性增加不仅使球磨纳米生物质炭颗粒间的静电斥力增强,颗粒不易发生团聚;同时增强了石英砂与球磨纳米生物质炭之间的静电斥力,减少球磨纳米生物质炭的沉积,有利于其在石英砂柱中的迁移。这是因为pH的变化引起生物质炭胶体表面电荷数量的改变(质子解离),羧基和羟基的质子化降低了球磨纳米生物质炭的稳定性,质子化的含氧官能团在球磨纳米生物质炭的迁移过程中起着重要作用[25]。根据DLVO势能计算(表 3),当pH从4增至10时,球磨纳米生物质炭与石英砂之间的最大势垒由431.979 KBT增加到685.969 KBT;而次级势阱变化不大,绝对值均小于1.5 KBT,次级势阱处会出现弱沉积。这表明球磨纳米生物质炭在酸性条件下更容易附着在砂体上,而在碱性条件下,球磨纳米生物质炭的双电层与砂体之间存在较强的排斥作用。模型拟合中的Smax1值也表现出相同的趋势(表 1),酸性条件下的Smax1为0.232 2 mg/g,而碱性条件下为0.041 2 mg/g,这说明pH变化引起的吸附位点的变化会影响球磨纳米生物质炭在石英砂多孔介质中的迁移。在大多数情况下,高pH对纳米颗粒运输的促进作用非常普遍[26]。
|
图 4 不同pH条件下球磨纳米生物质炭的穿透曲线(A)和滞留曲线(B) Fig. 4 Observed and fitted breakthrough curves(A)and retention profiles(B)for ball-milled nano-biochars at varying pH conditions |
球磨纳米生物质炭在背景溶液不同流速下的的穿透曲线和拟合曲线(图 5)表明,高流速下的水动力条件使球磨纳米生物质炭具有更强的可迁移性,但不同流速下球磨纳米生物质炭的迁移趋势相似。球磨纳米生物质炭的最大相对浓度由流速0.5 mL/min时的0.75增至流速2 mL/min时的0.88;出流液中的球磨纳米生物质炭的质量回收率由流速0.5 mL/min时的72.64% 增至流速2 mL/min时的88.31%(表 1);拟合结果显示,流速0.5、1、2 mL/min对应的Smax1值分别为0.139 1、0.083 4、0.077 2 mg/g。这表明随着流速增加,穿透曲线峰值升高,沉积在石英砂表面的颗粒减少,球磨纳米生物质炭的迁移能力增强。流速对球磨纳米生物质炭迁移的影响主要包括两个方面:一方面,高流速下的平流降低了球磨纳米生物质炭与颗粒介质之间的接触碰撞效率,从而增强了球磨纳米生物质炭的流动性[27-28],减少了球磨纳米生物质炭在石英砂柱中的停留时间,使其在石英砂介质表面吸附和滞留的可能性降低;另一方面,流速增加会增强水流的剪切作用力,得以平衡来自重力、分子间范德华力和电荷斥力之间的影响,使得球磨纳米生物质炭更不利于吸附在介质表面,也会使得部分已经吸附但是会受剪切力而剥落的球磨纳米生物质炭脱落从而重新回到液相条件中[29]。
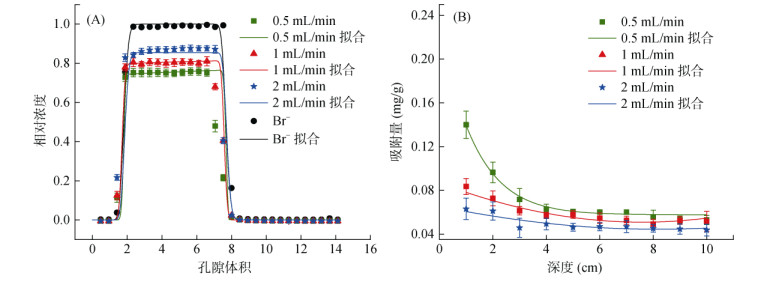
|
图 5 不同流速条件下球磨纳米生物质炭的穿透曲线(A)和滞留曲线(B) Fig. 5 Observed and fitted breakthrough curves and retention profiles for ball-milled nano-biochars at varying flow velocity conditions |
根据不同背景溶液IS、pH及流速条件下球磨纳米生物质炭的滞留曲线(图 3 ~ 图 5)可以看出,球磨纳米生物质炭在石英砂柱中的滞留量均随着柱深的增加呈现超指数形式递减的趋势,并且在石英砂柱入口处(0 ~ 2 cm)的滞留量较大,随着溶液离子强度、流速的增加及pH的减小这一趋势更加明显。例如,当背景电解质溶液为50 mmol/L NaCl时,入口处生物质炭的滞留量占总滞留量的37.1%;而当背景电解质溶液为1 mmol/L NaCl时,这一数值仅为24.5%。纳米颗粒在多孔介质中滞留机制主要有堵塞效应、次级势阱效应(Φmin2 < 0,此时胶体会滞留在次级势阱区域)、表面粗糙度、颗粒物团聚效应和颗粒物表面电荷异质性[30-31]。一般情况下,当胶体颗粒物与多孔介质的直径比大于0.002时,堵塞效应会在纳米颗粒迁移过程中发生作用[17]。本试验条件下,球磨纳米生物质炭的水力学直径与石英砂介质的直径比在0.000 71 ~ 0.001 1 (表 3),均小于临界值0.002,说明堵塞效应对球磨纳米生物质炭在石英砂柱中的滞留没有发生作用。根据DLVO理论计算,所用的试验条件均存在次级势阱效应,说明球磨纳米生物质炭在石英砂中的迁移过程中部分滞留在次级势阱处。例如,当背景溶液NaCl的浓度从1 mmol/L增加到50 mmol/L时,次级势阱从–0.023 1 KBT负增加至–2.855 4 KBT (表 3),因此球磨纳米生物质炭在高IS下更容易在次级势阱处发生滞留。此外,球磨纳米生物质炭的表面电荷异质性也会引起生物质炭的滞留。例如,当背景电解质溶液pH从4增加到10时,生物质炭的Zeta电位由–28.7 mV增加至–36.3 mV,而石英砂的Zeta电位由–46.6 mV增加至–55.3 mV,两者电负性增加,双电层排斥势能升高,有利于球磨纳米生物质炭的迁移。球磨纳米生物质炭在迁移过程中发生团聚作用,大的颗粒团聚体由于多孔介质选择效应[32-34],更容易滞留在石英砂柱入口处,使滞留曲线呈现超指数形式。上述滞留机制并非是单独作用于球磨纳米生物质炭,它们之间会相互耦合、彼此影响,共同控制球磨纳米生物质炭在石英砂多孔介质中的迁移与滞留。
3 结论1) 背景溶液的IS显著影响球磨纳米生物质炭的迁移,溶液IS的增大导致颗粒表面双电层压缩,从而增强球磨纳米生物质炭与石英砂表面负电荷的屏蔽效应,致使二者之间的排斥势垒及球磨纳米生物质炭的稳定性下降,最终导致球磨纳米生物质炭在石英砂表面沉积,迁移能力减弱。
2) 背景溶液的pH对球磨纳米生物质炭在多孔介质中的迁移影响较大,当溶液pH减小时,由于质子化作用石英砂和球磨纳米生物质炭表面的电负性减弱,Zeta电位绝对值随之减小,颗粒间的表面斥力减弱,从而降低球磨纳米生物质炭的迁移率。
3) 入流液的流速对球磨纳米生物质炭的迁移会产生较大影响,在较大的流速条件下,球磨纳米生物质炭在石英砂柱中的滞留时间因平流扩散影响而减少,同时水流剪切作用的增强更是促进球磨纳米生物质炭迁移的主要原因。
4) 本研究运用DLVO理论与两点动力学吸附模型解释了球磨纳米生物质炭在饱和石英砂柱中的迁移与滞留行为及作用机制。球磨纳米生物质炭与石英砂之间的最大势垒促进球磨纳米生物质炭的迁移,而次级势阱、团聚效应、颗粒物表面电荷异质性带来的沉降是球磨纳米生物质炭滞留的主要原因。
| [1] |
王一锟, 梁婷, 周国朋, 等. 不同生物质炭的镉吸附特征及对云南土壤镉污染的调控效应[J]. 土壤学报, 2024, 61(1): 151-162 (  0) 0) |
| [2] |
Chen H B, Gao Y R, Li J H, et al. Engineered biochar for environmental decontamination in aquatic and soil systems: A review[J]. Carbon Research, 2022, 1(1): 4 DOI:10.1007/s44246-022-00005-5 (  0) 0) |
| [3] |
李晓娜, 宋洋, 贾明云, 等. 生物质炭对有机污染物的吸附及机理研究进展[J]. 土壤学报, 2017, 54(6): 1313-1325 (  0) 0) |
| [4] |
张朴, 李仁英, 吴洪生, 等. 水稻秸秆生物质炭对土壤磷吸附影响的研究[J]. 土壤, 2018, 50(2): 264-269 (  0) 0) |
| [5] |
Leifeld J, Fenner S, Müller M. Mobility of black carbon in drained peatland soils[J]. Biogeosciences, 2007, 4(3): 425-432 DOI:10.5194/bg-4-425-2007 (  0) 0) |
| [6] |
Chen M, Wang D J, Yang F, et al. Transport and retention of biochar nanoparticles in a paddy soil under environmentally-relevant solution chemistry conditions[J]. Environmental Pollution, 2017, 230: 540-549 DOI:10.1016/j.envpol.2017.06.101 (  0) 0) |
| [7] |
杨雯, 郝丹丹, 徐东昊, 等. 生物炭颗粒在饱和多孔介质中的迁移与滞留[J]. 土壤通报, 2017, 48(2): 304-312 (  0) 0) |
| [8] |
Cao G, Qiao J C, Ai J H, et al. Systematic research on the transport of ball-milled biochar in saturated porous media: Effect of humic acid, ionic strength, and cation types[J]. Nanomaterials, 2022, 12(6): 988 DOI:10.3390/nano12060988 (  0) 0) |
| [9] |
Behnam H, Firouzi A F. Effects of synthesis method, feedstock type, and pyrolysis temperature on physicochemical properties of biochar nanoparticles[J]. Biomass Conversion and Biorefinery, 2023, 13(15): 13859-13869 DOI:10.1007/s13399-021-02108-2 (  0) 0) |
| [10] |
Naghdi M, Taheran M, Brar S K, et al. A green method for production of nanobiochar by ball milling- optimization and characterization[J]. Journal of Cleaner Production, 2017, 164: 1394-1405 DOI:10.1016/j.jclepro.2017.07.084 (  0) 0) |
| [11] |
Cao X W, Meng Z F, Song E, et al. Co-adsorption capabilities and mechanisms of bentonite enhanced sludge biochar for de-risking norfloxacin and Cu2+ contaminated water[J]. Chemosphere, 2022, 299: 134414 DOI:10.1016/j.chemosphere.2022.134414 (  0) 0) |
| [12] |
沈连舟, 蔡月, 孙昭玥, 等. 纳米铁–生物质炭复合材料对苋菜吸收累积菲的影响[J]. 土壤, 2023, 55(4): 848-859 (  0) 0) |
| [13] |
Liu Y M, Sun H M, Sun J X, et al. Transport of micro/nano biochar in quartz sand modified by three different clay minerals[J]. Environmental Pollutants and Bioavailability, 2021, 33(1): 113-121 DOI:10.1080/26395940.2021.1932605 (  0) 0) |
| [14] |
Loveland J P, Bhattacharjee S, Ryan J N, et al. Colloid transport in a geochemically heterogeneous porous medium: Aquifer tank experiment and modeling[J]. Journal of Contaminant Hydrology, 2003, 65(3/4): 161-182 (  0) 0) |
| [15] |
Kasel D, Bradford S A, Šimůnek J, et al. Transport and retention of multi-walled carbon nanotubes in saturated porous media: Effects of input concentration and grain size[J]. Water Research, 2013, 47(2): 933-944 DOI:10.1016/j.watres.2012.11.019 (  0) 0) |
| [16] |
Schijven J F, Simůnek J. Kinetic modeling of virus transport at the field scale[J]. Journal of Contaminant Hydrology, 2002, 55(1/2): 113-135 (  0) 0) |
| [17] |
Bradford S A, Simunek J, Bettahar M, et al. Modeling colloid attachment, straining, and exclusion in saturated porous media[J]. Environmental Science & Technology, 2003, 37(10): 2242-2250 (  0) 0) |
| [18] |
Gregory J. Approximate expressions for retarded van der waals interaction[J]. Journal of Colloid and Interface Science, 1981, 83(1): 138-145 DOI:10.1016/0021-9797(81)90018-7 (  0) 0) |
| [19] |
Hogg R, Healy T W, Fuerstenau D W. Mutual coagulation of colloidal dispersions[J]. Transactions of the Faraday Society, 1966, 62: 1638-1651 DOI:10.1039/tf9666201638 (  0) 0) |
| [20] |
Rawat S, Pullagurala V L R, Adisa I O, et al. Factors affecting fate and transport of engineered nanomaterials in terrestrial environments[J]. Current Opinion in Environmental Science & Health, 2018, 6: 47-53 (  0) 0) |
| [21] |
Stumpp C, Lawrence J R, Hendry M J, et al. Transport and bacterial interactions of three bacterial strains in saturated column experiments[J]. Environmental Science & Technology, 2011, 45(6): 2116-2123 (  0) 0) |
| [22] |
Shi L, Zhang G, Wei D, et al. Preparation and utilization of anaerobic granular sludge-based biochar for the adsorption of methylene blue from aqueous solutions[J]. Journal of Molecular Liquids, 2014, 198: 334-340 (  0) 0) |
| [23] |
杨志东, 罗冉, 徐红霞, 等. 人工纳米颗粒在饱和石英砂介质中的运移行为[J]. 南京大学学报(自然科学), 2021, 57(3): 409-416 (  0) 0) |
| [24] |
Jiang Y J, Yu L, Sun H M, et al. Transport of natural soil nanoparticles in saturated porous media: Effects of pH and ionic strength[J]. Chemical Speciation & Bioavailability, 2017, 29(1): 186-196 (  0) 0) |
| [25] |
Ma P K, Chen W. Sulfide reduction can significantly enhance transport of biochar fine particles in saturated porous medium[J]. Environmental Pollution, 2020, 263(Pt B): 114445 (  0) 0) |
| [26] |
Wang M, Gao B, Tang D S. Review of key factors controlling engineered nanoparticle transport in porous media[J]. Journal of Hazardous Materials, 2016, 318: 233-246 (  0) 0) |
| [27] |
Jiang Y J, Guan D, Liu Y M, et al. The transport of graphitic carbon nitride in saturated porous media: Effect of hydrodynamic and solution chemistry[J]. Chemosphere, 2020, 248: 125973 (  0) 0) |
| [28] |
殷宪强, 孙慧敏, 易磊, 等. 孔隙水流速对胶体在饱和多孔介质中运移的影响[J]. 水土保持学报, 2010, 24(5): 101-104 (  0) 0) |
| [29] |
Xie B Y, Jiang Y J, Zhang Z, et al. Co-transport of Pb (II) and Cd (II) in saturated porous media: Effects of colloids, flow rate and grain size[J]. Chemical Speciation & Bioavailability, 2018, 30(1): 135-143 (  0) 0) |
| [30] |
Chatterjee J, Abdulkareem S, Gupta S K. Estimation of colloidal deposition from heterogeneous populations[J]. Water Research, 2010, 44(11): 3365-3374 (  0) 0) |
| [31] |
Tufenkji N, Miller G F, Ryan J N, et al. Transport of Cryptosporidium oocysts in porous media: Role of straining and physicochemical filtration[J]. Environmental Science & Technology, 2004, 38(22): 5932-5938 (  0) 0) |
| [32] |
Kretzschmar R, Sticher H, Hesterberg D. Effects of adsorbed humic acid on surface charge and flocculation of kaolinite[J]. Soil Science Society of America Journal, 1997, 61(1): 101-108 (  0) 0) |
| [33] |
Wang D J, Jin Y, Jaisi D P. Effect of size-selective retention on the cotransport of hydroxyapatite and goethite nanoparticles in saturated porous media[J]. Environmental Science & Technology, 2015, 49(14): 8461-8470 (  0) 0) |
| [34] |
Wang D J, Bradford S A, Harvey R W, et al. Humic acid facilitates the transport of ARS-labeled hydroxyapatite nanoparticles in iron oxyhydroxide-coated sand[J]. Environmental Science & Technology, 2012, 46(5): 2738-2745 (  0) 0) |
 2024, Vol. 56
2024, Vol. 56

