工业革命以来,过量化肥投入和化石燃料燃烧导致大气氮沉降量持续增加,氮的输入对生态系统功能可产生重要影响[1-3]。在氮限制地区或者低水平氮输入地区氮可以促进植物生产,增加生态系统净初级生产力,提高生态系统碳汇功能[4-5]。而在氮饱和地区或者过量氮输入地区氮会导致植物多样性丧失、土壤酸化及阳离子流失,以及土壤微生物数量及多样性改变,且氮富集条件下植被、土壤和微生物变化及相互作用可对生态系统碳循环产生重要影响[6-8]。
土壤可溶性有机碳(DOC)和微生物生物量碳(MBC)作为土壤中活性有机碳组分,由于活跃的化学性质和简单的分子组成,极易被微生物利用从而快速循环[9-10]。土壤DOC主要来源于植物凋落物的浸出和土壤易溶性小分子有机化合物[11-12]。微生物是调节土壤碳生物化学循环的重要参与者,在分解土壤有机碳的同时,也会自身同化合成MBC,MBC是衡量土壤微生物活性和土壤养分状况的重要指标之一[13-15]。虽然DOC和MBC在土壤碳库中占比相对较少,但对于驱动微生物代谢活动和养分周转具有极为重要的作用。
氮富集对土壤碳循环产生显著影响。有研究表明,施氮对土壤DOC存在正面或负面影响[16-19]。DOC对氮添加的不同响应可归因于两方面原因:一是氮肥种类对土壤pH的不同影响,如硝酸铵和尿素的添加通过降低土壤pH增加矿物对DOC的固持能力,而硝酸钠由于增加土壤pH,pH升高可能导致大量羟基基团与土壤中铁铝氧化物共价连接从而降低对DOC的吸附[20-21];二是DOC对氮添加的响应与植物碳输入变化有关,如氮添加改变植物地上和地下生产力从而影响DOC的浸出数量[22]。因此,DOC不仅与微生物代谢过程有关,同时还与植物碳输入和矿物学吸附稳定过程密切相关。而MBC对氮添加响应也存在争议。有研究表明,氮添加导致土壤无机氮富集会减少土壤MBC含量[23]。但有Meta分析结果显示,氮富集显著增加了土壤MBC含量[24]。这些矛盾的结果被解释为与试验地点的氮限制程度有关,在氮限制地区,氮添加能够缓解微生物氮限制,促进微生物生长和养分利用,而在氮富集地区,持续氮添加会通过改变植被和土壤化学性质(如pH下降)抑制微生物活性[25-26]。综合目前研究结果,尽管土壤DOC和MBC对氮添加响应过程已有大量研究,但由于不同研究中生态系统、气候和研究方法的差异导致结果存在很大的不确定性,这限制了未来氮富集背景下土壤有机碳预测的精准性。
利用Meta分析可以整合当前相关研究数据,有利于揭示实际生态过程。尽管已经有学者利用Meta分析探究氮添加对DOC和MBC的影响[27-28],但是由于数据收集范围较小、数据量较少和指标不全面,且纳入过多农田生态系统数据,未能系统揭示氮输入条件下DOC和MBC变化的潜在过程。因此,为了揭示氮添加对土壤DOC和MBC的实际影响过程和途径,本研究通过收集全球范围内草地和森林生态系统相关文献,运用Meta分析量化土壤DOC和MBC对氮输入的响应,并结合植物、土壤和微生物相关数据揭示氮输入对土壤DOC和MBC影响的潜在机制。本研究试图解决以下两个问题:①土壤DOC和MBC对氮输入如何响应?②氮输入背景下驱动土壤DOC和MBC变化的潜在机制?
1 材料与方法 1.1 数据收集为了探究全球尺度土壤DOC和MBC对氮输入的响应,于2022年3月5日,利用Web of Science和中国知网检索了1990年1月至今发表的相关文献。检索词如下:(氮沉降或氮输入或氮富集或氮添加)和(土壤可溶性有机碳或微生物量碳)和(森林或草地)。为了增加数据代表性和可对比性,对收集的文献按照以下标准进行筛选:①观测结果需来源于森林或草地生态系统的野外原位控制试验;②每项研究应至少包括一组(氮添加和无添加)处理来对比氮输入效应,如果在同一研究中包括了不同水平氮素添加,则不同氮添加水平的观测结果被视为独立的;③氮素处理中不包括其他试验处理(如增温、增水和磷钾肥料添加);④对照组和处理组的平均值、样本量和标准差/标准误差可直接从文章内容或图表中获取。
通过以上筛选,本研究共纳入了符合标准的86项研究,1 910对观测数据(图 1)。所有原始数据均来自文献中表格、图形及附录,文中图形数字通过Getdada软件获取。在每个已发表的研究中,提取土壤碳相关变量的平均值、样本量和标准误/标准偏差。此外,本研究还收集了每个研究地点的气候因子(年均温和年降水量)和氮添加试验条件(氮添加水平、试验年限、施氮类型以及氮累计添加量),并将氮添加试验条件作为分类变量来进行Meta分析。分类标准如下,氮添加水平分为低氮(< 50 kg/(hm2·a))、中氮(50 ~ 100 kg/(hm2·a))、高氮(> 100 kg/(hm2·a)),试验年限分为 < 5、5 ~ 10、> 10 a, 施氮类型分为尿素、硝酸铵和其他氮肥(硝酸钠、氯化铵等)。为了探究自然条件下土壤DOC和MBC对氮输入的响应,本研究将植被类型主要分为草原和森林两种生态系统类型,而农田则由于人为干扰因素(耕作、轮作以及肥料混合施用等)过多被排除。
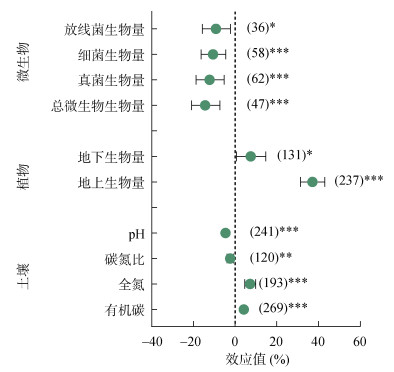
|
(图中|——|表示95% 的置信区间,括号内数值样本,*、**、***分别表示在P < 0.05、P < 0.01、P < 0.001水平影响显著;图 2同) 图 1 氮输入对土壤化学性质、植物生物量和微生物生物量的影响 |
本研究使用自然对数转换响应比(LRR)量化土壤DOC和MBC对氮输入的响应大小[29],公式如下:
| $ LRR=ln(X_{t}/X_{c}) (1) $ | (1) |
式中:Xt是处理组平均值;Xc是对照组平均值。
案例内方差计算公式如下:
| $ v = \frac{{S_t^2}}{{{n_t}\bar X_t^2}} + \frac{{S_c^2}}{{{n_c}\bar X_c^2}} $ | (2) |
式中:nt和nc分别为处理组和对照组的样本量;St和Sc分别为处理和对照组标准偏差。如果文中报道的为标准误,则通过以下公式来计算标准偏差:
| $ {\text{SD}} = \sqrt n \times {\text{SE}} $ | (3) |
式中:n为重复;SD为标准偏差;SE为标准误。
根据方差赋予每个研究案例单独的权重,可以使得结果更准确,并增强统计效力。单个研究的权重计算公式如下:
| $ {w_i} = \frac{1}{{{v_i} + {\tau ^2}}} $ | (4) |
式中:wi为单个研究的权重;vi为研究案例内方差;τ2为研究案例间方差。
加权响应比(LRR++)计算公式如下:
| $ {\text{LR}}{{\text{R}}_{ + + }} = \frac{{\sum\limits_{i = 1}^k {{W_i}{\text{LRR}}} }}{{\sum\limits_{i = 1}^k {{W_i}} }} $ | (5) |
式中:wi为单个研究的权重;LRR为单个研究的自然对数响应比。
LRR的总体标准误和95% 置信区间(CI)计算公式如下:
| $ S{\text{(LR}}{{\text{R}}_{ + + }}{\text{)}} = \sqrt {\frac{1}{{\sum\limits_{i = 1}^k {{w_i}} }}} $ | (6) |
| $ 95 \% \mathrm{CI}=\mathrm{LRR}_{++} \pm 1.96 S\left(\mathrm{LRR}_{++}\right) $ | (7) |
式中:S(LRR++)为总体标准误,wi为单个研究的权重;k为研究案例的个数。
此外,为了方便解释土壤DOC和MBC对氮输入的响应,将效应值大小转换为百分比(%),公式如下:
| $ \text { 效应值 }(\%)=\left(\mathrm{e}^{\mathrm{LRR}}-1\right) \times 100 \% $ | (8) |
本研究使用R软件“metafor”包中的“escalc”函数计算每个案例的效应值大小;应用方差加权混合模型,以95%CI来评估效应值是否显著(LRR++),如果95%CI不包含零,则表示效应值显著;使用随机效应模型计算每个变量的累计效应值;使用R软件“metafor”包中的“rma. mv”函数分析分类解释变量(生态系统类型、氮添加水平、氮素类型和试验年限)对效应值的影响;使用随机森林算法探究影响土壤DOC和MBC的重要环境因子。
2 结果与分析 2.1 氮输入对土壤、植物和微生物因子的影响从累计效应值来看(图 1),氮添加显著影响土壤化学性质、植物生物量及土壤微生物生物量。对于土壤化学性质,氮输入显著提高土壤有机碳(4.15%,P < 0.01)和全氮含量(7.18%,P < 0.01),显著降低土壤碳氮比(2.37%,P < 0.01)和pH(4.61%,P < 0.01)。对于植物生物量,氮输入显著提高地上(37.07%,P < 0.01)和地下植物生物量(7.47%,P < 0.05)。对于微生物生物量,氮输入显著降低总微生物(14.36%)、真菌(12.26%)、细菌(10.59%)和放线菌(9.20%)生物量(P < 0.05)。
2.2 生态系统类型和施氮条件对土壤DOC和MBC的影响累计效应值结果显示(图 2),氮输入显著增加土壤DOC含量(7.48%,P < 0.01),显著降低土壤MBC含量(4.03%,P < 0.05)。当划分为不同生态系统时,氮添加显著增加了草地土壤DOC含量(11.93%,P < 0.001),森林土壤DOC含量变化不显著。无论是硝酸铵还是尿素对土壤DOC含量均有显著的促进作用(P < 0.05)。随着施氮年限的增加,土壤DOC含量增幅越大。而对于不同施氮水平,低氮和中氮条件下,土壤DOC含量显著增加(P < 0.05),高氮条件下变化不显著(图 2)。氮添加显著降低了草地土壤MBC含量(6.38%,P < 0.05),森林土壤MBC含量变化不显著。无论是硝酸铵还是尿素均显著降低土壤MBC含量(P < 0.05)。对于施氮年限,短期和中期施氮对土壤MBC含量无显著影响,长期施氮能显著降低土壤MBC含量(P < 0.001)。而对于不同施氮水平,低氮和中氮对土壤MBC含量无显著影响,高氮条件下显著降低(P < 0.001)。
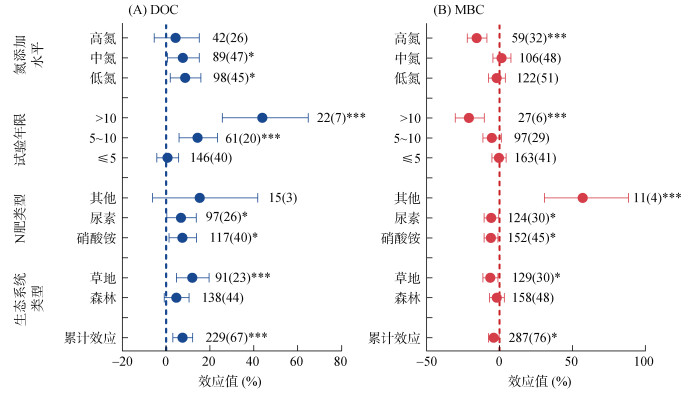
|
图 2 不同生态系统类型和施氮条件下氮输入对土壤DOC(A)和MBC(B)的影响 |
为了体现生态系统氮累积效应对土壤DOC和MBC含量的影响,进一步计算了不同试验地点累积氮输入量,并与土壤DOC和MBC含量进行回归分析(图 3),结果显示,随着累积氮输入量的增加,土壤DOC含量显著增加,而土壤MBC含量显著下降(P < 0.001)。
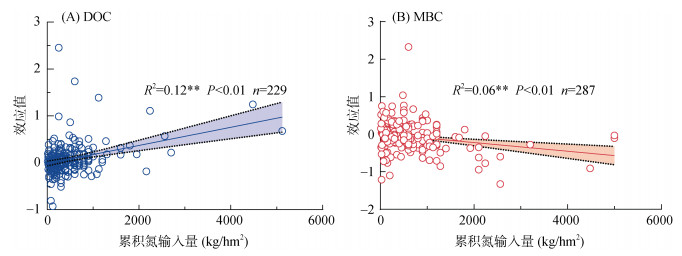
|
(图中线性回归用实线表示,两条虚线间的区域表示95% 置信区间;n代表样本数量;**表示在P < 0.01水平显著相关) 图 3 土壤DOC(A)和MBC(B)含量与累积氮输入量的关系 |
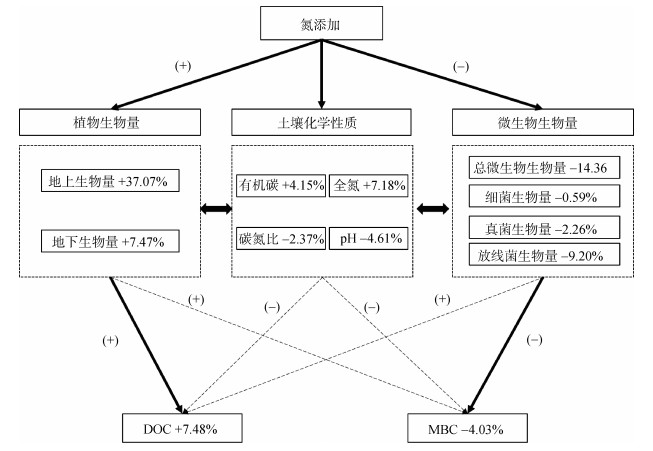
利用随机森林算法确定影响土壤DOC和MBC的主要因子(图 4)。结果表明,氮输入条件下,驱动DOC和MBC变化的主要因子有所差异,地上生物量和pH是影响DOC的重要因子,pH、总微生物生物量和真菌生物量是影响MBC的重要因子。因此,氮添加下DOC增加主要由植物碳输入增加驱动,而MBC的降低则主要与微生物生物量抑制有关(图 5),表现了氮输入对土壤DOC和MBC的不同驱动途径。
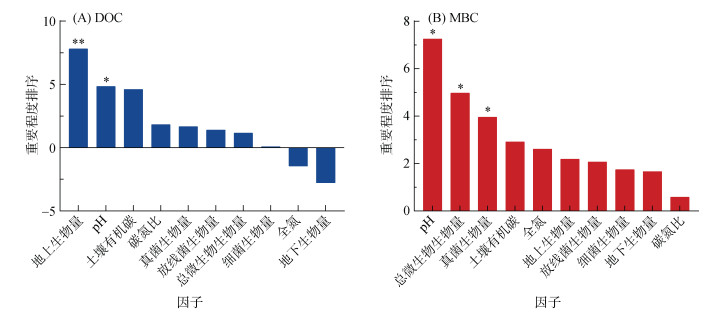
|
(利用随机森林算法计算每个预测变量的MSE(均方根误差),变量MSE增加的百分比(MSE%)被用来表征因子预测的重要性,而较高的MSE% 值意味着更重要的预测因子;*、**分别表示在P < 0.05、P < 0.01水平影响显著) 图 4 影响土壤DOC和MBC效应值的因子重要程度排序 |
|
((+)代表积极影响,(–)代表消极影响;实线代表重要的影响途径,虚线代表实际存在但不重要的影响途径) 图 5 氮添加对土壤DOC和MBC影响概念图 |
本研究通过Meta分析量化土壤DOC含量对氮输入的响应,结果表明,全球范围内,氮添加显著提高土壤DOC含量(图 1)。DOC由于活跃的化学性质,对外界环境变化较为敏感[30]。当前氮添加对土壤DOC含量影响的研究结果存在一定争议(增加或者降低)[16-18],研究认为氮添加对DOC的影响机制主要包括以下3种:①影响DOC的吸附固定过程。有研究显示,氮添加条件下土壤pH下降导致矿物铁铝氧化物表面羟基质子化从而促进对DOC的吸附,降低土壤DOC含量[31]。②影响DOC的输入过程。氮添加增强植物碳输入和凋落物分解,有利于提高土壤中DOC含量[21]。③影响DOC的分解转化。有研究显示,氮添加对微生物的抑制作用,会降低微生物碳代谢功能,从而降低DOC分解,有利于DOC固定和保存[32]。相反,有研究显示,在养分富集条件下,有利于富营养微生物的生存,因此,更倾向于对易分解有机碳氮的利用,抑制对难分解有机物质的分解,从而不利于土壤DOC的固存[33]。本研究通过结合土壤、植物和微生物属性分析,发现氮添加下植物生物量和pH是影响DOC的主要环境因子(图 4),微生物对DOC影响并不显著。氮添加下pH显著降低,植物生物量显著增加(图 1),虽然pH显著降低不利于土壤DOC的淋溶和渗出,但植物碳输入增强促进了土壤DOC含量增加。可见,氮添加下DOC含量的增加主要由植物碳变化驱动。
本研究结果显示,添加尿素和硝酸铵对DOC均表现出积极影响(图 2),因为无论有机氮还是无机氮的投入,均有利于植物生长,而其他类型(包括硝酸钠、氯化铵等)氮肥也表现出对DOC的促进作用,但并不显著,这可能主要受到数据样本量限制。本研究中,不同生态系统土壤DOC对氮添加响应并不一致,氮添加显著提高草地土壤DOC含量,对森林土壤DOC影响不显著(图 2),其原因可能是由于草地和森林生态系统植被对氮输入响应差异导致。据报道,相比森林生态系统,草地生产力受到氮限制更为强烈[1]。因此,草地比森林对氮输入的响应更为灵敏,这也表现在植物生产力对氮输入的响应上。有研究显示,不同生态系统的植物总生物量对氮添加均表现出积极响应,而氮添加对草原生物量的促进作用要明显高于森林[34]。因此,这解释了为什么氮添加下对草地DOC促进作用高于森林。此外,施氮年限和施氮水平同样显著影响土壤DOC对氮输入的响应,本研究结果显示,随着施氮年限增加,土壤DOC含量增幅越大。而施氮水平和施氮年限对DOC的影响规律并不一致,低氮水平下土壤DOC含量显著增加,高氮水平下变化不显著(图 2),这可能与生态系统的承载能力有关。大量研究显示,氮输入对生态系统功能的影响存在阈值效应[35, 1],低氮条件下可以缓解氮限制,从而显著增加植物生产力和微生物活性,而高氮条件下由于酸化效应、养分失衡等问题抑制植物生长和微生物活性[34-37]。因此,长期低氮投入更有利于生态系统碳的固存,这与Ngaba等[38]研究结果类似,其发现 < 30 kg/hm2的低水平氮投入可以促进森林土壤碳固存,而在高氮条件下这种效应则会发生逆转。因此,未来需进一步明确不同生态系统碳循环对氮添加的具体响应过程及阈值。
3.2 氮添加对土壤MBC影响机制MBC是微生物生物量的重要组成部分,其数量变化表征微生物体内碳对土壤碳库的贡献,土壤MBC虽然占土壤碳库比例小,但对于驱动土壤碳的生物化学循环具有重要意义[39]。本研究结果显示,氮添加显著降低土壤MBC含量(图 1),这与大部分研究结果相似,即氮富集往往导致土壤pH下降,抑制微生物活性,从而降低土壤MBC含量[40-42]。本研究还发现,氮添加显著降低pH和微生物生物量(包括细菌、真菌和放线菌),且氮添加条件下,pH和总微生物生物量是影响MBC的重要因子。因此,氮富集对微生物的负面影响是驱动MBC含量下降的主要因素。而Yang等[24]研究结果显示,氮添加增加了土壤MBC含量,这可能与数据收集范围有关,在其研究中纳入了农田和苔原生态系统,而本研究只针对草地和森林生态系统,因此可能造成结果的不一致。
考虑不同生态系统之间的差异,本研究结果显示,氮添加显著降低草地土壤MBC含量,森林土壤MBC无显著变化(图 2),这可能与土壤碳的固存机制不同有关。最近研究表明,微生物残体积累主导了草地生态系统土壤碳的累积。相比森林,草地具有更大的地下生物量,植物将更多的光合作用产物转移到地下部分,促进了微生物碳的合成代谢过程,因此草地微生物数量降低对于微生物残体积累具有直接负面影响[43]。而森林生态系统具有更多的地上植物碳输入,如凋落物的持续积累,有研究表明森林土壤有机碳的增加主要由土壤木质素增加驱动[44]。此外,草地生态系统稳定性要低于森林生态系统,对外界环境变化表现出更灵敏的响应。对于施氮年限和施氮水平,本研究结果显示,短期施氮和低氮条件下,对土壤MBC无显著影响,长期施氮和高氮条件下,可显著降低土壤MBC含量(图 2),这主要是由于随着施氮水平增加,氮添加对土壤化学性质和微生物负面影响加剧,显著抑制微生物生长及功能,从而降低土壤MBC含量。此外,本研究还发现,尿素和硝酸铵添加对土壤MBC均有显著的负面影响,这主要由于氮的投入导致土壤pH降低,而其他类型(包括硝酸钠、氯化铵等)氮肥显著促进土壤MBC积累,这主要与施氮量较低和施氮年限较短有关。有研究显示,低氮水平添加提高了草地土壤MBC含量[24-25],但过量的氮添加会对微生物产生显著负面作用。
本研究显示,土壤DOC和MBC对氮添加响应并不一致,这主要是由于不同驱动途径导致。氮添加下,植物碳输入增加主导土壤DOC含量增加,土壤酸化效应加剧对微生物生物量的抑制从而降低土壤MBC含量。虽然本研究无法量化土壤DOC和MBC差异化响应对生态系统碳循环的具体影响,但结果表明,氮富集对微生物及其介导碳循环过程可能产生重要的负面影响。总的来说,土壤有机碳对氮添加的响应是由多种机制共同作用的结果。因此,未来需进一步明确不同碳组分对氮添加响应过程及潜在机制,解析氮添加对土壤碳的作用机理。
4 结论本研究利用Meta分析量化土壤DOC和MBC对氮添加的响应及潜在过程,结果表明,氮添加通过增强植物碳输入增加土壤DOC含量,但对土壤微生物的负面作用降低了土壤MBC含量。总的来说,氮输入对土壤DOC和MBC不同驱动途径是导致土壤DOC和MBC对氮输入差异化响应的根本原因。
| [1] |
Liu X J, Duan L, Mo J M, et al. Nitrogen deposition and its ecological impact in China: An overview[J]. Environmental Pollution, 2011, 159(10): 2251-2264 DOI:10.1016/j.envpol.2010.08.002 (  0) 0) |
| [2] |
Borer E T, Stevens C J. Nitrogen deposition and climate: An integrated synthesis[J]. Trends in Ecology & Evolution, 2022, 37(6): 541-552 (  0) 0) |
| [3] |
Zhang Q, Li Y N, Wang M R, et al. Atmospheric nitrogen deposition: A review of quantification methods and its spatial pattern derived from the global monitoring networks[J]. Ecotoxicology and Environmental Safety, 2021, 216: 112180 DOI:10.1016/j.ecoenv.2021.112180 (  0) 0) |
| [4] |
Yang G J, Hautier Y, Zhang Z J, et al. Decoupled responses of above- and below-ground stability of productivity to nitrogen addition at the local and larger spatial scale[J]. Global Change Biology, 2022, 28(8): 2711-2720 DOI:10.1111/gcb.16090 (  0) 0) |
| [5] |
Eastman B A, Adams M B, Brzostek E R, et al. Altered plant carbon partitioning enhanced forest ecosystem carbon storage after 25 years of nitrogen additions[J]. New Phytologist, 2021, 230(4): 1435-1448 DOI:10.1111/nph.17256 (  0) 0) |
| [6] |
席颖青, 李晓, 刘小飞. 模拟氮添加对亚热带杉木人工林土壤有机碳矿化的影响[J]. 土壤, 2023, 55(1): 196-204 (  0) 0) |
| [7] |
Tian Q Y, Lu P, Zhai X F, et al. An integrated belowground trait-based understanding of nitrogen-driven plant diversity loss[J]. Global Change Biology, 2022, 28(11): 3651-3664 DOI:10.1111/gcb.16147 (  0) 0) |
| [8] |
袁颖红, 樊后保, 刘文飞, 等. 模拟氮沉降对杉木人工林(Cunninghamia lanceolata)土壤酶活性及微生物群落功能多样性的影响[J]. 土壤, 2013, 45(1): 120-128 (  0) 0) |
| [9] |
Liu F T, Wang D, Zhang B B, et al. Concentration and biodegradability of dissolved organic carbon derived from soils: A global perspective[J]. Science of the Total Environment, 2021, 754: 142378 DOI:10.1016/j.scitotenv.2020.142378 (  0) 0) |
| [10] |
Sawicka K, Monteith D T, Vanguelova E I, et al. Fine-scale temporal characterization of trends in soil water dissolved organic carbon and potential drivers[J]. Ecological Indicators, 2016, 68: 36-51 DOI:10.1016/j.ecolind.2015.12.028 (  0) 0) |
| [11] |
Sokol N W, Sanderman J, Bradford M A. Pathways of mineral-associated soil organic matter formation: Integrating the role of plant carbon source, chemistry, and point of entry[J]. Global Change Biology, 2019, 25(1): 12-24 DOI:10.1111/gcb.14482 (  0) 0) |
| [12] |
Stockmann U, Adams M A, Crawford J W, et al. The knowns, known unknowns and unknowns of sequestration of soil organic carbon[J]. Agriculture, Ecosystems & Environment, 2013, 164: 80-99 (  0) 0) |
| [13] |
Wang Z Q, Zhao M Y, Yan Z B, et al. Global patterns and predictors of soil microbial biomass carbon, nitrogen, and phosphorus in terrestrial ecosystems[J]. CATENA, 2022, 211: 106037 DOI:10.1016/j.catena.2022.106037 (  0) 0) |
| [14] |
Stevenson B A, Sarmah A K, Smernik R, et al. Soil carbon characterization and nutrient ratios across land uses on two contrasting soils: Their relationships to microbial biomass and function[J]. Soil Biology and Biochemistry, 2016, 97: 50-62 DOI:10.1016/j.soilbio.2016.02.009 (  0) 0) |
| [15] |
Das S, Deb S, Sahoo S S, et al. Soil microbial biomass carbon stock and its relation with climatic and other environmental factors in forest ecosystems: A review[J]. Acta Ecologica Sinica, 2023, 43(6): 933-945 DOI:10.1016/j.chnaes.2022.12.007 (  0) 0) |
| [16] |
Fang H J, Cheng S L, Yu G R, et al. Experimental nitrogen deposition alters the quantity and quality of soil dissolved organic carbon in an alpine meadow on the Qinghai-Tibetan Plateau[J]. Applied Soil Ecology, 2014, 81: 1-11 DOI:10.1016/j.apsoil.2014.04.007 (  0) 0) |
| [17] |
刘红梅, 张海芳, 赵建宁, 等. 氮添加对贝加尔针茅草原土壤活性有机碳和碳库管理指数的影响[J]. 草业学报, 2020, 29(8): 18-26 (  0) 0) |
| [18] |
焦宏哲, 李欢, 陈惠, 等. 增温、施氮对中亚热带杉木林土壤可溶性有机质的影响[J]. 土壤学报, 2020, 57(5): 1249-1258 (  0) 0) |
| [19] |
袁吉有, 苏以荣. 大气氮沉降对森林土壤碳输入输出过程的影响[J]. 云南大学学报(自然科学版), 2021, 43(3): 577-586 (  0) 0) |
| [20] |
Pregitzer K S, Zak D R, Burton A J, et al. Chronic nitrate additions dramatically increase the export of carbon and nitrogen from northern hardwood ecosystems[J]. Biogeochemistry, 2004, 68(2): 179-197 DOI:10.1023/B:BIOG.0000025737.29546.fd (  0) 0) |
| [21] |
Lu X, Gilliam F S, Yu G, et al. Long-term nitrogen addition decreases carbon leaching in a nitrogen-rich forest ecosystem[J]. Biogeosciences, 2013, 10(6): 3931-3941 DOI:10.5194/bg-10-3931-2013 (  0) 0) |
| [22] |
Zhou W J, Sha L Q, Schaefer D A, et al. Direct effects of litter decomposition on soil dissolved organic carbon and nitrogen in a tropical rainforest[J]. Soil Biology and Biochemistry, 2015, 81: 255-258 DOI:10.1016/j.soilbio.2014.11.019 (  0) 0) |
| [23] |
Ning Q S, Jiang L C, Wang R Z, et al. Greater soil microbial biomass loss at low frequency of N addition in an Inner Mongolia grassland[J]. Journal of Plant Ecology, 2022, 15(4): 721-732 DOI:10.1093/jpe/rtac015 (  0) 0) |
| [24] |
Yang Y, Chen X L, Liu L X, et al. Nitrogen fertilization weakens the linkage between soil carbon and microbial diversity: A global meta-analysis[J]. Global Change Biology, 2022, 28(21): 6446-6461 DOI:10.1111/gcb.16361 (  0) 0) |
| [25] |
Yang Y, Liang C, Wang Y Q, et al. Soil extracellular enzyme stoichiometry reflects the shift from P- to N-limitation of microorganisms with grassland restoration[J]. Soil Biology and Biochemistry, 2020, 149: 107928 DOI:10.1016/j.soilbio.2020.107928 (  0) 0) |
| [26] |
Wang X H, Li S, Zhu B, et al. Long-term nitrogen deposition inhibits soil priming effects by enhancing phosphorus limitation in a subtropical forest[J]. Global Change Biology, 2023, 29(14): 4081-4093 DOI:10.1111/gcb.16718 (  0) 0) |
| [27] |
Deng L, Peng C H, Zhu G Y, et al. Positive responses of belowground C dynamics to nitrogen enrichment in China[J]. Science of the Total Environment, 2018, 616: 1035-1044 (  0) 0) |
| [28] |
曹丛丛, 齐玉春, 董云社, 等. 氮沉降对陆地生态系统关键有机碳组分的影响[J]. 草业学报, 2014, 23(2): 323-332 (  0) 0) |
| [29] |
Hedges L V, Gurevitch J, Curtis P S. The meta-analysis of response ratios in experimental ecology[J]. Ecology, 1999, 80(4): 1150 DOI:10.1890/0012-9658(1999)080[1150:TMAORR]2.0.CO;2 (  0) 0) |
| [30] |
Kaiser K, Kalbitz K. Cycling downwards–dissolved organic matter in soils[J]. Soil Biology and Biochemistry, 2012, 52: 29-32 DOI:10.1016/j.soilbio.2012.04.002 (  0) 0) |
| [31] |
王磊, 应蓉蓉, 石佳奇, 等. 土壤矿物对有机质的吸附与固定机制研究进展[J]. 土壤学报, 2017, 54(4): 805-818 (  0) 0) |
| [32] |
Tian J, Dungait J A J, Lu X K, et al. Long-term nitrogen addition modifies microbial composition and functions for slow carbon cycling and increased sequestration in tropical forest soil[J]. Global Change Biology, 2019, 25(10): 3267-3281 DOI:10.1111/gcb.14750 (  0) 0) |
| [33] |
Liu W X, Qiao C L, Yang S, et al. Microbial carbon use efficiency and priming effect regulate soil carbon storage under nitrogen deposition by slowing soil organic matter decomposition[J]. Geoderma, 2018, 332: 37-44 DOI:10.1016/j.geoderma.2018.07.008 (  0) 0) |
| [34] |
Xia J Y, Wan S Q. Global response patterns of terrestrial plant species to nitrogen addition[J]. New Phytologist, 2008, 179(2): 428-439 DOI:10.1111/j.1469-8137.2008.02488.x (  0) 0) |
| [35] |
Tipping E, Henrys P A, Maskell L C, et al. Nitrogen deposition effects on plant species diversity; threshold loads from field data[J]. Environmental Pollution, 2013, 179: 218-223 DOI:10.1016/j.envpol.2013.04.008 (  0) 0) |
| [36] |
Wang X, Wang M, Tao Y M, et al. Beneficial effects of nitrogen deposition on carbon and nitrogen accumulation in grasses over other species in Inner Mongolian grasslands[J]. Global Ecology and Conservation, 2021, 26: e01507 DOI:10.1016/j.gecco.2021.e01507 (  0) 0) |
| [37] |
de Vries W. Impacts of nitrogen emissions on ecosystems and human health: A mini review[J]. Current Opinion in Environmental Science & Health, 2021, 21: 100249 (  0) 0) |
| [38] |
Ngaba M J Y, Uwiragiye Y, Bol R, et al. Low-level nitrogen and short-term addition increase soil carbon sequestration in Chinese forest ecosystems[J]. CATENA, 2022, 215: 106333 DOI:10.1016/j.catena.2022.106333 (  0) 0) |
| [39] |
Patoine G, Eisenhauer N, Cesarz S, et al. Drivers and trends of global soil microbial carbon over two decades[J]. Nature Communications, 2022, 13(1): 4195 DOI:10.1038/s41467-022-31833-z (  0) 0) |
| [40] |
Wang C, Liu D W, Bai E. Decreasing soil microbial diversity is associated with decreasing microbial biomass under nitrogen addition[J]. Soil Biology and Biochemistry, 2018, 120: 126-133 DOI:10.1016/j.soilbio.2018.02.003 (  0) 0) |
| [41] |
Zhang T A, Chen H Y H, Ruan H H. Global negative effects of nitrogen deposition on soil microbes[J]. The ISME Journal, 2018, 12(7): 1817-1825 DOI:10.1038/s41396-018-0096-y (  0) 0) |
| [42] |
Zhou Z H, Wang C K, Zheng M H, et al. Patterns and mechanisms of responses by soil microbial communities to nitrogen addition[J]. Soil Biology and Biochemistry, 2017, 115: 433-441 DOI:10.1016/j.soilbio.2017.09.015 (  0) 0) |
| [43] |
Ma T, Zhu S S, Wang Z H, et al. Divergent accumulation of microbial necromass and plant lignin components in grassland soils[J]. Nature Communications, 2018, 9(1): 3480 DOI:10.1038/s41467-018-05891-1 (  0) 0) |
| [44] |
Dai G H, Zhu S S, Cai Y, et al. Plant-derived lipids play a crucial role in forest soil carbon accumulation[J]. Soil Biology and Biochemistry, 2022, 168: 108645 DOI:10.1016/j.soilbio.2022.108645 (  0) 0) |
 2024, Vol. 56
2024, Vol. 56


