2. 福建师范大学福建省植物生理生态重点实验室, 福州 350007;
3. 福建师范大学地理研究所, 福州 350007
19世纪工业革命以来,由于矿物燃料燃烧、含氮化肥的生产和使用等人类活动,全球陆地向大气排放的活性氮数量成比例增加,预计到2050年全球活化氮的沉降量将增加1倍[1]。目前,北美、西欧和亚洲已经成为全球三大氮沉降热点地区,氮沉降增加对土壤,特别是森林土壤的影响已引起了科学家的广泛关注[2]。
磷(P)是维持植物生长发育所必需的营养元素,更是陆地生态系统得以正常运行的关键元素[3]。土壤中磷的总含量在0.02% ~ 0.2%,相比其他营养元素,土壤磷元素含量较低。据全国土壤普查资料估算,我国缺磷土壤的面积达土壤总面积的2/3[4]。影响土壤磷有效性的因子有很多,如土壤理化因子、土壤微生物、环境因子、不同的土地利用和耕作方式等[5]。
目前有关氮沉降对土壤磷素的影响研究大多是基于植物、微生物、非生物因素等角度,如方华和莫江明[6]研究发现,氮沉降会通过改变林下凋落物的分解速率来改变土壤中的磷含量。同时,植物和微生物在不同氮沉降强度下,也会受到抑制或促进,从而使土壤磷含量减少或增加[7]。而氮沉降亦会通过影响土壤pH及其他理化性质来影响土壤酶的迁移和转化[8]。如Fan等[9]研究发现,土壤微生物生物量碳磷比(C/P)会在氮沉降下失衡,从而加剧土壤磷限制。此外,还有研究通过土壤酶化学计量比来评估微生物碳、氮、磷养分资源需求状况。例如,在温带草地的研究中,氮沉降会加剧土壤磷限制[10];基于土壤酶活性化学计量比角度,曾泉鑫等[11]发现,5 a的氮添加显著加剧了毛竹林土壤微生物的碳磷限制;林惠瑛等[12]亦发现,随着海拔梯度的升高,武夷山黄山松林土壤微生物磷限制进一步加剧。氮沉降对土壤磷的影响也会因所处环境不同而发生变化,例如在温带地区,土壤有效磷、中等有效磷含量会因氮沉降而降低[13];在热带地区,长达7 a的氮沉降未显著改变土壤磷含量[14];而在原本就存在磷限制的亚热带地区,氮沉降会进一步加剧土壤的磷限制[11]。总之,前人的研究结果说明氮沉降对于土壤磷的影响是一种多因子调控的结果,环境因素、施氮年限、施氮强度等都会影响土壤磷的变化。目前从土壤酶活性化学计量比角度出发研究长期氮沉降是否加剧土壤磷限制的研究仍有限。我国亚热带地区拥有世界上面积最大的常绿阔叶林,被称为全球同纬度带的“绿洲”,更是全世界亚热带生物多样性的中心[15]。基于土壤胞外酶活性化学计量比,开展亚热带森林长期氮沉降对土壤磷限制的研究,有助于深入认识森林土壤养分循环调控机制。
基于以上,本研究以福建三明格氏栲(Castanopsis kawakii)自然保护区的米槠天然林为研究对象,通过设置不同年限、不同强度的氮沉降模拟试验,从土壤酶活性及其化学计量比角度出发,探讨长期施氮对亚热带地区土壤磷限制的影响,并分析主要影响因素,以进一步厘清长期氮沉降下亚热带森林土壤生态过程的响应及其调控机理,为亚热带天然林的保护提供理论依据。
1 材料与方法 1.1 研究区概况试验地点位于福建省三明市格氏栲自然保护区(26°11′45″ N, 117°28′38″ E),该保护区内气候属亚热带季风性气候,年均温19.4℃,年均降水量1 700 mm,降水主要集中在3—7月,年均蒸发量1 585 mm,相对湿度81%。保护区内土壤类型主要是红壤,生物种类较为丰富,植物分层明显,乔木优势种为米槠(Castanopsis carlesii)[16]。
1.2 试验设计2012年11月在研究区内设置氮沉降长期试验样地,共12块,大小均为20 m × 20 m,各样地之间间隔10 m左右。
本研究以三明地区年平均氮沉降量(N 36 kg/(hm2·a))为参考值,设置对照(CK,N 0 kg/(hm2·a))、低氮(LN,N 40 kg/(hm2·a)和高氮(HN,N 80 kg/(hm2·a) 3种施氮处理,每个处理4个重复。试验时,按试验设置用量在20 L去离子水中加入NH4NO3(分析纯),充分溶解后进行施氮,施氮时间为每月月初,在各个样地的土壤表面以溶液的形式均匀喷洒,CK处理则使用等量去离子水喷洒。
1.3 样品采集分别于2017年1月和2020年12月按照“S”形取样法在每个样地随机选取4个取样点,用土钻分层(0 ~ 10 cm和10 ~ 20 cm)采集土壤。各样点土壤混合均匀后,用镊子挑除土壤中的动植物残体以及石块,然后分成三份:一份置于4℃的冰箱保存用于测定土壤含水率(SWC)、pH、可溶性有机碳(DOC)、可溶性有机氮(DON)、NH4+-N和NO3–-N;一份在–20 ℃冰箱保存,用于土壤微生物指标的测定;一份自然风干,用于土壤全氮、全碳的测定。
1.4 测定项目与方法 1.4.1 土壤基本理化性质的测定采用烘干法测定土壤(SWC)[17];采用水土质量比2.5︰1,玻璃电极计法测定土壤pH[17];采用20 mL去离子水浸提5 g土壤,250 r/min振荡30 min,4 000 r/min离心30 min后,用0.45 μm玻璃纤维滤膜对浸提溶液进行抽滤,滤液中DOC使用总有机碳分析仪(TOC-VCPH,日本)测定,DON使用连续流动分析仪(Skalar San++,荷兰)测定[18];土壤NH4+-N和NO3–-N采用20 mL 2 mol/L KCl溶液浸提5 g鲜土,于250 r/min振荡30 min,4 000 r/min离心30 min后,用0.45 μm中速定量滤纸过滤,最后使用连续流动分析仪(Skalar San++,荷兰)测定[19]。此外,土壤全氮、全碳的测定采用土壤碳氮元素分析仪(Elemental Analyzer Vario ELIII,德国)[17],并计算碳氮比(C︰N)。
1.4.2 土壤微生物生物量的测定使用氯仿熏蒸–硫酸钾浸提法[20]对微生物生物量碳(MBC)和氮(MBN)进行提取,再分别使用总有机碳分析仪(TOC-VCPH/ CPN,日本)和连续流动分析仪(Skalar San++,荷兰)测定。
1.4.3 土壤酶活性的测定3种水解酶的活性使用Saiya-Cork等[21]方法测定:称取1 g土壤加入装有125 mL pH 5.0 50 mmol/L醋酸缓冲液的广口瓶中,用磁力搅拌器搅拌5 min,使土壤和溶液均质化;再使用移液器取200 μL悬浮液,添加到96孔微孔板;将微孔板置于黑暗、20 ℃条件下培养4 h,再加入10 μL 1 mol/L NaOH溶液;最后,使用多功能酶标仪(Synergy H,美国)测定土壤酶活性。3种水解酶的缩写及其底物信息见表 1。
|
|
表 1 3种酶的缩写、类型及底物信息 Table 1 Abbreviations, types and substrate information of activities of three enzymes |
首先对所有测定指标进行正态分布检验和F检验,以检验数据的正态分布和方差齐性。采用ln(βG)∶ln(NAG)作为土壤酶化学计量碳氮比(C∶N),ln(βG)∶ln(ACP)作为土壤酶化学计量碳磷比(C∶P),ln(NAG)∶ ln(ACP)作为土壤酶化学计量氮磷比(N∶P)[22]。采用单因素方差分析(one-way ANOVA)并使用LSD法检验不同施氮量、土壤深度之间土壤基本理化、土壤胞外酶活性及其化学计量比的差异(P < 0.05),施氮年限、施氮量和土壤深度之间的交互影响则使用双因素方差分析(two-way ANOVA)检验。以不同深度土壤胞外酶活性及其化学计量比作为响应变量,土壤理化性质和微生物生物量作为解释变量进行冗余分析(RDA)。本研究的统计分析利用SPSS 26.0完成,所有数据处理和图形绘制则利用Origin 2021、CANOCO 5.0和AI 2021软件完成。
此外,利用土壤酶化学计量的矢量分析,预测微生物资源限制[23],具体公式如下。
| $ \mathsf{\text{VL}= \sqrt{{\left[\frac{\text{ln}\left(\text{βG}\right)}{\text{ln}\left(\text{NAG}\right)}\right]}^{2}+{\left[\frac{\text{ln}\left(\text{βG}\right)}{\text{ln}\left(\text{ACP}\right)}\right]}^{2} }} $ | (1) |
| $ \mathsf{\text{VA}=\text{Degrees} \{\text{ATAN}2\left[\frac{\text{ln}\left(\text{βG}\right)}{\text{ln}\left(\text{ACP}\right) },\frac{\text{ln}\left(\text{βG}\right)}{\text{ln}\left(NAG\right)}\right]\}} $ | (2) |
式中:VL表示向量长度,VL越大表示碳限制越大;VA表示矢量角度,VA < 45°表示相对氮限制,VA > 45°为磷限制,偏离程度越大,限制越强[24]。
2 结果与分析 2.1 不同施氮年限下不同施氮量土壤理化性质由表 2数据可知,施氮4 a后,各土层不同处理土壤含水率无显著变化(P > 0.05)。在0 ~ 10 cm土层中,与CK处理相比,LN、HN处理pH显著下降,而DOC和NH4+-N含量无显著变化(P > 0.05);而与CK、LN处理相比,C∶N和MBN含量在HN处理下显著下降;DON含量在HN处理下最高,MBC含量在LN处理下最高,NO3–-N含量则随着施氮量的增加而显著增加(P < 0.05)。在10 ~ 20 cm土层中,不同处理间NH4+-N和MBC含量无显著变化(P > 0.05),DOC和DON含量在LN处理下最高,pH在HN处理下达到最低值;与CK、LN处理相比,在HN处理下C∶N显著增加;与CK处理相比,NO3–-N含量在LN、HN处理下显著增加,而MBN含量则随施氮量的增加而明显增加。整体上,随着土层的加深,土壤pH显著增加,土壤含水量、C∶N及NH4+-N、MBC和MBN含量均显著下降。
|
|
表 2 2017年不同施氮量下不同深度土壤理化性质 Table 2 Soil physiochemical properties at different depths under different nitrogen application rates in 2017 |
而施氮8 a后,与CK处理相比,各深度土壤含水率在HN处理下显著下降(P < 0.05)(表 3)。在0 ~ 10 cm土层中,LN和HN处理均显著降低了pH、MBN含量,显著增加了DOC含量;HN处理使DON含量显著增加,而使C∶N显著降低;NH4+-N含量随着施氮量增加而显著降低,NO3–-N含量则随着施氮量增加而显著增加。在10 ~ 20 cm土层中,HN处理下土壤pH、C∶N及NH4+-N、MBC、MBN含量均显著低于CK和LN处理,但NO3–-N含量则相反;与CK处理相比,LN和HN处理下土壤DOC含量明显更高,但不同处理间土壤DON含量差异不显著。整体上,随着土层的加深,土壤pH显著增加,DOC、DON、NH4+-N、NO3–-N、MBN含量均显著下降,而土壤含水率和C∶N则无显著变化。
|
|
表 3 2020年不同施氮量下不同深度土壤理化性质 Table 3 Soil physiochemical properties at different depths under different nitrogen application rates in 2020 |
方差分析显示,施氮年限显著影响土壤理化性质(P < 0.01),NO3–-N、DOC、C∶N、MBC和MBN受到施氮年限、施氮量和土层三者交互影响(P < 0.05) (表 4)。
|
|
表 4 施氮年限、施氮量、土层及其交互作用对土壤理化性质影响的显著性 Table 4 Effect significances of nitrogen application years and rates, soil layer and their interactions on soil physicochemical properties |
由图 1可知,在0 ~ 10 cm土层,施氮4 a和8 a后HN处理下βG活性均显著增加(P < 0.05);而在10 ~ 20 cm土层,施氮4 a对βG活性无显著影响,施氮8 a则显著增强了βG活性。对于NAG,施氮4 a对两个土层NAG活性均无显著影响;而在施氮8 a后,HN处理下0 ~ 10 cm土层中NAG活性显著降低,10 ~ 20 cm土层中LN和HN处理下土壤NAG活性均显著增加。对于ACP,施氮4 a后,与CK处理相比,LN和HN处理下0 ~ 10 cm土层中ACP活性显著增加,10 ~ 20 cm土壤层中ACP活性则显著下降;而施氮8 a对ACP活性无显著影响。施氮年限显著影响土壤酶活性(P < 0.01),βG和ACP活性受到施氮年限和施氮量二者交互影响(P < 0.05)(图 1)。
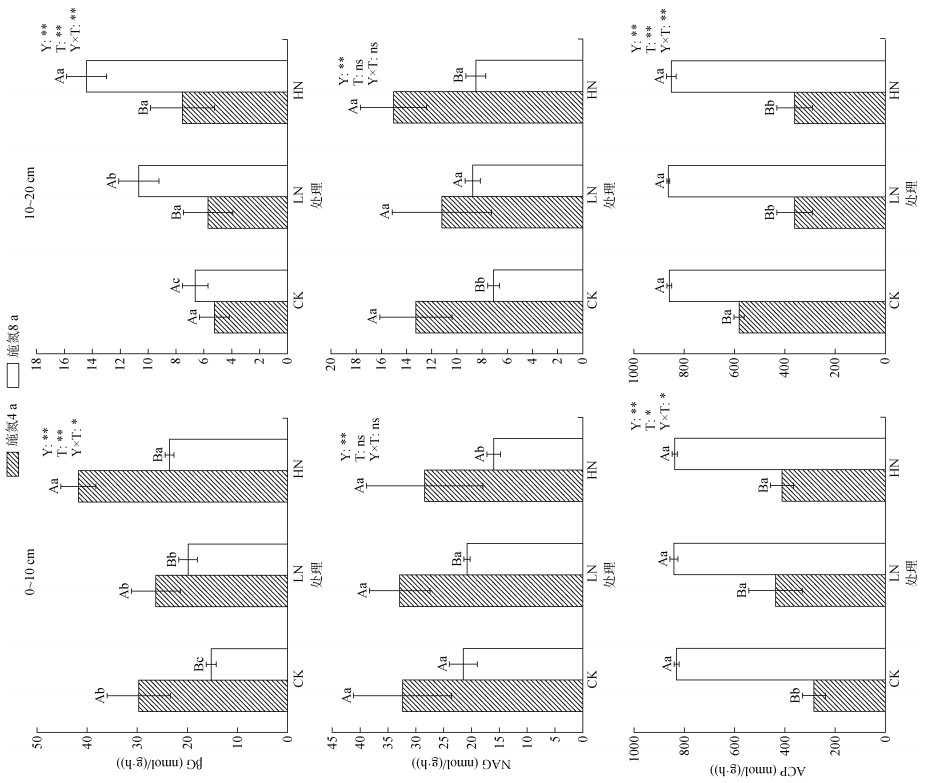
|
(图上方不同小写字母表示同一年限同一土层不同施氮处理间差异显著(P < 0.05),不同大写字母表示同一施氮处理同一土层不同年限间差异显著(P < 0.05);方差分析中,S表示土层,T表示施氮量,Y表示施氮年限,ns、*、**分别表示影响不显著(P > 0.05)、显著(P < 0.05)和极显著(P < 0.01)) 图 1 不同施氮处理下不同深度土壤酶活性 Fig. 1 Soil enzyme activities at different depths under different nitrogen application treatments |
施氮4 a后,与CK、LN处理相比,HN处理下0 ~ 10 cm土层中ln(βG)∶ln(NAG)以及两土层ln(βG)∶ ln(ACP)均显著提高,但两土层ln(NAG)∶ln(ACP)均无显著变化(图 2)10 ~ 20 cm土层ln(βG)∶ln(NAG)、ln(βG)∶ln(ACP)和ln(NAG)∶ln(ACP)均显著低于0 ~ 10 cm土层。施氮8 a后,与CK、LN处理相比,HN处理下各土层ln(βG)∶ln(NAG)明显提高,且随着土层的增加而增加(图 2);HN处理下0 ~ 10 cm土层ln(NAG)∶ln(ACP)显著低于CK和LN处理;10 ~ 20 cm土层ln(βG)∶ln(ACP)和ln(NAG)∶ln(ACP)均显著低于0 ~ 10 cm土层。
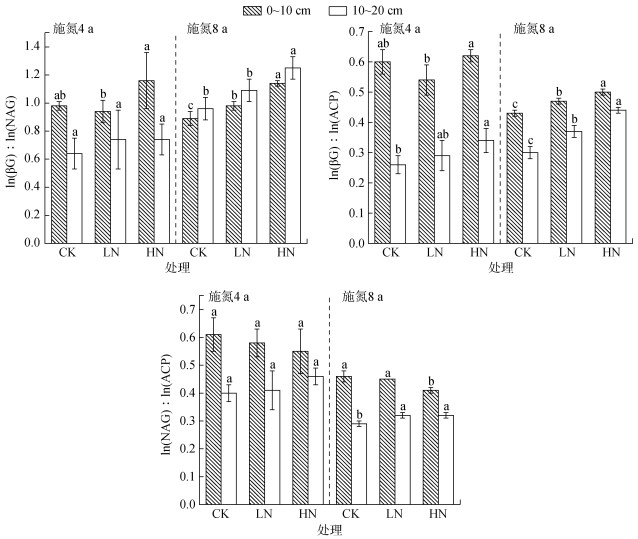
|
(图中不同小写字母表示同一土层不同处理间差异显著(P < 0.05);图 3、图 4同) 图 2 不同施氮处理下不同深度土壤酶化学计量比 Fig. 2 Soil enzyme stoichiometric ratios at different depths under different nitrogen application treatments |
土壤酶化学计量比C∶N∶P用ln(βG)∶ln(NAG)∶ln(ACP)表示,不同施氮年限下0 ~ 10 cm和10 ~ 20 cm土层土壤酶化学计量比C∶N∶P分别为1∶1∶2和1∶1∶3。
不同施氮年限下,两土层在不同施氮量下土壤酶化学计量比的向量角度均 > 45°,但施氮8 a的向量角度显著大于施氮4 a的向量角度(图 3)。
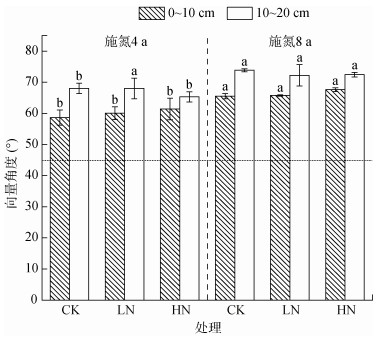
|
图 3 不同施氮处理下不同深度土壤酶化学计量比向量角度 Fig. 3 Vector angles of soil enzyme stoichiometric ratios at different depths under different nitrogen application treatments |
施氮4 a后,各土层土壤酶化学计量比的向量长度随着施氮量的增加而显著增加(图 4)。施氮8 a后,0 ~ 10 cm土层,土壤酶化学计量比的向量长度随着施氮量的增加而显著增加;10 ~ 20 cm土层,HN处理下土壤酶化学计量比向量长度显著大于CK和LN处理,而CK和LN处理之间差异不显著。
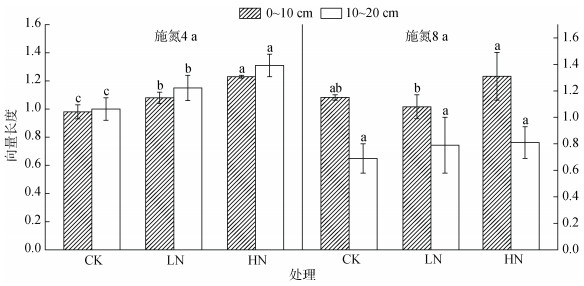
|
图 4 不同施氮处理下不同深度土壤酶化学计量比向量长度 Fig. 4 Vector lengths of soil enzyme stoichiometric ratios at different depths under different nitrogen application treatments |
冗余分析结果(图 5)表明,施氮4 a后,在0 ~ 10 cm土层中,DON含量显著影响土壤酶活性及其化学计量比,解释了土壤酶活性及其化学计量比变化的28.2%;DON含量与βG活性呈正相关,与NAG和ACP活性呈负相关,并且DON含量与ln(βG)∶ln(NAG)和ln(βG)∶ln(ACP)呈正相关,与ln(NAG)∶ln(ACP)呈负相关。在10 ~ 20 cm土层中,MBN含量与土壤酶活性显著相关,解释了土壤酶活性及其化学计量比变化的27.6%,且与βG和NAG活性呈正相关,与ACP活性呈负相关(图 5)。
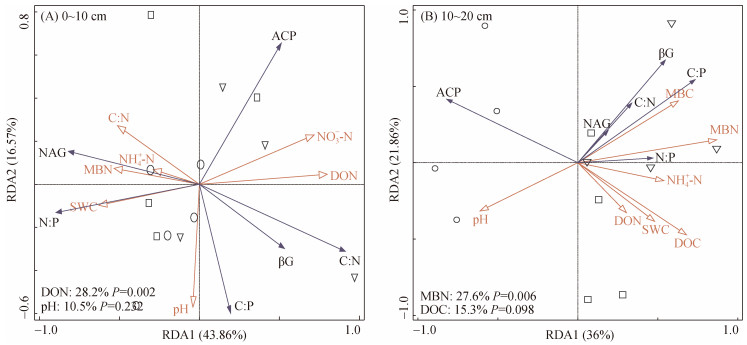
|
(图中○为对照处理,□为低氮处理,▽为高氮处理;下图同) 图 5 2017年不同施氮量下不同深度土壤酶活性及其化学计量比的冗余分析 Fig. 5 Redundancy analyses of soil enzyme activities and stoichiometric ratios at different depths under different nitrogen application rates in 2017 |
施氮8 a后,在0 ~ 10 cm土层中,NH4+-N含量与土壤酶活性及其化学计量比显著相关,解释了土壤酶活性及其化学计量比变化的67.0%;NH4+-N含量与NAG活性呈正相关,与βG和ACP活性呈负相关,并且NH4+-N含量与ln(NAG)∶ln(ACP)呈正相关,与ln(βG)∶ln(NAG)和ln(βG)∶ln(ACP)呈负相关(图 6)。在10 ~ 20 cm土层中,MBN含量与土壤酶活性及其化学计量比显著相关,解释了其变化的71.6%,其中与βG和NAG活性呈负相关,与ACP活性呈正相关,与ln(βG)∶ln(NAG)、ln(βG)∶ln(ACP)和ln(NAG)∶ln(ACP)均呈负相关(图 6)。
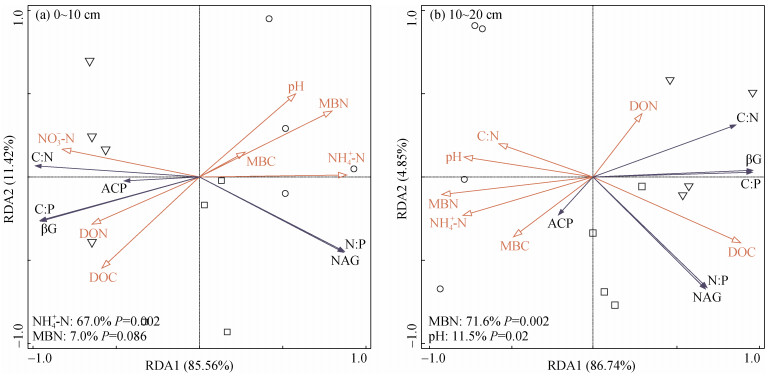
|
图 6 2020年不同施氮量下不同深度土壤酶活性及其化学计量比的冗余分析 Fig. 6 Redundancy analyses of soil enzyme activities and stoichiometric ratios at different depths under different nitrogen application rates in 2020 |
本研究发现,不同施氮年限下LN处理各土层土壤DOC含量显著提高,这为微生物生长提供更多的能量来源,微生物活性增强[25]。此外,施氮4 a后土壤中有效氮(主要是NO3–-N)含量增加;而在施氮8 a的情况下,随着施氮量的增加NO3–-N含量显著增加,NH4+-N含量显著降低。这可能受降水、温度等因素影响,长期施氮导致土壤有效氮含量增加,当超过该森林生态系统的氮需求时,土壤中微生物硝化作用加强,产生了更多的NO3–-N,而土壤中NH4+-N被硝化细菌消耗,NH4+-N含量下降[26](表 2)。本研究还发现,DON含量在氮沉降处理中增加,这与Fan等[27]研究结果一致。部分NO3–-N是DON被微生物利用分解转化而成,这可能也是氮沉降导致NO3–-N含量增加的原因之一。
土壤微生物生物量是土壤中最活跃易变的部分,其直接参与调控土壤养分循环[28]。本研究中,不同施氮年限下MBC和MBN含量随着土层的变化呈现出不同的结果。施氮4 a和8 a后,0 ~ 10 cm土层中的MBC含量在LN处理下达到最高值。LN处理下土壤中的氮有效性增加,C∶N降低,土壤微生物对土壤有机质的利用、分解效率提高,MBC含量增加。与之不同的是施氮8 a后,HN处理减少MBC和MBN含量,这可能是由于长期施氮导致土壤中的NO3–含量显著增加,土壤酸化(表 2),这一方面会抑制微生物生长[16],另一方面也会导致植物在地下分配的养分减少[28],因此,土壤微生物的养分获取能力被削弱,MBC和MBN含量下降。王晖等[29]研究亦发现,LN处理会促进亚热带地区土壤MBC含量增加,但在HN处理下则降低。因此,氮沉降所造成的土壤酸化可能是影响土壤微生物生物量的关键因子。
3.2 氮沉降对土壤胞外酶活性及其化学计量比的影响本研究中,施氮4 a后,各土层βG活性虽有所增加但不显著,这可能是由于施氮年限较短的原因;而在施氮8 a后,各土层βG活性显著增加,且在10 ~ 20 cm土层中βG活性显著高于施氮4 a。范跃新[30]早前的研究也发现,施氮6 a的土壤βG活性要比施氮4 a的显著增加。这主要是因为长期氮沉降提高了凋落物的分解速率,βG活性随之增加。此外,不同施氮量也会影响土壤酶活性,如沈芳芳等[31]研究表明亚热带杉木人工林土壤βG活性在LN处理下增加,而在HN处理下受到抑制。这进一步说明土壤βG活性受施氮的影响较为复杂,包含许多因子的参与,施氮量、施氮年限、季节等都会在不同程度上影响土壤βG活性。
本研究中,施氮4 a后各土层NAG活性变化均不显著,施氮8 a后0 ~ 10 cm土壤NAG活性呈现下降趋势,这与曹平丽等[32]研究结果不同。这可能是因为当土壤氮有效性较低时,微生物需要通过消耗自身生长所需的养分来生产NAG;当土壤处于氮饱和状态时,微生物生长代谢所需得到满足,就会降低对NAG的投资,使得NAG活性呈现下降趋势[32]。可见,这说明长期氮沉降会通过影响土壤微生物的养分需求或微生物分泌酶的能力,间接影响土壤酶活性。
本研究中,施氮8 a后不同施氮处理下ACP活性无明显变化,但与施氮4 a相比,施氮8 a后ACP活性均显著增加(图 1),这一发现符合亚热带森林土壤磷有效性低的已有认知[33]。与温带森林相比,低磷有效性在土壤高度风化的亚热带生态系统中很常见[34]。在长达8 a的施氮处理下,土壤微生物和植物对磷养分的竞争加剧,土壤中一部分磷元素被植物根系所吸收,进而导致土壤中微生物可利用的磷含量减少[16]。总之,氮添加对土壤ACP活性的影响较复杂,主要与施氮量、施氮年限、研究区域的气候和土壤环境因素等有关。国内外大多学者研究认为,施氮年限的长短与土壤理化和生物性质的变化密不可分,进而会间接影响土壤ACP活性和磷有效性[33-34]。
土壤酶化学计量比是衡量土壤微生物对碳、氮、磷养分需求的重要指标,也反映了土壤有机质和土壤微生物生物量之间的平衡状态[35]。本研究中,不同施氮年限土壤0 ~ 10 cm土层碳、氮、磷酶活性对数转换后的比值均为1∶1∶2,10 ~ 20 cm土层均为1∶1∶3,均与全球生态系统1∶1∶1的比值相偏离[36],这表明研究区域内不同深度土壤磷素均相对缺乏。施氮4 a后ln(βG)∶ln(ACP)(0.44)低于全球生态系统的平均值(0.62),但ln(NAG)∶ln(ACP)(0.50)则高于全球生态系统的平均值(0.44);施氮8 a后ln(βG)∶ln(ACP)和ln(NAG)∶ln(ACP)(0.39和0.37)分别低于全球生态系统的平均值(0.62和0.44)[35],这进一步表明长期施氮显著加剧了土壤磷限制。
本研究中,随着施氮年限的增加,ln(βG)∶ln(NAG)和ln(βG)∶ln(ACP)显著升高,而ln(NAG)∶ln(ACP)显著降低,其中施氮8 a变化更为显著,这表明在亚热带生态系统中,微生物群落的磷限制大于氮限制[30],且长期施氮会加剧磷限制。全球性研究也表明,土壤和微生物群落的养分限制一般为:磷限制 > 氮限制 > 碳限制[37]。此外,有研究认为,在磷有效性低的亚热带地区,持续的氮添加可能会加剧土壤微生物磷限制[38]。本研究中,土壤酶化学计量的矢量分析也印证了这一观点,不同施氮年限下不同深度土壤碳、氮、磷酶活性的向量角度均大于45°,但施氮8 a的向量角度显著大于施氮4 a,表明随着施氮年限增加,土壤微生物磷限制加剧。这可能是因为亚热带地区土壤盐基离子含量较低,且富含铁铝氧化物,土壤微生物更容易吸收土壤磷,因此在土壤高度风化的亚热带地区,长时间的氮沉降使得土壤微生物可利用性磷含量减少,从而加剧土壤的磷限制[39]。早前的研究也认为,在亚热带地区森林生态系统中,土壤磷元素是限制性养分之一,当土壤微生物处于磷限制的情况下,为了进一步提高土壤有机磷的矿化,微生物会通过分泌更多与磷相关的酶来提高土壤磷有效性,从而缓解自身磷限制的问题[40]。
3.3 影响土壤胞外酶活性及其化学计量比的主要因素本研究冗余分析结果显示,不同施氮年限下影响土壤胞外酶活性及其化学计量比的因子各不相同。在施氮4 a下,DON含量是调控0 ~ 10 cm土层土壤胞外酶活性及化学计量比的主要因子。Cusack[41]研究表明,土壤有机氮是微生物生长不可或缺的关键营养,在土壤酶活性变化中起着举足轻重的作用。短期施氮使得土壤有机氮含量增加,为了获取更多的营养物质,土壤微生物对有机氮进行分解和利用,从而刺激土壤酶活性及其化学计量比的变化。此外,MBN和DOC含量是调控10 ~ 20 cm土层土壤胞外酶活性的主要因子。这主要是由于短期施氮后该土层MBN含量增加(表 2),对微生物活动产生有利影响,从而导致土壤酶活性的变化[26]。土壤DOC含量反映土壤微生物的活性,为微生物生长提供营养[16]。短期施氮后,DOC含量增加,微生物可以从土壤中汲取更多的营养来促进自身生长,其活性进一步提高,刺激土壤酶活性的变化。
本研究中,在施氮8 a后,0 ~ 10 cm土层NH4+-N含量与土壤胞外酶活性及化学计量比的相关性较强。由于长期施氮,NH4+-N和MBN含量随着施氮量的持续增加而降低,其含量的减少使微生物可利用的NH4+-N含量减少,微生物活性减弱,这在一定程度上降低了微生物分泌胞外酶的能力,使NAG活性呈现下降状态,ln(NAG)∶ln(ACP)也相应地呈下降趋势。与0 ~ 10 cm土层相比,10 ~ 20 cm土层土壤βG和NAG酶活性显著降低,MBN含量显著影响该土层βG和NAG酶活性。这可能是因为一方面土壤含水量和氧气含量随土层深度的加深而减少,土壤中MBC和MBN含量下降,从而导致βG和NAG活性降低[27];另一方面,由于土壤微生物的硝化作用会产生H+,加之长时间施氮,导致土壤酸化,阳离子的淋失加剧,土壤微生物生长所需营养被限制,从而影响土壤胞外酶活性[37]。MBN含量也显著影响该层土壤酶活性化学计量比,长期施氮可能造成了土壤的氮饱和,MBN含量下降,ln(βG)∶ln(NAG)和ln(βG)∶ln(ACP)显著增加,ln(NAG)∶ln(ACP)则显著下降,土壤微生物对碳相关酶的投资高于对氮、磷相关酶的投资,进而加剧了该地区的磷限制[42]。与0 ~ 10 cm土层向量长度相比,该土层土壤酶化学计量比向量长度的降低也说明10 ~ 20 cm土层微生物的碳限制减小。
4 结论1) 施氮4 a仅显著影响各土层ACP活性,在LN、HN处理下0 ~ 10 cm土层ACP酶活性显著升高,10 ~ 20 cm土层ACP活性显著下降;而施氮8 a显著增强了各土层βG活性,在HN处理下各土层的NAG活性显著降低,各处理ACP活性则无显著变化。
2) 不同施氮年限下,ln(βG)∶ln(NAG)和ln(βG)∶ln(ACP)在HN处理下均显著增加,施氮4 a的ln(NAG)∶ln(ACP)变化不显著,施氮8 a的ln(NAG)∶ln(ACP)则显著下降。不同施氮年限下亚热带森林土壤酶C∶N∶P化学计量比低于全球生态系统土壤酶C∶N∶P比值,表明亚热带地区土壤存在磷素限制,且在长期施氮下土壤磷限制加剧。
3) DON、MBN和NH4+-N是调控不同施氮年限、不同深度土层下土壤酶活性及其化学计量比的主要因子。
| [1] |
郑裕雄, 曹际玲, 杨智杰, 等. 氮沉降对亚热带常绿阔叶天然林不同季节土壤微生物群落结构的影响[J]. 土壤学报, 2018, 55(6): 1534-1544 (  0) 0) |
| [2] |
郑翔, 刘琦, 曹敏敏, 等. 森林土壤氧化亚氮排放对氮输入的响应研究进展[J]. 土壤学报, 2022, 59(5): 1190-1203 (  0) 0) |
| [3] |
郑威, 李晨曦, 谭玲, 等. 南亚热带桉树人工林与典型乡土树种人工林土壤磷组分及磷吸附特性比较[J]. 土壤, 2020, 52(5): 1017-1024 (  0) 0) |
| [4] |
来璐, 郝明德, 彭令发. 土壤磷素研究进展[J]. 水土保持研究, 2003, 10(1): 65-67 (  0) 0) |
| [5] |
宋春, 韩晓增. 长期施肥条件下土壤磷素的研究进展[J]. 土壤, 2009, 41(1): 21-26 (  0) 0) |
| [6] |
方华, 莫江明. 氮沉降对森林凋落物分解的影响[J]. 生态学报, 2006, 26(9): 3127-3136 DOI:10.3321/j.issn:1000-0933.2006.09.043 (  0) 0) |
| [7] |
刘修元, 杜恩在, 徐龙超, 等. 落叶松原始林树木生长对氮添加的响应[J]. 植物生态学报, 2015, 39(5): 433-441 (  0) 0) |
| [8] |
Wang C, Lu X K, Mori T, et al. Responses of soil microbial community to continuous experimental nitrogen additions for 13 years in a nitrogen-rich tropical forest[J]. Soil Biology and Biochemistry, 2018, 121: 103-112 DOI:10.1016/j.soilbio.2018.03.009 (  0) 0) |
| [9] |
Fan Y X, Lin F, Yang L M, et al. Decreased soil organic P fraction associated with ectomycorrhizal fungal activity to meet increased P demand under N application in a subtropical forest ecosystem[J]. Biology and Fertility of Soils, 2018, 54(1): 149-161 DOI:10.1007/s00374-017-1251-8 (  0) 0) |
| [10] |
Dong C C, Wang W, Liu H Y, et al. Temperate grassland shifted from nitrogen to phosphorus limitation induced by degradation and nitrogen deposition: Evidence from soil extracellular enzyme stoichiometry[J]. Ecological Indicators, 2019, 101: 453-464 DOI:10.1016/j.ecolind.2019.01.046 (  0) 0) |
| [11] |
曾泉鑫, 张秋芳, 林开淼, 等. 酶化学计量揭示5年氮添加加剧毛竹林土壤微生物碳磷限制[J]. 应用生态学报, 2021, 32(2): 521-528 (  0) 0) |
| [12] |
林惠瑛, 周嘉聪, 曾泉鑫, 等. 土壤酶计量揭示了武夷山黄山松林土壤微生物沿海拔梯度的碳磷限制变化[J]. 应用生态学报, 2022, 33(1): 33-41 (  0) 0) |
| [13] |
Yang K, Zhu J J, Gu J C, et al. Changes in soil phosphorus fractions after 9 years of continuous nitrogen addition in a Larix gmelinii plantation[J]. Annals of Forest Science, 2015, 72(4): 435-442 DOI:10.1007/s13595-014-0444-7 (  0) 0) |
| [14] |
Mirabello M J, Yavitt J B, Garcia M, et al. Soil phosphorus responses to chronic nutrient fertilisation and seasonal drought in a humid lowland forest, Panama[J]. Soil Research, 2013, 51(3): 215 DOI:10.1071/SR12188 (  0) 0) |
| [15] |
卢胜旭, 许恩兰, 吴东梅, 等. 米槠人工林土壤微生物群落组成对凋落物输入的响应[J]. 森林与环境学报, 2020, 40(1): 16-23 (  0) 0) |
| [16] |
周嘉聪, 刘小飞, 郑永, 等. 氮沉降对中亚热带米槠天然林微生物生物量及酶活性的影响[J]. 生态学报, 2017, 37(1): 127-135 (  0) 0) |
| [17] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000: 146-195
(  0) 0) |
| [18] |
Jones D L, Willett V B. Experimental evaluation of methods to quantify dissolved organic nitrogen (DON) and dissolved organic carbon (DOC) in soil[J]. Soil Biology & Biochemistry, 2006, 38: 991-999 (  0) 0) |
| [19] |
苏涛, 司美茹, 王朝辉, 等. 土壤矿质氮分析方法的影响因素研究[J]. 农业环境科学学报, 2005, 24(6): 1238-1242 (  0) 0) |
| [20] |
孙宇, 彭天驰, 李顺, 等. 模拟氮沉降对湿性常绿阔叶次生林土壤碳氮组分和酶活性的影响[J]. 水土保持学报, 2019, 33(2): 235–243, 250 (  0) 0) |
| [21] |
Saiya-Cork K R, Sinsabaugh R L, Zak D R. The effects of long-term nitrogen deposition on extracellular enzyme activity in an Acer saccharum forest soil[J]. Soil Biology and Biochemistry, 2002, 34(9): 1309-1315 (  0) 0) |
| [22] |
Tian J H, Wei K, Condron L M, et al. Impact of land use and nutrient addition on phosphatase activities and their relationships with organic phosphorus turnover in semi-arid grassland soils[J]. Biology and Fertility of Soils, 2016, 52(5): 675-683 (  0) 0) |
| [23] |
Sinsabaugh R L, Hill B H, Follstad Shah J J. Ecoenzymatic stoichiometry of microbial organic nutrient acquisition in soil and sediment[J]. Nature, 2009, 462: 795-798 (  0) 0) |
| [24] |
Moorhead D L, Sinsabaugh R L, Hill B H, et al. Vector analysis of ecoenzyme activities reveal constraints on coupled C, N and P dynamics[J]. Soil Biology and Biochemistry, 2016, 93: 1-7 (  0) 0) |
| [25] |
Cui Y X, Wang X, Zhang X C, et al. Soil moisture mediates microbial carbon and phosphorus metabolism during vegetation succession in a semiarid region[J]. Soil Biology and Biochemistry, 2020, 147: 107814 (  0) 0) |
| [26] |
曹平丽, 孙思怡, 卢胜旭, 等. 亚热带米槠天然林不同深度土壤胞外酶活性对隔离降雨的响应[J]. 水土保持学报, 2022, 36(1): 205-211 (  0) 0) |
| [27] |
Fan Y X, Yang L M, Zhong X J, et al. N addition increased microbial residual carbon by altering soil P availability and microbial composition in a subtropical Castanopsis forest[J]. Geoderma, 2020, 375: 114470 (  0) 0) |
| [28] |
Pregitzer K S, Zak D R, Burton A J, et al. Chronic nitrate additions dramatically increase the export of carbon and nitrogen from northern hardwood ecosystems[J]. Biogeochemistry, 2004, 68(2): 179-197 (  0) 0) |
| [29] |
王晖, 莫江明, 鲁显楷, 等. 南亚热带森林土壤微生物量碳对氮沉降的响应[J]. 生态学报, 2008, 28(2): 470-478 (  0) 0) |
| [30] |
范跃新. 氮沉降对中亚热带米槠天然林土壤磷组分的影响及其调控机理[D]. 福州: 福建师范大学, 2019.
(  0) 0) |
| [31] |
沈芳芳, 袁颖红, 樊后保, 等. 氮沉降对杉木人工林土壤有机碳矿化和土壤酶活性的影响[J]. 生态学报, 2012, 32(2): 517-527 (  0) 0) |
| [32] |
曹平丽, 孙思怡, 卢胜旭, 等. 亚热带米槠天然林土壤有机氮组分对模拟氮沉降的响应[J]. 水土保持学报, 2023, 37(4): 243-249 (  0) 0) |
| [33] |
Wisawapipat W, Kheoruenromne I, Suddhiprakarn A, et al. Phosphate sorption and desorption by Thai upland soils[J]. Geoderma, 2009, 153(3/4): 408-415 (  0) 0) |
| [34] |
郝亚群, 谢麟, 陈岳民, 等. 中亚热带地区氮沉降对杉木幼林土壤细菌群落多样性及组成的影响[J]. 应用生态学报, 2018, 29(1): 53-58 (  0) 0) |
| [35] |
孙思怡, 卢胜旭, 陆宇明, 等. 杉木林下套种阔叶树对土壤生态酶活性及其化学计量比的影响[J]. 林业科学研究, 2021, 34(1): 106-113 (  0) 0) |
| [36] |
Sinsabaugh R L, Lauber C L, Weintraub M N, et al. Stoichiometry of soil enzyme activity at global scale[J]. Ecology Letters, 2008, 11(11): 1252-1264 (  0) 0) |
| [37] |
Cui Y X, Moorhead D L, Peng S S, et al. New insights into the patterns of ecoenzymatic stoichiometry in soil and sediment[J]. Soil Biology and Biochemistry, 2023, 177: 108910 (  0) 0) |
| [38] |
张晓晴, 曾泉鑫, 元晓春, 等. 氮添加诱导的磷限制改变了亚热带黄山松林土壤微生物群落结构[J]. 应用生态学报, 2023, 34(1): 203-212 (  0) 0) |
| [39] |
Fink J R, Inda A V, Tiecher T, et al. Iron oxides and organic matter on soil phosphorus availability[J]. Ciência e Agrotecnologia, 2016, 40(4): 369-379 (  0) 0) |
| [40] |
陆宇明, 许恩兰, 吴东梅, 等. 凋落物双倍添加和移除对米槠林土壤水解酶活性及其化学计量比的影响[J]. 水土保持学报, 2021, 35(4): 313-320 (  0) 0) |
| [41] |
Cusack D F. Soil nitrogen levels are linked to decomposition enzyme activities along an urban-remote tropical forest gradient[J]. Soil Biology and Biochemistry, 2013, 57: 192-203 (  0) 0) |
| [42] |
史丽娟, 王辉民, 付晓莉, 等. 中亚热带典型人工林土壤酶活性及其化学计量特征[J]. 应用生态学报, 2020, 31(6): 1980-1988 (  0) 0) |
2. Fujian Provincial Key Laboratory for Plant Eco-physiology, Fujian Normal University, Fuzhou 350007, China;
3. Institute of Geography, Fujian Normal University, Fuzhou 350007, China
 2024, Vol. 56
2024, Vol. 56


